Diferentes estudios epidemiológicos muestran la relación que existe entre osteoporosis, enfermedad cardiovascular y la mortalidad asociada a ésta. Aunque tradicionalmente estas enfermedades se han considerado como procesos independientes relacionados con la edad, como se muestra en este trabajo de revisión, cada vez existe una evidencia más sólida que confirma que ambas entidades comparten mecanismos fisiopatológicos. Entre ellos destacan la relación entre proteínas de origen óseo como la osteocalcina y la osteoprotegerina con la patología vascular. Además, recientemente se han producido diversos avances en el conocimiento de la relación entre metabolismo óseo y metabolismo energético, lo que pudiera tener implicaciones en la patología cardiovascular.
Different epidemiological studies show the relationship between osteoporosis, cardiovascular disease, and cardiovascular-related mortality. Previously considered as age-related but independent diseases, this review reports emerging data showing the common mechanism of both conditions. The relationship between bone-related proteins such as osteocalcin and osteoprotegerin and vascular disease is of special interest. In addition, recent data suggest the influence of bone metabolism on energy balance which may be relevant for cardiovascular disease.
La relación entre osteoporosis, enfermedad cardiovascular y la mortalidad asociada a ésta ha sido descrita previamente1–3. Aunque tradicionalmente estas enfermedades se han considerado como procesos independientes relacionados con la edad, cada vez existe una evidencia más sólida que confirma que ambas entidades comparten mecanismos fisiopatológicos. En la presente revisión se hará un breve repaso de los aspectos epidemiológicos, así como de los factores comunes a la enfermedad ósea y la patología vascular que pueden explicar esta relación, con especial atención a los últimos avances en este campo.
EpidemiologíaLa relación entre baja masa ósea, fracturas y mortalidad cardiovascular está bien documentada. En mujeres con baja masa ósea existe un aumento de la mortalidad cardiovascular que oscila entre un 22 y un 40% por cada descenso de una desviación estándar (DE) de la densidad mineral ósea (DMO)4,5 y en varones por cada aumento de una DE en la DMO de cadera disminuye un 24% la mortalidad cardiovascular6. Además, los casos de fallecimiento por enfermedad cardiovascular son un 30% más frecuentes en mujeres con fractura vertebral7.
De la misma forma, la masa ósea está reducida en pacientes con enfermedad cardiovascular independientemente de la edad8, y la presencia de enfermedad arterial periférica y/o cardiopatía isquémica se asocia a un mayor riesgo de fractura de cadera9. También se ha descrito una asociación significativa entre la presencia de infarto de miocardio y una baja DMO10 y entre la presencia de osteoporosis/osteopenia y un riesgo incrementado de enfermedad coronaria obstructiva en ambos sexos11,12. Por último, se ha descrito una relación entre la presencia de enfermedad cerebrovascular13 y arteriopatía periférica14 con baja masa ósea y fracturas por fragilidad.
Existe también una interrelación entre los marcadores de arterioesclerosis y la enfermedad ósea. Así, la mayoría de los estudios transversales han descrito una asociación inversa entre la presencia, la intensidad y la progresión de la calcificación a nivel de aorta abdominal y la masa ósea a nivel lumbar y femoral, tanto en mujeres posmenopáusicas15 como en varones16. Además, la calcificación aórtica se asocia a un mayor riesgo de fractura de cadera en mujeres posmenopáusicas17. La ateromatosis carotídea, otro marcador de enfermedad cardiovascular, se ha asociado con una menor masa ósea en mujeres posmenopáusicas18 y con un aumento del riesgo de fractura no vertebral19. De forma análoga, la presencia de fractura vertebral se asocia a un mayor riesgo de presentar placa carotídea en mujeres posmenopáusicas con DMO13 y la pérdida de masa ósea medida en metacarpo está asociada con la progresión de la arterioesclerosis aórtica en mujeres15.
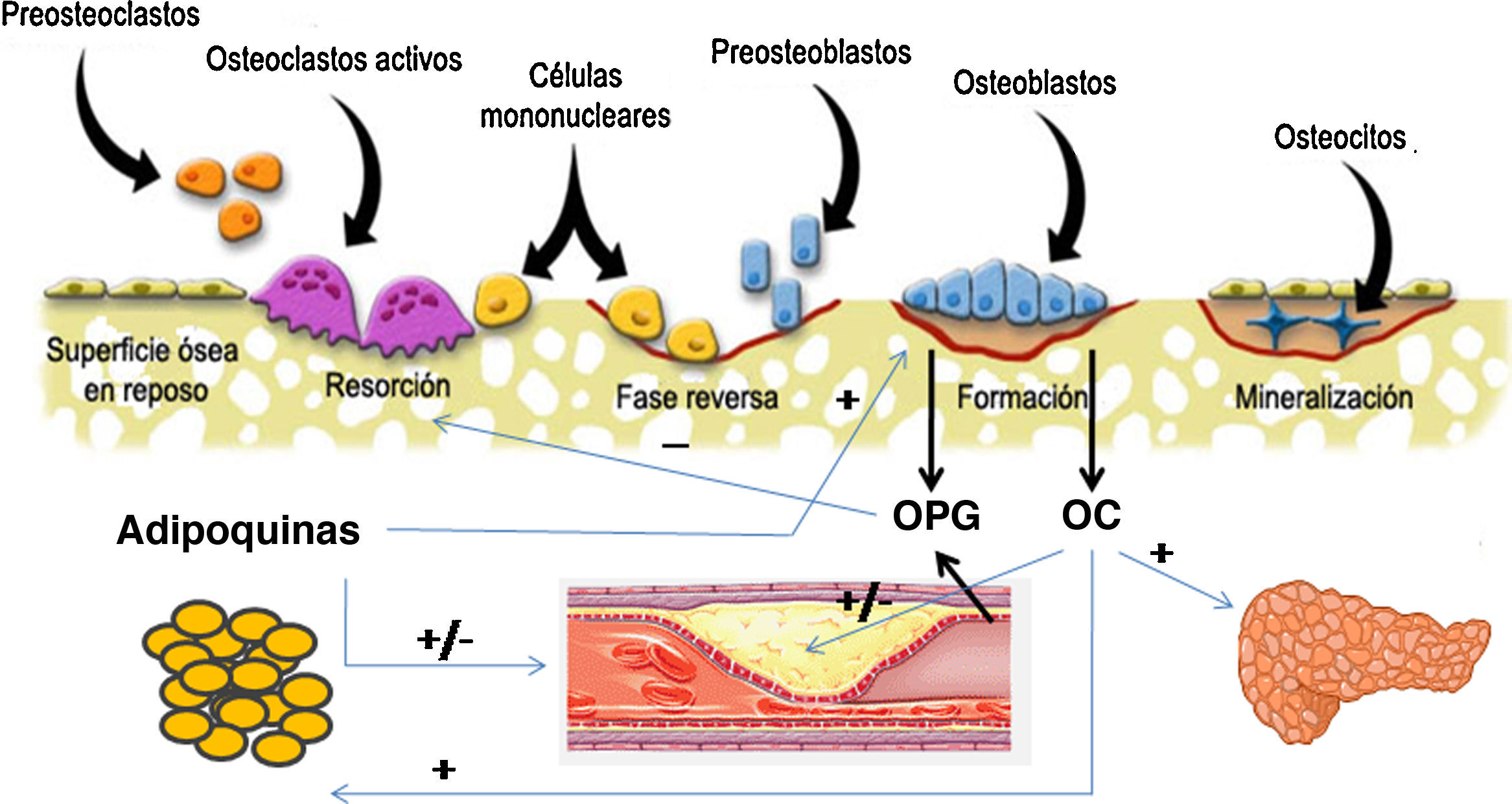
Mecanismos fisiopatológicos comunesDesde hace tiempo se sabe que estas dos patologías comparten factores de riesgo que podrían justificar la asociación que existe entre ambas. Entre ellos destacan la edad, la depleción estrogénica, el sedentarismo, el consumo de alcohol y tabaco y factores dietéticos como la ingesta cálcica, el consumo de ácidos grasos saturados y concentraciones deficitarias de vitamina C y K. En los últimos años ha despertado gran interés la investigación de los factores y mecanismos comunes implicados en la fisiopatología de ambas entidades (fig. 1).
Representación esquemática de la interrelación entre células óseas, sistema vascular, tejido adiposo y metabolismo energético. Los osteoblastos son la fuente de la osteoprotegerina (OPG), y de la osteocalcina (OC). La OC ha demostrado ejercer efectos sobre el metabolismo energético a través de los cuales podría también influir en la enfermedad cardiovascular. La OPG no solo inhibe la reabsorción ósea, sino que también está implicada en la incidencia y gravedad de la enfermedad cardiovascular. Por último, el tejido adiposo secreta adipocinas con influencia sobre las células óseas y también sobre el árbol vascular.
La obesidad es un claro factor de riesgo para el desarrollo de enfermedades cardiovasculares. El tejido adiposo es considerado actualmente como un tejido metabólicamente activo, y en los últimos años ha cobrado relevancia el estudio del efecto de diversas citocinas secretadas por el tejido adiposo sobre el hueso y el sistema vascular. La leptina, una adipoquina aumentada en pacientes con obesidad, tiene un efecto dual ya que a nivel hipotalámico frena la formación ósea por inhibición de la proliferación de los osteoblastos, mientras que por efecto directo sobre las células óseas estimula la formación20. Estudios recientes muestran la influencia de la leptina sobre el sistema cardiovascular, incluyendo efectos sobre el remodelado cardíaco21. Sin embargo, los estudios clínicos que han evaluado la asociación entre leptina y enfermedad cardiovascular no han sido concluyentes22,23. La adiponectina, otra adipoquina que está disminuida en la obesidad, ha demostrado que favorece la formación ósea24 y en el campo de la patología vascular reduce la aterogenesis inhibiendo la capacidad de adhesión de monocitos y el acúmulo de lipoproteínas modificadas en la pared vascular25. Además, la adiponectina reduce el daño endotelial y estimula la producción de óxido nítrico por las células endoteliales26. En este contexto, concentraciones bajas de adiponectina podrían contribuir parcialmente al proceso de aterogénesis.
Calcificación vascular y remodelado óseoSin duda es el campo en el que más se ha avanzado recientemente en cuanto al conocimiento de los mecanismos fisiopatológicos comunes compartidos por la patología vascular y el metabolismo óseo. Diferentes proteínas producidas por las células óseas, como osteocalcina (OC), osteopontina, osteoprotegerina (OPG), el ligando del receptor activador del factor nuclear kappa-ß (RANKL) y las proteínas morfogenéticas óseas (BMPs), están presentes en lesiones ateroescleroticas27. Además, también se ha demostrado la presencia de células de estirpe osteoblástica en la pared vascular28.
La influencia de estos factores óseos en la patogenia de la enfermedad cardiovascular se ha puesto de manifiesto a través de estudios en modelos animales. Ratones knockout para la proteína Gla de la matriz ósea (MGP), proteína de amplia distribución tisular incluyendo el hueso y la pared vascular, sufren una intensa calcificación vascular por lo que se ha atribuido a esta proteína un efecto inhibidor de la calcificación arterial29. La OC es una proteína sintetizada por los osteoblastos o células formadoras de hueso que tras sufrir un proceso de carboxilación es liberada al torrente sanguíneo. Aunque clásicamente se ha considerado como un marcador de formación ósea, cada vez más se reconoce su papel como hormona. En modelos animales de enfermedad arterial periférica la intensidad de esta se relaciona con el número de células mononucleares con inmunorreactividad para OC30, por lo que podría estar relacionada con la afectación vascular.
En humanos la ya conocida relación entre concentraciones bajas de marcadores de remodelado óseo y la gravedad de la arterioesclerosis se ha ampliado recientemente. Así, la secreción de OC es paralela a la de MGP tanto en vasos normales como en placas de arterioesclerosis27, y las concentraciones séricas de OC han mostrado una correlación negativa con el grosor de la íntima-media carotídea en pacientes con diabetes mellitus tipo 2 (DM 2) de raza asiática31. Además, pacientes con ateromatosis carotídea y calcificación aórtica presentan concentraciones menores de OC respecto a controles sanos32. También en pacientes asiáticos concentraciones bajas de OC sérica se asociaron a un menor riesgo de cardiopatía isquémica33. Otros autores han demostrado resultados distintos, como una mayor prevalencia de ateromatosis carotídea en mujeres posmenopáusicas sanas con elevación de OC34. Los resultados contradictorios de estos estudios pueden explicarse en parte por diferencias en las características basales de los pacientes y por diferencias raciales en el grado de adiposidad y probablemente también en los niveles de adipocinas. Aunque en el momento actual no se conoce si la OC producida por los osteoblastos o por células osteoblasto-like en la pared arterial ejerce o no un papel modulador sobre la arterioesclerosis, futuros estudios deben confirmar el valor de la determinación de OC en el diagnóstico y seguimiento de la patología vascular, ya que los datos iniciales son prometedores.
Estudios recientes muestran la influencia que las células óseas ejercen sobre el metabolismo energético y la homeostasis de la glucosa, factores ambos con posible repercusión sobre el sistema cardiovascular. En animales de experimentación la OC aumenta la liberación de insulina y la sensibilidad a ésta, disminuye la grasa visceral y aumenta el gasto energético35. Estudios in vivo confirman la asociación de las concentraciones séricas de OC con el grado de insulinorresistencia y con la liberación de insulina, así como el efecto positivo de la pérdida de peso sobre las concentraciones de esta hormona36. Por último, en la DM 2 las concentraciones séricas de OC se asocian de forma negativa con los niveles de glucosa y con el grado de control metabólico medido a través de las cifras de HbA1c31, y el tratamiento hipoglucemiante induce un aumento de OC37.
OsteoprotegerinaLa osteoprotegerina (OPG) es una proteína de la familia de los TNF (factor de necrosis tumoral) que regula el proceso de osteoclastogénesis a través de la inhibición de RANKL, receptor activador del factor nuclear kappaB. El sistema OPG/RANKL es un factor crítico que determina el grado de activación de los osteoclastos y, por lo tanto, el grado de destrucción ósea. La OPG es secretada por los osteoblastos o células osteoformadoras y también por células vasculares entre ellas células endoteliales y células musculares de las arterias coronarias (fig. 1). Datos recientes sugieren que la OPG puede ser un factor importante regulador de la calcificación arterial y que puede constituir un indicador de lesión vascular. Además, la relación que existe entre mayores concentraciones de OPG y una mayor incidencia y mortalidad por enfermedad cardiovascular se ha confirmado en distintas poblaciones de estudio.
En la enfermedad coronaria las concentraciones plasmáticas elevadas de OPG se asocian con la presencia y gravedad de la misma38. A su vez, las concentraciones de OPG se correlacionan con la gravedad de la arteriopatía periférica39 y OPG se expresa en cantidades elevadas en lesiones arterioescleróticas carotídeas40, lo que en su conjunto avala el papel de la OPG como marcador de eventos cardiovasculares.
La OPG también se ha relacionado con marcadores de aterosclerosis subclínica como el GIM (grosor íntima-media carotídea). En mujeres posmenopáusicas sin enfermedad cardiovascular, concentraciones elevadas de OPG se relacionan de forma positiva con la disfunción endotelial, la rigidez arterial y el GIM41. Por el contrario, otros estudios no encuentran asociación entre OPG y GIM tras ajustar por edad y sexo42 o bien encuentran una relación inversa43.
En pacientes con DM 2 existe una elevación de OPG en ambos sexos respecto a controles sin diabetes mellitus y el valor predictor de la misma sobre la mortalidad parece ser aún más importante en este grupo de pacientes que en la población no diabética44. El aumento de la OPG en pacientes diabéticos se manifiesta desde fases iniciales de la enfermedad y aunque la regulación de su secreción a nivel vascular no es del todo conocida sabemos que la glucemia no parece tener un papel importante y que tampoco existe relación con la leptina ni la adiponectina, lo que sugiere que la obesidad no es la causa del aumento de la OPG en este grupo de pacientes45.
En lo que respecta a las complicaciones vasculares en pacientes diabéticos, concentraciones altas de OPG se han asociado a un mayor riesgo de isquemia miocárdica silente46 y de complicaciones microangiopáticas47. Al igual que en población general, en pacientes con DM 2 las concentraciones séricas de OPG se relacionan con la presencia y severidad de la calcificación coronaria.
Aunque los estudios realizados in vitro muestran claramente la influencia del sistema OPG/RANKL en la fisiología y patología vascular, los resultados de estudios clínicos han mostrado resultados contradictorios en algunos casos. El mejor conocimiento de los factores que intervienen en su regulación y el perfeccionamiento de las técnicas de medición de las proteínas de este sistema han hecho que los estudios más recientes sí muestren resultados uniformes. Sin embargo, en el momento actual queda aún por aclarar si la elevación de las concentraciones séricas de OPG en diferentes afecciones cardiovasculares representa un mecanismo compensador para prevenir el daño vascular o es el responsable de dicha lesión.
Vía WntEsta vía está integrada por 19 glucoproteínas solubles con un papel crítico en la regulación del desarrollo de osteoblastos y por lo tanto, del proceso de formación ósea. Estas proteinas se unen a dos receptores, LRP-5 y LRP-6, iniciando la señalización de factores nucleares implicados en la formación ósea. Además, esta vía de señalización está implicada en la regulación de la calcificación vascular y en la diferenciación de células musculares lisas a osteoblastos48. Datos recientes sugieren una inhibición de la vía Wnt por el estrés oxidativo característico del envejecimiento49, lo que constituiría un mecanismo común para el desarrollo de osteoporosis y arterioesclerosis.
Cbfa1 y Runx2Cbfa1 (Core-binding factor a1) y Runx2 (Runt-related transcriptional factor-2) constituyen dos factores que inducen la diferenciación de células osteoformadoras, los osteoblastos, y participan el el proceso de mineralización50. Se ha demostrado expresión de Runx2 en lesiones de arteriosclerosis en humanos, pero no en vasos sanos, lo que indica un posible papel de estos factores en la calcificación vascular. También parece que tienen un papel en el proceso de calcificación vascular inducido por estrés oxidativo51.
Fibroblastic growth factor 23Fibroblastic growth factor 23 (FGF 23) es una proteína de 251 aminoácidos secretada por los osteocitos (células inmersas en la matriz ósea) y con un importante papel en el metabolismo mineral. Es de especial importancia su participación en la fisiología renal. Sus concentraciones aumentan ya desde fases iníciales de la insuficiencia renal, por lo que se ha implicado tanto en la fisiología normal como en las alteraciones del metabolismo fosfocálcico características de la insuficiencia renal52. Además, recientemente se ha propuesto que pueda constituir un mecanismo patogénico en la enfermedad cardiovascular, en base a la asociación de ésta con la insuficiencia renal y al hecho de que otros factores de crecimiento de esta familia se relacionen con el metabolismo lipídico y de la glucosa. Así, en población caucásica se ha demostrado una relación negativa entre las concentraciones séricas de FGF 23 y HDL, y una correlación positiva entre FGF23 y triglicéridos, índice de masa corporal, índice cintura/cadera y grasa visceral, así como con el riesgo de presentar síndrome metabólico53. La reciente asociación entre este factor de crecimiento sintetizado por las células óseas, masa grasa y alteraciones lipídicas puede representar un nuevo mecanismo común que explique la relación que existe entre metabolismo óseo y riesgo cardiovascular.
Vitamina DExiste una amplia evidencia acerca del papel de la vitamina D en la patogenia de la enfermedad cardiovascular. Concentraciones bajas de vitamina D han demostrado ser un factor de riesgo independiente para el desarrollo de hipertensión arterial, diabetes mellitus, insuficiencia cardíaca, accidente cerebrovascular, enfermedad arterial periférica, cardiopatía isquémica y la mortalidad asociada a estas entidades54. Sin embargo, los estudios de intervención que han evaluado el efecto del tratamiento con vitamina D sobre diferentes resultados cardiovasculares no han mostrado resultados uniformes por lo que en el momento actual no existe suficiente evidencia para recomendar su uso en el tratamiento y/o prevención de enfermedades cardiovasculares aunque este aspecto merezca una mayor investigación.
Implicaciones terapéuticasEstatinasVarios autores han estudiado la asociación entre las concentraciones plasmáticas de lípidos con la DMO y con la presencia de fractura obteniendo resultados contradictorios. En cuanto a la influencia de las estatinas sobre el metabolismo óseo los resultados son mas uniformes. En estudios in vitro las estatinas estimulan la formación ósea55 y los estudios epidemiológicos parecen mostrar que las pacientes tratadas con estatinas muestran valores más altos de DMO, tanto en mujeres menopáusicas56 como en DM257. Por el contrario, el efecto sobre el riesgo de fractura es controvertido ya que si los estudios transversales parecen mostrar un efecto protector58 éste no se ha ratificado en los estudios prospectivos59 aunque sí se han observado efectos beneficiosos sobre la consolidación de la fractura60.
Fármacos hipotensoresAunque no está totalmente establecido si la hipertensión arterial es un factor de riesgo de masa ósea baja y/o fracturas, la influencia de diferentes fármacos hipotensores sobre el metabolismo óseo ha sido ampliamente estudiada. Así, las tiazidas reducen la excreción urinaria de calcio y han demostrado prevenir la pérdida de masa ósea en la posmenopausia61. También se ha demostrado un efecto directo en la diferenciación osteoblástica y la mineralización ósea62.
La angiotensina II estimula la pérdida ósea induciendo un aumento de los niveles de RANKL, y el tratamiento con ARA-II (olmesartán) inhibe este efecto63. La evidencia procedente de estudios clínicos es contradictoria con datos que muestran un aumento de masa ósea64 y otros ausencia de efecto, diferencias que probablemente se explican por polimorfismos de la ECA.
Finalmente, los beta-bloqueantes ejercen efecto sobre el remodelado óseo a través del sistema nervioso simpático. En un amplio estudio prospectivo poblacional se ha demostrado que estos fármacos reducen el riesgo de fracturas65, aunque en el momento actual no se recomienda su uso en la prevención de fracturas.
BifosfonatosVarios estudios sugieren que los bifosfonatos tienen una acción antiaterogénica por un mecanismo directo sobre la pared vascular y también por efectos indirectos sobre otros factores de riesgo cardiovascular. In vitro inhiben la calcificación extraósea, reducen la acumulación de lípidos y la fibrosis de lesiones arterioescleróticas y disminuyen los depósitos de calcio66. El etidronato oral disminuye el GIM carotídeo en pacientes con DM2 y osteopenia67 y en mujeres posmenopáusicas el tratamiento crónico con bifosfonatos orales disminuye el C-LDL y aumenta el C-HDL68 mejorando la elasticidad y disminuyendo la resistencia arterial de manera independiente a los cambios en las concentraciones de lípidos.
ConclusionesEn los últimos años se han producido importantes avances en la ya conocida relación epidemiológica entre osteoporosis, fracturas, y enfermedad cardiovascular. Así, cada vez más se reconoce la interrelación que existe entre células óseas y el sistema vascular. Además, también se ha avanzado en el conocimiento de la influencia de demostrados factores de riesgo cardiovascular como la obesidad y la dislipemia sobre el metabolismo óseo. Por último, diferentes estudios han mostrado el efecto de fármacos de amplio uso en patologías óseas como los bifosfonatos sobre el sistema vascular, así como la influencia de estatinas e hipotensores sobre la masa ósea y el riesgo de fracturas. El mejor conocimiento de los mecanismos fisiopatológicos comunes a ambas entidades puede ayudar al desarrollo futuro de fármacos activos sobre el metabolismo óseo y la enfermedad cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.