La eficacia publicada de las terapias en acromegalia es discordante entre centros de referencia y registros nacionales. El objetivo del presente estudio es describir el manejo clínico de esta enfermedad y la eficacia de los tratamientos implementados en la práctica clínica habitual.
Material y métodosEstudio epidemiológico, observacional, longitudinal y multicéntrico, en pacientes adultos con acromegalia de reciente diagnóstico (n = 74), y con participación de 30 endocrinólogos de la geografía española, que recogieron durante las visitas clínicas rutinarias datos acerca del tratamiento y control de enfermedad durante un periodo de seguimiento de 2 años.
ResultadosLa cirugía hipofisaria fue la terapia de primera elección en el 76% de los pacientes, indicándose en el 24% restante tratamiento de primera línea con análogos de somatostatina, sin diferencias en función del tamaño tumoral. El tratamiento quirúrgico controló la enfermedad en el 27% de sujetos intervenidos. Tras el fracaso de la cirugía inicial, la opción terapéutica preferida fueron los análogos de somatostatina, que normalizaron el factor de crecimiento insulínico tipo 1 (IGF-I) en el 52% de casos, con criterios de control de enfermedad en más del 40% de los sujetos. Al final del seguimiento, un 63% de microadenomas y un 53% de macroadenomas presentaban IGF-I normal. Solo el 19% de los pacientes con macroadenomas cumplía criterios de control sin precisar fármacos. Un 85% de los pacientes requirió tratamiento farmacológico en algún momento del seguimiento.
ConclusionesEl tratamiento inicial preferido en nuestro medio para la acromegalia es la intervención quirúrgica, independientemente del tamaño tumoral. La eficacia del tratamiento en la práctica clínica real se aleja de las tasas de éxito publicadas por centros de referencia.
The reported efficacy of treatments for acromegaly varies depending on reference centers and national registries. The aim of this study was to describe clinical management of this disease and to assess the efficacy of treatments used in standard clinical practice.
Material and methodsAn epidemiological, observational, longitudinal, multicenter study was performed in adult patients with newly diagnosed acromegaly (n = 74) seen by 38 Spanish endocrinologists who collected during routine clinic visits data on disease treatment and control during 2 years of follow-up.
ResultsPituitary surgery and treatment with somatostatin analogs were the first choice therapies in 76% and 24% of patients respectively, with no differences related to tumor size. Surgery achieved disease control in 27% of operated patients. After surgery failure, the preferred therapeutic option were somatostatin analogs, which normalized insulin-like growth factor-1(IGF-I) in 52% of patients and achieved disease control criteria in more than 40% of patients. At the end of follow-up, normal IGF-I levels were found in 63% and 53% of patients with microadenomas and macroadenomas respectively. Only 19% of patients with macroadenoma met disease control criteria without requiring drug treatment, which was required by 85% of them at some time during follow-up.
ConclusionsSurgery is the preferred initial treatment for patients with acromegaly, regardless of tumor size. Treatment efficacy in actual clinical practice is far from the success rates reported by reference centers.
La acromegalia es una enfermedad poco frecuente con una prevalencia estimada en España de 36 casos por 106 habitantes1, pero acarrea una importante morbimortalidad a los pacientes que la padecen como consecuencia de los efectos deletéreos de la exposición tisular a unas concentraciones patológicamente elevadas de hormona de crecimiento (GH) y su efector, el factor de crecimiento insulínico tipo 1 (IGF-I). La mortalidad en los pacientes con acromegalia2–4, y el acortamiento en la esperanza de vida que conlleva la enfermedad5, es atribuible fundamentalmente a un incremento de eventos cardiovasculares, enfermedad respiratoria y la aparición de neoplasias secundarias6. No obstante, el control bioquímico de la enfermedad definido por unas concentraciones basales circulantes de GH inferiores a 2,5μg/L4 , la supresión de la secreción de GH tras una sobrecarga oral de glucosa estándar (GH-SOG) y/o la normalización de las concentraciones de IGF-I se asocian con una disminución de la mortalidad que se equipara a la de la población general7,8.
El tratamiento consensuado actualmente de los pacientes con adenomas hipofisarios secretores de GH se basa bien en la resección quirúrgica, de primera elección en aquellos casos con microadenomas, macroadenomas no invasores o síntomas compresivos locales, bien en el tratamiento farmacológico (análogos de somatostatina [ASS], agonistas dopaminérgicos [DA] y antagonistas del receptor de GH) combinado o no con cirugía en aquellos tumores con escasa probabilidad de éxito quirúrgico, reservándose la radioterapia convencional o radiocirugía para aquellos pacientes no controlados con los tratamientos previos9. La cirugía, habitualmente por vía transesfenoidal, consigue el control bioquímico en aproximadamente un 75-90% de los microadenomas10–12 y en un 40-50% de los macroadenomas10–12, con peores resultados en aquellas lesiones que cursan con extensión extraselar12. El tratamiento con ASS, terapia farmacológica de primera elección, consigue normalizar las concentraciones de IGF-I en un 70% de pacientes preseleccionados13, con descensos significativos del tamaño tumoral en un 40-45% de los sujetos14. No obstante, por un lado, los datos quirúrgicos publicados suelen provenir de centros de referencia, y es bien conocido que el éxito de la cirugía hipofisaria depende del volumen de intervenciones y experiencia del cirujano15, y por otro lado, la eficacia de la terapia farmacológica con ASS tanto en términos de control bioquímico como de reducción de masa tumoral es inferior cuando se evalúan pacientes previamente no seleccionados por su respuesta al tratamiento con octreótida por vía subcutánea16. Teniendo en cuenta estas premisas, parece lógico pensar que la literatura científica podría sobreestimar el éxito de las terapias disponibles en un escenario clínico real.
El objetivo del presente trabajo es describir de forma prospectiva el manejo de los pacientes con acromegalia secundaria a un adenoma hipofisario en situación de práctica clínica habitual, evaluando las preferencias de tratamiento de los especialistas de nuestro medio y la eficacia de las terapias aplicadas.
Material y métodosEste trabajo fue diseñado como un estudio epidemiológico, observacional, longitudinal, multicéntrico y abierto. Participaron 38 especialistas en endocrinología de 30 centros de la geografía española que tratan de manera habitual pacientes con acromegalia, con un periodo de reclutamiento de octubre de 2005 a abril de 2007. Los investigadores debían recoger en todas las visitas que realizara el paciente según práctica clínica habitual, durante los 2 años de seguimiento para los que fue diseñado el estudio, y sin aplicar ninguna intervención externa, una serie de variables en un cuaderno electrónico prediseñado y cumplimentado por ellos mismos.
El estudio fue realizado de acuerdo con los principios de la Declaración de Helsinki de investigación en seres humanos, y recibió la aprobación administrativa y ética del CEIC del Hospital Clinic i Provincial de Barcelona, así como de los CEIC de los centros participantes que así lo requirieron.
Criterios de inclusión- –
Paciente entre 18 y 80 años con acromegalia por adenoma hipofisario, debidamente documentada con nadir de GH-SOG superior a 1μg/L y concentraciones de IGF-I por encima del límite superior de la normalidad ajustado por edad.
- –
Paciente de reciente diagnóstico o paciente intervenido en los últimos 6 meses, con tratamiento farmacológico de no más de 3 meses previo a la cirugía, o sin él.
- –
Seguimiento mínimo de 20 meses.
- –
Paciente que hubiera firmado el consentimiento informado para participar en el estudio.
- –
Paciente que no estuviera participando en ningún ensayo clínico u otros estudios con medicamentos.
- –
Paciente que hubiera sido tratado con fármacos después de la cirugía (previamente a la inclusión del estudio).
- –
Paciente con tratamiento farmacológico de más de 3 meses, previo a la cirugía.
- –
Paciente que presentara cualquier condición física o médica que a criterio del investigador pudiera interferir en la recogida de datos o en los objetivos del estudio.
- –
Paciente embarazada, en periodo de lactancia, o en edad fértil que no estuviera tomando medidas anticonceptivas fiables.
El objetivo principal fue describir de manera prospectiva el manejo terapéutico de los pacientes con acromegalia según práctica clínica habitual en España. Como objetivo secundario se planteó determinar la eficacia en términos de control bioquímico de las diferentes estrategias terapéuticas aplicadas.
Variables de análisis y definición de control de enfermedadSe tuvieron en cuenta variables sociodemográficas (edad y sexo) y clínicas: momento del diagnóstico de la enfermedad, tipo de tumor (microadenoma igual o inferior a 10 mm y macroadenoma superior a 10 mm); tratamientos de la acromegalia: cirugía, tratamiento farmacológico y/o radioterapia (fecha, dosis y pauta), cambios en el tratamiento y control bioquímico de la acromegalia tras las intervenciones. Debido a que el periodo de reclutamiento se realizó entre los años 2005 al 2007, y a la no disponibilidad de ensayos ultrasensibles para la determinación de GH en todos los centros, se definió como criterio de control de enfermedad, en ausencia de tratamiento farmacológico, la presencia de unas concentracions de GH-SOG inferiores a 1μg/L y concentraciones de IGF-I dentro de los límites de la normalidad ajustadas a la edad del paciente según el consenso internacional vigente en dicho periodo17, y en aquellos pacientes en tratamiento con ASS ± DA, unas concentraciones basales de GH inferiores a 2,5μg/L junto con IGF-I normal4,17, o unas concentraciones de IGF-I normales independientemente de los niveles de GH en aquellos sujetos en tratamiento al final del seguimiento con pegvisomant.
Análisis estadístico y descripción de resultadosAl tratarse de un estudio observacional exploratorio, el cálculo del tamaño muestral no se basó en supuestos estadísticos. De acuerdo a una incidencia estimada anual de acromegalia en España de 2,5 casos por 106 habitantes1, se estimó como necesaria una muestra mínima de 60 pacientes para conseguir una valoración representativa del manejo clínico habitual.
Los datos se presentan como media ± DE y números crudos (porcentajes). Para el análisis descriptivo de las variables se establecieron 2 grupos de tratamiento en función de la terapia de primera línea indicada (cirugía o tratamiento farmacológico). Asimismo, se describen y analizan las diferencias en el tratamiento y eficacia terapéutica en función del tamaño tumoral. En 3 casos no se pudo clasificar la lesión tumoral en micro o macroadenoma al no disponer de datos suficientes en el cuaderno electrónico, por lo que estos pacientes fueron excluidos de los subanálisis realizados en función del tamaño de la lesión. La comparación entre variables cuantitativas se llevó a cabo mediante la prueba de la t de Student y modelos lineales generales univariante. Para evaluar la eficacia de la intervención quirúrgica sobre las determinaciones hormonales se utilizaron modelos lineales generales para medidas repetidas. En todos los casos se aseguró previamente la normalidad de las variables mediante la prueba de Kolmogorov-Smirnov y se aplicaron transformaciones logarítmicas si fue preciso. La comparación entre variables cualitativas se realizó mediante la prueba de χ2 o prueba exacta de Fisher según fuera necesario. Para evitar errores tipo I derivados de la presencia de resultados no disponibles, se aplicó un análisis por intención de tratar otorgando a la variable perdida el último valor previamente reportado a lo largo de las visitas de evaluación.
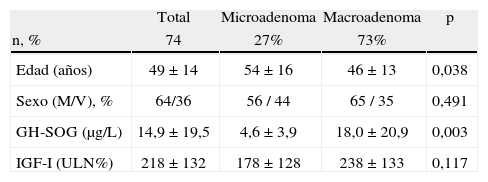
ResultadosCaracterísticas basales de la muestraSe reclutaron 86 pacientes de los que 12 pacientes fueron excluidos por no cumplir todos los criterios de inclusión o presentar algún motivo de exclusión. Los datos de los 74 pacientes restantes, en los que se realizó un seguimiento de 28 ± 5 meses y se recogieron los datos de 6 ± 2 visitas, fueron los utilizados para la descripción de resultados. Las características basales de los pacientes reclutados se muestran en la tabla 1.
Características basales de la muestra
| Total | Microadenoma | Macroadenoma | p | |
| n, % | 74 | 27% | 73% | |
| Edad (años) | 49 ± 14 | 54 ± 16 | 46 ± 13 | 0,038 |
| Sexo (M/V), % | 64/36 | 56 / 44 | 65 / 35 | 0,491 |
| GH-SOG (μg/L) | 14,9 ± 19,5 | 4,6 ± 3,9 | 18,0 ± 20,9 | 0,003 |
| IGF-I (ULN%) | 218 ± 132 | 178 ± 128 | 238 ± 133 | 0,117 |
GH-SOG: concentraciones de hormona de crecimiento a las 2 horas de sobrecarga oral de glucosa estándar; IGF-I: factor de crecimiento insulínico tipo 1; M: mujer; ULN%, porcentaje de la concentración de IGF-I por encima del rango de la normalidad ajustado por edad; V: varón.
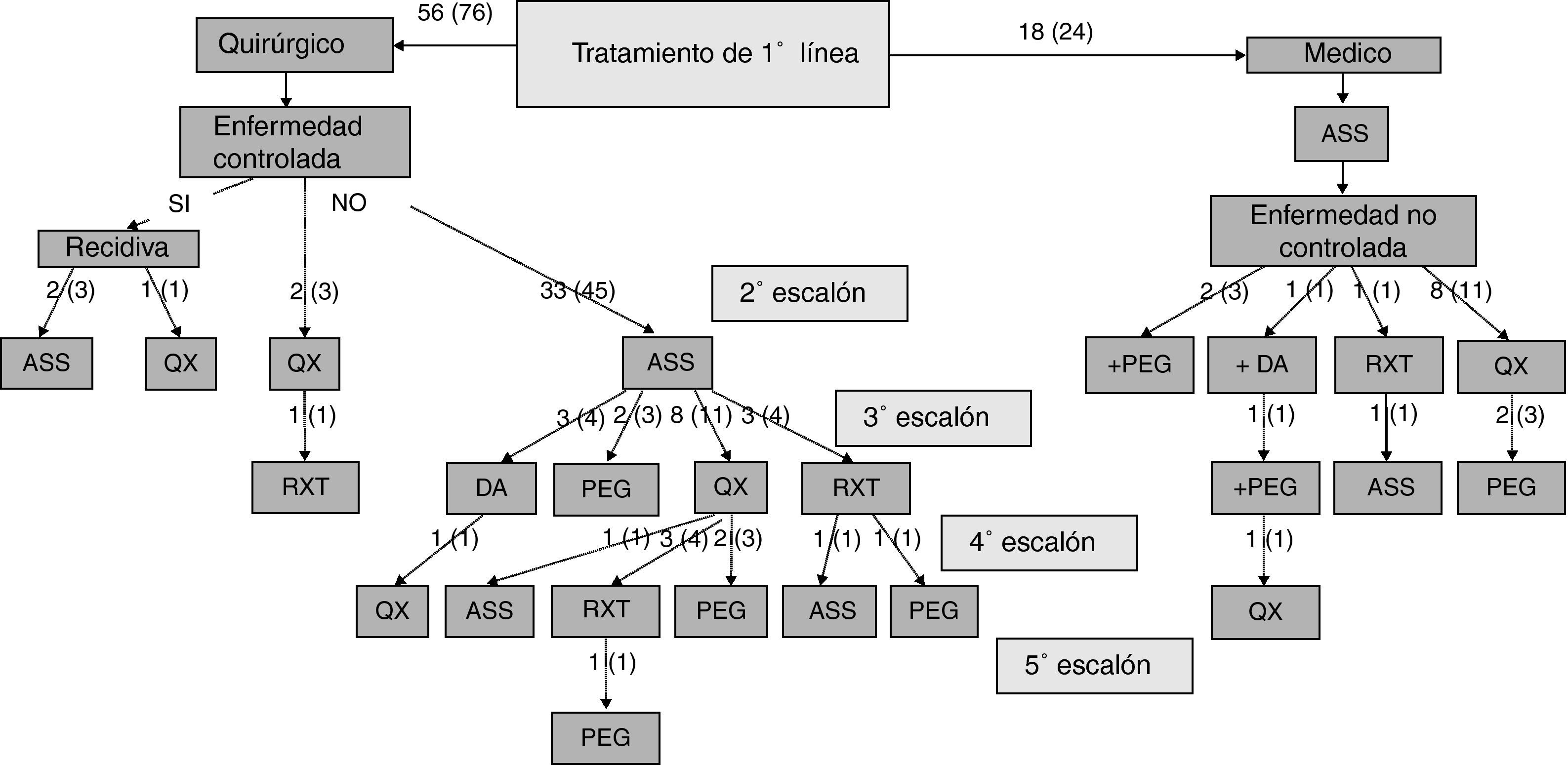
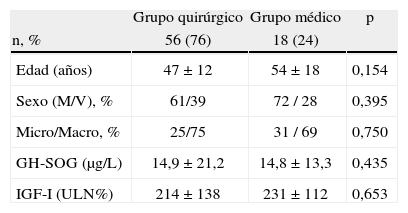
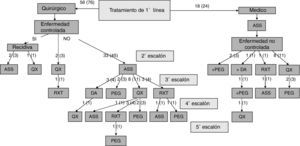
Los especialistas a cargo del manejo de los pacientes con acromegalia eligieron como primera opción terapéutica la intervención quirúrgica en 56 casos (76%), y en los 18 restantes (24%) el tratamiento farmacológico de primera línea con ASS. No existieron diferencias significativas en las características basales de los pacientes entre aquellos en los que se indicó tratamiento quirúrgico o médico de primera línea (tabla 2). La opción quirúrgica fue la de preferencia tanto en los microadenomas como en los macroadenomas. Un 36% de los pacientes intervenidos quirúrgicamente como terapia de primera línea fue tratado antes de la intervención con ASS (37% de los microadenomas y 35% de los macroadenomas). El escalonamiento terapéutico realizado en aquellos pacientes con enfermedad no controlada y el porcentaje de pacientes respecto del total que recibieron cada modalidad tratamiento se muestra en la figura 1. La opción mayoritariamente elegida tras el fracaso de la cirugía inicial fue el tratamiento con ASS seguido de la reintervención quirúrgica.
Características basales de los grupos de tratamiento quirúrgico y médico de primera línea
| Grupo quirúrgico | Grupo médico | p | |
| n, % | 56 (76) | 18 (24) | |
| Edad (años) | 47 ± 12 | 54 ± 18 | 0,154 |
| Sexo (M/V), % | 61/39 | 72 / 28 | 0,395 |
| Micro/Macro, % | 25/75 | 31 / 69 | 0,750 |
| GH-SOG (μg/L) | 14,9 ± 21,2 | 14,8 ± 13,3 | 0,435 |
| IGF-I (ULN%) | 214 ± 138 | 231 ± 112 | 0,653 |
GH-SOG, concentraciones de hormona de crecimiento a las 2 horas de sobrecarga oral de glucosa estándar; IGF-I: factor de crecimiento insulínico tipo 1; M: mujer; ULN%, porcentaje de la concentración de IGF-I por encima del límite de la normalidad ajustado por edad; V: varón.
Escalonamiento terapéutico realizado en aquellos pacientes con enfermedad no controlada y porcentaje de pacientes respecto del total que recibieron cada modalidad de tratamiento.
El número de pacientes se presenta como números crudos (porcentaje respecto del total).
ASS: análogos de somatostatina; DA; agonistas dopaminérgicos; PEG: pegvisomant; QX: cirugía; RXT: radioterapia hipofisaria.
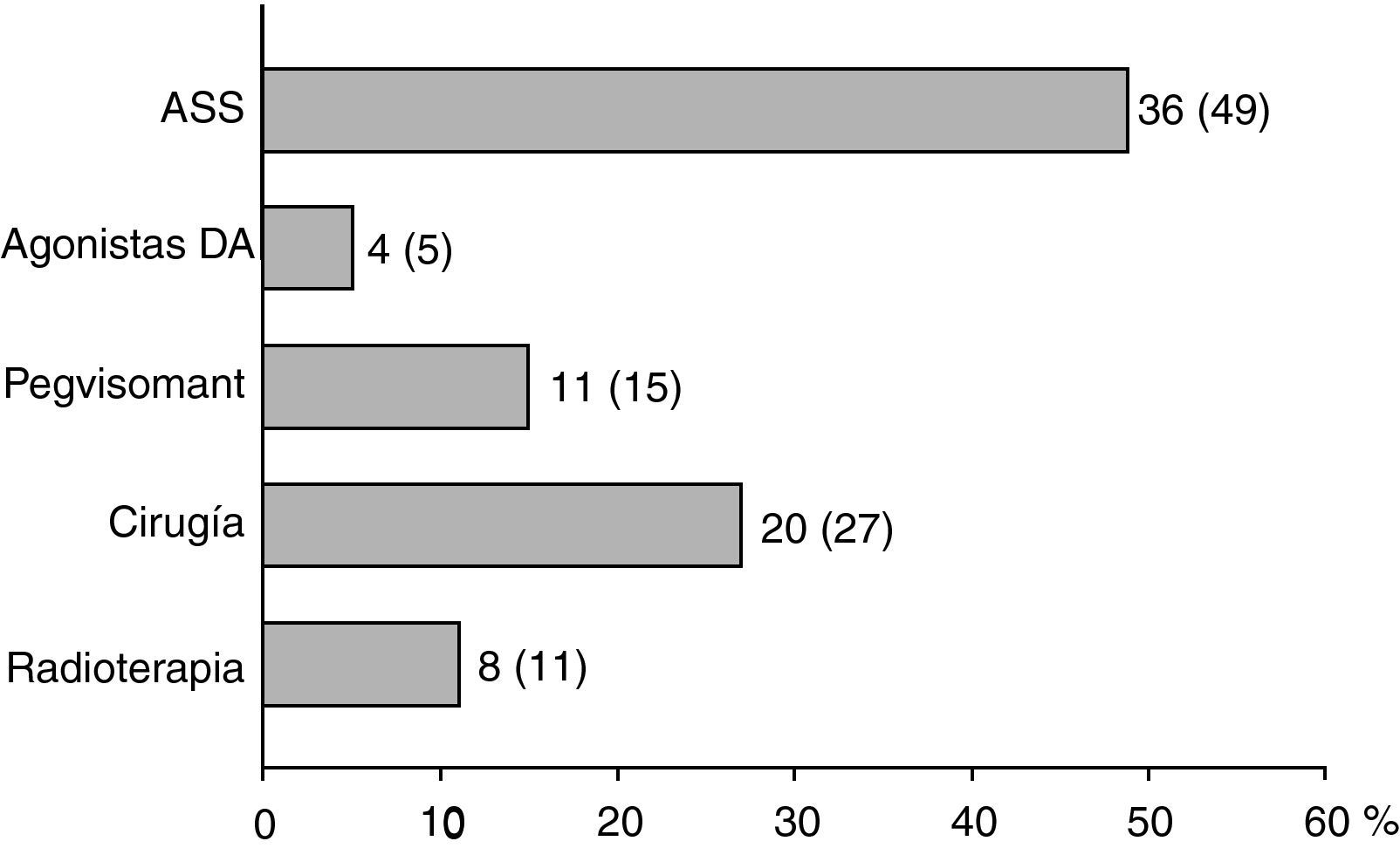
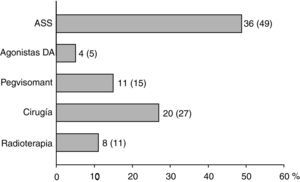
De los 18 pacientes en los que se indicó terapia médica de primera línea con ASS, en 9 casos (50%) se indicó la intervención quirúrgica por mal control de la enfermedad tras 13 ± 6 meses de tratamiento farmacológico. En los otros 9 pacientes que continuaron con tratamiento con ASS hasta el final del periodo de seguimiento, en 2 casos se indicó administración conjunta con pegvisomant, y otro caso recibió tratamiento radioterápico por la presencia de enfermedades asociadas que contraindicaban la intervención quirúrgica. La frecuencia en el conjunto de pacientes con los que se utilizaron las diferentes modalidades terapéuticas de segunda línea se muestra en la figura 2. La necesidad de ASS como tratamiento de segunda línea fue más frecuente en los pacientes con macroadenomas que en aquellos con microadenomas (56 frente a 26%; χ2: 5,48; p = 0,019). De forma similar, el tratamiento quirúrgico de segunda línea fue también más frecuente en los sujetos con macroadenomas (37 frente a 5%; χ2: 6,73; p = 0,009). Sin embargo, no existieron diferencias significativas en función del tamaño tumoral en relación con la indicación de tratamiento con agonistas DA, pegvisomant o radioterapia hipofisaria.
Al final del seguimiento 33 pacientes (45%) se encontraban en tratamiento farmacológico sin existir diferencias significativas en función del tamaño del adenoma, y 63 (85%) del total de pacientes había recibido tratamiento farmacológico en algún momento a lo largo del estudio.
Objetivo segundo: eficacia de las estrategias terapéuticas implementadasPacientes con tratamiento de primera línea quirúrgicoTras la intervención quirúrgica inicial los pacientes de este grupo experimentaron un descenso significativo de las concentraciones de GH-SOG (17,0 ± 21,8 frente a 8,3 ± 17,1μg/L, F: 32,76; p < 0,001), sin diferencias significativas en función del tamaño tumoral. Los pacientes con microadenomas presentaron tras la cirugía una GH-SOG inferior a 1μg/L en un 71% de los casos frente al 15% de los macroadenomas (χ2: 16,32; p < 0,001). Con respecto a las concentraciones de IGF-I, el tratamiento quirúrgico se tradujo en un descenso significativo de las mismas respecto a los valores previos a la cirugía (249 ± 170 frente a 129 ± 120 ULN%; F: 12,40; p = 0,001), sin influencia significativa del tipo de adenoma. Un 79% de los microadenomas y un 32% de los macroadenomas alcanzaron concentraciones basales de IGF-I normales ajustadas por edad (χ2: 9,32; p = 0,002). Tras la intervención inicial, 15 pacientes (27%) presentaban criterios de control de enfermedad, siendo el porcentaje de éxito quirúrgico significativamente superior en los pacientes con microadenomas frente a aquellos con macroadenomas (71 frente a 12%; χ2: 18,46; p < 0,001). La administración de ASS antes de la cirugía no tuvo ninguna influencia sobre el porcentaje de éxito quirúrgico en el global de pacientes (18% en no tratados frente a 28% en tratados; χ2: 0,393; p = 0,531), ni en función del tamaño tumoral (microadenomas: 57% en no tratados frente a 86% en tratados; χ2: 1,40; p = 0,559; macroadenomas: 13% en no tratados frente a 11% en tratados; χ2: 0,35; p = 1,000). Tras el fracaso del tratamiento quirúrgico inicial o recurrencia de actividad acromegálica, la opción terapéutica más empleada fue la administración de ASS, consiguiendo normalizar las concentraciones de IGF-I en el 52% de los pacientes, GH basales «seguras» inferiores a 2,5μg/L en el 47% de los casos y criterios de control de enfermedad en el 43% de los mismos, sin precisar otro tratamiento añadido.
Al final del periodo de seguimiento, 34 pacientes (61%) presentaban concentraciones de IGF-I basales dentro de los límites de la normalidad (86% de los microadenomas y 54% de los macroadenomas; χ2: 4,54; p = 0,033), 17 (30%) pacientes cumplían criterios de control de enfermedad sin precisar tratamiento médico para la acromegalia (64% de los microadenomas y 20% de los macroadenomas; χ2: 9,80; p = 0,005), y 24 (43%) se encontraban bajo tratamiento farmacológico. De estos últimos, 10 (42%) presentaban criterios de control, sin diferencias significativas en función del tamaño tumoral.
Pacientes con tratamiento farmacológico de primera líneaTras una media de 28 ± 5 meses de seguimiento, 7 (39%) de los 18 pacientes presentaban IGF-I dentro del límite de la normalidad, sin diferencias en función del tamaño del adenoma ni del hecho de haber sido intervenidos quirúrgicamente a lo largo del periodo de estudio. Solo 2 (11%) de los 9 pacientes (50%) que fueron intervenidos quirúrgicamente en este grupo presentaba criterios de curación (2 macroadenomas), y 4 pacientes (22%) cumplían criterios de control de enfermedad bajo tratamiento farmacológico.
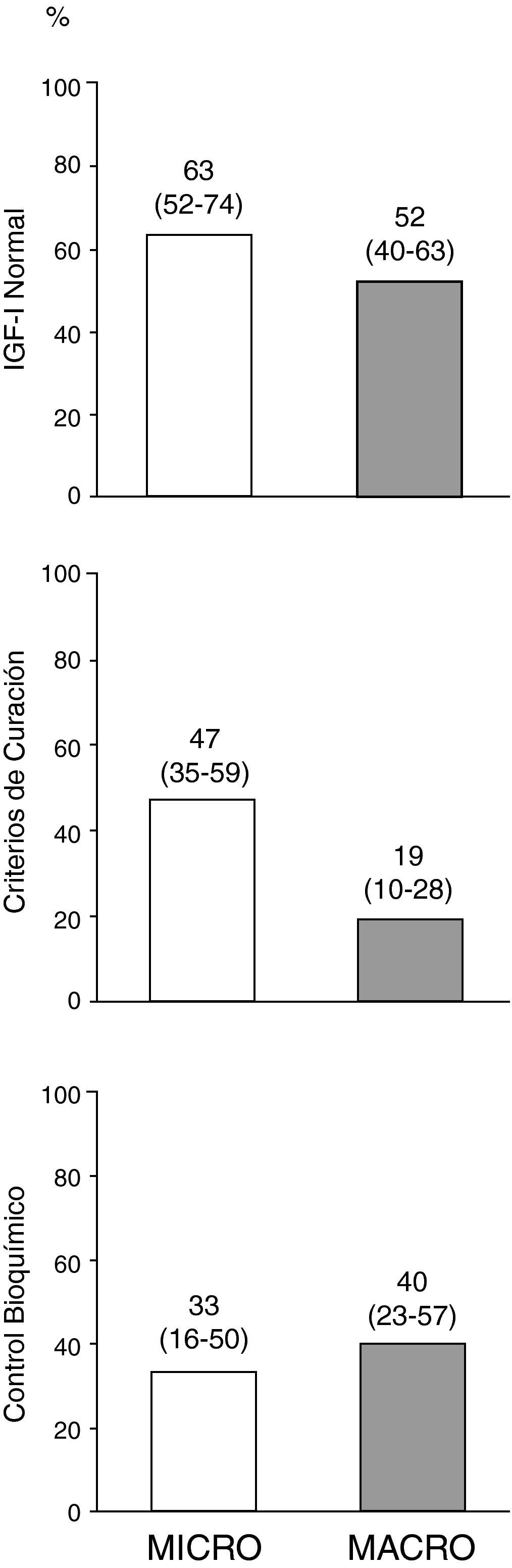
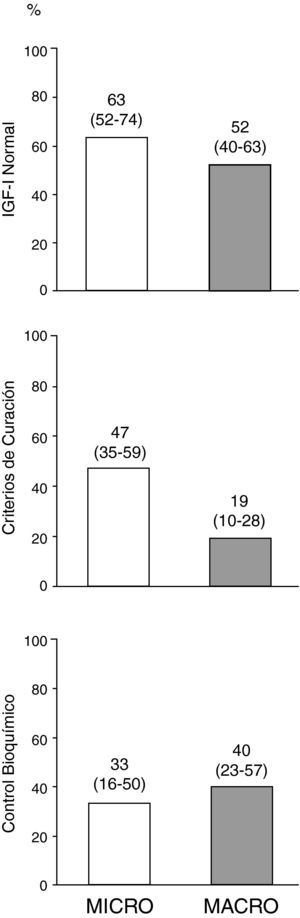
El porcentaje del global de pacientes al final del seguimiento que presentaron IGF-I ajustada para edad normal, criterios de curación (control de enfermedad sin fármacos) y control bioquímico (control de enfermedad con fármacos), en función del tipo de adenoma se muestra en la figura 3. De los 10 pacientes que al final del seguimiento se encontraban en tratamiento con pegvisomant, 5 (50%) presentaban concentraciones basales de IGF-I ajustadas por edad por encima del límite de la normalidad.
Control de la enfermedad en el global de pacientes al final del periodo de seguimiento en función del tipo de adenoma.
El término curación de enfermedad se refiere a aquellos pacientes que cumplen criterios de control de enfermedad (GH-SOG inferior a 1μg/L junto con IGF-I normal) sin precisar tratamiento médico para la acromegalia, y el término control bioquímico a aquellos pacientes que cumplen criterios de control de enfermedad de entre los que finalizaron el seguimiento estando en tratamiento con análogos de somatostatina, agonistas dopaminérgicos y/o pegvisomant (n = 34). Los números encima de las barras representan porcentaje de pacientes (intervalo de confianza al 95%, límite inferior-límite superior).
Los datos reportados en el presente trabajo, recogidos prospectivamente, completan los ya publicados en el Registro Nacional de Acromegalia (REA)1,18, y junto a estos últimos nos proporcionan una instantánea bastante fidedigna e informativa del manejo actual de la acromegalia en España.
La terapia inicial de elección en aproximadamente un 80% de los pacientes de reciente diagnóstico de nuestro estudio es la resección quirúrgica por vía transesfenoidal, en concordancia con los datos previos del REA actualizados a 2004, y otros registros nacionales similares de nuestro entorno más recientes19,20. La cirugía es la forma más rápida de disminuir las concentraciones de GH e IGF-I en pacientes con acromegalia, y las tasas de éxito quirúrgico publicadas en centros neuroquirúrgicos de referencia en microadenomas y macroadenomas intraselares son superiores al 75% de los casos, y en torno al 40% en lesiones invasivas12. Sin embargo, el control de la enfermedad que proporciona la cirugía es inferior en los diferentes registros nacionales19–21, incluyendo el REA, donde se comunican criterios de curación posoperatoria en tan solo un 40% de los pacientes1, datos en consonancia con nuestros resultados. Esta sensible discordancia entre las series quirúrgicas y los registros nacionales en términos de eficacia podría explicarse por 2 motivos fundamentales. Por un lado, el sesgo de publicación a favor de resultados positivos o de superioridad, y la no comunicación de series de centros con resultados menos «brillantes», y por otro lado, por factores inherentes a la cirugía hipofisaria. El éxito de la cirugía hipofisaria es altamente dependiente de la curva de aprendizaje y experiencia del neurocirujano22, obteniéndose los mejores resultados en aquellos centros con un mayor número de intervenciones quirúrgicas y que concentran las mismas en un menor número de cirujanos15,22, y los peores en aquellos sistemas en los que la autoría de la cirugía está más repartida15,23. De acuerdo con esta evidencia en la comunicación de 2004 del REA1 se reportaba un 25% más de éxito quirúrgico en los centros con mayor volumen de pacientes. Con esta premisa, realizando un cálculo bastante grosero pero no por ello menos ilustrativo, según datos de la Sociedad Española de Neurocirugía existen actualmente en el territorio nacional 72 Servicios de Neurocirugía acreditados24, con alguna Comunidad Autónoma uniprovincial que cuenta en su haber con 17 Servicios. Suponiendo que la neurocirugía hipofisaria se concentre en un solo especialista en cada uno de estos servicios, y de acuerdo a la incidencia anual estimada en España de acromegalia1, la relación paciente con acromegalia de reciente diagnóstico-neurocirujano es de 1,6 casos/año, lo que da una idea de la dificultad que implica completar una curva de aprendizaje adecuada.
Otro aspecto a destacar es el hecho de que más de un tercio de los pacientes en los que se indicó cirugía hipofisaria fueron tratados antes de la intervención con ASS con la probable intención de disminuir la morbilidad y mejorar el éxito quirúrgico. No obstante, el beneficio del tratamiento farmacológico previo a la intervención es motivo de controversia25,26, no pareciendo existir en estudios prospectivos un claro beneficio en pacientes con microadenomas e incrementando en alguna serie la probabilidad de éxito quirúrgico en pacientes con macroadenomas, especialmente en aquellos invasores26. En nuestra serie su administración antes de la cirugía no se acompañó de ningún beneficio en los pacientes con micro ni macroadenomas.
Tras la terapia quirúrgica de primera línea, el tratamiento más utilizado tanto en aquellos pacientes con control de enfermedad inicial que recidivaron como en aquellos con persistencia de actividad acromegálica tras la intervención, fue la administración de ASS, indicada en más del 90% de estos casos, y que se convirtió en el único tratamiento posquirúrgico en el 54% de los pacientes que lo precisaron. La exéresis quirúrgica parcial en aquellos pacientes con macroadenomas no completamente resecables27,28, especialmente cuando se consigue retirar más del 75% de la masa tumoral27, parece mejorar la eficacia del tratamiento posterior con ASS en términos de control de enfermedad. En nuestro estudio, este proceder terapéutico consiguió controlar la enfermedad y normalizar las concentraciones de IGF-I, en más del 40 y 50% de los casos respectivamente, lo que confirma los resultados de series retrospectivas previas27, apoyando la elección de este esquema terapéutico por su elevada eficacia en una alta proporción de pacientes.
El empleo de la radioterapia o radiocirugía en nuestra serie es bastante marginal. La irrupción en el arsenal terapéutico de la acromegalia de los ASS de acción prolongada y el pegvisomant, su moderada eficacia en términos de control de enfermedad, el largo periodo de latencia desde el momento de su administración hasta la obtención del máximo efecto y la preocupación acerca de la morbilidad ocasionada a medio-largo plazo han hecho que esta modalidad de tratamiento haya sido relegada a un segundo plano tras el tratamiento farmacológico, siendo su indicación fundamental la de aquellos escasos pacientes no controlados tras cirugía más tratamiento farmacológico y/o tumores con tendencia expansiva pese a estos tratamientos9,18. No obstante, el corto periodo de seguimiento de nuestra serie no permite extraer más conclusiones, puesto que su administración podría continuar siendo una estrategia adecuada en el elevado porcentaje de pacientes no controlados al final del estudio.
Algunos expertos, y las guías terapéuticas más recientes, recomiendan el tratamiento médico como primera opción terapéutica en pacientes con escasa posibilidad de resección quirúrgica completa inicial9,29. La terapia médica de primera elección con ASS es eficaz independientemente del tamaño e invasividad tumoral30, y metaanálisis de ensayos clínicos con ASS de acción prolongada como tratamiento primario muestran una normalización de las concentraciones de GH e IGF-I en torno al 50-60% tanto en microadenomas como macroadenomas16. Sin embargo, los ratios de control de la hipersecreción de GH e IGF-I reportados no son tan elevados en la práctica clínica real cuando se emplean en pacientes no seleccionados19,20, a lo que hay que añadir la importante carga económica que suponen, más aún cuando hablamos de un tratamiento que se va a aplicar de manera indefinida31,32. En la serie aquí presentada la terapia farmacológica de primera línea se indicó en el 24% de los pacientes de reciente diagnóstico, elección que no se vio influenciada por la edad de los pacientes ni el tamaño tumoral. Por otro lado, las comorbilidades asociadas solo fueron responsables de la no indicación quirúrgica en un paciente mencionado previamente tratado con ASS seguido de radioterapia convencional, por lo que tampoco permiten establecer inferencias causales acerca de esta indicación. No obstante, 2 variables no recogidas en el estudio, la situación funcional de los pacientes y la presencia de adenomas invasores con pocas probabilidades de resección quirúrgica completa, podrían explicar parcialmente la indicación farmacológica de primera línea, si bien, esta es una hipótesis meramente especulativa, teniendo en cuenta que un 50% de estos pacientes tratados inicialmente con ASS fueron finalmente intervenidos.
En nuestra serie, solo un 22% de los pacientes con tratamiento médico de primera línea presentó criterios de control de enfermedad al final del seguimiento, datos similares a los publicados del REA1 y en el registro nacional belga19, y discretamente inferiores al registro alemán20. En relación con el tratamiento farmacológico merece la pena destacar cómo solo 5 (50%) de los 10 pacientes en tratamiento con pegvisomant al final del seguimiento presentaban concentraciones de IGF-I dentro del rango de la normalidad. Este dato en una terapia tan altamente efectiva en conseguir este objetivo33 sugiere la presencia de problemas de inercia terapéutica en su dosificación escalonada, si bien otros factores que se encuentran más allá del ámbito de análisis de este estudio, inherentes al paciente, al propio tumor y otros tratamientos utilizados, pueden modificar la respuesta al fármaco34,35.
Finalmente, subrayar que el presente trabajo pese a contar con puntos fuertes entre los que se encuentran la recogida prospectiva de datos, el análisis por intención de tratar de las variables estudiadas o la multicentricidad, que apoyan la información obtenida del mismo, no está carente de alguna debilidad que debe ser tenida en cuenta a la hora de analizar los resultados, como es la ausencia de datos exactos bidimensionales o volumétricos del tamaño tumoral, la ausencia de datos sobre invasividad del tumor o la falta de determinaciones centralizadas de las concentraciones de GH o IGF-I, que hubieran permitido una mayor estandarización de los resultados.
En conclusión, la intervención quirúrgica es la modalidad terapéutica preferida inicialmente para el tratamiento de la acromegalia por una muestra representativa de los especialistas en Endocrinología y Nutrición de nuestro medio, independientemente del tamaño tumoral, aunque esta solo consigue el control de enfermedad en un 27% de los pacientes, resultados especialmente pobres en el caso de los macroadenomas. En aquellos pacientes con fracaso de la terapia quirúrgica inicial, el tratamiento más frecuentemente indicado es la administración de ASS. El tratamiento médico de primera línea consigue el control bioquímico en torno al 20% de los casos, y en un 50% de los pacientes de nuestra serie es seguido de tratamiento quirúrgico por control no adecuado de la enfermedad. Estos resultados en práctica clínica real, y que se encuentran en consonancia con el REA y los registros nacionales de países de nuestro entorno, subrayan la importancia de la elaboración y mantenimiento de estas bases de datos multicéntricas que permiten obtener una valiosísima información práctica, y apoyan la creación de centros de referencia, como es el caso en otras enfermedades de las consideradas raras, con protocolos sistematizados de estudio y tratamiento que consigan mejorar los resultados en términos de éxito terapéutico.
FinanciaciónLa realización de este estudio ha sido posible gracias al apoyo logístico de IMS Health Barcelona, y al apoyo y financiación de NOVARTIS FARMACÉUTICA, S.A.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el trabajo realizado y el compromiso adquirido por todos los centros, investigadores y pacientes que han participado en el estudio.
Albero R., Acha J., Hospital Universitario Miguel Servet, Zaragoza; Ballesteros M., Hospital de León, León; Bernal C., Hospital Universitario 12 de Octubre, Madrid; Blanco C., Hospital Universitario Príncipe de Asturias, Madrid; Boronat M., Hospital Universitario Insular de Gran Canaria, Las Palmas; Catalá M., Hospital Clínico Universitario de Valencia, Valencia; Díez A., Hospital del Bierzo, Ponferrada, León; Donnay S., Hospital Universitario Fundación de Alcorcón, Alcorcón, Madrid; Fernández P., Hospital de Montecelo, Pontevedra; Ferrer J.C., Hospital General Universitario de Valencia, Valencia; García A., Hospital Universitario Puerta del Mar, Cádiz; García H., Hospital Universitari Son Dureta, Palma, Mallorca, Illes Balears; Gaztambide S., Hospital de Cruces, Baracaldo, Bizkaia; López J.F., Hospital Rafael Méndez, Lorca, Murcia; López P., Hospital General Universitario de Elche, Elche, Alicante; de Luis D., Hospital Universitario Río Hortega, Valladolid; Martínez P., Complejo Hospitalario de Jaén, Jaén; Montreal M., Hospital Universitario Miguel Servet, Zaragoza; Moreno A., Complejo Hospitalario de Jaén, Jaén; Pardo C., Hospital Virgen de los Lirios, Alcoi, Alicante; Pavón I., Hospital Universitario de Getafe, Getafe, Madrid; Pazos F., Hospital Universitario Marqués de Valdecilla, Santander, Cantabria; Pérez J., Hospital Universitario de Canarias, La Laguna, Tenerife; Pinedo R., Hospital General de Elda, Elda, Alicante; Rodríguez P., Hospital General Universitario Gregorio Marañón, Madrid; Salinas I., Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona; Sanabria C., Hospital Clínico San Carlos, Madrid; Sillero A., Hospital de Mérida, Mérida, Badajoz; Soto A., Hospital Universitario Virgen del Rocío, Sevilla; Tarroba C., Hospital Universitario Río Hortega, Valladolid; Villabona C., Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, Barcelona.