Evaluar 2 ensayos sensibles para la determinación de insulin-like growth factor 1 (IGF-1) y somatotropina (GH) tras la prueba de sobrecarga oral de glucosa (SOG) en controles sanos.
MétodosSe realizó una SOG con 75 g a 19 adultos sanos y se determinaron las concentraciones séricas de IGF-1 y GH. Las concentraciones de GH e IGF-1 se midieron mediante un ensayo inmunorradiométrico sensible (IRMA) y por un ensayo inmunométrico quimioluminiscente muy sensible (CLIA).
ResultadosLa concentración media de IGF-1 fue 153±65ng/ml medida por IRMA y 144±56ng/ml por CLIA. Las concentraciones medianas (rango intercuartílico) de GH basal por IRMA frente a CLIA fueron 0,8 (0,5-3) μg/l frente a 0,5 (0,1-2,4) μg/l. La mediana del nadir de GH medido por IRMA fue 0,4 (0,3-0,5) μg/l y 0,08 (0,01-0,22) μg/l con CLIA. Cuando en cada sujeto se calculó el cociente de GH basal IRMA/CLIA, se obtuvo una mediana del ratio en todo el grupo de 1,68. Igualmente, la mediana del ratio del nadir de GH IRMA/CLIA total fue 4,44. Uno de los sujetos no consiguió una supresión por debajo de los valores establecidos, con un nadir de GH de 1,2 μg/l por IRMA y 1 μg/l por CLIA, sobrepasando el punto de corte tradicional que define la presencia de acromegalia cuando el método de medida fue IRMA.
ConclusionesLa evaluación del eje GH/IGF-1 debería realizarse con un ensayo inmunométrico quimioluminiscente muy sensible (CLIA). En nuestra opinión, no hay necesidad de rebajar el punto de corte en la supresión de GH para establecer el diagnóstico de acromegalia. No encontramos diferencias significativas en cuanto a sexo, IMC o edad respecto al nadir de GH, por lo que nuestros datos no apoyan la utilización de diferentes criterios para el cribado de acromegalia en varones y mujeres o en jóvenes y mayores.
To evaluate 2 highly sensitive assays for serum insulin-like growth factor-1 (IGF-1) and growth hormone (GH) determination following an oral glucose tolerance test (OGTT) in healthy controls.
MethodsNineteen healthy adults underwent a standard 75g OGTT and GH and IGF-1 were measured. Serum GH and IGF-1 levels were assayed by a sensitive immunoradiometric assay (IRMA) and a highly sensitive chemiluminescent immunometric assay (CLIA).
ResultsThe mean IGF-1 concentration was 153±65ng/ml measured by IRMA and 144±56ng/ml measured by CLIA. The median (interquartile range) basal GH concentrations by IRMAvs CLIA were 0.8 (0.5-3) μg/l vs 0.5 (0.1-2.4) μg/l. The median nadir GH measured by IRMA in these subjects was 0.4 (0.3-0.5) μg/l, and the mean nadir GH by CLIA was 0.08 (0.01-0.22) μg/I. When a ratio of basal IRMA/CLIA GH was calculated in each subject, the median ratio of basal IRMA/CLIA GH concentrations in subjects overall was 1.68. Similarly, the median ratio of nadir IRMA/CLIA GH values was 4.44. One of the subjects did not achieve GH suppression into the established normal range, with a GH nadir of 1.2 μg/l by IRMA and 1 μg/l by CLIA, overlapping with the traditional cut-off defining acromegaly when GH suppression was measured by IRMA.
ConclusionsHighly sensitive chemiluminescent immunometric assays should be used to assess the GH/IGF-1 axis. In our opinion, there is no need for a lower GH suppression cut-off for diagnosing acromegaly. We found no significant gender-, BMI- or age-related differences in nadir GH levels and thus our results do not support different OGTT criteria for screening of acromegaly in men and women, or in younger and older subjects.
La evaluación bioquímica de la acromegalia se basa en la determinación del grado de supresión de somatotropina (GH) tras una sobrecarga oral de glucosa (SOG) y del péptido GH dependiente de insulin-like growth factor 1 (IGF-1) que refleja la secreción de GH. La disponibilidad clínica de ensayos para medir IGF-1ha mejorado notablemente el estudio de la acromegalia y ha favorecido un diagnóstico más temprano. La utilización de ensayos altamente sensibles y específicos para la GH ha conducido a una reevaluación de los criterios diagnósticos, ya que la acromegalia activa puede estar presente en pacientes con concentraciones de GH inferiores a las que se utilizaban previamente como corte con ensayos menos sensibles. Actualmente, con la disponibilidad de modernas técnicas bioquímicas y herramientas terapéuticas más eficaces, los esfuerzos también deberían centrarse en definir criterios fiables basados en los nuevos ensayos más sensibles, que identifiquen la enfermedad en sus estadios más tempranos.
El documento de consenso para el diagnóstico de acromegalia se estableció con ensayos sensibles inmunométricos para GH1. El límite de detección de la mayoría de los métodos inmunométricos está por debajo de 1μg/l, aunque existen diferencias en la concentración de GH según el ensayo con el que se mida2. A pesar de las diferencias en los resultados obtenidos con los diferentes métodos, se han establecido unos criterios claros (un nadir en las concentraciones de GH por debajo de 1μg/l tras SOG) para el diagnóstico y la definición de curación en pacientes acromegálicos1. Sin embargo, este límite ha sido criticado por ser demasiado elevado y se ha propuesto un nuevo punto de corte en 0,3μg/l3, 4. Algunos estudios realizados en sujetos sanos jóvenes también indican que el nadir normal de GH tras la supresión con SOG, medidos con los nuevos ensayos altamente sensibles para GH, es menor que el establecido previamente, y que la respuesta normal es por debajo de 1μg/l3, 5. Finalmente, algunos autores defienden que no es necesario realizar toda la curva de supresión de GH tras SOG y que con la determinación de la concentración de GH a los 120min, junto con las concentraciones de IGF-1, sería suficiente para la evaluación bioquímica de la acromegalia6. El objetivo de este trabajo fue comparar los resultados procedentes de 2 ensayos inmunométricos altamente sensibles para la determinación de las concentraciones de IGF-1 y de GH en respuesta a la administración oral de 75g de glucosa en varones y mujeres sanos.
MATERIAL Y MÉTODOSe estudió a 19 adultos sanos: 10 mujeres (edad, 32,2±10,09 [intervalo, 25–57] años) y 9 varones (edad, 34,2±7,3 [intervalo, 25–48] años). El índice de masa corporal (IMC) fue 20,52±1,58 para las mujeres y 23,3±2,27 para los varones. El protocolo del estudio fue aprobado por el comité ético local y se obtuvo el consentimiento informado de todos los sujetos.
La SOG se realizó tras ayuno de 10h y descanso en posición supina durante al menos 30min antes de la extracción de la muestra basal. Las muestras sanguíneas se obtuvieron a través de una vía periférica en los minutos 0, 30, 60, 90 y 120 tras beber una bebida con 75g de dextrosa. Las concentraciones de IGF-1 se midieron en condiciones basales en la primera extracción. La sangre se dejó a temperatura ambiente durante 15min y posteriormente se centrifugó.
Ensayo inmunorradiométrico (IRMA)La IGF-1 sérica se midió con el kit de Diagnostic Systems Laboratories para IGF-1 (Diagnostic Systems Laboratories, Inc., Upper Heyford, Oxon, Gran Bretaña). El IRMA es un ensayo no competitivo en el que la molécula a medir es atrapada entre dos anticuerpos. El primer anticuerpo está adherido al interior de las paredes del tubo y el segundo anticuerpo está marcado radiactivamente para la detección. La molécula a medir, que está en el suero del paciente, se une a los dos anticuerpos formando un complejo anticuerpo-antígeno-anticuerpo que emite radiactividad, que se mide. Este kit utiliza un tratamiento ácido previo para separación de las proteínas transportadoras. El coeficiente de variación intraensayo (CV) era<3,4%, y el CV interensayo, < 8,2%. La sensibilidad de este método es 2,06ng/ml.
Para la medición de GH sérica se utilizó un método inmunorradiométrico no competitivo (DiaSorin s.r.l., Saluggia, Vercelli, Italia), cuyo principio es el mismo que el descrito previamente para la IGF-1. Este kit está calibrado frente al estándar internacional WHO International Reference Preparation (IRP) 80/505. El ensayo emplea 2 anticuerpos monoclonales dirigidos contra dos epítopos diferentes de la GH humana (hGH). Este kit reconoce las 2 variantes monoméricas de la hGH (20 y 22 kD). El CV intraensayo era<3,9% y la variación interensayo, < 5,5%. La sensibilidad de este método es 0,2μg/l.
Ensayo inmunométrico quimioluminiscente (CLIA)La IGF-1 sérica se midió con el analizador Immulite (IGF-1 Immulite, DPC, Los Angeles, CA, Estados Unidos). Este ensayo requiere una dilución del suero 1:10 con un diluyente específico del kit. Las muestras del paciente, previamente diluidas, se añaden junto con un anticuerpo policlonal marcado con fosfatasa alcalina al ensayo, cuyas paredes están cubiertas con un anticuerpo monoclonal específico para la IGF-1, de tal manera que se forma un complejo anticuerpo-antígeno-anticuerpo. Posteriormente, se añade un sustrato quimioluminiscente y se mide la emisión de fotones que es proporcional a la concentración de IGF-1. Este kit utiliza un tratamiento previo ácido y el bloqueo de los lugares de unión de las proteínas de transporte mediante un exceso de IGF-2. El CV intraensayo era<4,3% y la variación interensayo, < 8,4%. La sensibilidad analítica de este método es 2ng/ml.
Para la medición de GH sérica se utilizó el analizador Immulite para hGH (Immulite, DPC, Los Angeles, CA, Estados Unidos). El principio del ensayo es idéntico al descrito para el kit Immulite IGF-1. El CV intraensayo era<6,5% y la variación interensayo, < 6,2%. La sensibilidad analítica de este método es 0,01μg/l.
Análisis estadísticoLas variables cualitativas se presentan con su distribución de frecuencias. Las variables cuantitativas se resumen con su media±desviación estándar y las variables que no siguen una distribución normal se expresan con mediana y rango intercuartílico (RIQ). Las comparaciones de medias se realizaron con el test no paramétrico de la U de MannWhitney o con la prueba de la mediana cuando las variables no siguen una distribución normal. Para valorar la relación entre dos variables se utilizó el coeficiente de correlación de Spearman. Para el estudio de la concordancia de las variables continuas se aplicó el coeficiente de correlación intraclase (CCI) de acuerdo absoluto, junto con su intervalo de confianza (IC) del 95%. Para las variables cualitativas de más de dos categorías se utilizó el índice kappa ponderado por los pesos cuadráticos, junto con su intervalo de confianza del 95%. Para todas las pruebas se aceptó un valor de significación del 5%. Cuando los valores obtenidos por IRMA o CLIA fueron indetectables, el valor que se consideró para el análisis estadístico fue el umbral de sensibilidad. El procesamiento y análisis de los datos se realizó mediante el paquete estadístico SPSS 12.0.
RESULTADOSConcentraciones de IGF-1La concentración media de IGF-1 fue 153 ±65 (intervalo, 85–386) ng/ml medido por IRMA y 144±56 (intervalo, 80–275) ng/ml medido por CLIA. En todos los sujetos las concentraciones se encontraban dentro del intervalo de normalidad para su edad y sexo. La concordancia entre los dos métodos fue buena (CCI=0,78; IC del 95%, 0,51-0,90; p<0,001), pero los datos obtenidos con CLIA mostraron una menor dispersión. Las concentraciones de IGF-1, medidas tanto por IRMA como por CLIA, fueron menores en mujeres que en varones, pero la diferencia no llegó a ser estadísticamente significativa. No encontramos en nuestro grupo correlación entre el IMC y las concentraciones de IGF-1.
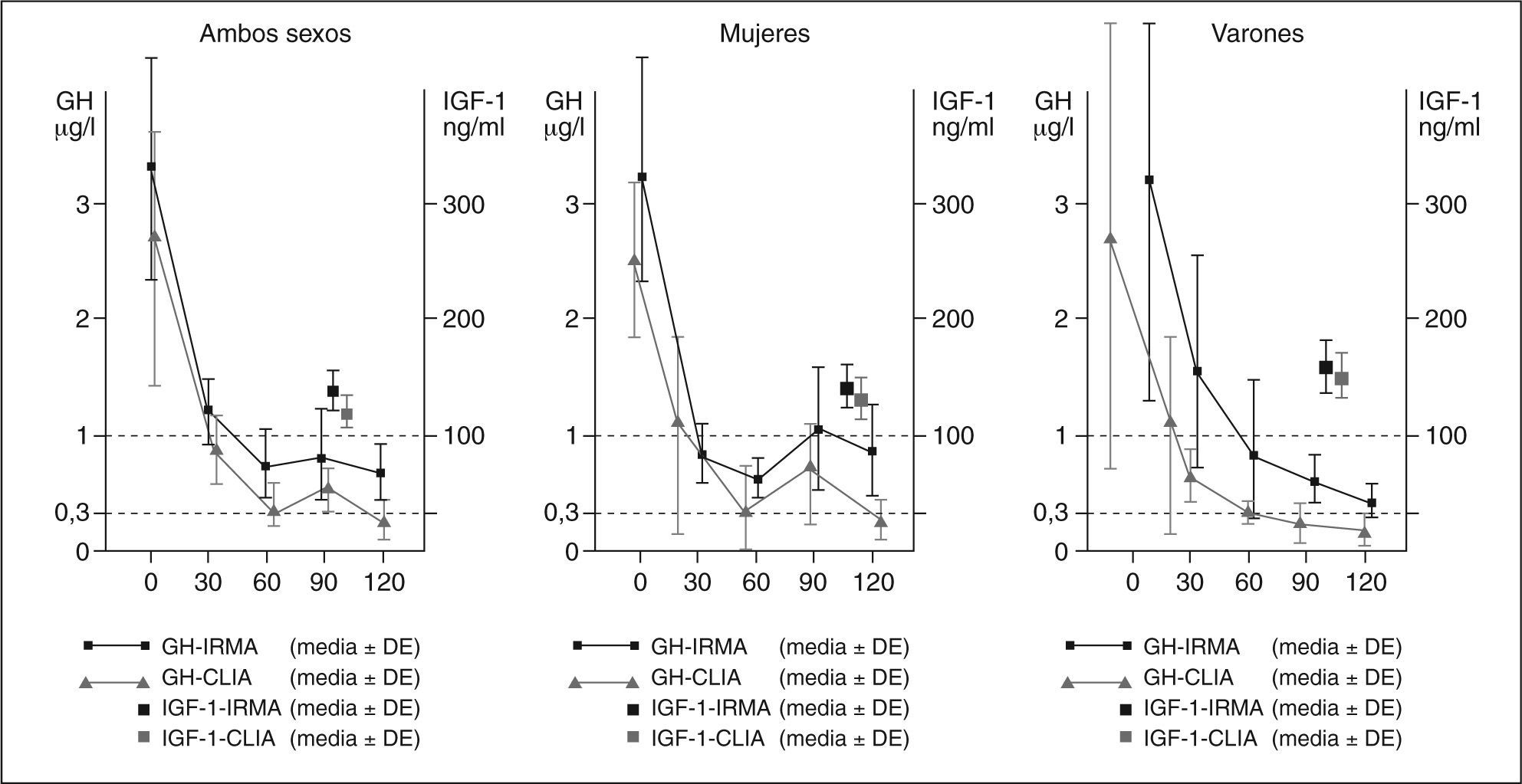
Supresión de GHEncontramos una buena concordancia entre ambos métodos de medida (CCI para GH basal=0,99; IC del 95%, 0,92-0,99; p<0,001; CCI para GH nadir=0,63; IC del 95%, 0,07-0,89; p<0,001). Tanto las concentraciones basales como las obtenidas durante la supresión con SOG fueron mayores con IRMA que con CLIA (fig. 1). La concentración mediana (rango intercuartílico) basal de GH con IRMA frente a CLIA fue 0,8 (0,5-3,0) frente a 0,5 (0,1-2,4) μg/l. La mediana del nadir medido por IRMA en estos sujetos sanos fue 0,4 (0,3-0,5) μg/l (intervalo, 0,2-1,2), y la mediana del nadir medido con CLIA fue 0,08 (0,01-0,22) μg/l (intervalo, 0,1-1). Las mujeres presentaban un nadir medio más elevado con ambos ensayos que los varones, pero la diferencia no llegó a alcanzar la significación estadística. Cuando en cada sujeto se calculó el cociente de GH basal IRMA/CLIA, se obtuvo una mediana de ratio en todo el grupo de 1,68. Igualmente, la mediana de ratio de nadir de GH IRMA/CLIA general fue 4,44.
En uno de los sujetos las concentraciones de GH no descendieron por debajo del rango establecido, con un nadir de 1,2μg/l por IRMA y 1μg/l por CLIA, así se superó el punto de corte establecido para definir la presencia de acromegalia cuando el método de medida utilizado fue IRMA. Otro control obtuvo un nadir de 0,89 y 0,8μg/l medidos por IRMA y CLIA, respectivamente, por encima del punto de corte propuesto más recientemente de 0,3μg/l4.
Al analizar el momento en que se alcanza el nadir con ambos métodos, se observa que no hay concordancia entre IRMA y CLIA (kappa=0,42; IC del 95%, 0,026-0,82; p=0,61). Con los dos métodos el tiempo en que un mayor porcentaje de sujetos sanos alcanzó el nadir (7 sujetos en ambos casos, 36,8%) fue el minuto 120. Sin embargo, considerando el nadir y el valor del minuto 120 aisladamente, y el punto de corte en 1μg/l, dos sujetos serían clasificados como sanos según el nadir, pero con enfermedad activa según el valor obtenido en el minuto 120 (3,3 y 1μg/l por IRMA y CLIA, respectivamente, en un sujeto; 3 y 2,4μg/l por IRMA y CLIA, respectivamente, en el segundo sujeto).
En los sujetos sanos el nadir de GH y los valores de IGF-1 por IRMA y por CLIA no se correlacionaron (r=0,175 y r=−0,03, respectivamente). No encontramos correlación alguna entre la edad y el nadir de GH ni entre el IMC y el nadir de GH en nuestro grupo.
DISCUSIÓNEl método de medida más utilizado habitualmente para la determinación de GH e IGF-1 es el IRMA. En general las ventajas de este ensayo son su rapidez, su reproducibilidad y su especificidad. Sin embargo, también presenta algunos problemas, como la incapacidad para saturar todas las proteínas transportadoras, particularmente en las situaciones clínicas que cursan con concentraciones circulantes bajas de IGF-1, como la diabetes mellitus pobremente controlada o la insuficiencia renal. Otros problemas que puede presentar son la interferencia endógena con ciertos anticuerpos presentes en el suero de algunos pacientes o la falta de reproducibilidad si el valor obtenido se encuentra fuera del intervalo lineal de la curva estándar. La quimioluminiscencia ha permitido mejorar la sensibilidad, lo que favorece un mejor proceso automatizado y una reducción en los tiempos de incubación7. De acuerdo con esto, hemos hallado unas concentraciones mayores de GH, tanto basal como tras supresión con SOG, cuando las medíamos con IRMA que cuando lo hacíamos con CLIA. Cuando calculamos el ratio de GH basal medida con IRMA/CLIA obtuvimos un valor de 1,68; y un ratio de 4,44 para el nadir de GH medida con IRMA/CLIA. Además, los valores de IGF-1 obtenidos con CLIA mostraron una menor dispersión que los obtenidos con IRMA.
Mediante ensayos más modernos, se revisaron los criterios para una supresión normal de GH en sujetos sanos, y también los criterios para establecer o excluir el diagnóstico de acromegalia activa. Con el uso de los nuevos métodos se propuso como criterio diagnóstico de acromegalia la falta de supresión por debajo de 1μg/l tras la SOG1. Uno de nuestros sujetos alcanzó un nadir de GH de 1,2μg/l por IRMA y 1μg/l por CLIA. Según los criterios actuales este sujeto no habría obtenido una supresión dentro del intervalo designado como normal. Todos nuestros controles eran sujetos aparentemente sanos sin ninguna enfermedad que causara una supresión anormal de GH, como insuficiencia renal crónica, insuficiencia hepática, hepatitis activa, hipertiroidismo, diabetes mellitus, anorexia nerviosa o alguna otra forma de desnutrición8. También las mujeres menores de 30 años pueden presentar un nadir de GH más elevado que otros sujetos sanos, especialmente si toman anticonceptivos orales5, 9. Sin embargo, este control era un varón de 25 años con un IMC normal (23) y concentraciones de IGF-1 dentro del intervalo de la normalidad (123ng/ml por IRMA y 105ng/ml por CLIA). De acuerdo con nuestros resultados, otros autores también han encontrado un nadir de GH>1μg/l en sujetos sanos con el ensayo quimioluminiscente Immulite10. Otro de nuestros controles tuvo un nadir de 0,89 y 0,8μg/l medidos por IRMA y CLIA, respectivamente, por encima del punto de corte de 0,3μg/l propuesto recientemente4. Algunos trabajos han mostrado que ciertos pacientes diagnosticados de novo de acromegalia pueden tener un nadir de GH tras SOG por debajo de 1μg/l11, 12. Pero todos estos pacientes presentaban concentraciones elevadas de IGF-1, por lo tanto el diagnóstico de acromegalia sólo se habría perdido si se considerase la supresión de GH tras SOG como único criterio diagnóstico, pero no si se valoran las concentraciones de IGF-1. Por lo tanto, es importante identificar y estudiar a los sujetos con concentraciones elevadas de IGF-1, aunque la respuesta de la GH a la SOG sea aparentemente normal. Sin embargo, en nuestra opinión, no es necesario disminuir el punto de corte en la supresión de GH para el diagnóstico de acromegalia, ya que todo cribado inicial incluye la determinación de las concentraciones de IGF-1.
Un trabajo previo ha indicado que una única determinación de Gh a los 120min tras la SOG, junto con la IGF-1, sería suficiente para la evaluación sistemática de la acromegalia6. Aunque también nosotros hemos hallado que con los dos métodos de medida el minuto 120 fue el tiempo en que un mayor porcentaje de sujetos sanos alcanzó el nadir (7 sujetos en ambos casos, 36,8%), si consideramos el nadir y el valor del minuto 120 aisladamente y el punto de corte en 1μg/l, dos sujetos serían clasificados como sanos según el nadir, pero con enfermedad activa por el valor obtenido en el minuto 120 (3,3 y 1μg/l por IRMA y CLIA, respectivamente, en un sujeto; 3 y 2,4μg/l por IRMA y CLIA, respectivamente, en el segundo sujeto). Por lo tanto, en nuestra experiencia, es recomendable realizar la SOG clásica con determinaciones de GH cada 30min.
Algunos autores han encontrado correlación entre las concentraciones de GH tras la SOG y la concentración de IGF-1 en pacientes acromegálicos13. Sin embargo, en nuestro grupo de sujetos sanos no hemos podido observar dicha relación. Nuestros datos están en concordancia con los estudios previos de Freda et al3, 14, en los que las concentraciones de IGF-1 se correlacionan con el nadir de GH sólo en pacientes con enfermedad activa, pero no en aquellos en remisión ni en los controles sanos.
Hay datos a favor de diferencias entre sexos respecto a la secreción de GH e IGF-1. Las mujeres para alcanzar concentraciones de IGF-1 similares a las de los varones necesitan una mayor secreción de GH, y en caso de déficit de GH, necesitan una mayor dosis sutitutiva15, 16, lo que indica una resistencia relativa en la secreción de IGF-1 estimulada por GH en las mujeres. Esta resistencia relativa pudiera deberse al efecto del ambiente estrogénico en la producción de IGF-117. En nuestro grupo, hemos observado una tendencia hacia unas concentraciones más bajas de IGF-1 en mujeres sanas que en varones, y un nadir medio de GH más elevado en mujeres con los dos métodos de medida, aunque en ningún caso las diferencias llegaron a ser estadísticamente significativas. Otros estudios sí que han confirmado estas diferencias, ya que encontraron concentraciones de IGF-1 más bajas18 y un nadir de GH significativamente mayor en mujeres5, 10. Por el contrario, otros trabajos no han encontrado diferencias en las concentraciones de IGF-1 o nadir de GH entre varones y mujeres, ya sean sanos o con acromegalia3, 14.
Aunque la secreción de GH disminuye con la edad, no hay intervalos ajustados por edad para valorar la supresión de la GH a la SOG. En los sujetos sanos que hemos estudiado, no hemos encontrado correlación alguna entre la edad y los valores del nadir de GH, tal y como han publicado otros autores5, 10, 18. En otro trabajo el nadir de GH era significativamente mayor en mujeres jóvenes que en las de mayor edad, pero en varones no se observó esta disminución en el nadir de GH con la edad9. Sin embargo, en la mayoría de los estudios, de acuerdo con nuestros resultados, no se ha encontrado ninguna correlación entre la edad y el nadir de GH, ya se trate de controles sanos, pacientes en remisión o pacientes con enfermedad activa3, 14.
También se ha estudiado la relación entre el IMC y la secreción de IGF-1 y supresión de GH. Nosotros no encontramos correlación entre el IMC y el nadir de GH o entre el IMC y las concentraciones de IGF-1 en nuestros sujetos sanos, de acuerdo con trabajos previos3, 5. Otros estudios incluso indican una correlación negativa entre el IMC y el nadir de GH18, y entre el IMC y la concentración de IGF-119.
En conclusión, para la evaluación del eje GH/IGF-1 se debería utilizar un ensayo inmunométrico altamente sensible. En nuestra opinión, no hay necesidad de disminuir el punto de corte de supresión de GH tras SOG para el diagnóstico de acromegalia, ya que el cribado inicial siempre incluye la determinación de IGF-1. Finalmente, se necesitan bases de datos cuidadosamente caracterizadas de concentraciones de IGF-1 y supresión de GH para determinar la relevancia del sexo, la edad y el IMC en la evaluación bioquímica de la acromegalia. No obstante, nosotros no encontramos diferencias significativas en el nadir de GH en cuanto a sexo, edad o IMC, por lo que nuestros resultados no apoyan la idea de utilizar diferentes criterios en la respuesta de GH a SOG en mujeres o en varones y en sujetos jóvenes o de mayor edad.