Los agonistas del péptido similar al glucagón-1 (GLP-1) reducen los niveles de glucosa con muy bajo riesgo de hipoglucemia, limitan el aumento de peso asociado a la insulinoterapia y presentan efectos favorables sobre la dislipidemia, hipertensión, función endotelial, contractilidad cardíaca, lipoproteínas intestinales, inflamación y marcadores indirectos de función renal1–3.
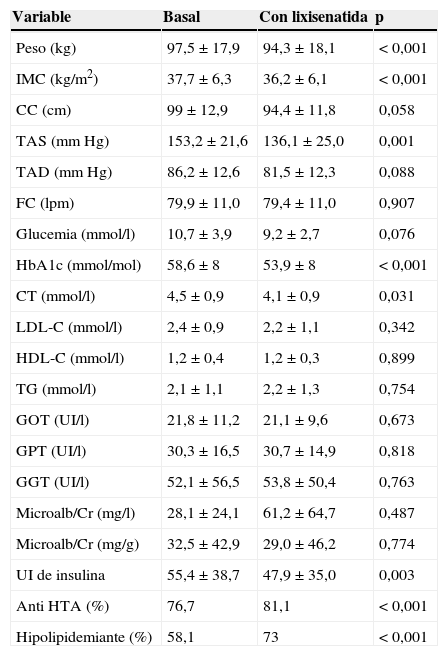
Realizamos un estudio prospectivo con medidas de cambio intrasujeto de 43 pacientes (62,8% mujeres) con diabetes tipo 2 y obesidad que inician tratamiento con lixisenatida (Lyxumia®, Sanofi Aventis S.A.) para valorar su tolerancia y los efectos sobre el peso y el control metabólico. Se analizaron los subgrupos sin y con tratamiento previo antihipertensivo (23,3% y 76,7% respectivamente) e hipolipidemiante (41,9% y 58,1% respectivamente), y la aparición de efectos secundarios. La edad media fue 58±13,4 años y la duración media de diabetes de 11,9±7,3 años. Presentaban antecedentes familiares de enfermedad cardiovascular (ECV) un 41,4% y de diabetes un 62,9%. El tratamiento en la visita inicial era: 86% agentes orales, 18,6% análogos de GLP-1 y 79,1% insulina (basal 37,2%, premezclas 25,6% y basal-bolo 16,3%). El tiempo medio de revisión tras el inicio de lixisenatida fue 3,9±1,5 meses. La tabla 1 muestra la evolución de las variables clínico-analíticas. La mejoría de la tesión arterial sistólica (TAS) y del colesterol total (CT) seguía siendo significativa en los subgrupos sin y con antihipertensivos antes y después del tratamiento con lixixenatida (TAS antes 147±26,5mmHg vs TAS después 113,6±7,9mmHg; p=0,023 y TAS antes 153,6±21mmHg vs TAS después 140,0±25,4mmHg; p=0,020, respectivamente) mientras que el descenso de CT solo se mantuvo significativo en el subgrupo que ya tomaba hipolipidemiantes antes de iniciar lixisenatida (CT antes 178,5±36mg/dl vs CT después 152,6±25,6mg/dl; p=0,007), que además mostró descenso significativo de LDL-colesterol (LDL-C) (LDL-C antes 93,3±37,2mg/dl vs LDL-C después 73,1±25,9mg/dl; p=0,023). No se observó alteración de las cifras de amilasa (amilasa media 40,6±6,7UI/l). Respecto a la tolerancia digestiva el 20% no lo toleró, el 5% toleró 10mcg/día y el 75% toleró 20mcg/día.
Evolución de las variables clínico-analíticas antes y después del tratamiento con lixisenatida
| Variable | Basal | Con lixisenatida | p |
|---|---|---|---|
| Peso (kg) | 97,5±17,9 | 94,3±18,1 | <0,001 |
| IMC (kg/m2) | 37,7±6,3 | 36,2±6,1 | <0,001 |
| CC (cm) | 99±12,9 | 94,4±11,8 | 0,058 |
| TAS (mmHg) | 153,2±21,6 | 136,1±25,0 | 0,001 |
| TAD (mmHg) | 86,2±12,6 | 81,5±12,3 | 0,088 |
| FC (lpm) | 79,9±11,0 | 79,4±11,0 | 0,907 |
| Glucemia (mmol/l) | 10,7±3,9 | 9,2±2,7 | 0,076 |
| HbA1c (mmol/mol) | 58,6±8 | 53,9±8 | <0,001 |
| CT (mmol/l) | 4,5±0,9 | 4,1±0,9 | 0,031 |
| LDL-C (mmol/l) | 2,4±0,9 | 2,2±1,1 | 0,342 |
| HDL-C (mmol/l) | 1,2±0,4 | 1,2±0,3 | 0,899 |
| TG (mmol/l) | 2,1±1,1 | 2,2±1,3 | 0,754 |
| GOT (UI/l) | 21,8±11,2 | 21,1±9,6 | 0,673 |
| GPT (UI/l) | 30,3±16,5 | 30,7±14,9 | 0,818 |
| GGT (UI/l) | 52,1±56,5 | 53,8±50,4 | 0,763 |
| Microalb/Cr (mg/l) | 28,1±24,1 | 61,2±64,7 | 0,487 |
| Microalb/Cr (mg/g) | 32,5±42,9 | 29,0±46,2 | 0,774 |
| UI de insulina | 55,4±38,7 | 47,9±35,0 | 0,003 |
| Anti HTA (%) | 76,7 | 81,1 | <0,001 |
| Hipolipidemiante (%) | 58,1 | 73 | <0,001 |
Los datos están expresados como media±desviación estándar.
CC: circunferencia de cintura; CT: colesterol total; FC: frecuencia cardíaca; GGT: gamma-glutamil transpeptidasa; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico-pirúvica; HbA1c: hemoglobina glucosilada; HDL-C: HDL-colesterol; HTA: hipertensión arterial; IMC: índice de masa corporal; LDL-C: LDL-colesterol; Microalb/Cr: cociente microalbúmina/creatinina; TAD: tensión arterial diastólica; TAS: tesión arterial sistólica; TG: triglicéridos; UI: unidades de insulina.
En nuestro estudio no observamos mejoría significativa de la glucemia en ayunas. Los análogos de GLP-1 han mostrado mejorías similares de la glucemia basal, aunque lixisenatida 20mcg alcanza mayores reducciones del área bajo la curva respecto a la glucemia posprandial y mayor enlentecimiento de vaciado gástrico4. Encontramos un descenso significativo de HbA1c en nuestros pacientes. Los análogos de GLP-1 han demostrado no inferioridad respecto a otros agentes hipoglucemiantes5, e incluso mayor y similar reducción de la HbA1c en un metaanálisis respecto a agentes orales e insulina basal y bifásica, respectivamente6.
Observamos reducción significativa de peso e IMC, en consonancia con lo descrito por otros autores7, con una pérdida media de peso de 3,2kg. Estos resultados son similares a los publicados previamente con reducciones de 1,4kg y 4,8kg frente a placebo e insulina respectivamente5, así como reducciones de 3,31kg frente a controles diabéticos bajo otros tratamientos y de 1,22kg comparado con placebo en un metaanálisis8.
Pese a conseguir disminuciones similares de HbA1c, se ha descrito un 35% menos de hipoglucemias con GLP-1 que con insulina7. Meier et al. encontraron mayor riesgo de hipoglucemias con lixisenatida frente a liraglutida4 frente a lo observado por Rosenstock et al., con menos hipoglucemias sintomáticas en el grupo de lixisenatida (2,5% vs 7,9%; p<0,05)9. En línea con este último estudio, nuestros pacientes no presentaron hipoglucemias sintomáticas.
Se ha descrito un perfil de tolerabilidad digestiva más favorable de lixisenatida frente a exenatida 2 veces al día9 y liraglutida4. La mayoría de los pacientes de nuestro estudio presentaron buena tolerancia al tratamiento con lixisenatida.
Respecto al perfil lipídico se observó mejoría de las cifras de CT, que se mantuvieron significativas en el subgrupo que ya tomaba hipolipidemiantes, junto a un descenso significativo de LDL-C. En consonancia con nuestros resultados otros autores han descrito mejoría de los lípidos en pacientes tratados con análogos de GLP-11–3.
El tratamiento con lixisenatida redujo las cifras de TAS, sin alcanzar significación estadística respecto a las cifras de TA diastólica. Estos resultados concuerdan con lo publicado por otros autores7,8.
No encontramos cambios significativos en la frecuencia cardíaca (FC). Sin embargo, un metaanálisis concluye que los análogos de GLP-1 incrementan la FC en 1,86 latidos por minuto frente a placebo y en 1,90 latidos por minuto frente a otros antidiabéticos, siendo más evidente este efecto con liraglutida que con exenatida 2 veces al día8. Lixisenatida produce menor elevación5, e incluso descenso de la FC10 respecto a liraglutida.
Nuestro estudio presenta limitaciones, tales como el reducido número de trabajos publicados de la práctica clínica habitual con los que poder comparar nuestros resultados, el pequeño tamaño muestral, el corto periodo de seguimiento y no haber evaluado la glucemia posprandial.
Nuestro análisis muestra que el tratamiento con lixisenatida mejora de forma significativa los parámetros antropométricos, el control glucémico en términos de HbA1c con menos requerimientos de insulina y el descenso significativo de TAS y CT. Encontramos buena tolerancia en la mayoría de los pacientes. Además, observamos una significativa intensificación del tratamiento antihipertensivo e hipolipidemiante, no solo hipoglucemiante, en nuestra práctica clínica, con un abordaje metabólico global de los pacientes. Se requieren estudios más duraderos y de amplios tamaños muestrales para evaluar la eficacia y seguridad a largo plazo de las terapias con análogos de GLP-1.
FinanciaciónPublibeca otorgada por el Comité científico del xxvi Congreso Nacional de la Sociedad Española de Diabetes gracias a la colaboración de AstraZeneca.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
A los pacientes que han participado en el estudio, a la Sociedad Española de Diabetes y al Dr. Gabriel Olveira-Fuster, jefe de la UGC de Endocrinología y Nutrición, Hospital Regional Universitario Carlos Haya, Málaga.