La obesidad mórbida es una enfermedad grave asociada a múltiples comorbilidades, y a un incremento de la mortalidad1. Por su escasa respuesta al tratamiento conservador (dietético, conductual y farmacológico), y por el incremento de su prevalencia, se ha desarrollado una alternativa terapéutica, la cirugía bariátrica, que ha mostrado su eficacia para la reducción del peso a largo plazo y la mejora o resolución de comorbilidades asociadas como la diabetes, hipertensión arterial y dislipemia.
Las complicaciones a medio y largo plazo de la cirugía gástrica han sido bien definidas, incluyendo déficits nutricionales, complicaciones gastrointestinales y neuropatía. Una complicación poco frecuente pero grave, descrita recientemente, es la hipoglucemia postprandial2, debida a hiperinsulinemia endógena. Aunque algunos autores lo consideran una manifestación tardía del síndrome de dumping3, sus características clínicas con síntomas neuroglucopénicos graves, su aparición tardía, tras meses o años de un by-pass gástrico, y la falta de respuesta a tratamiento dietético, la convierten en una entidad bien diferenciada cuyos mecanismos fisiopatológicos aún no han sido bien aclarados.
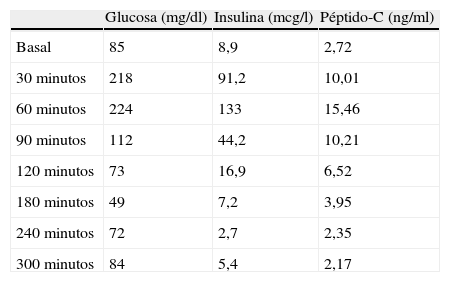
Presentamos el caso de una mujer de 41 años con obesidad mórbida, sin historia previa de diabetes ni clínica previa similar, que mostró episodios repetidos de hipoglucemia grave, un año después de una re-intervención de by-pass gástrico (conversión a Y de Roux). La paciente acudió a nuestro servicio a los 34 años de edad. Refería incremento de peso progresivo desde la adolescencia, hábito dietético compulsivo con frecuentes atracones, picoteo habitual y seguimiento de múltiples regímenes dietéticos con ganancias ponderales posteriores, a pesar de recibir ayuda farmacológica ocasional. A la exploración física destacaba: peso de 142kg, talla de 164cm, con IMC (índice de masa corporal) de 52,8kg/m2. Previamente a la cirugía, se realizó una sobrecarga oral de glucosa (SOG), destacando únicamente unos valores anormalmente elevados de insulina a las 2 horas (96,1 microU/ml) con glucemia dentro de los límites de la normalidad (132mg/dl). Se programó para by-pass gástrico, realizándose gastroyeyunostomía y anastomosis yeyuno-yeyunal, dejando un reservorio gástrico de 30ml, con un asa alimentaria de 140cm, un asa biliopancreática de 80cm y un asa común de 340cm. La evolución inicial fue satisfactoria con pérdida importante de peso (descenso hasta 104kg e IMC de 38,6kg/m2). Sin embargo, a los 2 años hubo una recuperación parcial del peso hasta 122kg e IMC de 45kg/m2. Finalmente, se optó por una nueva intervención, realizándose alargamiento del by-pass gástrico con resección de fondo de saco dilatado (15cm) distal a la anastomosis y reconstruyéndose un nuevo pie de asa a 80cm de la válvula ileocecal junto a eventroplastia. Un año tras la re-intervención, el peso era de 103kg con un IMC de 38kg/m2. La paciente comenzó a presentar episodios de hipoglucemia objetivada (glucemias capilares<50mg/dl, así como una glucosa plasmática de 41mg/dl) con sintomatología principalmente neuroglucopénica (debilidad, mareo y visión borrosa, con caídas y traumatismos ocasionales), progresivamente más frecuentes hasta 1 o 2 episodios semanales, durante el período postprandial tardío, sin relación con el contenido de la ingesta, y nunca tras ayuno prolongado. Hubo una discreta ganancia ponderal (109kg). La función tiroidea y el eje hipófiso-suprarrenal se encontraban dentro de la normalidad. Se realizó test de ayuno, que resultó negativo tras 72 horas, y SOG, con rápida elevación de la glucemia a los 30 y 60 minutos, respuesta insulínica elevada e hipoglucemia a los 180 minutos, con perfil de insulina y péptido-C inapropiadamente elevados para esa cifra de glucosa (tabla 1). Se diagnosticó hipoglucemia reactiva tras cirugía bariátrica, recomendando ingestas frecuentes cada 3 horas, pobres en hidratos de carbono, y 50mg de acarbosa 3 veces al día con buena tolerancia (ligera flatulencia). Tras 3 meses la paciente experimentó una reducción en la frecuencia y en la intensidad de los episodios de hipoglucemia.
Resultados de la prueba de sobrecarga oral de glucosa en el caso presentado.
| Glucosa (mg/dl) | Insulina (mcg/l) | Péptido-C (ng/ml) | |
| Basal | 85 | 8,9 | 2,72 |
| 30 minutos | 218 | 91,2 | 10,01 |
| 60 minutos | 224 | 133 | 15,46 |
| 90 minutos | 112 | 44,2 | 10,21 |
| 120 minutos | 73 | 16,9 | 6,52 |
| 180 minutos | 49 | 7,2 | 3,95 |
| 240 minutos | 72 | 2,7 | 2,35 |
| 300 minutos | 84 | 5,4 | 2,17 |
Los primeros casos de hipoglucemia postprandial reactiva tras cirugía bariátrica fueron descritos en el año 20052. Esta complicación aparece meses o años después de la cirugía, y cumple los criterios del denominado síndrome de hipoglucemia de origen pancreático no producida por insulinoma4. Se considera que su incidencia es baja, si bien no ha sido aún realmente cuantificada5.
Como en nuestro caso, se suele presentar como episodios de hipoglucemia con clínica predominantemente neuroglucopénica, entre 2 a 4 horas tras la ingesta. Su diagnóstico se basa en la SOG prolongada, donde existe un patrón característico, con hiperglucemia e hiperinsulinemia a los 30 minutos, descenso entre las 2 y 3 horas siguientes a una glucemia inferior a 50mg/dl con niveles de insulina y péptido-C, inapropiadamente elevados, y finalmente normalización espontánea. El test de ayuno y las técnicas de imagen pancreáticas son normales. Este tipo de respuesta es similar a la presentada en nuestro caso.
Algunos autores consideran a esta entidad una manifestación tardía del síndrome de dumping3. Sin embargo, el caso que presentamos es diferente en aspectos clínicos y temporales. Consideramos, al igual que otros autores6, que se trata de 2 cuadros bien diferenciados, con mecanismos fisiopatológicos distintos. En la hipoglucemia reactiva existiría una alteración grave en la regulación de la secreción de la insulina asociada a cambios anatomopatológicos que perpetuarían esta situación. Otros mecanismos propuestos (disminución de la resistencia a la insulina tras la derivación gástrica, junto a la hipertrofia de células beta pancreáticas en obesos mórbidos, detectada precozmente tras la intervención7) tampoco explicarían el lapso de tiempo hasta la aparición de la hipoglucemia reactiva.
Por tanto, podría tratarse de un problema funcional asociado a cambios metabólicos, que aparecen por las modificaciones anatómicas realizadas en la derivación gástrica, que producirían un rápido flujo de nutrientes a íleon distal y un incremento en la liberación de GLP-1 (glucagon like peptide-1) por las células L, tal y como mostraron Goldfine et al8. Este péptido se ha relacionado con la hipoglucemia reactiva, con el aumento de la masa de estas células al inducir su proliferación y neogénesis, y con la disminución de la apoptosis en los islotes pancreáticos en roedores. Por otra parte, los estudios en pacientes que precisaron tratamiento quirúrgico mediante pancreatectomía parcial9, revelaron una hiperplasia difusa de los islotes pancreáticos, a partir del epitelio ductal, compatible con el concepto de nesidioblastosis. Asimismo, se ha sugerido una hiperactividad de la célula beta y un incremento de la expresión de factores proteicos asociados con la neogénesis de islotes pancreáticos10.
El objetivo del tratamiento médico es evitar el pico de hiperglucemia postprandial mediante medidas dietéticas, tales como el fraccionamiento de la ingesta y evitar alimentos ricos en azúcares, y la administración de acarbosa, que retrasa la absorción de hidratos de carbono. En pacientes con mala respuesta se ha intentado tratamientos con somatostatina, con escasos resultados, y como último recurso el tratamiento quirúrgico11.
En conclusión, la hipoglucemia tras derivación gástrica es una complicación rara, pero cada vez más frecuente dado el incremento del uso de la cirugía bariátrica. Es una patología potencialmente grave, dadas sus repercusiones clínicas. Es importante establecer los mecanismos fisiopatológicos para un mejor enfoque terapéutico, así como identificar a los pacientes con predisposición a desarrollarla. Aunque el punto de partida parece ser el rápido tránsito de los nutrientes con una liberación excesiva de GLP-1 por las células L del íleon distal, provocando una hiperestimulación secundaria de las células beta pancreáticas, otros factores anatómicos, hormonales y genéticos podrían contribuir a su aparición, siendo necesarios más estudios.