Aproximadamente, la mitad de los niños diabéticos presentan cetoacidosis diabética (CAD) en el momento de su diagnóstico (4,6-8/1.000 pacientes diabéticos/año). Es la principal causa de morbimortalidad por esta enfermedad, y su reducción depende del manejo adecuado. En esta revisión se presenta una descripción de la fisiopatología de la CAD, sus manifestaciones clínicas y su manejo.
Diabetic ketoacidosis (DKA) is present in nearly half of all diabetic children and adolescents at diagnosis. The incidence is 4.6 to 8 cases/1000 diabetics per year. DKA is a major cause of mortality and morbidity, which can only be reduced by appropriate treatment. The present article describes the physiopathology and clinical manifestations of DKA and discusses the management of this entity.
Aproximadamente en el 35-45 % de los niños y adolescentes se identifica cetoacidosis diabética (CAD) en el momento del diagnóstico de la diabetes tipo 1. La incidencia anual de la CAD varía de 4,6 a 8 episodios por 1.000 pacientes con diabetes y es la principal causa de morbilidad y mortalidad en casos de diabetes mellitus tipo 1. La mortalidad predominantemente se asocia al edema cerebral y sólo una minoría de las muertes se atribuyen a otras causas. El edema cerebral ocurre en cerca de un 0,3-1% de todos los episodios de CAD, y su etiología y el método ideal de tratamiento son pobremente entendidos. Es debatido si al tratar la CAD se puede prevenir o predecir el edema cerebral. La prevención de la CAD y la reducción de su incidencia debe ser una meta en el manejo de los niños y adolescentes con diabetes1.
DEFINICIÓNLa CAD es el estado de descompensación metabólica grave manifestada por la sobreproducción de cuerpos cetónicos y cetoácidos que se desplazan a la circulación y resultan en acidosis metabólica. Es causada por una disminución en las concentraciones de insulina en relación con un incremento en las hormonas moduladoras, incluidos el glucagón, las catecolaminas, el cortisol y la hormona de crecimiento, lo cual lleva a un aumento en la producción de glucosa por el hígado y el riñón, y disminuye la utilización periférica de glucosa con la consecuente hiperglucemia e hiperosmolaridad. El incremento en la lipólisis y la producción de cuerpos cetónicos (betahidroxibutirato y acetoacetato) causa cetonemia y acidosis metabólica. Por tanto las principales características de la CAD son la cetonemia, la cetonuria, la acidosis metabólica y la deshidratación.
Los criterios bioquímicos para el diagnóstico de CAD incluyen hiperglucemia mayor de 250mg/dl, acidosis metabólica con pH menor de 7,3 y/o bicarbonato menor de 15mEq/l, cetonemia, cetonuria1-4. En ocasiones excepcionales se observa que pacientes jóvenes o niños parcialmente tratados o adolescentes embarazadas presentan valores de glucemia cercanos a los normales (cetoacidosis euglucémica).
FRECUENCIA DE CETOACIDOSIS DIABÉTICADiagnóstico de novoHay una amplia variación geográfica en la frecuencia de la CAD como presentación de diabetes mellitus. El intervalo de prevalencia comunicado en Europa y América del Norte varía entre el 15 y el 67%. En Canadá y Europa la tasa de hospitalización por CAD en pacientes con diagnóstico de novo o con antecedente de diabetes tipo 1 se ha mantenido estable en 10/100.000 niños en los últimos 20 años y la gravedad parece estar disminuyendo.
La CAD como diagnóstico de inicio de diabetes mellitus tipo 1 (DM1) es más común en niños menores de 4 años, y niños sin un familiar de primer grado con DM1.
Las dosis altas de corticoides, antipsicóticos atípicos, diazóxido y algunos medicamentos inmunosupresores se han relacionado con el desarrollo de CAD en individuos sin diagnóstico previo de DM11-4.
En niños con diagnóstico de DM1El riesgo de CAD en pacientes con DM1 es del 1-10%/paciente/año. El riesgo se incrementa en niños con episodios previos de CAD, niñas púberes y adolescentes, con un estrato socioeconómico bajo, y en niños con afecciones psiquiátricas, incluidos trastornos alimentarios y conflictos familiares.
Un 75% de los episodios de CAD probablemente están relacionados con no aplicar insulina o errores en el tratamiento. El porcentaje restante se relaciona con terapia insulínica inadecuada durante enfermedades intercurrentes1-4.
MORBILIDAD Y MORTALIDAD EN NIÑOS CON CETOACIDOSIS DIABÉTICAEn Estados Unidos la tasa de mortalidad comunicada en pacientes pediátricos con CAD es del 0,15%; del 0,18% en Canadá y el 0,31% en Gran Bretaña. En países subdesarrollados el riesgo de morir por CAD es mayor, y los niños pueden fallecer incluso antes de recibir tratamiento.
El edema cerebral causa un 57-87% de todas las muertes por CAD. Otras causa posibles de mortalidad y morbilidad incluyen hiperpotasemia, hipoglucemia, complicaciones en el sistema nervioso central (SNC), como hematomas, trombosis, sepsis y edema pulmonar, entre otras.
Las secuelas tardías asociadas a edema cerebral y otras complicaciones del SNC incluyen la insuficiencia hipotálamo-hipofisaria, la deficiencia de somatotropina (GH) y la deficiencia combinada de GH y tirotropina (TSH)1-4.
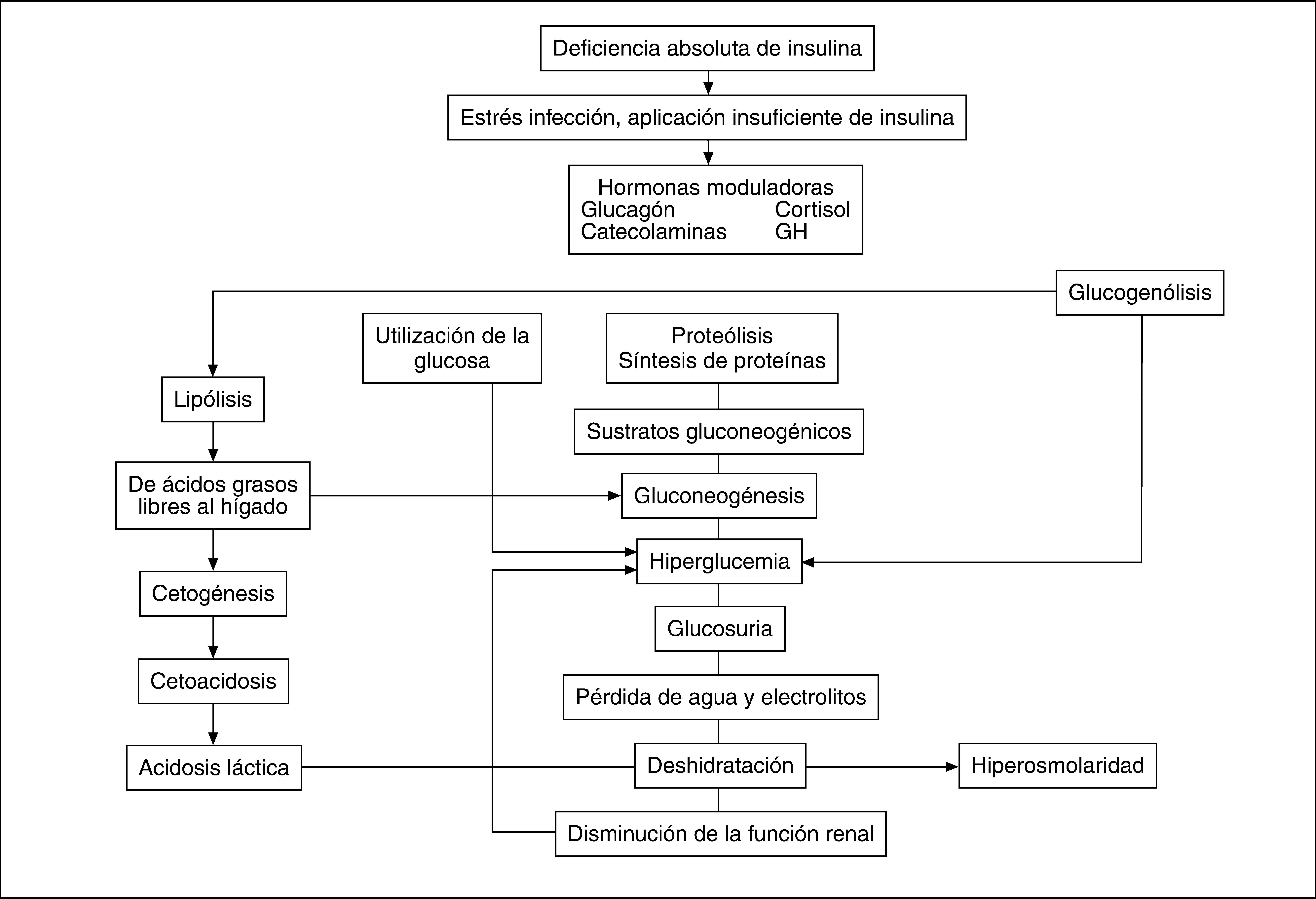
FISIOPATOLOGÍACetogénesisEl proceso se inicia por una grave hipoinsulinemia y un exceso de hormonas moduladoras, en particular de catecolaminas cuya secreción está aumentada por la enfermedad concurrente y por el estrés fisiológico ocasionado por la deficiencia insulínica. Estos factores aumentan la actividad de la lipasa (enzima muy sensible a la insulina), que incrementa la lipólisis a partir del tejido adiposo, lo que se traduce en un aumento de las concentraciones de ácidos grasos no esterificados circulantes. Éstos constituyen el sustrato principal de la cetogénesis hepática, que por acción de la coenzima A (CoA) son transformados en acil-CoA derivados y transportados, mediante un transportador a partir de la carnitina, al interior de las mitocondrias, donde experimentan una betaoxidación a acetil-CoA (que en condiciones normales es oxidado completamente en el ciclo tricarboxílico o utilizado en la síntesis de lípidos). La cantidad elevada de derivados de acil-CoA que entran en la mitocondria saturan la vía metabólica normal. Por lo tanto, algunos de éstos son parcialmente oxidados a acetoacetato y 3 betahidroxibutirato que constituyen los cuerpos cetónicos. El acetoacetato se descarboxila espontáneamente a acetona, cuyo olor característico es fácilmente detectable al eliminarse en la respiración.
La acidosis en la CAD se debe al exceso de acetoacetato y 3 betahidroxibutirato, dado que el ion hidrógeno de estos ácidos neutraliza el bicarbonato, lo que ocasiona su disminución en el suero y la disminución del pH. En la mayoría de los tejidos (excepto el hígado) hay un sistema enzimático capaz de utilizar los cuerpos cetónicos. En la reacción se generan iones bicarbonato que contrarrestan la acidosis producida por la acumulación de ácidos grasos. A través de la orina y la respiración se elimina otra fracción de los cuerpos cetónicos (fig. 1)2,5.
Esquema de la fisiopatología de la cetoacidosis diabética. Adaptado de Wolfsdorf2.
Cuando se alcanza el umbral renal para la reabsorción de glucosa, la hiperglucemia produce diuresis osmótica que lleva a deshidratación y pérdida de electrolitos. La cetonuria produce los mismos efectos aunque menos pronunciados.
El aumento de la osmolalidad plasmática ocasiona pérdida de agua intracelular y crea un gradiente osmótico que desplaza agua hacia el compartimento extracelular, lo que puede ocasionar hiponatremia, que en la CAD puede descender de 1,6 a 1,8mEq por 100mg/dl de aumento de la glucemia. La expansión temporal de agua en el compartimento extracelular al comienzo de la cetoacidosis lleva a aumento de la filtración glomerular. La glucosuria causa una diuresis osmótica con pérdidas de sodio, potasio, magnesio y fosfatos.
La disminución del volumen plasmático reduce el flujo renal y con ello también la capacidad del riñón para filtrar la glucosa y los cuerpos cetónicos. El mayor número de iones H+ en el plasma induce su flujo hacia el interior de las células en las que desplaza los iones K+, que son eliminados. De este modo, aún cuando las concentraciones de potasio en plasma pueden ser elevadas o normales puede haber una considerable depleción tisular de potasio5.
CLASIFICACIÓNLa CAD se clasifica generalmente por la gravedad de la acidosis de la siguiente manera2,4,6-8:
- 1.
Leve: pH < 7,3 y bicarbonato < 15mmol/l.
- 2.
Moderada: pH < 7,2 y bicarbonato < 10mmol/l.
- 3.
Grave: pH < 7,1 y bicarbonato < 5mmol/l.
La acidosis no corregida grave puede tener un efecto inotrópico negativo en el músculo cardíaco, lo cual puede ocasionar o exacerbar la hipotensión arterial por vasodilatación periférica y, en casos extremos, arritmias ventriculares. También puede producir depresión respiratoria, lo que disminuye la eliminación del dióxido de carbono y reduce aún más el pH.
DIAGNÓSTICO Y EVALUACIÓN INICIALFactores desencadenantesEl factor desencadenante más común en el desarrollo de CAD son las infecciones (neumonía e infección urinaria en un 30-40% de los casos, gastroenteritis, gripe, otitis media, meningitis, apendicitis y sepsis).
Otros factores desencadenantes son los traumatismos y los fármacos, así como el cuadro inicial de una diabetes mellitus que pueden llegar a representar el 20-25% de las causas de CAD, la terapia insulínica inadecuada o su omisión en el 15-20% de los pacientes con antecedente de diabetes tipo 1.
Los fármacos que afectan al metabolismo de los carbohidratos, como los glucocorticoides, tiacidas y simpático-miméticos (dobutamina, terbutalina, entre otros), pueden precipitar el desarrollo de CAD.
En adolescentes con DM1 los problemas psicosociales asociados a trastornos de la conducta alimentaria son un factor que contribuye en el 20% de los casos a cetoacidosis recurrente1,2,5.
Manifestaciones clínicasFrecuentemente, los signos clínicos y los síntomas de la CAD en el paciente pediátrico no se correlacionan con la gravedad de la acidosis ni de la deshidratación. Por tanto, los niños que consultan y en quienes se sospecha una CAD deben ser considerados como críticamente enfermos hasta que la evaluación completa pruebe lo contrario.
Los signos clásicos de la CAD incluyen: hiperglucemia (poliuria, polidipsia, nicturia), acidosis (hiperventilación, dolor abdominal) y deshidratación, que se identifica por hallazgos en el examen físico tales como: mucosas secas, ausencia de lágrimas, pobre turgencia de la piel, pérdida aguda de peso y pobre perfusión. La deshidratación asociada con CAD puede acompañarse de hipotensión arterial ortostática.
Los pacientes pueden tener un olor dulce del aliento como resultado de la cetosis. El dolor abdominal puede confundirse con gastroenteritis o un cuadro quirúrgico; también puede presentarse como un cuadro de íleo.
Además, pueden presentar sed extrema, taquicardia, náuseas, vómito, hipotensión arterial, debilidad, anorexia, deshidratación, piel seca y caliente, alteraciones visuales, hiperventilación (respiración de Kussmaul), somnolencia, hipotermia, hiporreflexia y deterioro del estado de conciencia. La fiebre es rara, pero si está puede ser a causa de una infección subyacente.
El choque y el coma no son frecuentes en niños con CAD a menos que sean inusualmente prolongados o graves o que se desarrolle edema cerebral.
Como se mencionó anteriormente, las manifestaciones clínicas de la CAD, en niños, son diversas y variadas y, con excepción del estado de conciencia, no se correlacionan con el grado de gravedad5.
Hallazgos de laboratorioLa evaluación inicial de los pacientes con sospecha de CAD debe incluir: determinación de glucemia, nitrógeno ureico, creatinina, cetonemia, electrolitos (con cálculo de hiato aniónico), osmolalidad, análisis de orina, gases arteriales, hemograma y electrocardiograma. En caso de sospecha de infección, deben tomarse muestras para hemocultivos y urocultivo. Si se sospecha que el origen infeccioso es pulmonar, se realizará una radiografía de tórax6.
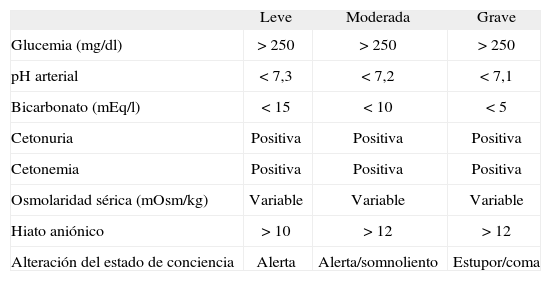
Los criterios diagnósticos para CAD son: hiperglucemia > 250mg/dl, acidosis metabólica con pH < 7,3 y/o bicarbonato < 15mEq/l, cetonemia y cetonuria positivas2,4 (tabla 1).
Criterios diagnósticos de la cetoacidosis diabética
| Leve | Moderada | Grave | |
| Glucemia (mg/dl) | > 250 | > 250 | > 250 |
| pH arterial | < 7,3 | < 7,2 | < 7,1 |
| Bicarbonato (mEq/l) | < 15 | < 10 | < 5 |
| Cetonuria | Positiva | Positiva | Positiva |
| Cetonemia | Positiva | Positiva | Positiva |
| Osmolaridad sérica (mOsm/kg) | Variable | Variable | Variable |
| Hiato aniónico | > 10 | > 12 | > 12 |
| Alteración del estado de conciencia | Alerta | Alerta/somnoliento | Estupor/coma |
Otras alteraciones bioquímicas que se pueden encontrar son las siguientes: hiato aniónico elevado, leucocitosis, hiponatremia, hipopotasemia o hiperpotasemia, hipofosfatemia, hiperosmolalidad o hiperamilasemia.
Si es posible se deben determinar las concentraciones de betahidroxibutirato, ya que es el principal cuerpo cetónico presente en la CAD.
La mayoría de los pacientes presentarán leucocitosis, que es proporcional a la concentración de cuerpos cetónicos en sangre. Puede encontrarse leucocitosis entre 40.000 y 60.000 leucocitos/cm2, que no necesariamente es un indicador de infección. El recuento de leucocitos tiende a disminuir rápidamente durante el tratamiento, especialmente tras hidratar, y una elevación persistente indica que es necesario considerar un proceso infeccioso.
La concentración de sodio está usualmente disminuida por el flujo osmótico de agua desde el espacio intracelular al extracelular. Para evaluar la gravedad del déficit de sodio y agua, el sodio sérico se puede corregir añadiendo 1,6mEq al sodio sérico medido por cada 100mg/dl de glucosa por encima de 100mg/dl; a partir de 400mg/dl de glucemia por cada 100mg/dl el sodio se aumenta 2,4mEq/l. En algunos casos la concentración de sodio puede estar falsamente baja por hipertrigliceridemia grave.
La concentración de potasio puede estar elevada por un aumento del potasio extracelular dada la deficiencia de insulina, la hipertonicidad y la acidemia. Los pacientes con concentraciones normales o disminuidas tienen una deficiencia grave y requieren monitorización permanente y reemplazo de potasio.
En pediatría el electrocardiograma es de utilidad en las siguientes situaciones: a) en acidosis metabólica grave para monitorización de arritmias y cambios por hipopotasemia (acidosis metabólica grave pH < 7,1); b) cuando de entrada no se dispone de un nomograma, y c) si se identifica una hiperpotasemia grave para evaluar cambios electrocardiográficos con el tratamiento.
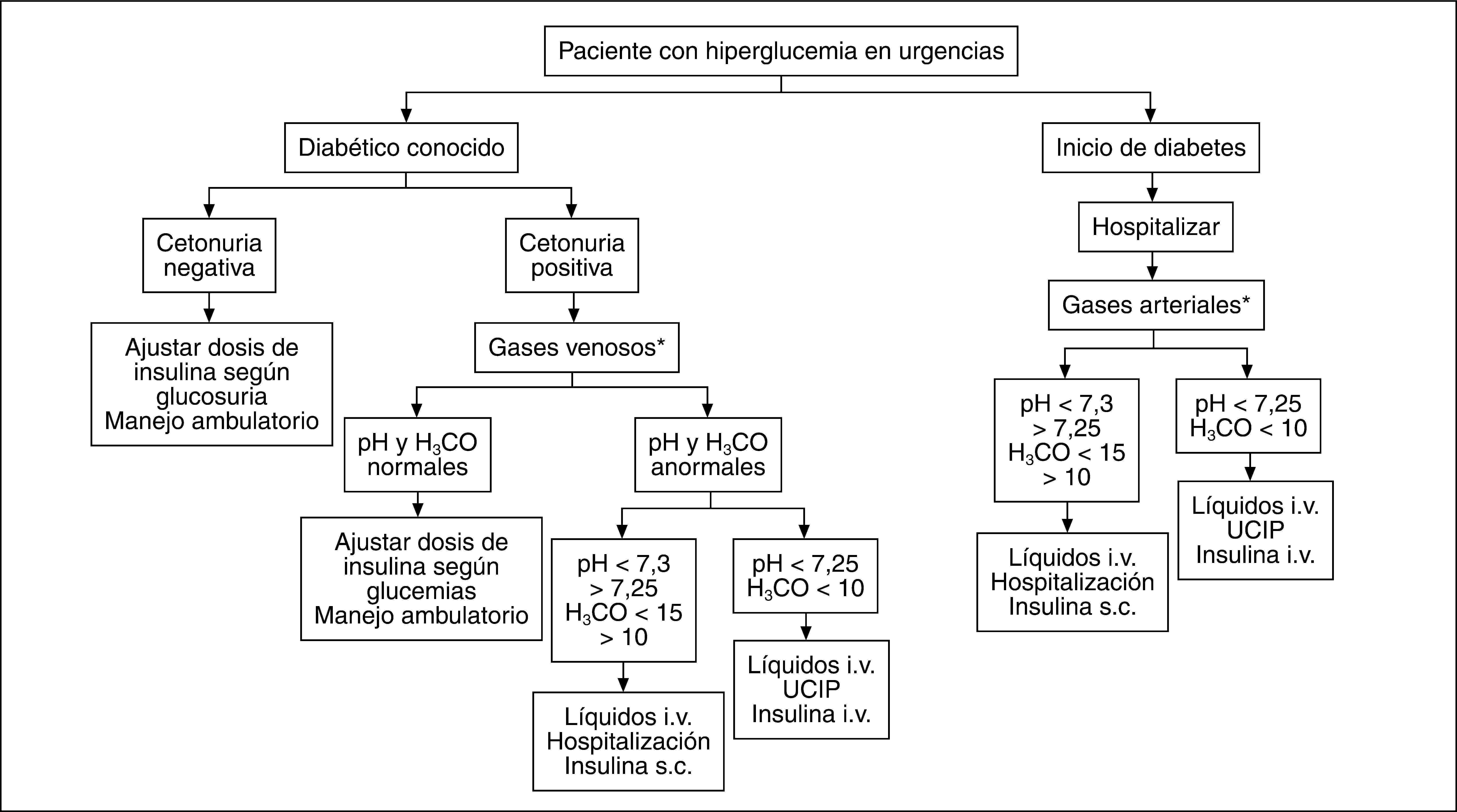
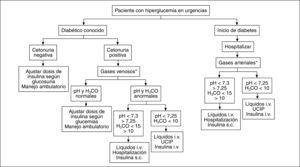
Cualquier persona con diagnóstico de diabetes mellitus que presente hiperglucemia y cetonuria persistentes durante más de 24 horas debe considerarse en cetosis, y se debe descartar una CAD. Por tanto, todo paciente diabético conocido que consulte en urgencias por hiperglucemia > 200mg/dl durante 24h tiene cetonuria; si ésta es negativa, se puede ajustar la dosis de insulina y continuar con control ambulatorio. Si la cetonuria es positiva, se determinarán gases, electrolitos y glucemia en plasma y hemograma, para definir si la cetosis se acompaña de acidosis o de alteraciones electrolíticas, y definir la magnitud de la hiperglucemia. Según el grado de acidosis y las posibilidades propias de cada centro hospitalario, se determinará si se maneja en sala de hospitalización convencional o en la unidad de cuidados intensivos con infusión intravenosa de insulina (fig. 2).
En los casos leves, la cetoacidosis puede ser compensada por la reposición oral de líquidos, la capacidad tampón, el contenido de líquido extracelular y los mecanismos renales de regulación del estado ácidobase y de electrolitos. En general, si además de la hiperglucemia y la cetonuria no hay otros hallazgos de laboratorio alterados, especialmente el pH y el bicarbonato, el paciente puede tratarse en su casa y controlarse de forma ambulatoria.
Los casos moderados se presentan cuando la acidosis excede la habilidad del organismo para compensar o cuando la compensación no es posible. Por ejemplo, cuando no se puede reponer líquidos por vía oral (vómito persistente), por lo cual, aunque pueden no tener otras anormalidades, requieren terapia con líquidos intravenosos para prevenir la progresión de la deshidratación y la acidosis. Podrían ser manejados inicialmente en urgencias y no requerir una hospitalización prolongada.
En los casos graves, los mecanismos compensatorios no son suficientes y el paciente puede presentar deterioro importante de su estado hemodinámico, además de dolor abdominal, emesis persistente y acidosis grave, lo cual requiere manejo hospitalario en la unidad de cuidados intensivos con monitorización permanente.
La cuantificación de los iones no medibles o hiato aniónico es un elemento a considerar en el diagnóstico y el seguimiento del tratamiento en los pacientes con CAD. En la CAD se espera un valor de hiato aniónico alto, generalmente entre 20 y 30 (normal hasta 12) y, por tanto, se utiliza para controlar que el paciente vaya mejorando con la terapia y no se transforme en una acidosis metabólica con hiato aniónico normal o también llamada hiperclorémica, que puede suceder por la misma fluidoterapia con solución salina en grandes cantidades. Debe tenerse en cuenta que cuando el hiato aniónico es mayor de 35 se puede estar frente a una acidosis láctica por hipoxemia tisular e hipoperfusión periférica y se debe reevaluar la fluidoterapia y el estado hemodinámico del paciente.
En algunos casos, el diagnóstico de CAD puede confundirse por la presencia de otras alteraciones del equilibrio ácido-base. El pH arterial puede estar normal o incluso aumentado, según el grado de compensación respiratoria y la presencia de alcalosis metabólica, por vómitos frecuentes o uso de diuréticos. De igual forma, las concentraciones de glucosa sérica pueden estar normales o ligeramente aumentadas en el 15% de los casos cuando los pacientes están recibiendo insulina. Asimismo, puede haber una amplia variación en el tipo de acidosis metabólica: se ha comunicado que el 46% de los pacientes admitidos por CAD tienen acidosis con hiato aniónico elevado, el 43% tiene acidosis mixta e hiperclorémica, y el 11% tiene sólo acidosis metabólica hiperclorémica5.
Variaciones en los valores de laboratorioSe debe tener en cuenta algunas precauciones para interpretar los resultados de los exámenes de laboratorio en ciertas situaciones.
La hiperlipemia grave, que se presenta en ocasiones en la CAD, puede reducir las concentraciones séricas de glucosa y sodio de forma ficticia, lo que conduce a seudohipoglucemia o normoglucemia y seudohiponatremia, en laboratorios que usan pruebas volumétricas o muestras diluidas con electrodos ion-específicos.
La creatinina que se mide por métodos colorimétricos puede encontrarse falsamente elevada como resultado de la interferencia del acetoacetato con el método.
La hiperamilasemia que se ve en la CAD puede ser el resultado de su secreción extrapancreática y debe interpretarse cuidadosamente como signo de pancreatitis.
La utilidad del análisis de orina es únicamente en el diagnóstico inicial de glucosuria, cetonuria y en la detección de infección urinaria. Para la cuantificación de glucosa o cetonas este examen no es confiable, debido a que la concentración urinaria de glucosa tiene pobre correlación con sus concentraciones sanguíneas5. Igualmente, en relación con la cetonuria no debe olvidarse que ésta puede persistir positiva 24 y hasta 48 horas luego de corregida la cetoacidosis, ya que lo que mide la tira reactiva es acetoacetato y no betahidroxibutirato que es la causa principal de acidemia, el cual desaparece primero y persiste al convertirse en acetoacetato.
TRATAMIENTOEl tratamiento exitoso de la CAD requiere:
- 1.
Restaurar el volumen circulatorio y la perfusión tisular.
- 2.
Disminuir las concentraciones séricas de glucosa y la osmolaridad del plasma hasta valores normales.
- 3.
Restaurar la tasa de filtración glomerular, lo que conlleva una disminución en las concentraciones séricas y urinarias de cuerpos cetónicos.
- 4.
Corregir los desequilibrios electrolíticos.
- 5.
Identificar y tratar los eventos precipitantes.
El tratamiento inicial con líquidos intravenosos va dirigido a la expansión del volumen intravascular y extravascular, y la restauración de la perfusión renal. La reposición de líquidos en la CAD se hace de manera similar a como se realiza en general, pero a una velocidad más lenta. Debe hacerse cuidadosamente por el riesgo de edema cerebral asociado a su administración rápida.
El tratamiento inicial se realiza con suero salino al 0,9% (10-20ml/kg/h), con excepción de los pacientes que cursen con hipernatremia, en cuyo caso debe administrarse suero salino al 0,45%. El paciente puede requerir de 1-2 bolos de 10-20ml/kg que se deben pasar en 30-60min, según sea el grado de deshidratación. El tratamiento inicial no debe exceder de 50ml/kg en las primeras 4h3.
Los líquidos de mantenimiento se deben calcular entre 1.500 y 2.000ml/m2/día, pero puede aumentarse la cantidad en caso de fiebre o hiperventilación. Se debe tener en cuenta que los signos clínicos pueden subestimar el grado de deshidratación. Cuando el déficit de fluidos no se conoce fiablemente, se puede asumir un déficit estimado del 10% y usarse como guía inicial para el tratamiento en la CAD grave. Las concentraciones séricas de sodio > 140mEq/l y de osmolaridad > 330mOsm/kg están asociadas a una deficiencia importante de líquidos. Si la osmolaridad calculada es de 330-360mOsm/kg, la rehidratación debe hacerse en 36h; si la osmolaridad es > 360mOsm/kg, la rehidratación debe hacerse en 48h5.
Una vez las concentraciones de glucosa están en 250mg/dl, se debe iniciar suero glucosado al 5%, más cloruro de sodio y cloruro de potasio.
Terapia insulínicaA menos que el episodio de CAD sea leve, la insulina regular en infusión continua intravenosa es el tratamiento de elección.
En los pacientes pediátricos no se recomienda un bolo previo de insulina. En estos pacientes se debe iniciar una infusión continua de insulina regular a una dosis de 0,1 U/kg/h. Esta dosis baja de insulina usualmente disminuye la concentración de glucosa en plasma a una tasa de 50-75mg/dl/h. Si la concentración de glucosa plasmática no disminuye en 50mg/dl en la primera hora con respecto al valor de glucemia inicial, hay que reevaluar el estado de hidratación. Si éste es adecuado, la infusión de insulina puede duplicarse cada hora hasta que la glucemia disminuya de 50-75mg/dl3.
Cuando la concentración plasmática de glucosa está en 250mg/dl, es posible disminuir la infusión de insulina a 0,05-0,1 U/kg/h y se puede adicionar al líquido intravenoso suero glucosado (5-10%). Sin embargo, el goteo de insulina o la concentración de suero glucosado pueden necesitar ser ajustados para mantener los valores de glucemia en 250mg/dl hasta corregir la acidosis.
En la CAD leve, la administración de insulina regular ya sea por vía subcutánea o intramuscular cada hora es tan efectiva como la intravenosa para disminuir las concentraciones de glucemia y de cuerpos cetónicos. Estos pacientes deben recibir una dosis de impregnación de insulina regular de 0,4-0,6 U/kg, la mitad como un bolo intravenoso y la otra mitad por vía subcutánea o intramuscular. Posteriormente se debe administrar insulina regular a 0,1 U/kg/h por vía subcutánea o intramuscular3.
Los criterios de resolución de la CAD3 incluyen glucemia < 200mg/dl, bicarbonato ≥ 18mEq/l y pH venoso > 7,3.
Una vez resuelta la CAD, se debe iniciar insulina subcutánea entre 0,5 y 1 U/kg/día, o de tratarse de un paciente diabético conocido, se instaurará el tratamiento que venía recibiendo y se realizarán los ajustes según control por glucemia capilar.
MONITORIZACIÓN DEL TRATAMIENTOHay parámetros bioquímicos dinámicos que se modifican durante el tratamiento de la CAD. Entre los más importantes están:
Potasio. Es frecuente que los pacientes presenten hiperpotasemia leve a moderada al ingreso debido a la concentración baja de insulina, la hiperosmolalidad y la acidosis. Por tanto, la terapia con insulina, la corrección de la acidosis y la expansión de volumen disminuyen las concentraciones de potasio. Raramente, los pacientes con CAD presentarán hipopotasemia significativa. En estos casos, se debe iniciar la reposición de potasio junto con líquidos intravenoso, y la insulina debe postergarse hasta que las concentraciones de potasio estén por encima de 3,3mEq/l para evitar arritmias o paro respiratorio3. En general, si el potasio al ingreso es normal o está ligeramente elevado se puede iniciar con 40mmol/l en la infusión o con 20mmol/l cuando se esté pasando infusiones > 10ml/kg/h6. Si hay franca hiperpotasemia se recomienda diferir el inicio de potasio hasta que se compruebe una micción. La infusión máxima recomendada de potasio es de 0,5mmol/kg/h. Si la hipopotasemia persiste una vez alcanzada esta tasa de infusión máxima, puede ser indicativo disminuir la infusión de insulina. No se debe olvidar que su monitorización regular y el de los demás electrolitos es indispensable.
Bicarbonato. El uso de bicarbonato en la CAD permanece controvertido. Con un pH > 7 la terapia con insulina inhibe la lipólisis, la producción de cetonas y promueve la regeneración de bicarbonato. En el paciente pediátrico no hay estudios aleatorizados en pacientes con pH < 6,9. Si el pH permanece < 7 después de la primera hora de hidratación, es prudente administrar 1-2mEq/kg de bicarbonato de sodio en suero salino al 0,45% en 1h. Si el pH es ≥ 7 no se requiere tratamiento con bicarbonato de sodio3.
Fosfato. El fosfato sérico frecuentemente está normal o incrementado en el momento del diagnóstico de la CAD. La concentración de fosfato disminuye con el tratamiento insulínico. Estudios aleatorizados prospectivos no han mostrado un efecto beneficioso de la reposición de fosfato en los pacientes con CAD, y el exceso en su administración puede causar hipocalcemia grave3. Sin embargo, para evitar el paro cardiorrespiratorio debido a hipofosfatemia, la reposición cuidadosa de fosfato en algunos casos puede estar indicada en pacientes con alteraciones cardíacas, anemia, inminencia de insuficiencia respiratoria, y en aquellos con concentraciones de fosfato < 10mg/dl. Cuando es necesario, se añaden 20-30mEq/l de fosfato potásico al líquido intravenoso3.
En forma práctica se propone realizar la monitorización de la siguiente manera:
- −
Glucemia: inicial y continuar cada hora con glucemia capilar; un valor > 500mg/dl requiere confirmación de laboratorio.
- −
Glucosuria: inicial y con cada micción.
- −
Na y K: inicial y luego cada 2-4h.
- −
Equilibrio acidobásico: inicial, y luego cada 2-4h. La estimación directa de la osmolalidad inicial por osmómetro no se utiliza puesto que es un análisis caro no siempre disponible, por lo cual se hace por medio de cálculo una vez se tenga el informe de los electrolitos séricos. Generalmente, repetir los gases arteriales es innecesario, el pH venoso (que usualmente está 0,03 unidades por debajo del pH arterial) y el hiato aniónico permiten hacer el seguimiento de la resolución de la acidosis3.
- −
La cetosis usualmente toma más tiempo en resolver que la hiperglucemia. Las concentraciones de betahidroxibutirato en sangre son el método de elección para el control de la CAD.
El edema cerebral es una complicación rara de la CAD, pero frecuentemente fatal, y ocurre en un 0,3-1%. Usualmente se presenta a las 4-12h después de iniciado el tratamiento. Sin embargo, hay casos comunicados desde antes de iniciar el tratamiento de la CAD3. Es más común en niños con diagnóstico de diabetes de novo, pero también se ha comunicado en pacientes con antecedentes de diabetes, en pacientes jóvenes (20 años) y aquellos con nitrógeno ureico elevado.
Clínicamente, el edema cerebral se caracteriza por un deterioro del estado de conciencia y cefalea. El deterioro neurológico puede ser rápido, y el paciente puede presentar convulsiones, incontinencia, cambios en pupilas, bradicardia y paro respiratorio. Estos síntomas empeoran con la herniación cerebral. La mortalidad es alta (70%), y sólo un 7-14% de los pacientes se recuperan sin secuelas.
Aunque la fisiopatología del edema cerebral es desconocida, es probable que resulte del paso de agua al SNC cuando la osmolaridad plasmática disminuye rápidamente con el tratamiento de la CAD3.
Las medidas preventivas que probablemente disminuyen el riesgo de edema cerebral en pacientes con alto riesgo de presentarlo son: la reposición gradual de sodio y agua (reducción máxima de la osmolalidad en 3mOsm/kg/h) y la adición de suero glucosado a la hidratación, una vez la glucemia está en 250mg/dl.
Los estudios de imagen cerebrales pueden mostrar edema cerebral focal o difuso, pero hasta en un 40% de los casos la tomografía computarizada inicial, en niños con CAD y diagnóstico clínico de edema cerebral, es normal. Imágenes ulteriores en estos pacientes muestran edema, hemorragia o infarto cerebral.
En cuanto al tratamiento, dado que es infrecuente, los datos son limitados, a pesar de la efectividad de la intervención farmacológica. Algunos autores indican que el manejo con manitol (0,25-1g/kg) puede ser beneficioso. En otros casos más recientes, se propone el uso de suero salino hipertónico (3%) 5-10ml/kg en 30min como alternativa al manitol. La intubación puede ser necesaria para asegurar la vía aérea y una ventilación adecuada. La hiperventilación (pCO2 < 22mmHg) en este tipo de pacientes se ha correlacionado con desenlaces neurológicos desfavorables. Por tanto, debe tratar de evitarse a menos que sea absolutamente necesaria para tratar el aumento de la presión intracraneal3.
Otras complicacionesOtras complicaciones de la CAD incluyen: hipoglucemia debida a sobredosificación de insulina, hipopotasemia secundaria a la administración de insulina y al tratamiento de la acidosis con bicarbonato e hiperglucemia secundaria a la interrupción de la insulina intravenosa sin cubrimiento posterior con insulina subcutánea3.
Comúnmente, los pacientes que se están recuperando de un cuadro de CAD presentan hipercloremia causada por el uso excesivo de suero salino y la reposición de electrolitos, que clínicamente no suele ser significativa, excepto en casos de insuficiencia renal aguda.