La mastopatía diabética es una entidad muy poco conocida y, por ello, poco descrita que puede confundirse fácilmente con carcinoma mamario. Ha sido descrita principalmente en pacientes con diabetes mellitus tipo 1 y, en mucho menor medida, otras endocrinopatías.
En este artículo se muestra un caso clínico en el que la mastopatía diabética se encuentra asociada a diabetes mellitus tipo 2 y presenta una evolución muy rápida en muy poco tiempo.
El gran desconocimiento de esta entidad puede llevar a multitud de actuaciones clínicas equívocas. Al no reconocer histológicamente la lesión y carecer de datos clínicos de sospecha, es posible emitir un diagnóstico negativo de neoplasia. se puede juzgar de errónea la toma de muestras y requerir una nueva prueba innecesaria. Únicamente sospechándola se puede llegar a un diagnóstico correcto y a la actuación clínica adecuada. Los resultados de las pruebas diagnósticas son inespecíficos, y la biopsia con aguja gruesa es la clave diagnóstica.
Diabetic mastopathy is a little known entity and can easily be mistaken for breast carcinoma. This entity has mainly been described in patients with diabetes type 1 and, to a much lesser extent, in those with other endocrine disorders.
We describe a case of diabetic mastopathy associated with diabetes mellitus type 2, which showed a rapid clinical course. Lack of awareness of this entity can lead to inappropriate management. Because there are no specific histological or clinical features for diabetic mastopathy, patients may receive an incorrect diagnosis or undergo unnecessary investigations. A high index of suspicion is required to reach a correct diagnosis and provide appropriate treatment. The results of diagnostic tests are non-specific and the key to diagnosis is core needle biopsy.
La diabetes mellitus, como enfermedad crónica, produce una serie de lesiones muy variadas en casi todos los tejidos del organismo, en mayor o menor medida dependiendo del tiempo de evolución de la enfermedad y el control que de ésta se tenga. El tejido mamario se ve afectado en ocasiones por un cortejo de hallazgos histopatológicos denominado mastopatía diabética. Esta complicación evolutiva de la diabetes mellitus, infrecuente y poco estudiada, fue descrita por primera vez en el año 1984 por Soler et al1. Se piensa que el mecanismo inicial es la alteración de la microvascularización, que se correlaciona con alteraciones renales, neuronales y en la retina. Ha sido descrita en pacientes con diabetes mellitus tipo 1 y mujeres premenopáusicas que presentan lesiones secundarias a las alteraciones inmunológicas por la hiperglucemia crónica. Puede presentarse unilateral o bilateral. Existen diferentes patrones de presentación oriente/occidente. En oriente, la presentación acostumbra ser unilateral en mujeres posmenopáusicas, mientras que la presentación occidental es bilateral, recurrente y en mujeres premenopáusicas.
Rode et al2 explican que la hiperglucemia crónica produce más cantidad de productos finales de la glucosilación que se acumulan en la matriz extracelular de la mama y producen una reacción autoinmunitaria por parte de linfocitos B y por producción de autoanticuerpos3,4. El diagnóstico diferencial debe realizarse con la mastopatía fibroquística y con el carcinoma infiltrante lobulillar. Pueden apreciarse alteraciones como la adenosis, la hiperplasia ductal y la metaplasia apocrina que no se presentarán en el caso de la mastopatía fibroquística4. Los marcadores inmunohistoquímicos son una herramienta diagnóstica definitiva para diferenciar estas alteraciones celulares con las realmente neoplásicas en casos controvertidos5.
CASO CLÍNICOMujer de 76 años, alérgica a la penicilina y con los siguientes antecedentes patológicos: hipertensión arterial, fibrilación auricular crónica en tratamiento con acenocumarol, diabetes mellitus tipo 2 en tratamiento con insulina, miocardiopatía diabética, insuficiencia cardíaca congestiva, episodio de hemorragia digestiva alta por acenocumarol en el año 2001, hiperreactividad bronquial e hipotiroidismo primario.
La paciente acudió al servicio de cirugía general y digestiva por detección de nódulo mamario bilateral no doloroso de 2 meses de evolución. No presentaba ningún otro síntoma relacionado. A la exploración se palpaba una masa retroareolar bilateral de más de 5cm de diámetro, algo más voluminosa en el lado derecho.
Se le había realizado de forma ambulatoria una mamografía 1 mes antes que informaba de mamas con predominio del componente fibroepitelial sobre el componente graso. No se observaban imágenes aparentes de focalidad. Se describían calcificaciones groseras y vasculares de características benignas. Se continuó el estudio con una ecografía mamaria bilateral, que informó de sendas formaciones hipoecogénicas heterogéneas de 53 × 18 × 32mm en la mama derecha y de 46 × 17 × 24mm en la mama izquierda, compatible con parénquima glandular de características normales, aunque sin descartar malignidad con absoluta seguridad.
Dada la discordancia clinicorradiológica, se decidió realizar una resonancia magnética (RM) por el riesgo de hemorragia en la corebiopsia al tratarse de una paciente en tratamiento con acenocumarol. Ésta no proporcionó información relevante por ser incompleta y poco valorable, por la poca colaboración de la paciente debido a su estado de ansiedad. Sin embargo, se realizó una reconstrucción inicial en tres dimensiones que no indicó proceso neoformativo.
Debido a la falta de concordancia entre las pruebas, se decidió realizar una punción con aguja fina (PAAF) de las dos masas, y ambas resultaron positivas para células malignas compatibles con carcinoma.
Ante los últimos hallazgos, se decidió realizar biopsia quirúrgica excisional mediante tumorectomía mamaria bilateral, que se llevó a cabo sin incidencias.
Anatomía patológicaEn el procesamiento del tejido enviado, se realizaron secciones con microtomo, de 4μm de grosor, tras congelación de la muestra. Los cortes fueron teñidos con el método convencional con hematoxilina y eosina (H-E).
Para el examen microscópico definitivo se fijó el tejido en formaldehído al 4% durante 24h. Tras seleccionar varias secciones representativas de tejido y parafinarlas, se realizaron cortes con microtomo de 3μm de grosor y se tiñeron con H-E.
Además se realizó técnica de inmunohistoquímica enzimática con los anticuerpos monoclonales CD20 (L26; DakoCytomation, Glostrup, Denmark) y CD3 (PS1; Novocastra, Newcastle, Reino Unido), marcadores de linfocitos B y T, respectivamente.
RESULTADOSEl examen macroscópico mostró una tumoración derecha consistente en un nódulo de 60mm de diámetro máximo, blanco-amarillento y firme, de aspecto fibroso al corte. La tumoración izquierda presentaba las mismas características macroscópicas y medía 50mm de diámetro máximo. En ninguna de ellas se identificaron lesiones de aspecto tumoral microscópicamente.
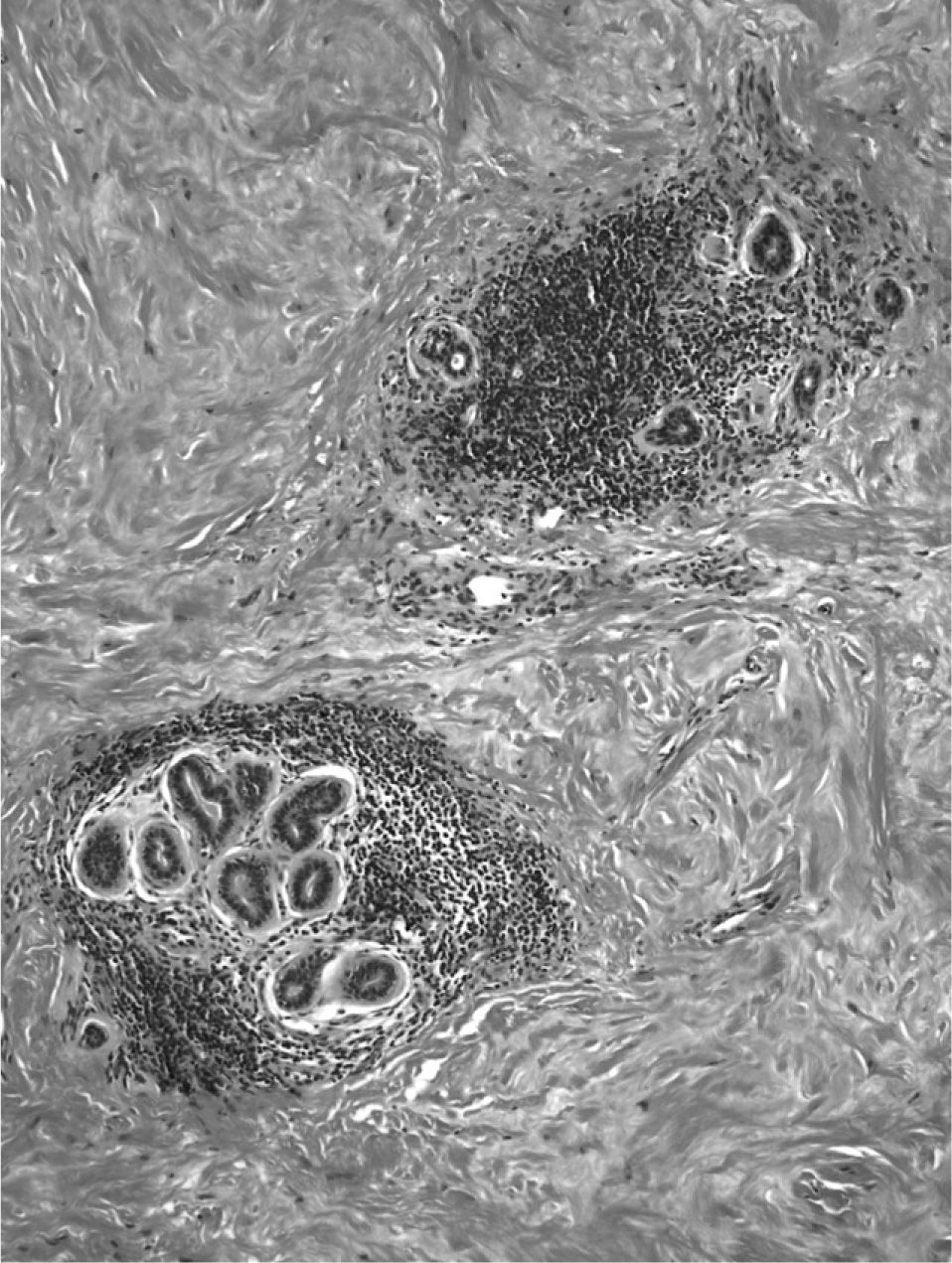
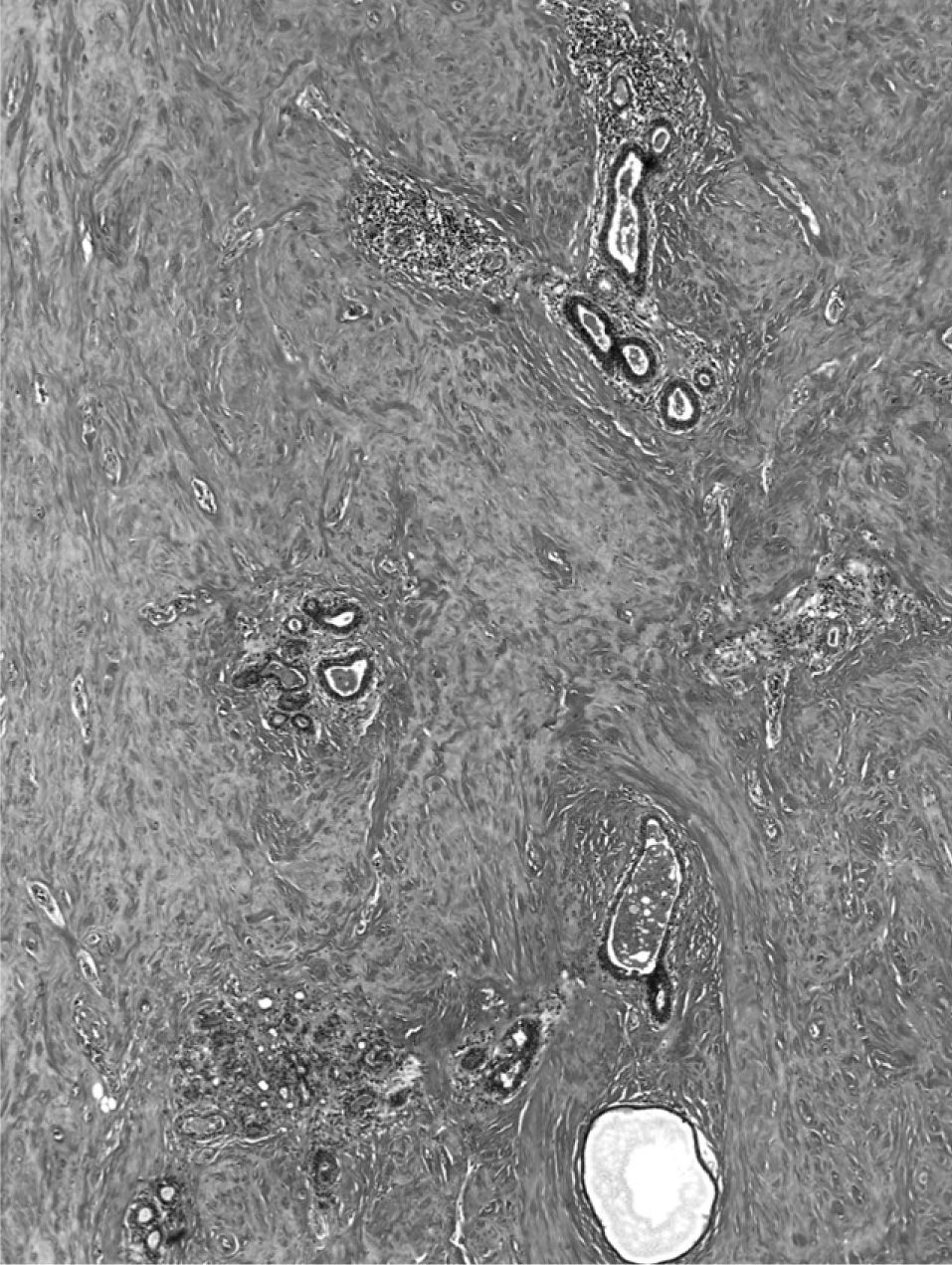
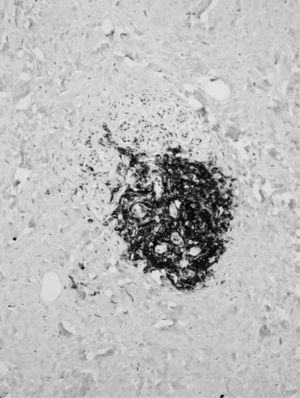
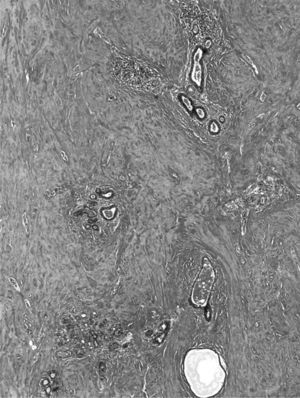
El examen microscópico mostró, en ambas biopsias, la presencia de parénquima mamario con importante fibrosis estromal, densa y de aspecto cicatricial (fibrosis queloidea), atrofia glandular con ectasia focal y un infiltrado inflamatorio linfocitario, con tendencia a formar pequeños cúmulos, con disposición preferentemente periductal y perilobulillar, aunque focalmente también perivascular (figs. 1 y 2). Se apreciaron escasos fibroblastos de morfología epitelioide. En secciones seriadas no se identificó lesión tumoral.
Los cambios morfológicos observados en todas las secciones fueron los mismos que en las muestras peroperatorias.
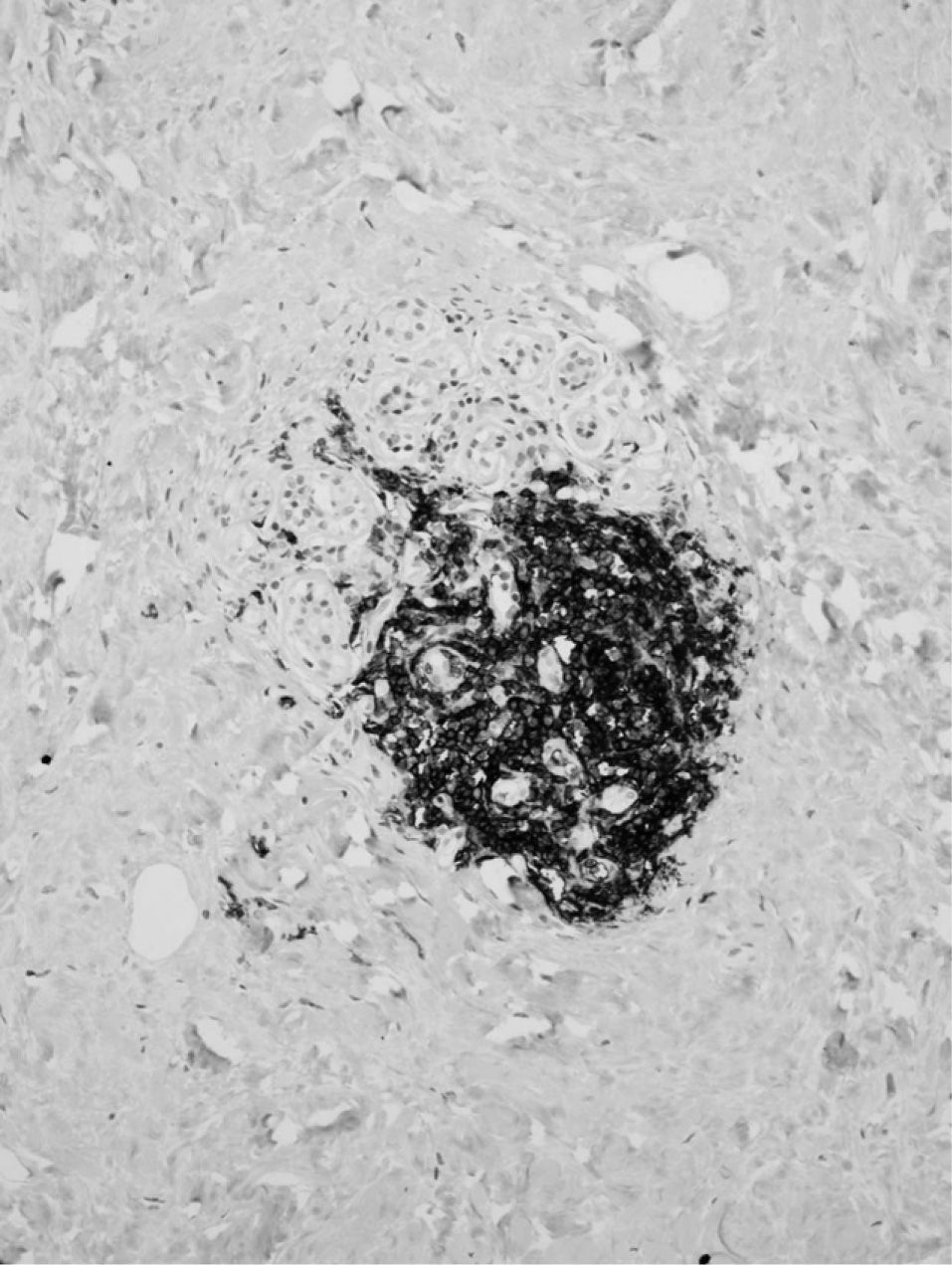
El estudio de inmunohistoquímica enzimática puso de manifiesto que la mayoría de los linfocitos que constituían los agregados eran de tipo B, frente a la presencia de escasos linfocitos T (fig. 3).
DISCUSIÓNLa revisión de la bibliografía muestra que la mayoría de los casos en que la mastopatía diabética ha sido diagnosticada están en relación con diabetes mellitus tipo 16. La frecuencia real de la mastopatía diabética se estima en 1:1.694 mujeres diabéticas7,8.
Aunque ya habían sido descritos algunos casos de mastopatía diabética en relación con diabetes mellitus tipo 2 no insulinodependiente y otras enfermedades autoinmunitarias9, en este caso la paciente padecía diabetes mellitus tipo 2 dependiente de insulina.
La paciente presentada tenía enfermedad diabética avanzada, riesgo cardiológico importante, gran riesgo tromboembólico y estaba valorada por anestesia por la American Society of Anesthesiologists (ASA) como clase 3 (paciente con enfermedad sistémica grave, pero no incapacitante). Esta paciente fue sometida a un acto quirúrgico por un proceso benigno, con los riesgos que ello conllevaba, tanto anestésicos como de la propia cirugía.
En casos previos hallados en la bibliografía de esta misma índole, se estimó que la PAAF resulta útil en la identificación de la verdadera naturaleza del proceso sólo en la mitad de los casos, ya que en la otra mitad no se obtiene suficiente material10. Esto se debe a la extensa fibrosis y a la inespecificidad de los hallazgos (amplio grupo de entidades con presencia de células fusiformes en la mama).
En este caso el estudio citológico de ambas tumoraciones se interpretó como positivo para células malignas, un error diagnóstico infrecuente ante esta entidad, probablemente debido a la escasa representación celular en el material extraído. Éste es el motivo por el que la mayoría de los autores recomiendan la biopsia con aguja gruesa para un diagnóstico correcto. En los casos donde los hallazgos radiológicos mencionados se objetivan junto con el antecedente de diabetes mellitus, es aconsejable la realización directa de corebiopsia, pues hay evidencia del beneficio diagnóstico sobre la PAAF4,11-13.
En este caso, como en el resto de los transmitidos en la literatura, el patrón linfocitario es de predominio de linfocitos B sobre los T, hallazgo habitual en la mama, y de patrón inverso en los demás órganos. Su distribución periductal y perilobulillar es la clásica descrita en la mastopatía diabética.
Aunque en este caso los resultados de las pruebas de imagen no fueron concluyentes en el diagnóstico, algunos autores describen imágenes que pueden asociarse a esta entidad. La mamografía no debería mostrar imágenes vinculadas a neoplasia, como microcalcificaciones, distorsión de la arquitectura o masas sospechosas, aunque sí podrían verse imágenes de hiperdensidad cálcica amplias, más frecuentes en la ginecomastia. En el caso de la ultrasonografía es de soporte diagnóstico no encontrar imágenes de correlación con neoplasia y/o imágenes hipoecoicas sin sombra posterior14.
Ante una lesión mamaria bilateral simétrica, la precaución debe ser la norma. Como norma general, se debe tener en cuenta los antecedentes endocrinológicos de la paciente y valorar con cautela los resultados de las pruebas realizadas.
Es fundamental la reevaluación tanto clínica como patológica de los casos en que tras tumorectomía no se halla neoplasia, para realizar una correlación correcta. Realizar un muestreo amplio o total de la pieza quirúrgica, junto con la revisión de los antecedentes clínicos, especialmente de tipo endocrinológico, será esencial para un diagnóstico definitivo. Así se evita someter a la paciente a nuevos actos quirúrgicos innecesarios.
En el caso que nos ocupa, la paciente presentaba un mal control glucémico. Estaba diagnosticada desde 1996 de diabetes mellitus tipo 2. Se le había iniciado tratamiento con antidiabéticos orales (metformina), 1 comprimido al día, que tomó hasta el año 2001. A partir de entonces se le inició tratamiento con insulina NPH; durante 4 años se aplicó dosis de 26 UI por la mañana y 10 UI por la tarde. Antes del inicio de la insulina, la paciente había llegado a presentar glucemias de 709mg/dl. Por ello es importante que, una vez identificado el caso, se mantenga un estricto control glucémico que asegure las concentraciones < 140mg/dl15.