INTRODUCCIÓN
El término diabetes tipo MODY (maturity-onset diabetes of the young) se utiliza en la actualidad para describir formas monogénicas de diabetes, que afectan fundamentalmente la función de la célula ß y que se estima suponen el 2% de las diabetes no insulinodependientes en Europa. Paralelamente a la evolución de los conocimientos sobre la prevalencia, patogenia, historia natural y respuesta al tratamiento de este tipo de diabetes, han ido conociéndose datos (imperfectos) de su prevalencia en la gestación, así como, en el caso concreto de la diabetes MODY 2, información mucho más relevante sobre el impacto de la hiperglucemia materna sobre el feto dependiendo de que esté o no afectado y que sería importante poder tener en cuenta para instaurar el tratamiento materno.
PREVALENCIA
MODY 2
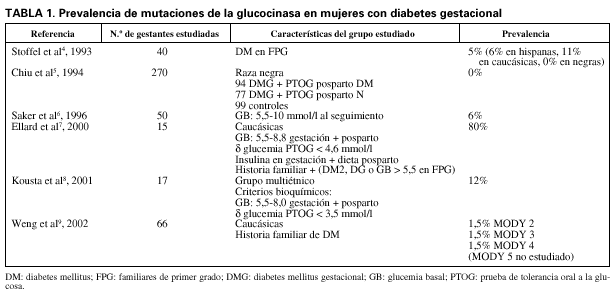
Ya en las primeras descripciones de familias afectadas de mutaciones en el gen de la glucocinasa consta que en algunas mujeres, la presentación había sido en forma de diabetes gestacional (DG)1-3. Además, en algunos casos, estas mujeres eran el caso índice de la familia3. Los estudios que analizan la prevalencia de MODY 2 (tabla 1) aparecen con posterioridad4-9, y todos ellos se caracterizan por estudiar a subgrupos de mujeres con DG, seleccionadas para aumentar el rendimiento en el hallazgo de mutaciones: o bien historia familiar de diabetes mellitus4,9, o bien alteración de la tolerancia a la glucosa al seguimiento5, o bien criterios bioquímicos (glucemia basal elevada en gestación y posparto e incremento discreto tras sobrecarga oral de glucosa8) o bien varios de ellos7. Tratándose pues de subgrupos sesgados hacia un rendimiento positivo, las prevalencias oscilan entre un 04 y un 12%8, con la excepción del artículo que estudia el grupo más restringido y que describe una prevalencia del 80%7.
Otras mutaciones
Otras formas de MODY también pueden presentarse como DG. Así, Lehto et al10 han informado de que 11 de 29 mujeres (38%) con MODY 3 habían presentado DG, mientras Lindner et al11 han publicado que 2 de 4 mujeres de una familia afectada de MODY 5 presentaron DG. El artículo de Weng et al9 antes referido estudia a un subgrupo de mujeres con DG e historia familiar de diabetes mellitus y describen una prevalencia del 1,5% tanto para MODY 3 como para MODY 4. No es de extrañar que la información referente a gestaciones en mujeres con formas de MODY diferentes de MODY 2 y MODY 3 sea escasa, dado que las diabetes monogénicas MODY 1, MODY 4 y MODY 5 son muy poco frecuentes12-14.
CONSECUENCIAS FETALES EN EL PERÍODO NEONATAL
MODY 2
La hipótesis de Pedersen postulaba que el páncreas del feto de la madre diabética respondía a la mayor oferta de glucosa en forma de hiperinsulinemia, lo que conducía a la macrosomía fetal y otras expresiones de la fetopatía diabética. Dado que la función de sensor de la glucosa de la célula ß corre a cargo de la glucocinasa15, no nos debe sorprender la información que Hattersley et al16 publicaron en Nature Genetics en 1998: a) los niños que heredan una mutación de la glucocinasa presentan una reducción media del peso al nacer de 533 g; b) la hiperglucemia materna resultante de una mutación de la glucocinasa resulta en un incremento del peso medio al nacer de 601 g, y c) los efectos de la mutación materna y fetal son aditivos, de manera que los recién nacidos no afectados hijos de madres afectas tienen un peso al nacer superior al de niños controles (efecto simple de la hiperglucemia), mientras que los niños afectados hijos de madres no afectadas tienen un peso inferior (mutación de origen paterno, el reconocimiento deficiente de la glucemia normal comporta hipoinsulinismo) y que los niños afectados hijos de madres afectadas tienen un peso superponible al de los controles (el déficit en la función de sensor de la célula ß hace que se reconozca como normal la glucemia excesiva consecuencia de la hiperglucemia materna). Otros autores han confirmado estos datos, ya sea de forma anecdótica17 o con casuísticas más significativas18. No disponemos de información sobre otros aspectos de la fetopatía diabética, pero cabría esperar una situación paralela: los hijos no afectados de madres afectadas la presentarían como en cualquier gestación diabética, mientras que los hijos afectados de madres afectadas estarían protegidos.
Otras formas de MODY
No disponemos de información sobre la evolución de los recién nacidos de madres afectadas de otras formas de MODY, pero al estar íntegro el sensor de glucosa de la célula ß cabe suponer que presentarán la macrosomía y fetopatía diabética que corresponda a la hiperglucemia materna.
CONSECUENCIAS FETALES A LARGO PLAZO
MODY 2
Diabetes begets diabetes (la diabetes engendra diabetes) es un aforismo sobre la influencia de la hiperglucemia intraútero que favorece la hiperglucemia en las gestaciones futuras que se sustenta en múltiples líneas de evidencia: desde los indiscutibles modelos animales19,20, pasando por la agregación de diabetes en la línea materna en relación con la paterna en la mayoría de los estudios que analizan la historia familiar de diabetes en pacientes con diabetes mellitus tipo 221-23, hasta la presencia de un déficit en la secreción de insulina en los hijos de progenitores con diabetes tipo 1 sin autoinmunidad contra la célula ß, cuando el progenitor afectado es la madre24. Sin embargo, en los sujetos afectados de MODY 2 la diabetes materna, si bien tiene influencia sobre el peso al nacer, no afecta el peso, la talla, la secreción o la sensibilidad insulínicas en la edad adulta25. Dado que en hijos de madres con diabetes mellitus no MODY (tipo 1, tipo 2 o gestacional), la obesidad y la intolerancia a la glucosa en la adolescencia se asocian al grado de hiperinsulinismo fetal intraútero, definido a partir de la concentración de insulina en el líquido amniótico26, la ausencia de repercusión de la diabetes materna en sujetos con afectación de la glucocinasa podría atribuirse a que la célula ß fetal no ha detectado la hiperglucemia a la que ha estado expuesta. Sin embargo, dado que los autores tampoco encuentran diferencias entre los hijos no afectados de madres con y sin déficit de glucocinasa25, argumentan que la predisposición a diabetes en la edad adulta observada en las formas poligénicas de diabetes mellitus tipo 2 puede deberse al ambiente diabético intrauterino, a la información genética poligénica compartida por madre e hijo o a la interacción entre ambos, pero que en todo caso sus datos no apoyarían un efecto directo de la hiperglucemia materna.
MODY 3
En sujetos portadores de MODY 3, la edad de presentación está disminuida cuando la mutación se hereda por vía materna. Así, Stride et al27 describían una diferencia de 12 años en la edad de presentación de la diabetes según si los individuos que habían heredado la mutación por línea materna habían estado o no expuestos a hiperglucemia intraútero, diferencia no atribuible a una mayor gravedad del defecto genético (la edad de inicio era prácticamente la misma en individuos que habían heredado la mutación por vía paterna, tanto si ésta se había presentado en el padre antes o después de los 33 años). Los autores también describían que los individuos con mutación heredada por vía materna y expuestos a hiperglucemia intraútero presentaban asimismo un índice de masa corporal más alto, lo que también podía contribuir a la presentación temprana de la diabetes. En el artículo consecutivo del mismo ejemplar de Diabetes Care, Klupa et al28 publicaban datos similares. Así, en un grupo de 100 portadores de la mutación, el 52% presentaba diabetes a la edad de 25 años cuando el progenitor afectado era el padre, proporción que aumentaba cuando el progenitor afectado era la madre y sobre todo si había existido exposición intraútero (el 57 y el 0% de incidencia acumulada de diabetes a los 15 años de edad, y el 85 y el 55% a los 25 años de edad para exposición y no exposición intraútero, respectivamente). Para valorar un posible sesgo hacia una detección más temprana cuando el progenitor afectado es la madre, los autores también analizaron el riesgo acumulado de tratamiento con insulina, que a los 25 años de edad era del 33% en los hijos con mutaciones heredadas por vía materna frente al 12% en los individuos con mutaciones heredadas por vía paterna, lo que va en contra de diferencias espurias.
Otras mutaciones
No se dispone de información específica en este momento, pero a tenor de los conocimientos actuales cabría esperar que cuando la mutación se hereda por vía materna, y más si ha existido exposición intrauterina, la presentación sea más temprana que cuando se hereda por vía paterna.
¿DEBERÍAMOS CONOCER SI UNA GESTANTE CON DIABETES GESTACIONAL O PREGESTACIONAL PRESENTA UNA DIABETES TIPO MODY?
Pronóstico fetal
El conocimiento de que la diabetes materna se debe a una enfermedad con herencia autosómica dominante permite conocer tanto el riesgo en la descendencia (50%) como la gravedad de la entidad (escasa en familias con MODY 2, mayor en familias con MODY 3), hechos que sin embargo no implican la necesidad de un estudio sistemático.
Tratamiento intragestación
Mayor importancia revisten las connotaciones que el diagnóstico puede tener en el tratamiento. Las mutaciones de la glucocinasa son las que plantean las situaciones más paradigmáticas. Respecto al peso al nacer (e, hipotéticamente, al resto de manifestaciones de fetopatía diabética), es preciso tratar a la mujer portadora que tiene un hijo no afectado, ya que en caso contrario presentará un crecimiento fetal excesivo; sin embargo, no es necesario tratar (y puede ser contraproducente) al hijo afectado de mujer afectada ya que, si bien está expuesto a hiperglucemia materna, no es capaz de detectarla y si normalizamos con dieta o insulina la hiperglucemia materna el feto la registrará como glucemia inferior a la normal29, con el consiguiente retraso en el crecimiento. Sin embargo, poder fijar objetivos de control glucémico materno a partir del genotipo fetal implica conocer este último, con la consiguiente necesidad de recurrir a técnicas invasivas (biopsia de corion, amniocentesis, funiculocentesis) y la premura en la obtención del resultado si el proceso se ha iniciado como DG. Cuando ello no sea factible, Spyer et al17 proponen guiar el tratamiento a partir del perímetro abdominal fetal, tal como se ha propuesto para el tratamiento de las mujeres con DG30.
El tratamiento farmacológico por excelencia de la hiperglucemia durante la gestación es la insulina. Sin embargo, si tenemos en cuenta que los pacientes afectados de MODY 3 tienen una gran sensibilidad a las sulfonilureas --hecho atribuible a que estos fármacos cortocircuitan el defecto inherente a la mutación31-- y que el tratamiento con glibenclamida se ha demostrado eficaz y seguro en el tratamiento de pacientes con DG --si bien hasta la fecha en un único ensayo clínico32--, podría considerarse el tratamiento con sulfonilureas durante la gestación en pacientes con MODY 3. Aparte de la salvedad obvia de que el tratamiento con insulina sería inexcusable en caso de no mantener la glucemia en los límites normales, es obligado también recordar que la seguridad de la glibenclamida durante la gestación se ha estudiado en el segundo y tercer trimestres, pero se desconoce si atraviesa la placenta en el primero y existen dudas sobre su teratogenicidad33,34. Así, el tratamiento con glibenclamida podría ser una opción en mujeres afectadas de MODY 3 que haya comenzado como DG, mientras que, en caso de haberse iniciado la diabetes como diabetes pregestacional, debería utilizarse insulina en la preparación de la gestación y en el primer trimestre.