En el control de la presión arterial participan varias enzimas proteolíticas –incluidas en el llamado sistema renina-angiotensina– que producen diversos péptidos activos que son los agentes efectivos del sistema. El estudio de estas enzimas resulta esencial para conocer en profundidad el mecanismo de control de la presión arterial y puede ofrecer la posibilidad de controlar dicho sistema con fármacos. Una glutamato aminopeptidasa transforma la angiotensina II en angiotensina III. Ésta a su vez es transformada en angiotensina IV por la alanina o arginina aminopeptidasa. La angiotensina I, por acción de la aspartato aminopeptidasa, se transforma en angiotensina 2-10, a la que se han atribuido acciones contrapuestas a las hipertensivas de la angiotensina II. La angiotensina III es la forma más activa de las angiotensinas cerebrales y tiene un efecto estimulador tónico de la presión arterial. El estudio de la inhibición de la glutamato aminopeptidasa, por lo tanto, ha permitido el desarrollo de agentes que actúan eficazmente reduciendo la presión arterial. Asimismo, el desarrollo de activadores de la aspartato aminopeptidasa constituye otro posible objetivo para el diseño de nuevos agentes antihipertensivos. Nuestro grupo de investigación ha observado que las lesiones unilaterales del sistema nigroestriatal en ratas da lugar a modificaciones simultáneas de la presión arterial y de la actividad aminopeptidásica cerebral y plasmática, curiosamente dependiente del lado de la lesión. Esta posible interacción entre presión arterial, actividad aminopeptidásica y asimetría cerebral, que daría lugar a una respuesta neuroendocrina diferenciada sobre el control de la presión arterial, podría ayudarnos a comprender el mecanismo íntimo por el cual el cerebro controla en la circulación la presión arterial.
Control of blood pressure is partially accomplished by several proteolytic enzymes included in the renin-angiotensin system. These enzymes produce several peptides that form the active components of the system. Study of these enzymes is essential for a deep understanding of blood pressure control and could offer the possibility of controlling this system pharmacologically. Glutamylaminopeptidase converts angiotensin II into angiotensin III, which in turn is converted into angiotensin IV by an alanyl or arginyl aminopeptidase. Angiotensin I, through the action of aspartyl aminopeptidase, is converted into angiotensin 2-10, which may counteract the hypertensive actions of angiotensin II. Angiotensin III is the most active form of brain angiotensins and has a tonic stimulatory effect on blood pressure. Analysis of glutamyl-aminopeptidase inhibition has allowed the development of agents that effectively reduce blood pressure. Moreover, the development of aspartyl-aminopeptidase activators could be another goal, with a view to designing new antihypertensive agents. Our group has observed that unilateral lesions of the nigrostriatal pathway in rat brain produce simultaneous modifications in blood pressure and aminopeptidase activities, both in brain and plasma, curiously depending on the side of the lesion. This possible interaction among blood pressure, aminopeptidase activities and brain asymmetry, which could produce a differentiated neuroendocrine response on blood pressure control, may help us to understand the deep mechanism by which the brain is able to control blood pressure peripherally.
Las aminopeptidasas (AP) son enzimas proteolíticas, ubicuamente distribuidas, capaces de hidrolizar los aminoácidos aminoterminales de péptidos y polipéptidos que tienen un importante papel en su control a nivel central, así como en tejidos periféricos y sangre; sus actividades son reflejo del estado funcional de sus sustratos endógenos1. La terminología es confusa en relación con las aminopeptidasas, ya que una misma enzima habitualmente se identifica mediante diversos nombres1. La aminopeptidasa A (EC 3.4.11.7) (revisado por Mizutani et al2) hidroliza el terminal amino de los aminoácidos ácidos, principalmente los residuos de glutámico, pero también es capaz de reconocer los terminales de aspártico, por lo que a esta enzima también se la conoce como glutamato aminopeptidasa (GluAP). La aminopeptidasa N (EC 3.4.11.2) (revisado por Danziger3) tiene preferencia por los aminoácidos neutros, principalmente la alanina, por lo que también se la denomina alanina aminopeptidasa (AlaAP). Sin embargo, también es conocida como aminopeptidasa M, ya que está muy relacionada con la fracción de membrana microsomal del riñón de cerdo, a partir de la cual se purificó. La aminopeptidasa B (EC 3.4.11.6) hidroliza el terminal amino de los residuos básicos y también es conocida como arginina aminopeptidasa (ArgAP) porque en investigación se emplea la Arg-β-naftilamida como sustrato artificial, ya que es el más conveniente para determinar esa actividad enzimática.
La cistina aminopeptidasa (EC 3.4.11.3) (CysAP) (revisado por Tsujimoto et al4) hidroliza la cistina aminoterminal adyacente al residuo de tirosina, como es el caso de la oxitocina o la vasopresina, por lo que también se la conoce como oxitocinasa o vasopresinasa. No obstante, la leucina aminopeptidasa (LeuAP) de placenta se ha demostrado idéntica a la CysAP4. También, la aminopeptidasa regulada por insulina (APRI) se ha mostrado homóloga a la CysAP de rata1.
Por último, se ha descrito que el receptor de la angiotensina IV (Ang IV) (AT4) es la enzima APRI/CysAP/oxitocinasa5. Sin embargo, esta afirmación recientemente ha sido discutida, y se ha propuesto que la identidad del receptor AT4 se correspondería más bien con la del receptor tipo I de la tirosincinasa c-Met6. De la aspartato aminopeptidasa (EC 3.4.11.21) (AspAP), inicialmente considerada como un nombre alternativo de la GluAP, se ha demostrado que es otra aminopeptidasa diferente, con preferencia por residuos ácidos aminoterminales de sustratos distintos de los de la GluAP7. Debido a que son capaces de hidrolizar angiotensinas (Ang), también se conoce a estas enzimas como angiotensinasas. Su regulación es un tema aún controvertido y se han propuesto múltiples mecanismos que implican factores tanto endógenos como exógenos (revisado por Ramírez et al8).
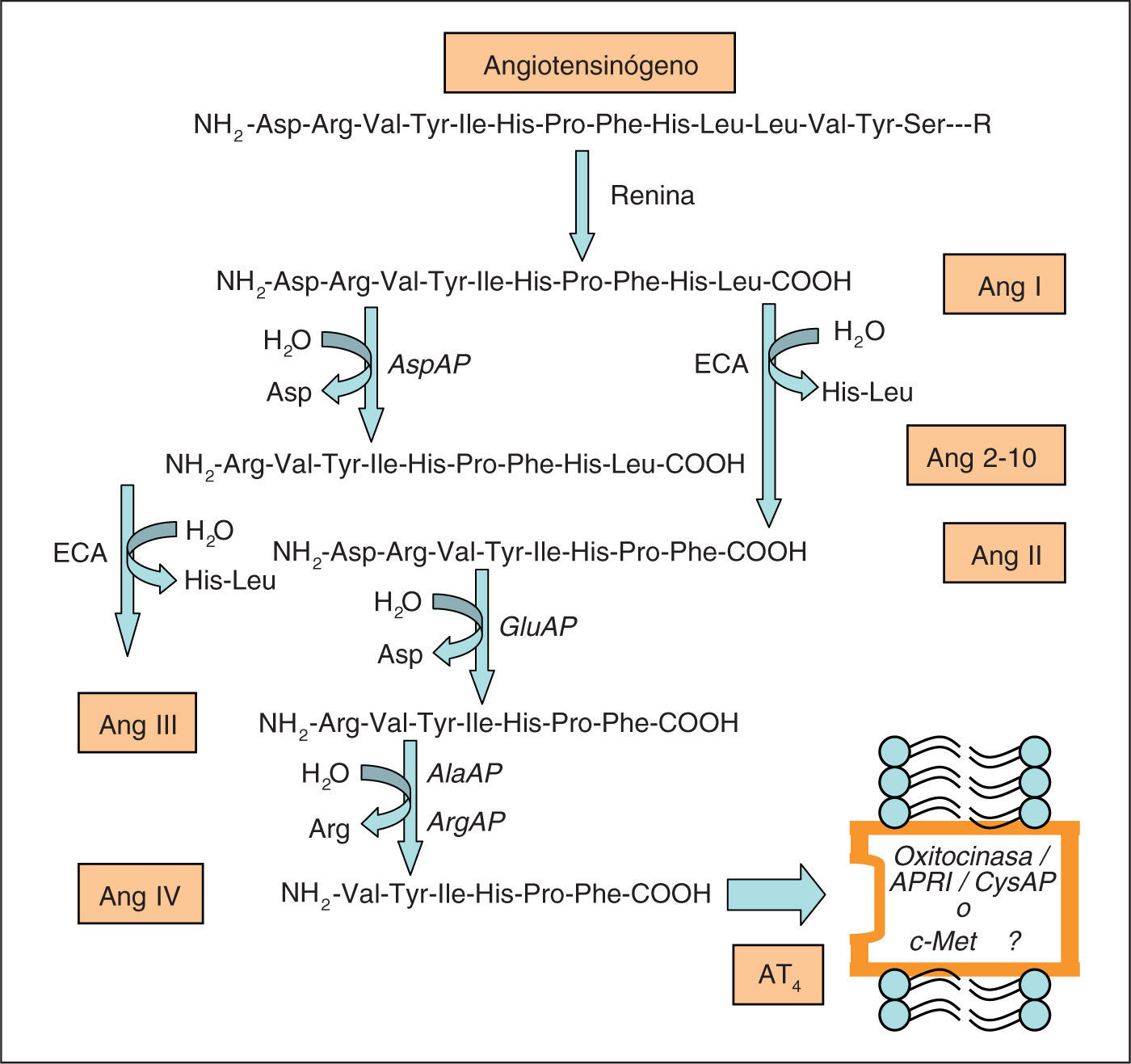
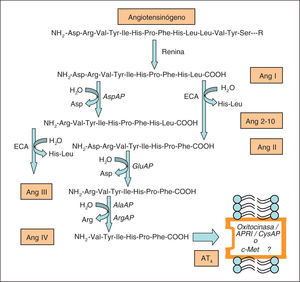
SISTEMA RENINA AGIOTENSINA (SRA)Diversas aminopeptidasas (angiotensinasas) intervienen en el metabolismo de los principales péptidos activos del SRA. En concreto, intervienen en el metabolismo de la Ang II, Ang III, Ang IV y Ang 2-10 (fig. 1). La Ang III se obtiene a partir del metabolismo de la Ang II por la acción de la GluAP que hidroliza el enlace peptídico aminoterminal con un residuo ácido, el Asp. La AlaAP y/o la ArgAP metaboliza la Ang III a Ang IV mediante hidrólisis de la Arg aminoterminal. La Ang I es transformada en Ang 2-10 por la acción de la AspAP tras la liberación del Asp aminoterminal9–11. La Ang III es un vasoconstrictor menos potente que la Ang II12, estimula la secreción adrenal de aldosterona, es un estimulador neuronal13 y tiene la misma afinidad por los receptores AT1 y AT214,15. La Ang IV tiene poca afinidad por los receptores AT1 y AT214 y mucha por el receptor AT416. La Ang IV tiene un papel importante en la regulación de flujos sanguíneos locales17, incluido el cerebral18, pero también se le ha asignado un papel en procesos cognitivos, estrés, ansiedad y depresión6. La Ang 2-10 se opone al efecto vasoconstrictor de la Ang II11. Sin embargo, también se ha dicho19 que este péptido daría lugar a una contracción aórtica dependiente de la dosis, por mediación del receptor AT1. Actualmente, en lo que se refiere al control de la presión arterial (PA), se trabaja con la hipótesis de una acción coordinada de los diferentes péptidos del sistema actuando conjuntamente sobre los receptores AT1, AT2 y AT4.
Representación parcial del sistema renina-angiotensina en la que se indican los pasos metabólicos en los que están implicadas las actividades aminopeptidásicas. AlaAP: alanina aminopeptidasa; Ang: angiotensina; APRI: aminopeptidasa regulada por insulina; ArgAP: arginina aminopeptidasa; AspAP: aspartato aminopeptidasa; CysAP: cistina aminopeptidasa; ECA: enzima de conversión de angiotensina; GluAP: glutamato aminopeptidasa.
Wright et al20–22 analizaron en diversos trabajos el papel de las aminopeptidasas cerebrales en la hipertensión. Esos autores demostraron que tras la inyección intracerebroventricular de Ang II y Ang III se observaba más sensibilidad y un incremento más prolongado de la PA en las ratas genéticamente hipertensas (SHR, del inglés spontaneously hypertensive rats) que en las ratas normotensas Wistar-Kyoto (WKY) y Sprague–Dawley. Pero si previamente se trataban con bestatina (un inhibidor de la AlaAP y la ArgAP), que evita la conversión de la Ang III en Ang IV, se potenciaba y se prolongaba la elevación de la PA. Estos resultados indican, por lo tanto, que la disfunción en la actividad de las aminopeptidasas centrales podría dar lugar a que la Ang II y Ang III actuaran durante más tiempo y, en consecuencia, pudieran llevar a cabo una elevación progresiva y sostenida de la PA en las ratas SHR. Posteriormente, Jensen et al23 demostraron que, si además de bestatina se inyectaba por vía intracerebroventricular un inhibidor de la GluAP, la amastatina, se inhibía la formación de Ang III, con lo que se induce un aumento de la PA en las ratas WKY y las SHR, de modo que debería producirse un efecto mediado por el SRA cerebral. Además, observaron que las ratas genéticamente hipertensas eran más sensibles a la acción de los inhibidores que las normotensas. En 1989, Wright et al24 demostraron que la leucina aminopeptidasa M (LeuAP M), que refleja parcialmente la actividad de la AlaAP, al ser inyectada por vía intracerebroventricular, reducía significativamente la PA en ratas SHR y WKY. Si previamente se trataba al animal con el antagonista del receptor de la Ang II, el [Sar1,Thr8] Ang II (Sarthran), que favorece la formación de Ang IV, disminuía significativamente la reducción de la PA inducida por la LeuAP M, lo que ayudaba a que la PA y la frecuencia cardiaca volvieran a su estado normal en ambas cepas. En 1990, Wright et al25 demostraron que la GluAP, que convierte la Ang II en Ang III pero no actúa con la Ang III, incrementaba la PA en las ratas SHR y las WKY al ser inyectada vía intracerebroventricular. Por el contrario, la LeuAP M, que es capaz de hidrolizar principalmente a la Ang III, disminuye la PA al ser inyectada vía intracerebroventricular, particularmente en las ratas SHR, pero también en las WKY. El pretratamiento con Sarthan disminuyó significativamente el ulterior incremento en la PA inducido por la GluAP en ambas cepas de ratas. De esta manera, los autores demostraron que el efecto de estas aminopeptidasas, al ser inyectadas por vía intracerebroventricular, dependía del SRA cerebral. Esos autores indicaron que tales resultados respaldan la hipótesis de que la Ang III es la principal forma activa de las angiotensinas centrales.
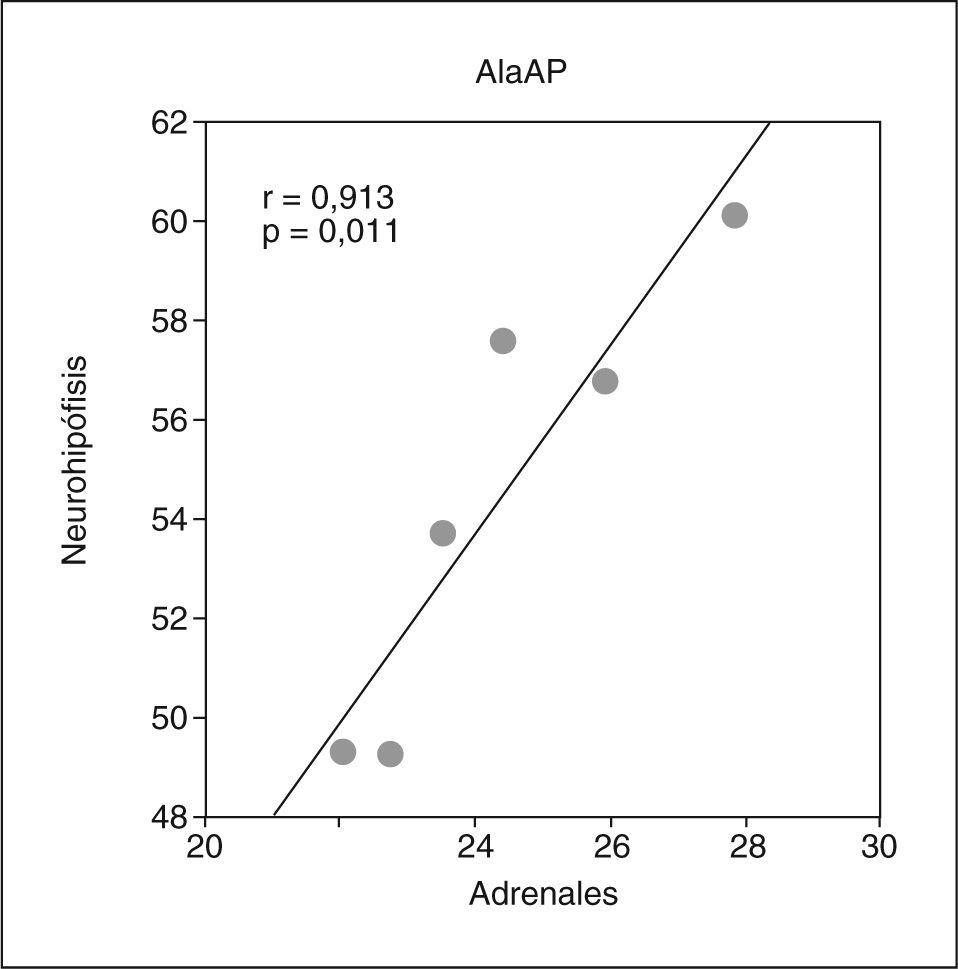
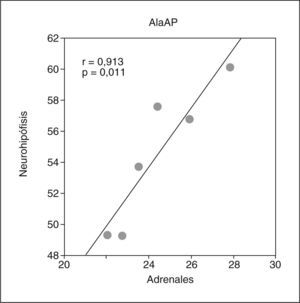
Bordineau et al26 también estudiaron el papel de la GluAP y AlaAP cerebral en el control de la PA y el balance hidroeléctrico. Zini et al27 demostraron que la acción de la Ang II en la liberación de la vasopresina dependía de que previamente se convirtiera en Ang III por acción de la GluAP. La inhibición posterior de la AlaAP, que metaboliza la Ang III, inducía la liberación de la vasopresina debido a que la Ang III actuaba de esta forma durante un tiempo más prolongado. En este sentido, resultados obtenidos en nuestro laboratorio sobre la respuesta aminopeptidásica a la deshidratación neurohipofisaria28 confirmaron fisiológicamente el incremento de la Ang III como consecuencia de un incremento en la actividad de GluAP, junto con un descenso en la actividad de AlaAP. Más recientemente, Wilson et al29 describieron que la Ang III era un importante, aunque no exclusivo, mediador del comportamiento osmorregulador. Concluyeron que la Ang II y la Ang III estaban involucradas en la regulación de la ingesta de sodio y agua, a través de la acción del receptor AT1. En relación con lo anterior, Prieto et al30 analizaron simultáneamente el comportamiento de la AlaAP en la neurohipófisis y las glándulas adrenales de animales a los que se indujo un modelo de hipertensión de masa renal reducida. Este modelo se caracteriza por un aumento en el volumen de orina de baja osmolaridad, a pesar de un aumento en la secreción de vasopresina, debido al incremento en la osmolaridad plasmática producido por la hipernatremia inducida a estos animales. Los autores describieron una marcada correlación positiva entre la actividad de AlaAP en neurohipófisis y la glándula adrenal en ese modelo de hipertensión (fig. 2). Sin embargo, esta correlación no se observó en los animales normotensos, lo que indicaría una respuesta coordinada de ambas estructuras en las condiciones específicas que determinaba este modelo de hipertensión. En 1997, Zini et al31 describieron la distribución de la GluAP en los núcleos del cerebro implicados en el control de las funciones cardiovasculares, así como en la hipófisis, comparándolos con la distribución de la enzima de conversión de angiotensina (ECA). La mayor actividad se observó en la hipófisis y los órganos circunventriculares, seguidos por la eminencia media, el núcleo arqueado, el área postrema, el plexo coroideo y los núcleos supraóptico y paraventricular. Los autores no encontraron ningún paralelismo entre la distribución de la GluAP y la ECA. Mientras que la actividad de GluAP fue más elevada en las ratas SHR que en las normotensas, la ECA no mostró esa diferencia. La estrecha relación entre la distribución de la actividad GluAP y la de los receptores de angiotensina en el cerebro, unido al hecho de que la GluAP era hiperactiva en las ratas SHR, permitió a los autores proponer que esta enzima podría contribuir en parte a la regulación de las funciones cardiovasculares por la capacidad que tiene de convertir la Ang II en Ang III. Posteriormente, Reaux et al10 demostraron que la inhibición de la GluAP cerebral, mediante la inyección intracerebroventricular de EC33, bloqueaba la respuesta presora de la Ang II exógena, lo que indicaría que la conversión de la Ang II a Ang III en el cerebro es necesaria para el incremento de la PA. La inyección intracerebroventricular de EC33 –que es un inhibidor selectivo de GluAP-, pero no la intravenosa, sólo causó un descenso de la PA al bloquear la formación de Ang III cerebral, pero no de la Ang III sistémica. Esto fue corroborado al administrar por vía intracerebroventricular el inhibidor PC18, selectivo para la AlaAP, que desencadena un incremento de la PA, ya que previno la formación de Ang IV. Esta respuesta se bloqueaba al llevar a cabo un tratamiento previo con losartán, un antagonista del receptor AT1, lo que demuestra que el bloqueo de la acción de la AlaAP en el metabolismo de la Ang III induce un incremento de la Ang III endógena, lo que da lugar a un incremento de la PA a través de la interacción con los receptores AT1. Estos datos demostraron que la Ang III es el principal péptido efector del SRA cerebral y ejerce un control tónico estimulador de la PA. Los autores indicaron que la GluAP, enzima encargada de la formación de la Ang III cerebral, representa un objetivo terapéutico que justifica el desarrollo de inhibidores de la GluAP como principal agente antihipertensivo. Más recientemente, Fournie Zaluski et al32 demostraron que la Ang III cerebral ejerce un efecto tónico estimulador de la PA en ratas DOCA-sal, un modelo de hipertensión dependiente del volumen de sal, caracterizado por un SRA cerebral hiperactivo junto con un SRA periférico hipoactivo. Los autores desarrollaron el RB150, un precursor del específico y selectivo inhibidor de la GluAP, EC33. Este compuesto atraviesa la barrera hematoencefálica y cuando se administró de forma sistémica inhibió la GluAP cerebral y disminuyó intensamente la PA. El RB150 está compuesto por dos moléculas de EC33 y está inactivo en la circulación; por lo tanto, al separarse en el cerebro las dos moléculas de EC33, actúan como inhibidores específicos y selectivos de la GluAP. Estos resultados demostraron que la hipertensión se puede tratar actuando sobre la GluAP y el RB150 podría ser un nuevo prototipo de agente antihipertensivo. Actualmente, Llorens-Cortes y su grupo de investigación están trabajando sobre la caracterización y el estudio de las propiedades de la GluAP33 y continúan investigando para encontrar un nuevo inhibidor de la GluAP como potente agente antihipertensivo34. Sin embargo, aunque se ha demostrado la eficacia de la inhibición de la GluAP cerebral para reducir la PA, otros autores35 han cuestionado que la Ang III sea el principal péptido activo del SRA en el cerebro aduciendo que la denominada "hipótesis de la Ang III" podría deberse a problemas metodológicos y a una mala interpretación de algunos resultados. Recientemente, en relación con la GluAP, Goto et al36, mediante el uso de sustratos sintéticos, demostraron que, aunque la enzima tiene una amplia especificidad de sustrato en ausencia de Ca2+, en su presencia libera preferentemente residuos de aminoácidos ácidos. Además, el Ca2+ regula la actividad enzimática, activando o inhibiendo según el tipo de sustrato. En presencia de Ca2+, la enzima rompe preferentemente Ang II, neurocinina B, colecistocinina-8 y cromogranina A. Sin embargo, la Lys-bradicinina se transforma en bradicinina, preferentemente en ausencia de Ca2+. Por otro lado, esos autores observaron que la Ang IV se une a la GluAP en presencia y en ausencia de Ca2+ e inhibe de forma competitiva la actividad de la GluAP, lo que indicaría que la Ang IV actúa como un regulador negativo de la enzima una vez que se genera por la acción secuencial de las aminopeptidasas A, M y B.
Además de la GluAP y la AlaAP, hay otras aminopeptidasas involucradas en el metabolismo de las angiotensinas. En 1994, Sim et al37 describieron que, en homogeinizados de hipotálamo obtenidos de ratas normotensas y de varios modelos de hipertensión, la Ang I era degradada principalmente a des-Asp-Ang I (Ang 2-10), en lugar de a Ang II. Los animales hipertensos mostraron más cantidad de Ang 2-10 que los normotensos. De acuerdo con esto, otros autores describieron que, en comparación con controles normotensos, la producción de Ang II en cultivos neuronales de cerebros de ratas SHR era significativamente inferior38. La aminopeptidasa que degrada la Ang I a Ang 2-10 no era inhibida por amastatina, bestatina ni ácido etilendiaminotetraacético (EDTA), lo que indica que no se trata de la GluAP, la AlaAP ni la ArgAP. De las cuatro aminoacil-β-naftilamidas (aspartil-, glutamil-, arginil- y leucil-β-naftilamida) que se utilizaron, la aspartil-β-naftilamida fue el sustrato más susceptible a la acción de la enzima. Esta actividad se localizaba principalmente en la fracción microsomal de los homogeneizados cerebrales39, se modificaba durante el desarrollo y el envejecimiento40 y tenía en el cerebro un ritmo circadiano41. En comparación con la GluAP, la actividad AspAP ha mostrado en repetidas ocasiones un comportamiento diferente en el cerebro42 y en los tejidos periféricos43. Finalmente, la AspAP ha sido purificada y caracterizada en el cerebro de conejo7. El mecanismo por el que la Ang 2-10 cerebral ejerce su control de la PA no se ha dilucidado aún. Sin embargo, estudios realizados a nivel periférico indican que la Ang 2-10 actúa sobre los receptores de Ang desencadenando respuestas que contrarrestan la acción de la Ang II43. Además, la Ang 2-10 (como la Ang IV) disminuyó la acción presora de la Ang III, tanto en las ratas WKY como en las SHR. Los efectos de la Ang 2-10 no fueron inhibidos por el antagonista AT2 PD123319 ni por indometacina, lo que demuestra que la acción no se lleva a cabo a través de los receptores de la AT2 ni por las prostaglandinas. Estos resultados indican que la Ang 2-10 posee acciones protectoras vasculares y que también está implicada en la fisiopatología de la hipertensión44.
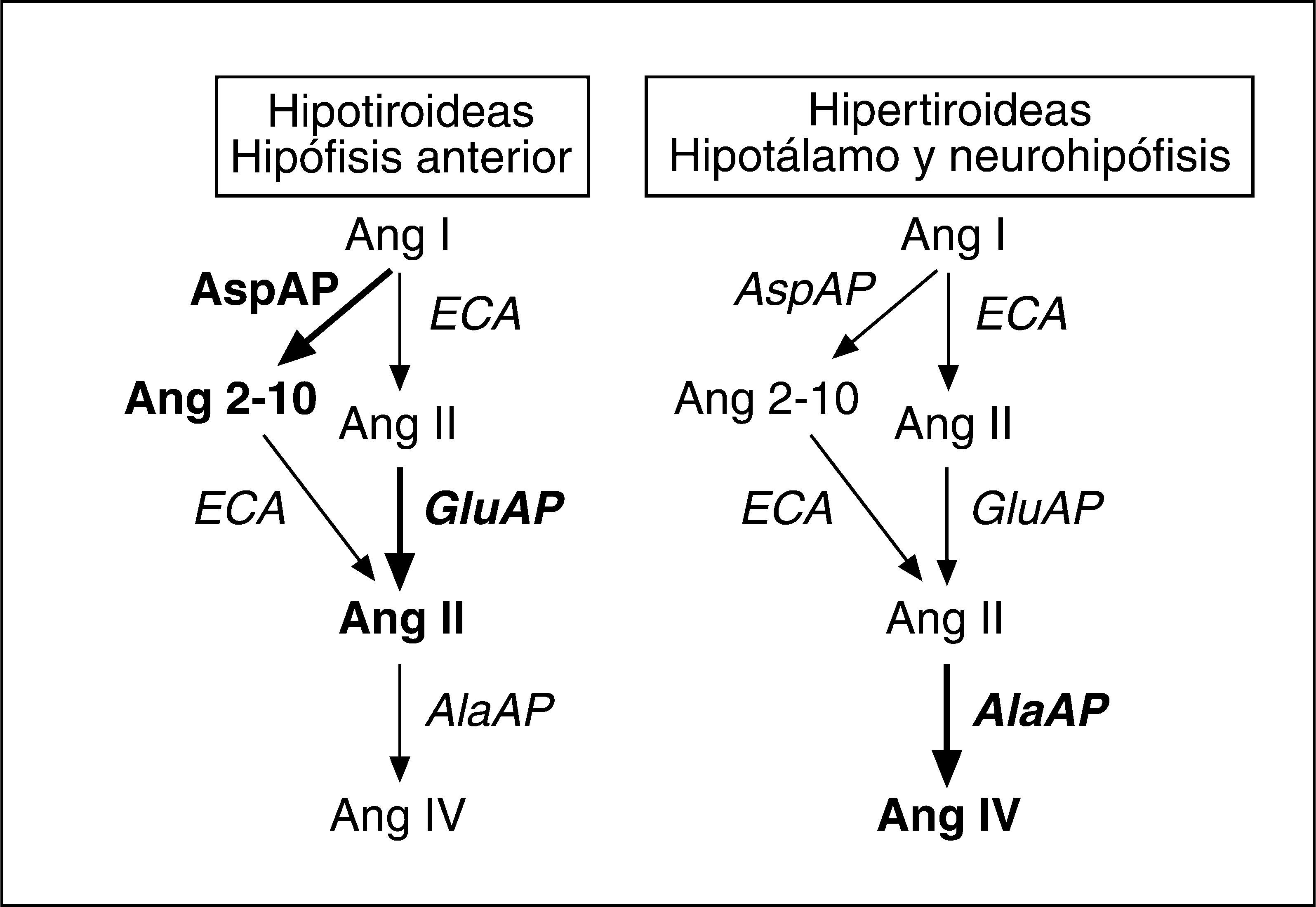
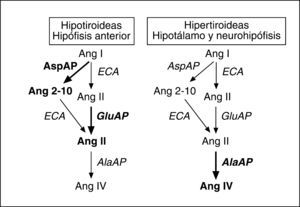
Prieto et al42 analizaron simultáneamente GluAP, AspAP y AlaAP en modelos experimentales de hipotiroidismo e hipertiroidismo, de los cuales ya se había demostrado que generan respectivamente hipotensión e hipertensión45. En la hipófisis anterior de las ratas hipotiroideas, los resultados demostraron un incremento en la actividad de GluAP y AspAP, sin modificación de la AlaAP. Esto implicaba un aumento delmetabolismo de la Ang I a Ang 2-10 y de la Ang II a Ang III, sin modificación en la degradación de ésta. Consecuentemente, las ratas hipotiroideas podrían tener menor disponibilidad de Ang II y mayor de Ang 2-10 y Ang III en la hipófisis anterior. Además, en este estudio se observó un aumento en la actividad degradativa de la Ang III (AlaAP) en hipotálamo y neurohipófisis de ratas hipertiroideas (fig. 3). Según los autores, estos resultados podrían ser en parte el origen de la alteración de la actividad secretora de hipotálamo e hipófisis en el hipotiroidismo y el hipertiroidismo.
Representación parcial del sistema renina-angiotensina en la que se destacan en negrita los pasos metabólicos que se encontraban activados según Prieto et al42 en hipotálamo e hipófisis de modelos animales de hipotiroidismo e hipertiroidismo. AlaAP: alanina aminopeptidasa; Ang: angiotensina; AspAP: aspartato aminopeptidasa; ECA: enzima de conversión de angiotensina; GRuAP: glutamato aminopeptidasa.
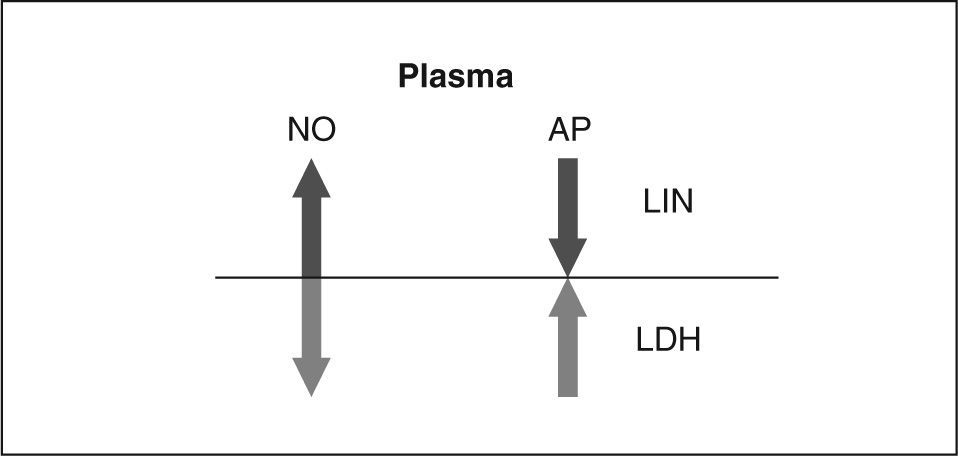
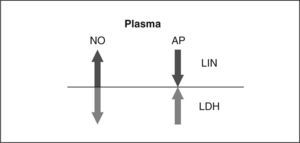
Recientemente se ha observado que la depleción unilateral central de dopamina, producida por lesiones del sistema nigroestriatal izquierdo o derecho (hemiparkinsonismo experimental izquierdo o derecho), modifica la PA en ratas normotensas de forma diferente que en las hipertensas, dependiendo del hemisferio en el cual se llevara a cabo la depleción. El efecto era más evidente en animales hipertensos que en normotensos y estos cambios ocurrían de forma simultánea a modificaciones en la actividad plasmática y cerebral de diversas aminopeptidasas y en el contenido plasmático de óxido nítrico46. Curiosamente, en algunos casos, aminopeptidasas y óxido nítrico mostraban un comportamiento inverso. Éste era particularmente interesante si se observaban los resultados obtenidos en plasma de animales lesionados normotensos e hipertensos, tras la comparación con sus respectivos grupos de controles sham. Mientras que los animales normotensos lesionados en el lado derecho y los hipertensos lesionados en el izquierdo no diferían en la concentración de aminopeptidasas y óxido nítrico, los normotensos lesionados en el lado izquierdo y los hipertensos lesionados en el derecho ofrecían una imagen especular en el comportamiento de ambas sustancias (fig. 4). Como causa de tales cambios se ha propopuesto una respuesta neuroendocrina asimétrica a las lesiones nigroestriatales de los lados izquierdo o derecho46,47. Estos cambios podrían modificar las concentraciones de sus sustratos circulantes implicados en el control de la PA. Sin embargo, aún no se ha propuesto ninguna explicación plausible para el origen y la regulación de las aminopeptidasas plasmáticas. Los resultados descritos sobre modelos de hemiparkinsonismo experimental izquierdo o derecho indicaban que la existencia de una alteración asimétrica en el sistema nervioso autónomo como consecuencia de una disfunción izquierda o derecha del sistema dopaminérgico cerebral podría dar lugar a tales cambios. Además, algunas de las modificaciones en las actividades aminopeptidásicas que se observaban en dicho modelo animal de hemiparkinsonismo se asemejan a alteraciones similares, en concreto las referidas también a una disminución plasmática de diversas aminopeptidasas, descritas en pacientes con enfermedad de Parkinson48, en los que es bien conocido que hay una marcada asimetría en el inicio y la evolución del proceso neurodegenerativo49. Sin embargo, aunque la observación de tales cambios podría ser útil para el desarrollo de un método diagnóstico de la enfermedad de Parkinson, queda por dilucidar su posible relación con la fisiopatología de la enfermedad.
Imagen especular para la actividad de aminopeptidasas (AP) y la concentración de óxido nítrico (NO) en plasma de animales normotensos con lesión del sistema nigroestriatal izquierdo (LIN) e hipertensos con lesión del sistema nigroestriatal derecho (LDH) tras la comparación con sus respectivos grupos de controles sham. Mientras que en LIN el NO aumenta y las AP disminuyen, en LDH el NO disminuye y las AP aumentan.
En conclusión, aunque los descubrimientos de inhibidores de la ECA y antagonistas de los receptores AT1 de la angiotensina fueron dos importantes hitos en el tratamiento de la hipertensión, el estudio de otros componentes del SRA que actúan a nivel tanto periférico como central ofrece nuevas posibilidades terapéuticas50. La Ang III cerebral es un potente factor hipertensor. Sin embargo, la Ang 2-10 parece contribuir más bien a atenuar la hipertensión. Los resultados de que disponemos hasta el momento indican que fundamentalmente la prevención en la formación de Ang III cerebral, o también quizá la facilitación de la formación de Ang 2-10, podría ser línea de investigación para el desarrollo de posibles tratamientos de la hipertensión alternativos. Por lo tanto, los recientes estudios sobre inhibidores centrales de la GluAP, encargada de la formación de Ang III, pueden aportar resultados alentadores. Además, es cada vez más evidente que, para comprender adecuadamente el control cerebral de la PA, los estudios deberían considerar la bilateralidad del sistema nervioso central y el periférico.
Este trabajo ha sido financiado en parte por la Junta de Andalucía (Grupo: PAI CVI-221; Péptidos y Peptidasas y Grupo: CTS-438; Grupo para la investigación de enfermedades neurológicas en Andalucía).