La hipoglucemia es una urgencia médica frecuente, en la mayoría de los casos, secundaria a sobredosificación de tratamiento con insulina o hipoglucemiantes orales en pacientes diabéticos. No obstante, en algunos casos puede ser una manifestación paraneoplásica. Presentamos el caso de una paciente de 61 años con un mesotelioma peritoneal maligno, que ingresó por disminución del nivel de conciencia, y finalmente, diagnosticada de hipoglucemia paraneoplásica, con respuesta positiva a la administración de glucagón, por lo que se le dio el alta con perfusión intravenosa continua.
Hypoglycemia is a common emergency, and is usually due to insulin therapy or oral hypoglycemic treatment in diabetic patients. In some cases, hypoglycemia can be a paraneoplastic sign. We report the case of a 61-year-old woman with a malignant peritoneal mesothelioma, who was admitted to hospital because of diminished consciousness. The final diagnosis was paraneoplastic hypoglycemia with a positive response to glucagon. The patient was finally discharged with glucagon perfusion.
La hipoglucemia es una urgencia médica frecuente, por lo que es esencial, además del correcto tratamiento, el diagnóstico del mecanismo productor para evitar su recurrencia. Generalmente, la hipoglucemia es secundaria a tratamiento hipoglucemiante (antidiabéticos orales y/o insulina), así como hipoglucemias reactivas; sin embargo, puede ser una manifestación paraneoplásica por hipersecreción tumoral. Los tumores relacionados se pueden dividir en 3 grupos: tumores productores de insulina, hipoglucemias secundarias a infiltración y destrucción tumoral del hígado y las glándulas suprarrenales y producción de factores que alteran el metabolismo de la glucosa, entre ellos IGF-I y precursores de IGF-II, también conocida como hipoglucemia inducida por tumor no insular (non islet cell tumor induced hypoglucemia, NICTH). Se trata de un síndrome muy infrecuente y complejo que comprende muchos tipos de neoplasias. En muchos casos el tratamiento curativo, es decir, la resección tumoral, no es posible, por lo que el objetivo terapéutico es evitar las hipoglucemias. Éstas requieren, generalmente, un tratamiento rápido y eficaz ya que son recurrentes, graves y, en muchos casos, interfieren con el tratamiento antineoplásico.
CASO CLINICOMujer de 61 años, fumadora, con antecedentes destacables de aneurisma de carótida interna izquierda y episodio de ictus isquémico en el hemisferio derecho. Fue diagnosticada de mesotelioma peritoneal maligno intermenstrual; por ello, se realizó laparotomía exploradora, con biopsia de omento y laparotomía bilateral; la anatomía patológica fue concluyente y se inició tratamiento quimioterápico. Pese al tratamiento quimioterápico, se evidenció, por técnicas de imagen, progresión tumoral extensa, por lo que se decidió tratamiento paliativo.
La paciente fue ingresada por disminución del nivel de conciencia, y la glucemia capilar era indetectable. A su llegada a urgencias destacaban: ausencia de respuesta a estímulos, palidez cutánea, sudoración profusa y midriasis arreactiva bilateral. Se confirmó la hipoglucemia mediante analítica (24 mg/dl), sin otros hallazgos significativos. Se realizó tomografía computarizada craneal que resultó normal. Se decidió ingreso para ampliar el estudio.
Durante los primeros días del ingreso, la paciente presentó episodios frecuentes de hipoglucemia grave a pesar de la infusión continuada de suero glucosado hipertónico, que revertían con dosis rápidas adicionales. Con la sospecha diagnóstica de hipoglucemia secundaria a tumor no insular productor de pro-IGF-II (insulin growth factor), se solicitó analítica hormonal en hipoglucemia, con los siguientes resultados: glucosa, 34 (70-120) mg/dl; péptido C < 0,51 (0,91-4,02) μg/l; insulina, 0,36 (0-13,1) U/ml; IGF-1, 10,46 (78-303) ng/ml; anticuerpos antiinsulina, 5,83% (3,4-6,2%); cortisol plasmático basal, 39,38 (4,3-22,4) μg/dl; GH, 1,16 (0-5) ng/ ml. Pese a no determinarse IGF-II ni IGFBP-III (insulin growth factor binding protein) que confirmarían el diagnóstico, se orientó, ya que las concentraciones de péptido C e insulina eran indetectables, como entidad más probable la hipoglucemia secundaria a tumor no insular productor de pro-IGF-II. Dada la irresecabilidad del tumor, se consideró necesario el tratamiento sintomático paliativo. Dada la recurrencia de las hipoglucemias a pesar de sueroterapia glucosada hipertónica, se revisó la literatura en busca de alternativas. Ante la ineficacia demostrada del diazóxido en tumores no insulares, se decidió realizar un test de glucagón (administración de 1 mg de glucagón en bolo intravenoso) con respuesta positiva. Por este motivo se inició perfusión continua de glucagón a 0,3 mg/kg/24 h intravenoso. La paciente fue trasladada a un centro de cuidados paliativos, donde se realizaban determinaciones de glucemia capilar cada 6 h, sin que presentara nuevos episodios de hipoglucemia (glucemia capilar media, 95-126 mg/dl) durante los 6 meses de seguimiento, hasta que falleció por parada cardiorrespiratoria secundaria a tromboembolia pulmonar.
DISCUSIÓNLos mesoteliomas son un tipo de neoplasias derivadas de la capa mesotelial de la pleura, el peritoneo, el pericardio o la túnica vaginal; es de origen pleural en el 80% de los casos. La incidencia de este tipo de tumores se estima en torno a 2.200 casos/año en los Estados Unidos1. Como factores predisponentes destaca la exposición al asbesto y, en menor número, la radioterapia1,2. El mesotelioma peritoneal es una entidad muy poco común, con una incidencia de un caso por millón de habitantes y año. Se caracteriza por ser tumores localmente agresivos y acompañarse de un amplio abanico de síntomas paraneoplásicos, como coagulación intravascular diseminada, tromboflebitis migratoria, hipercalcemia tumoral, anemia hemolítica e hipoglucemia3,4. El tratamiento de elección es la cirugía citorreductora y la quimioterapia. La supervivencia de los pacientes con mesotelioma maligno es reducida, con una media de 4-13 meses en los no tratados y de 6-18 meses en los que reciben quimioterapia y/o radioterapia5,6.
La hipoglucemia es una urgencia médica frecuente, en la mayoría de los casos, en el contexto de sobredosificación de insulina o antidiabéticos orales en pacientes diabéticos. Sin embargo, puede ser una manifestación paraneoplásica. Los tumores relacionados con hipoglucemia se pueden dividir en tres grupos. En primer lugar, tumores productores de insulina, tales como el insulinoma o las neoplasias no insulares productoras de insulina; en segundo lugar, hipoglucemias secundarias a infiltración y destrucción tumoral del hígado y las glándulas suprarrenales, y por último, por la producción de factores que alteran el metabolismo de la glucosa, como los anticuerpos antirreceptores de insulina, algunas citocinas (factor de necrosis tumoral alfa [TNFα], interleucina [IL] 1, IL-6), catecolaminas, IGF-I y precursores de IGF-II. Esta última entidad también se conoce como hipoglucemia inducida por tumor no insular (NICTH)7. Se trata de un síndrome muy infrecuente y complejo que comprende muchos tipos de neoplasias, por lo que en la literatura, hasta ahora, únicamente hay descritas series de casos. El primer caso se publicó en 1929, en un paciente con hepatocarcinoma8. En 1988 se estudió más exhaustivamente la fisiopatología, y se relacionó la hipoglucemia con la producción aberrante del precursor de IGF-II, que condicionaba una actividad insulina-like persistente9. El NICTH es 4 veces menos frecuente que el insulinoma, aunque en muchos casos no se llega a diagnosticarlos. Es frecuente en tumores sólidos de estirpe epitelial y mesenquimatosa y menos frecuente en tumores hematopoyéticos y neuroendocrinos. Los síntomas característicos de estos pacientes son, en primer lugar, la hipoglucemia sintomática en ayunas, por disminución de la producción hepática de glucosa al interferir en la glucogenólisis y gluconeogénesis, por inhibición de la lipólisis con disminución secundaria de los ácidos grasos libres circulantes y por aumento del consumo periférico y tumoral de glucosa. También se han descrito cambios cutáneos acromegaloideos por estimulación permanente del receptor de IGF-I7.
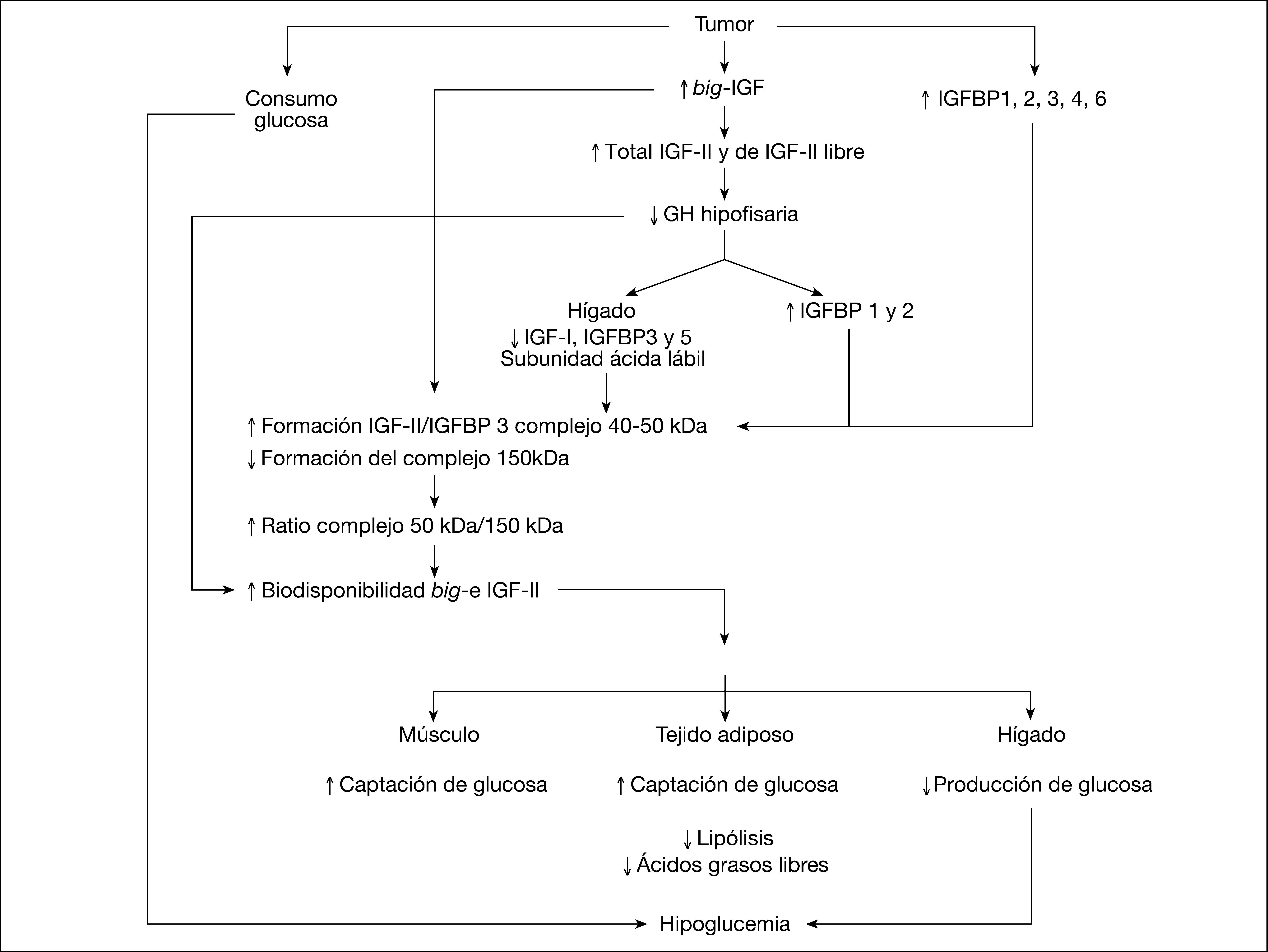
El mecanismo propuesto para al desarrollo de la hipoglucemia secundaria a tumor no insular se resume en la figura 1. Se sabe que las células tumorales no pueden procesar el aumento de pro-IGF-II sintetizado por el tumor, lo que lleva al aumento de la liberación de este factor a la circulación. Pro-IGF-II compite con IGF-II, IGF-I y la subunidad ácida lábil (ALS) por la unión a proteínas de unión a IGF (IGFBP-3), por lo que la unión de big-IGF-II, las proteínas de unión a IGF y la subunidad ácida lábil está dificultada. Como consecuencia, se forman complejos primarios binarios de 40-50 kDa. Asimismo las fracciones libres de IGF-I e IGF-II total están aumentadas. Como consecuencia, tanto los complejos primarios binarios como las fracciones libres de IGF pueden atravesar con mayor facilidad la membrana capilar, en comparación con el complejo terciario de 150 kDa. Por lo tanto, la concentración de IGF, sobre todo de big-IGF, en los tejidos aumenta considerablemente, con lo que se produce un potente efecto insulina-like, por la unión a receptores de insulina, que causa hipoglucemia. Además, mediante la retroalimentación negativa de la GH, la síntesis de IGF-I, proteínas de unión a IGF (IGFBP-3 e IGFBP-5) y la subunidad ácida lábil, está disminuida. Esto conlleva una menor formación de complejos ternarios. Todo esto conlleva un aumento del consumo periférico de glucosa en el músculo y el tejido adiposo, la disminución de la producción de glucosa por el hígado, la disminución de la lipólisis y de los ácidos grasos libres y favorece a la hipoglucemia.
Mecanismo propuesto para el desarrollo de la hipoglucemia inducida por tumor no insular: es frecuente que las células tumorales no puedan procesar la cantidad de pro-IGF-II sintetizado, con el consiguiente aumento de big-IGF-II en la circulación. Este último compite con IGF-II e IGF-I maduro por la unión a proteínas. Por lo tanto, la formación del complejo terciario entre big-IGF-II, IGFBP-3 y la subunidad ácida está dificultada. Como consecuencia, se forman complejos binarios de 40-50 kDa y las fracciones libres de IGF-I e IGF-II están aumentadas. Los complejos binarios e IGF libre pueden pasar sin dificultad por la membrana celular, en comparación con el complejo terciario de 150 kDa, por lo que las concentraciones de IGF, sobre todo, big-IGF en los tejidos, aumentará y se producirá mayor efecto insulina-like a través de los receptores insulínicos, que causará hipoglucemia. Por otro lado, por el aumento de la retroalimentación negativa por la producción de GH en la glándula pituitaria, la síntesis de péptidos dependiente de la GH, como IGF-I, IGFBP-3, IGFBP-5 y la subunidad ácida, está disminuida. Esto conlleva una disminución aún mayor de los complejos terciarios. IGF-1: insulin growth factor-1; IGF-2: insulin growth factor-2; IGFBP-1: insulin growth factor binding protein.
El NICTH suprime la secreción de insulina por las células betapancreáticas, la lipólisis y la cetogénesis, lo que causa un descenso de péptido C, GH y betahidroxibutirato. Todo esto, junto con la determinación de concentraciones séricas elevadas de pro-IGF-II aislada (por 2-3 veces) y en combinación con valores disminuidos de IGFBP-3 e IGF-I, es diagnóstico de NICTH7.
En la mayoría de los casos el tratamiento curativo, es decir la resección tumoral, no es posible, por lo que el objetivo terapéutico es evitar las hipoglucemias. La hipoglucemia inducida por tumores no insulares requiere, generalmente, un tratamiento rápido y eficaz, ya que es recurrente, grave y, en muchos casos, interfiere con el tratamiento antineoplásico. Las alternativas terapéuticas descritas en la literatura hasta el día de hoy son: administración continua de glucosa, análogos de somatostatina, glucocorticoides, hormona de crecimiento y glucagón en perfusión continua10,11. El glucagón es una hormona sintetizada en respuesta a hipoglucemia, que estimula la producción hepática de glucosa por medio de la glucogenólisis y la gluconeogénesis. La infusión de glucagón se ha utilizado también para el diagnóstico diferencial de la hipoglucemia, con el fin de distinguir hipoglucemias secundarias a hiperinsulinemia endógena, a efecto insulina-like o a fallo hepático por metástasis hepáticas. Si el paciente responde a la infusión de 1 mg de glucagón intravenoso con la elevación de las concentraciones de glucosa sanguíneas por encima de 50 mg/dl, podemos asumir que tiene reservas hepáticas de glucógeno adecuadas. Por el contrario, si la glucosa sérica no se eleva por encima de lo estipulado, nos orienta al diagnóstico de fallo hepático o reservas de glucógeno deplecionadas tras ayuno prolongado. Pero más allá de la utilidad en el diagnóstico diferencial, tal y como es nuestro caso, la infusión de glucagón es muy útil para optar rápidamente por una opción terapéutica, ya que los pacientes con hipoglucemias graves mantenidas, que responden al test de glucagón, también responderán a la infusión continua de glucagón intravenoso11. En este sentido, Oliveira et al han demostrado que la respuesta al test de glucagón podría predecir una respuesta favorable a la perfusión continua de glucagón.