A pesar de la elevada prevalencia de insuficiencia renal en la población anciana existen escasos datos sobre frecuencia del hiperparatiroidismo secundario en la población española afecta de este trastorno. Nos propusimos estudiar este aspecto a partir de las personas atendidas por los servicios de medicina interna de nuestra área.
Diseño y métodosEstudio transversal observacional realizado en servicios de medicina interna. Se incluyeron 415 pacientes con insuficiencia renal crónica estadios 3 y 4. Se recogieron antecedentes y factores de riesgo según un protocolo estandarizado. En todos los casos se determinaron niveles séricos de creatinina, fósforo, calcio, parathormona (PTH) intacta y 25-hidroxi-colecalciferol (25-OH-vitD).
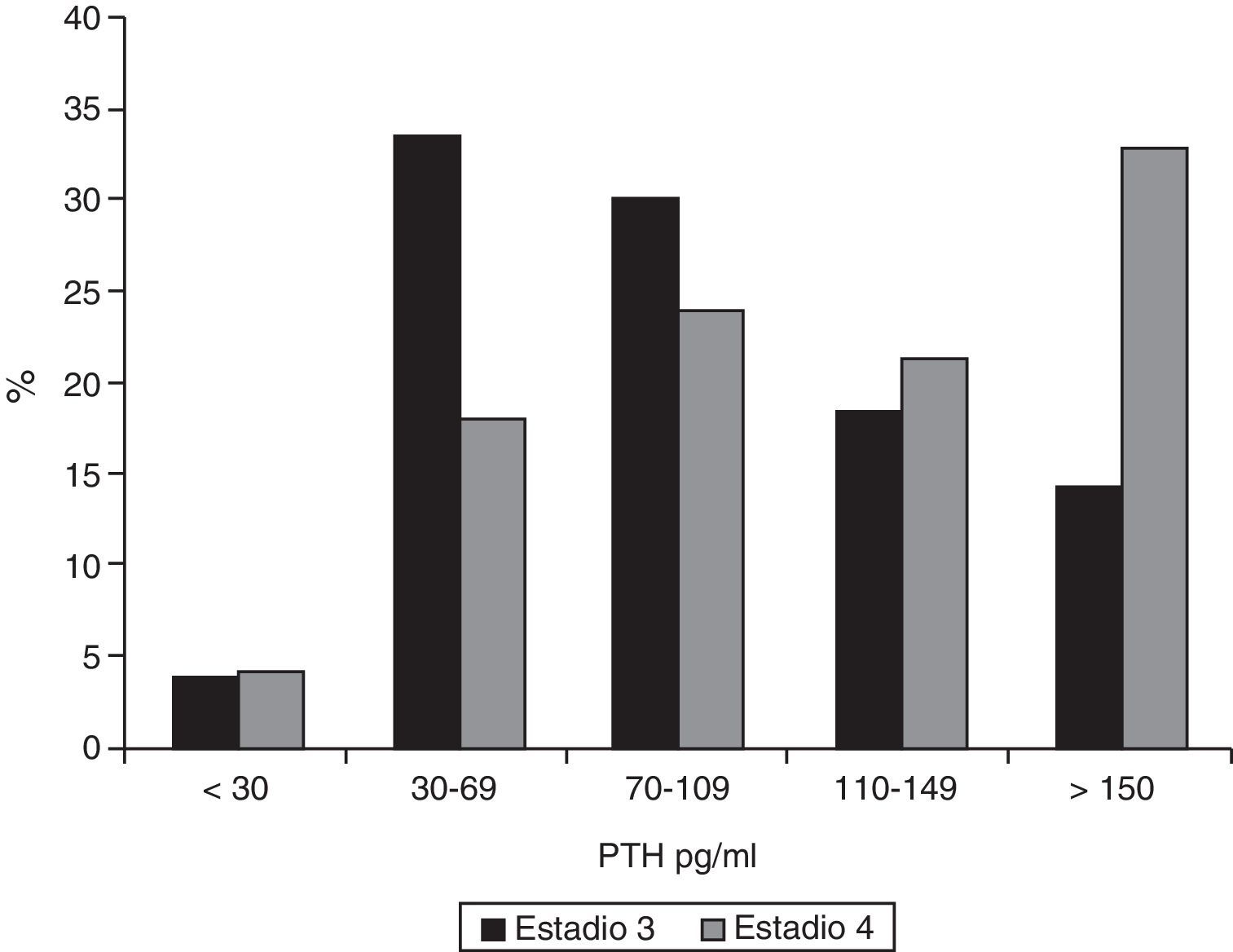
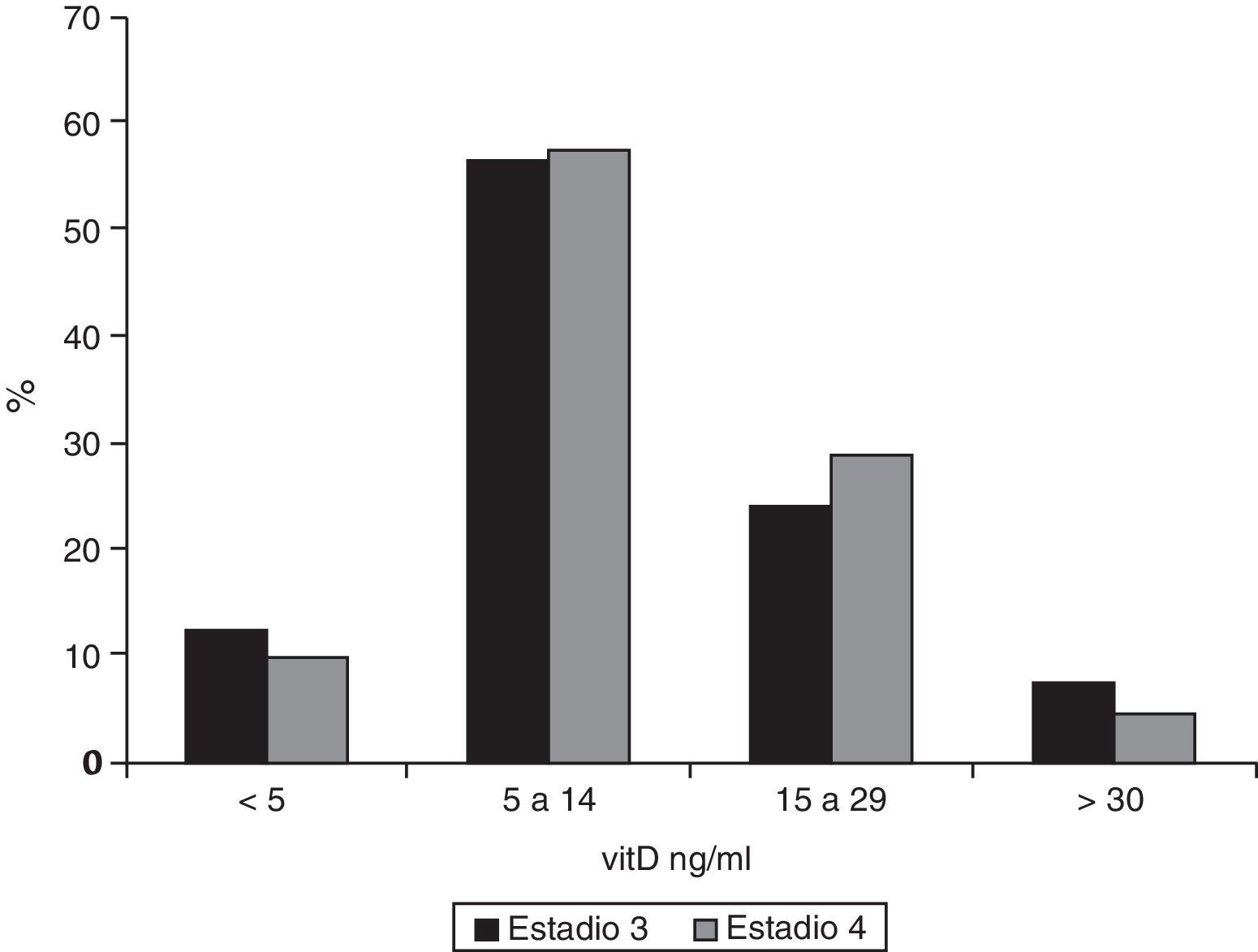
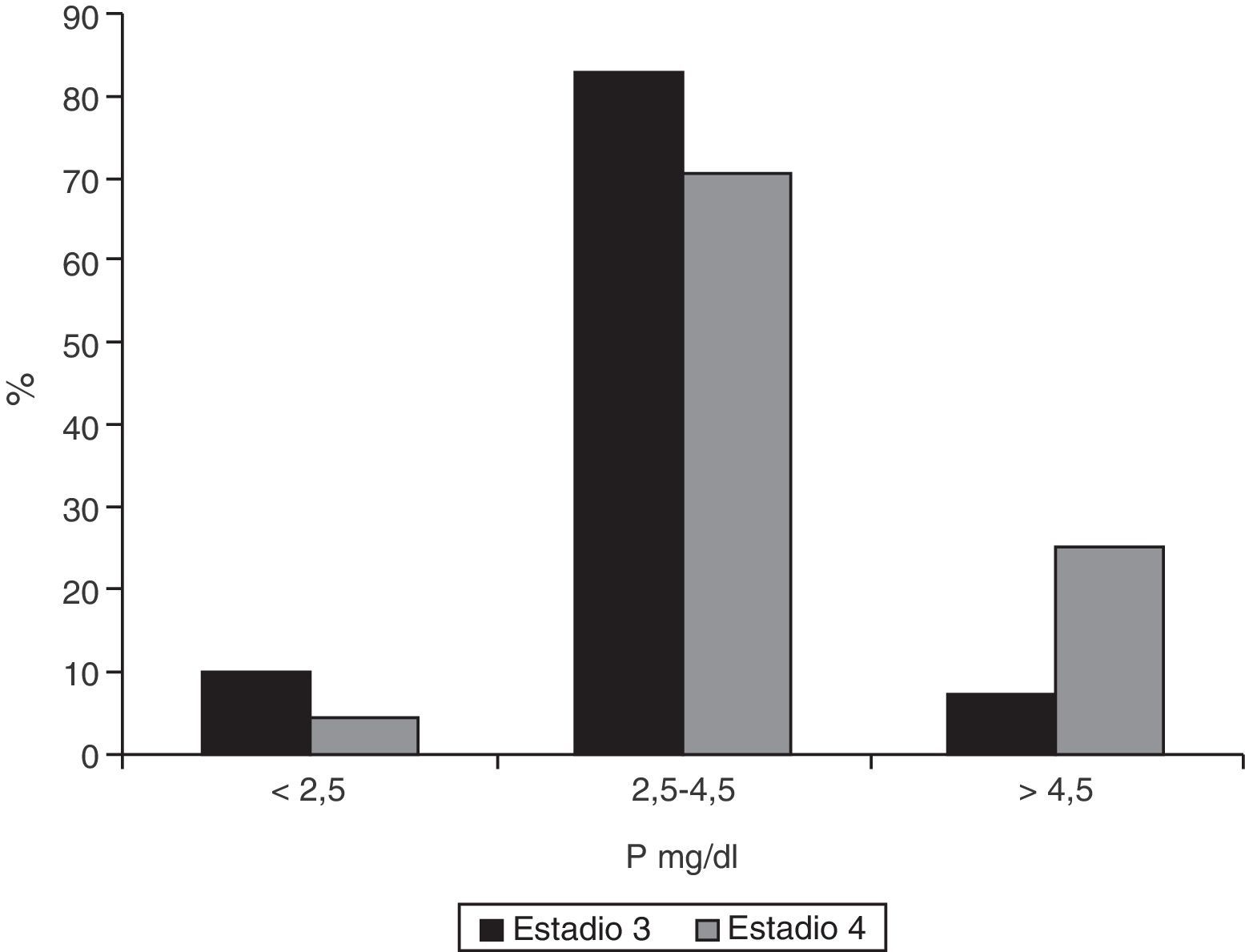
ResultadosDe los pacientes en estadio 3 el 62,9% presentaban una PTH ≥70pg/ml, y en el 32,7% los valores eran ≥110pg/ml. En los enfermos en estadio 4 la mediana de la concentración de PTH era 120pg/ml (p <0,001). De ellos, el 77,9% tenía una PTH ≥70pg/ml (p <0,001) y el 54,1% una PTH ≥110pg/ml (p=0,015). Los valores de 25-OH-vitD eran adecuados en el 7,2% de los pacientes en estadio 3 y en el 4,1% de los de estadio 4. Solamente el 7,2% de los pacientes en estadio 3 tenían hiperfosfatemia, frente al 25,4% en estadio 4 (p <0,001).
ConclusionesEl hiperparatiroidismo es una complicación frecuente de la insuficiencia renal crónica en los estadios 3 y 4, sin que aparezca alteración detectable en los niveles de calcemia o fosfatemia, por lo que es aconsejable determinar PTH en todos los pacientes con filtrado glomerular disminuido.
Despite the high prevalence of chronic kidney disease in the elderly population, few data are available on the frequency of secondary hyperparathyroidism in the Spanish population affected by this problem. We undertook a study on this issue in patients attending the internal medicine departments in our area.
Design and methodsAn observational, cross-sectional survey performed at internal medicine departments on 415 patients with stage 3 and 4 chronic kidney disease. Clinical history and risk factors were collected using a standardized protocol. Serum creatinine, phosphate, calcium, intact parathormone (PTH) and 25-hydroxy-cholecalciferol (25-OH-vitD) levels were measured in all patients.
ResultsAmong stage 3 patients, 62.9% had PTH levels ≥70pg/mL and 32.7% levels ≥110pg/mL. Median PTH level in stage 4 patients was 120pg/mL (p <0.001), and 77.9% of these patients had PTH ≥70pg/mL (p <0.001) and 54.1% ≥110pg/mL (p=0.015). Adequate 25-hydroxy-cholecalciferol levels were found in only 7.2% of stage 3 patients and 4.1% of stage 4 patients. Only 7.2% of stage 3 patients had hyperphosphatemia, as compared to 25.4% of stage 4 patients (p <0.001).
ConclusionsHyperparathyroidism is a common complication of stage 3 and 4 chronic kidney disease which is not associated to detectable changes in serum calcium and phosphate levels. It is therefore advisable to measure PTH levels in all patients with decreased glomerular filtration rate.
La insuficiencia renal crónica (IRC) es un síndrome clínico derivado del progresivo y generalizado deterioro irreversible de la función renal secundaria a la destrucción de la masa nefronal. La prevalencia de la IRC varía según los países y los estudios existentes. Habitualmente se utiliza como criterio de IRC un filtrado glomerular estimado (FGe) menor de 60ml/min según las recomendaciones de la The National Kidney Foundation-Kidney Disease Outcomes Quality Initiative (NFK-KDOQI) en las que se estratifica la IRC en 5 estadios según las cifras de FGe a partir de distintas fórmulas, siendo la más común la versión abreviada de la MDRD-41-3. La prevalencia de IRC utilizando estos criterios es relativamente elevada, particularmente en población anciana. El estudio EPIRCE, realizado en todo el territorio nacional, señalaba una prevalencia cercana al 6% en población general4, mientras que el estudio HERMEX, realizado en Extremadura, mostraba una prevalencia del 4%5. Por encima de los 65 años de edad la prevalencia de enfermedad renal alcanzaba superaba el 21% en el estudio EPIRCE y se triplicaba en el estudio HERMEX.
La disminución de la función renal produce alteraciones metabólicas que dan lugar a la aparición de niveles elevados de paratohormona (PTH). Una disminución de la masa renal funcionante da lugar a una deficiencia de calcitriol, lo cual «desinhibe» la producción de PTH mRNA. Además de la hipocalcemia y de la disminución del calcitriol, la retención de fósforo, consecuencia de la disminución del filtrado glomerular, es otro factor que, a través de distintos mecanismos, favorece el desarrollo del hiperparatiroidismo secundario6. El aumento de PTH circulante se empieza a detectar en estadios tempranos de la insuficiencia renal y el deterioro de la función renal se acompaña de un incremento progresivo de los niveles de PTH7.
A pesar de la elevada prevalencia de IRC en la población anciana existen muy escasos datos sobre la frecuencia con la que aparece hiperparatiroidismo secundario a enfermedad renal en la población española afecta de este trastorno. Hemos intentado estudiar este punto a partir de las personas con IRC que atendidas por los servicios de medicina interna de nuestra área.
Diseño y métodosEstudio transversal observacional realizado en servicios de medicina interna de 14 hospitales de Extremadura y Andalucía. Se recogió información de pacientes vistos de forma consecutiva en consultas u hospitalización de medicina interna. Se ha incluido en el estudio un total de 415 pacientes con IRC, estadios 3 y 4 según los criterios de la K/DOQI3. De ellos, 293 estaban en estadio 3 (70,6%; FGe medio 43,3±8,7ml/min) y 122 en estadio 4 (29,4%; FGe 24,7±6,2ml/min). El 47,7% de los pacientes eran varones y la edad media de la muestra era 78,5±8,8 años con una mediana de índice de comorbilidad de Charlson =2 (media 2,7). El 61% de los pacientes reclutados estaban hospitalizados (mediana de índice de Charlson =3, media 3,14). El 10,6% de los pacientes (hombres 7,8%, mujeres 13,5%) recibían tratamiento con suplementos de calcio, el 11,2% recibían vitamina D (98,8% calciferol) y el 4,8% estaban tratados con bifosfonatos. Había un 7,5% de pacientes en tratamiento con corticoides.
Se recogieron antecedentes y factores de riesgo según un protocolo estandarizado para todos los participantes, así como los tratamientos que estaban realizando. En todos los casos se determinaron niveles séricos de creatinina, fósforo y calcio en ayunas. El filtrado glomerular se estimó mediante la fórmula MDRD-4 abreviada. También se determinó parathormona (PTH) intacta y 25-hidroxi-colecalciferol (25-OH-vitD) según el procedimiento analítico utilizado en cada hospital participante. Conforme a las recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con enfermedad renal crónica8 se ha considerado hiperparatiroidismo secundario una PTH≥70pg/ml, y déficit de 25-OH-vitD, una concentración <30ng/ml. Se consideró hipocalcemia un calcio plasmático <8,5mg/dl.
Las variables cuantitativas se expresan mediante la media y la desviación estándar (DE), o bien la mediana y el rango intercuartílico (RI) según sus distribución. Las variables cualitativas se muestran como frecuencias absolutas y relativas con su correspondiente intervalo de confianza. La diferencia entre medias se analizó mediante la prueba de Mann-Whitney. Para las diferencias entre prevalencias se utilizó la prueba de chi cuadrado. Se ha utilizado el programa estadístico SPSS 21.0 (IBM, Armonk, Nueva York, EE. UU.). Para calcular el tamaño de la muestra se consideró como variable principal la proporción de PTHi, estimada en un 37%, un nivel de confianza del 95% y una precisión absoluta del 5%. Con los supuestos anteriores el tamaño muestral calculado era 359 pacientes.
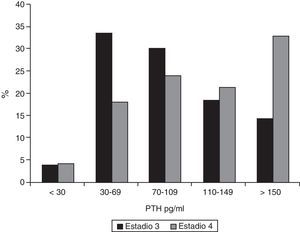
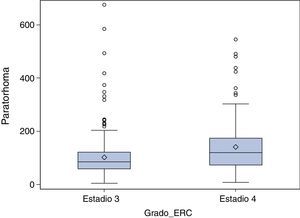
ResultadosLa mediana de PTH en los pacientes en estadio 3 era 86pg/ml (RI 60-122); de estos pacientes, 62,9% (IC 95% 0,57-0,68) presentaban una PTH≥70pg/ml y 32,7%, valores≥110pg/ml (IC 95% 0,28-0,38). En los enfermos en estadio 4 la mediana de la concentración de PTH era 120pg/ml (RI 74-175, p <0,001). De ellos, el 77,9% (IC 95% 0,70-0,84) tenían una PTH≥70pg/ml (p<0,001), y el 54,1% (IC 95% 0,45-0,63) una PTH ≥110pg/ml (p=0,015). Se pueden ver los datos desglosados en las figuras 1 y 2.
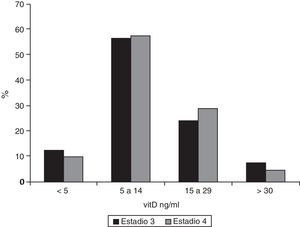
En cuanto a los niveles de 25-OH-vitD, solamente el 7,2% (IC 95% 0,05-0,11) de los pacientes en estadio 3 tenían valores adecuados, y esta proporción era aún menor entre los enfermos en estadio 4 (4,1%, IC 95% 0,02-0,09), si bien esta diferencia no era significativa. Los datos han sido desglosados en la figura 3. La mediana de 25-OH-vitD era 10,9ng/ml (RI 6,9-17,3) en los pacientes en estadio 3 y 11,0ng/ml (RI 7,1-17,0) en aquellos en estadio 4 (sin significación estadística).
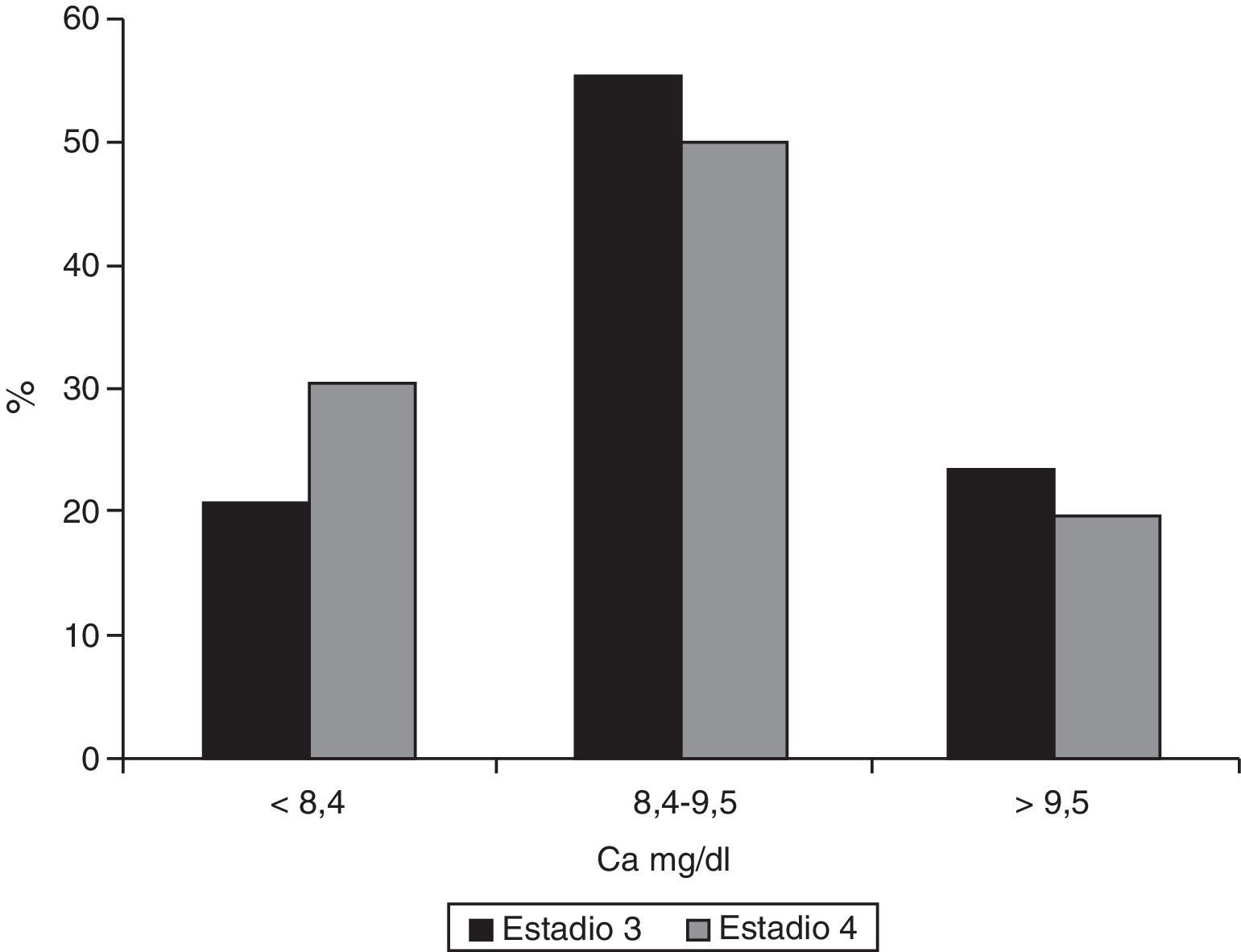
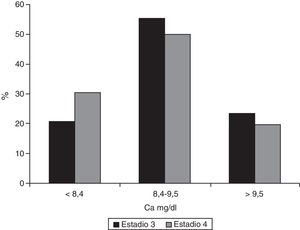
La mediana de calcemia en los pacientes en estadio 3 era 9,0mg/dl (RI 8,-9,4) frente a 8,7 (RI 8,2-9,3) en el grupo en estadio 4 (p=0,007). Un 20,9% (IC 95% 0,17-0,26) de los pacientes con IRC estadio 3 presentaban hipocalcemia frente al 30,3% (IC 95% 0,23-0,39) de los enfermos en estadio 4 (p=0,039, prueba de chi cuadrado) (fig. 4).
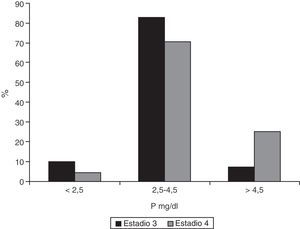
La mediana del fósforo de los enfermos con IRC estadio 3 era 3,3mg/dl (RI 2,9-3,8) y en aquellos estadio 4 la mediana era 3,9mg/dl (RI 3,5-4,9) (p <0,001). Solamente 7,2% (IC 95% 0,05-0,11) de los pacientes en estadio 3 tenían fosfatemia≥4,5mg/dl (IC 95% 0,19-0,34) frente al 25,4% en el estadio 4 (p<0,001). La figura 5 muestra la distribución de los valores fósforo.
La mediana del producto calcio-fósforo era 30,0 (RI 25,2-34,8) en el estadio 3 y 34,3 (RI 29,9-39,0) en el estadio 4. El número de pacientes con producto calcio-fósforo>55 era muy escaso: 0,68% (IC 95% 0,002-0,02) en el estadio 3 y 2,5% (IC 95% 0,01-0,07) en el estadio 4 (sin significación estadística).
DiscusiónNuestros datos demuestran una prevalencia muy elevada de hiperparatiroidismo secundario a enfermedad renal en la población con insuficiencia renal en estadios 3 y 4 atendidas en servicios de medicina interna, tanto si se consideran los niveles de diagnóstico como los objetivos de tratamiento para dichos estadios. Resultados similares se observaron en el estudio MERENA9, que comparó los datos de morbimortalidad de 1.129 pacientes distribuidos en 2 cohortes de pacientes, diabéticos (n=461) y no diabéticos (n=668), en estadios 3 y 4 KDOQI, seguidos en las consultas de nefrología. La edad media de la muestra era parecida a la nuestra (70 años) y el porcentaje de pacientes con PTH fuera de rango terapéutico era el 71,3% en el estadio 3 (PTH entre 35-70pg/ml) y 79,3% en el estadio 4 (entre 70-110pg/ml). En ambos casos los porcentajes son muy superiores a los encontrados en nuestro estudio lo cual puede explicarse por los diferentes orígenes de las muestras. Aunque puede sorprender el mal control del hiperparatiroidismo observado en las consultas de nefrología, el estudio OSERCE, con 634 pacientes incluidos procedentes de 32 unidades de nefrología de España, ofreció unos resultados similares10. Lo mismo ocurre cuando se compara con otros estudios con prevalencia también muy elevada de hiperparatiroidismo secundario a insuficiencia renal11–14.
Teniendo en cuenta la prevalencia relativamente elevada de la IRC dentro de la población española4,5,15, tanto el estudio MERENA como nuestros resultados construyen un panorama preocupante y demuestran la necesidad de realizar el despistaje de hiperparatiroidismo en todos estos pacientes, con los costes que ello evidentemente representa. Esto no es una cuestión menor, pues con independencia del problema inmediato de la enfermedad ósea renal, la PTH se ha considerado clásicamente como una toxina urémica y se ha asociado con diversos efectos sistémicos, y en particular con la aparición de calcificaciones vasculares16. También la hipertrofia de ventrículo izquierdo, un conocido factor de riesgo vascular muy prevalente en la insuficiencia renal, se ha relacionado con la presencia de hiperparatiroidismo17. Así mismo, se ha señalado su relación con la mortalidad general18,19 y morbimortalidad de origen cardiovascular20. Puesto que la mortalidad cardiovascular es la primera causa de muerte en los pacientes con insuficiencia renal21, la evaluación de los niveles de PTH se vuelve particularmente necesaria en todo paciente con FGe<60ml/min.
Nuestros datos demuestran que la aparición de alteraciones en los valores de fosfatemia y calcemia son raras incluso en cuando la PTH se encuentra elevada por encima de 110pg/ml. Tradicionalmente se ha ligado la retención de fósforo con la aparición de hiperparatiroidismo que sería el principal responsable de la enfermedad ósea de la insuficiencia renal22. También se han acumulado evidencias epidemiológicas que ligan la hiperfosfatemia tanto con la mortalidad cardiovascular y la mortalidad por cualquier causa del paciente renal, como con la progresión de la enfermedad renal23. A la vista de nuestros resultados parece que el riñón mantiene la capacidad de ajustar el balance de fósforo en el estadio 3 de enfermedad renal. Ello conlleva no obstante la estimulación de la producción de PTH y la aparición de hiperparatiroidismo, que solamente puede ser detectado por la determinación específica de PTH incluso en ausencia de hiperfosfatemia. Sin embargo, la hiperfosforemia, aunque sea leve, aparece efectivamente en un número significativo de pacientes en estadio 4.
En el pasado el incremento de PTH y el desarrollo de hipertrofia de las glándulas paratiroideas en la IRC se atribuyó a niveles bajos de calcemia. Posteriormente se comprobó que los niveles de calcitriol disminuían progresivamente a medida que se reducía la función renal24 y que eran los receptores de vitamina D, sobre los que actúa el calcitriol, los que regulaban la proliferación de las células paratiroideas y la síntesis de PTH25,26. Al igual que ocurría con los niveles de fósforo sérico, no parece que la alteración de la calcemia sea un hallazgo frecuente en los pacientes con IRC ni siquiera en el estadio 4, ni tampoco es habitual hallar alteraciones del producto calcio-fósforo. Por tanto, ambas determinaciones tienen escaso rendimiento diagnóstico en estos enfermos.
La vitamina D es una vitamina liposoluble que, además de ser un micronutriente esencial, debe considerarse como una hormona involucrada en un complejo sistema endocrino que regula la homeostasis mineral, protege la integridad del esqueleto y modula el crecimiento y la diferenciación celular en una amplia variedad de tejidos27. Se han publicado varios estudios que señalan que una gran parte de la población presenta déficit de vitamina D. Así, en un estudio realizado en España en población ambulatoria mayor de 64 años sin factores de riesgo conocidos de hipovitaminosis, la prevalencia de hipovitaminosis D (definida como niveles de 25-OH-vitD <25ng/ml) fue del 87%28. En otro estudio, el 61% de estudiantes universitarios jóvenes y sanos de Canarias presentaban déficit o insuficiencia de vitamina D (niveles de 25-OH-vitD <30ng/ml) y el 32% niveles inferiores a 20ng/ml29. Evidentemente la prevalencia del déficit de vitamina D es dependiente del valor plasmático de corte utilizado; la OMS considera 20ng/dl; sin embargo, actualmente se tiende a considerar insuficiencia con niveles <30ng/ml, lo cual incrementa la prevalencia30. Los resultados de nuestro estudio muestran una situación similar, en este caso en pacientes con insuficiencia renal en estadios 3 y 4. Llama la atención que solamente un diez por ciento de ellos recibían suplementos de vitamina D. Este trastorno no es inherente a la enfermedad renal «per se», sino que es un hallazgo habitual en la población general. Generalmente el déficit de vitamina D se asocia a baja exposición al sol, combinada con escasa ingesta de alimentos que contienen esta vitamina o bien con procesos que cursan con malabsorción de las grasas; esto resulta muy sorprendente en la población española si tenemos en cuenta la elevada insolación que hay en nuestro territorio. Aunque la variabilidad interindividual para producir vitamina D por acción de la luz solar es muy elevada esto difícilmente puede explicar la homogeneidad de los resultados31. No obstante, se trata de un hallazgo preocupante puesto que el déficit de vitamina D parece asociarse a múltiples patologías, entre ellas las cardiovasculares32, sin que la suplementación haya demostrado beneficios terapéuticos33.
La principal fortaleza de este estudio radica en el tamaño muestral y la procedencia de la muestra de una zona delimitada y con escasa inmigración tanto nacional como de otras áreas geográficas, lo que aumenta la homogeneidad de la población estudiada. No obstante, esto introduce una cierta duda sobre la reproductibilidad de estos datos en otras regiones. La principal debilidad reside en que se trata de una muestra de población enferma, y no de población general, con una edad media bastante elevada, lo que incrementa la prevalencia de hiperparatiroidismo secundario asintomático. Por otra parte, la determinación de parathormona no se realizó de forma centralizada, por lo que la variabilidad entre las técnicas usadas en los distintos laboratorios puede haber influido en los resultados, si bien solo existían pequeñas diferencias entre los diversos valores de referencia.
Nuestras conclusiones son: el hiperparatiroidismo es una complicación extremadamente frecuente de la IRC en los estadios III y IV. Habitualmente esta complicación ocurre antes de que aparezca ninguna alteración detectable en los niveles de calcemia o fosfatemia, lo que hace aconsejable determinar parathormona en todos los pacientes con filtrado glomerular disminuido por debajo de 60ml/min. El déficit de vitamina D es muy común también en este grupo de pacientes, aunque este no parece tener relación con la insuficiencia renal.
AutoríaLista de médicos participantes:
García Sánchez, Francisco (Hospital Virgen del Puerto, Plasencia); Luque, Maria José (Hospital de la Siberia, Talarrubias); Morales, Rocío (Hospital Infanta Cristina, Badajoz): Megías, Ana (Hospital de la Siberia, Talarrubias); Muñoz Díaz, Fernando (Hospital de Llerena); Ramiro, Jose Manuel (Hospital de Coria); Romero, Manuel (Hospital Infanta Elena, Huelva); Gutiérrez Díaz, María Dolores (Hospital de Llerena); Gómez Casero, Lourdes (Hospital Tierra de Barros, Almendralejo); Nevado, Leticia (Hospital Perpetuo Socorro, Badajoz); Bureo, Nicolás (Hospital Perpetuo Socorro, Badajoz); Buenavida, Jose Ramón (Hospital de Llerena); Fernández Auzmendi, Verónica (Hospital de la Siberia, Talarrubias); Maciá, Enrique (Hospital Perpetuo Socorro, Badajoz); Masero, Antonio (Hospital de Don Benito-Villanueva de la Serena); Pijierro, Agustin (Hospital Infanta Cristina, Badajoz).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.