Evaluar la prevalencia de anticuerpos frente a las células parietales gástricas (ACP) en pacientes con enfermedad tiroidea autoinmune (ETI).
Material y métodosEstudio descriptivo transversal con inclusión de pacientes con ETI. Se determinó la presencia de ACP. Se definieron como títulos elevados de anticuerpos antitiroideos (ATAS) niveles de anticuerpos antiperoxidasa o antitiroglobulina superiores al percentil 75.
Mediante modelo de regresión logística se evaluó la contribución independiente de las siguientes variables a la presencia de ACP positivos: edad, sexo, hemoglobina, volumen corpuscular medio (VCM), dosis/k de levotiroxina (LT4), duración de la ETI y títulos elevados de ATAS.
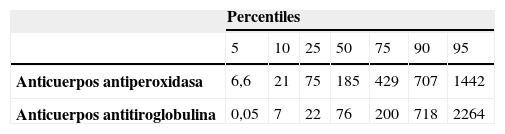
ResultadosSe incluyeron 148 pacientes (137 mujeres) con edad de 45,7 (DE 15) años y duración de la enfermedad de 4,5 (DE 4) años. De ellos, 43 (29%) tenían enfermedad de Graves y 105 (71%) hipotiroidismo primario. El percentil 75 fue para anticuerpos anti-peroxidasa 420U/ml y para anticuerpos antitiroglobulina 200U/ml.
Los ACP fueron positivos en 30 pacientes, con una prevalencia global del 20,3%. Títulos iguales o superiores a 1/640 aparecieron en 19 pacientes (12,8%).
El único factor predictivo independiente de ACP positivos fue la presencia de títulos elevados de ATAS (Odds Ratio [OR]=3; intervalo de confianza [IC] 95%: 1,1–8,6; p=0,04). El único factor predictivo independiente de ACP positivos a títulos iguales o superiores a 1/640 fue también la presencia de títulos elevados de ATAS (OR=7,3; IC 95% 1,6–32,7; p=0,009).
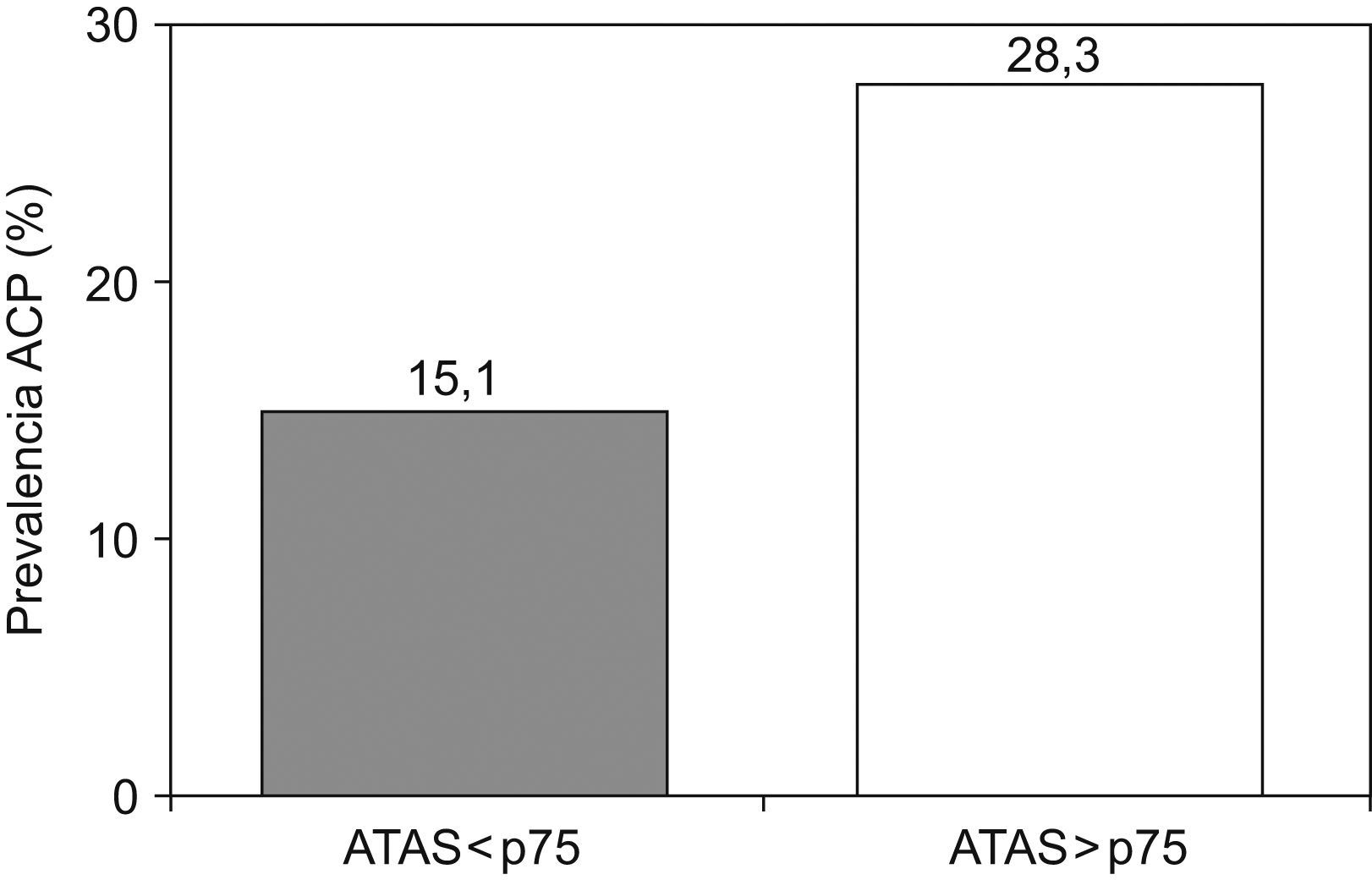
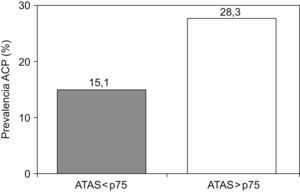
ConclusionesLa prevalencia de ACP positivos en pacientes con ETI fue del 20%. La presencia de títulos elevados de ATAS incrementa el riesgo de aparición de ACP positivos.
Our aim was to evaluate the prevalence of parietal cell antibodies (PCA) in patients with autoimmune thyroid disease (ATD).
Material and MethodsWe performed a descriptive, cross-sectional study of patients with ATD. The presence of PCA was determined. Elevated antithyroid antibodies (ATAs) were defined as those higher than the 75th percentile of distribution.
Multivariate logistic regression models were built to assess the independent contribution of the following variables to PCA positivity: age, sex, hemoglobin, medium corpuscular volume (MCV), dose/Kg of levothyroxine (LT4), disease duration and elevated ATA levels.
ResultsA total of 148 patients were included (137 females). The mean age was 45.7 (SD 15) years and disease duration was 4.5 (SD 4) years. Forty-three patients (29%) with Graves’ disease and 105 (71%) with primary hypothyroidism were included. The 75th percentile of distribution was 420U/ml for anti-peroxidase antibodies and 200U/ml for anti-thyroglobulin antibodies. PCA positivity was found in 30 patients, with an overall prevalence of 20.3%. PCA positivity with titers higher than 1/640 was found in 19 patients (12.8%).
The only independent predictive factor of PCA positivity was the presence of elevated levels of ATAs (odds ratio (OR)=3; 95% confidence interval (CI): 1.1-8.6; p=0.04). The only independent predictive factor of PCA positivity at titers ≥1/640 was also the presence of elevated levels of ATAS (OR=7.3; 95% CI: 1.6-32.7; p=0.009).
ConclusionsThe prevalence of PCA positivity in patients with ATD was 20%. Elevated levels of ATAs increase the risk of PCA positivity.
La gastritis autoinmune es una enfermedad autoinmune caracterizada por la presencia de anticuerpos anticélula parietal gástrica (ACP), y está frecuentemente asociada a otras enfermedades autoinmunes organoespecíficas.
La prevalencia de gastritis crónica autoinmune (GA) en la población general puede alcanzar el 2%. En pacientes con enfermedad tiroidea autoinmune (ETI), esta prevalencia está incrementada entre 3 y 5 veces1,2.
La GA se caracteriza por atrofia del cuerpo y fundus gástrico y por la presencia de anticuerpos ACP. La autoagresión crónica a la bomba de protones gástrica producirá disminución de la secreción de ácido gástrico, hipergastrinemia por respuesta de las células G antrales, y anemia. La anemia podrá ser ferropénica (debido a la falta de acidez gástrica que impide la conversión del hierro de la forma férrica a la forma ferrosa, lo cual dificulta la absorción) o perniciosa por deficiencia de vitamina B12 (debido a la ausencia de factor intrínseco o a la aparición de anticuerpos antifactor intrínseco). Además, hasta en un 10% de pacientes con GA, pueden desarrollarse tumores carcinoides gástricos o adenocarcinomas3. Debido a ello, es importante hacer un diagnóstico precoz.
A pesar de la frecuente asociación de autoinmunidad tirogástrica, no está bien definido si es preciso hacer una determinación sistemática de ACP en los pacientes diagnosticados de ETI.
En este trabajo nos planteamos 2 objetivos:
- 1.
Determinar la prevalencia de ACP en pacientes con ETI.
- 2.
Determinar factores predictivos de aparición de ACP en estos pacientes.
Estudio epidemiológico descriptivo transversal.
Población a estudioSe incluyeron de forma sistemática todos los pacientes diagnosticados de ETI en consultas externas hospitalarias de endocrinología durante un periodo de 3 meses. El diagnóstico de ETI se realizó mediante la presencia de hiper o hipotiroidismo autoinmune, confirmado mediante la positividad para anticuerpos antiperoxidasa, antitiroglobulina o antireceptor de TSH.
Se determinó de forma sistemática en todos estos pacientes la presencia de ACP. Se solicitó consentimiento verbal a los pacientes para la utilización anónima de los datos.
Variables recogidasSe recogieron en todos los pacientes variables clínicas (edad, sexo, peso, talla, presencia de bocio, duración de la enfermedad, tratamiento con hormona tiroidea) y analíticas (anticuerpos antiperoxidasa, anticuerpos antitiroglobulina, ACP, hemograma).
Métodos analíticosLos anticuerpos antiperoxidasa se determinaron mediante ELISA con rango de normalidad<28U/ml. Los anticuerpos antitiroglobulina se determinaron mediante ELISA con rango de normalidad<70U/ml. Los ACP se determinaron mediante inmunofluorescencia indirecta, considerándose positivos títulos ≥1/40.
Métodos estadísticosLas variables cuantitativas se describieron con la media y desviación estándar (DE) y las variables cualitativas, con distribución de frecuencias. Se incluyó el intervalo de confianza (IC) del 95% para la prevalencia de ACP.
Definimos como títulos elevados de anticuerpos antitiroideos (ATAS) los niveles de anticuerpos antiperoxidasa o antitiroglobulina superiores al percentil 75 de la distribución de ATAS en nuestros pacientes.
La comparación de medias se realizó mediante la prueba t de Student de grupos independientes y la comparación de proporciones, mediante la de chi cuadrado.
Mediante regresión logística se evaluó la contribución independiente de las siguientes variables a la presencia de ACP positivos: edad, sexo, hemoglobina, volumen corpuscular medio (VCM), dosis de levotiroxina (LT4) por kg de peso (dosis/kg), duración de la ETI y títulos elevados de ATAS.
Se consideraron significativos valores de p<0,05.
ResultadosSe incluyeron 148 pacientes, de los cuales 137 (92,6%) eran mujeres, con una edad media de 45,7 años (DE: 15). El tiempo medio de evolución de la ETI fue 4,5 años (DE: 4).
De todos ellos, 43 pacientes (29%) tenían enfermedad de Graves y 105 pacientes (71%) tenían hipotiroidismo primario. La prevalencia de bocio fue del 54,7%. La dosis media de LT4 por kg de peso en pacientes hipotiroideos fue de 1,17μg. La hemoglobina media fue de 13,7g/dl con un VCM de 89,49fl.
La distribución de anticuerpos antiperoxidasa y antitiroglobulina en nuestros pacientes queda reflejada en la tabla 1. El percentil 75 para anticuerpos antiperoxidasa fue de 420U/ml y para anticuerpos antitiroglobulina de 200U/ml.
En 30 pacientes se encontraron ACP positivos. Esto supone una prevalencia global del 20,3% (IC 95%: 14–28%). La prevalencia fue similar en pacientes con enfermedad de Graves y en pacientes con hipotiroidismo primario (21,4% vs. 19,2%; p=ns). Hubo 19 pacientes (12,8%; IC 95%: 8–19%) con títulos de ACP iguales o superiores a 1/640.
Los pacientes con ACP positivos tenían menor concentración de hemoglobina, aunque en el límite de la significación estadística, (13,4 vs. 13,9g/dl; p=0,06) y menor VCM (88 vs. 90fl; p=0,015) que los pacientes con ACP negativos. No hubo diferencias significativas en las concentraciones de hemoglobina de los pacientes con ACP positivos a títulos altos o bajos (13,5 vs. 13,2g/dl).
No hubo diferencias significativas en la dosis por kg de peso de LT4 en los pacientes hipotiroideos con ACP positivos o negativos (1,1 vs. 1,2μg; p=ns) ni entre los pacientes con ACP positivos a títulos altos o bajos (0,99 vs. 1,16μg; p=ns).
La prevalencia de ACP positivos fue mayor en pacientes con títulos elevados de ATAS (28,3 vs. 15,1%; p=0,05; fig. 1). La prevalencia de ACP positivos a títulos iguales o superiores a 1/640 fue mayor en pacientes con títulos elevados de ATAS (21,7% vs. 7%; p=0,009).
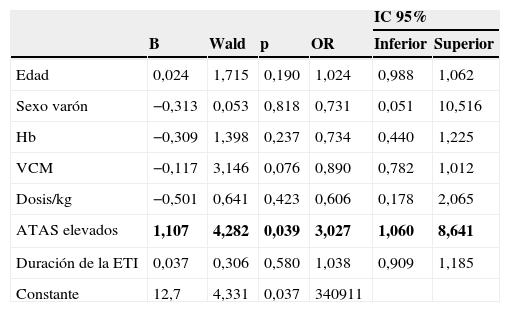
En modelo de regresión logística (tabla 2), el único factor predictivo independiente de ACP positivos fue la presencia de títulos elevados de ATAS (OR=3; IC 95% 1,1–8,6; p=0,04). Igualmente, el único factor predictivo independiente de ACP positivos a títulos iguales o superiores a 1/640 fue también la presencia de títulos elevados de ATAS (OR=7,3; IC 95% 1,6–32,7; p=0,009).
Factores predictivos en modelo de regresión logística para predecir la aparición de anticuerpos frente a las células parietales gástricas en pacientes con enfermedad tiroidea autoinmune
| IC 95% | ||||||
| B | Wald | p | OR | Inferior | Superior | |
| Edad | 0,024 | 1,715 | 0,190 | 1,024 | 0,988 | 1,062 |
| Sexo varón | −0,313 | 0,053 | 0,818 | 0,731 | 0,051 | 10,516 |
| Hb | −0,309 | 1,398 | 0,237 | 0,734 | 0,440 | 1,225 |
| VCM | −0,117 | 3,146 | 0,076 | 0,890 | 0,782 | 1,012 |
| Dosis/kg | −0,501 | 0,641 | 0,423 | 0,606 | 0,178 | 2,065 |
| ATAS elevados | 1,107 | 4,282 | 0,039 | 3,027 | 1,060 | 8,641 |
| Duración de la ETI | 0,037 | 0,306 | 0,580 | 1,038 | 0,909 | 1,185 |
| Constante | 12,7 | 4,331 | 0,037 | 340911 | ||
ATAS elevados: anticuerpos antitiroideos > percentil 75; ETI: enfermedad tiroidea autoinmune; Hb: hemoglobina; IC: intervalo de confianza; OR: odds ratio; VCM: volumen corpuscular medio.
En nuestro trabajo hemos detectado una prevalencia del 20% de ACP positivos en pacientes con ETI. Esta prevalencia era más elevada en los pacientes que tenían los títulos más elevados de ATAS.
La GA está frecuentemente asociada a otras enfermedades autoinmunes, incluyendo diabetes tipo 1 y ETI4. De hecho la GA5 es parte del síndrome poliglandular autoinmune tipo 3. Los ACP pueden ser positivos en un 20% de los pacientes con enfermedad de Graves y en un 30–40% de los pacientes con hipotiroidismo4. En el trabajo de Centanni et al2 la prevalencia de ACP fue de un 40%, superior al 20% detectada en nuestro trabajo. Esto podría justificarse por la utilización de un método de detección más sensible en su muestra de pacientes.
El autoantígeno diana en la GA es la bomba H+/K+-ATPasa de las células parietales gástricas6. El proceso autoinmune, que podría ser facilitado por la infección por Helicobacter pylori7, conduce a la pérdida de las células parietales de la mucosa gástrica. En un estudio reciente se demostró una relación entre la autoinmunidad tiroidea, gástrica y la infección por H. pylori8. Sean o no patogénicos, los títulos de ACP se correlacionan con la gravedad de la atrofia del cuerpo gástrico y pueden ser adecuados para el despistaje de GA4. En un trabajo9 en el que se incluyeron 129 niños con ETI se concluyó que la GA es una enfermedad que se da tempranamente en niños con ACP positivos. No obstante, también se ha descrito que la sensibilidad de los ACP para despistaje de GA puede ser inferior al 70%2. Por ello, se han sugerido como marcadores serológicos más adecuados de GA la presencia de elevaciones de la gastrina2 y los descensos de ghrelina10.
También hay datos indirectos que pueden sugerir la presencia de GA en pacientes con ETI. Entre ellos, el mejor descrito es la presencia de anemia, que puede ser microcítica por deficiencia de hierro (favorecida por la frecuente aparición de la enfermedad en mujeres de edad fértil) o macrocítica por deficiencia11 de vitamina B12. En segundo lugar, también se ha sugerido que los requerimientos de LT4 pueden ser superiores en pacientes con hipotiroidismo y GA12. En nuestro estudio vimos que los pacientes con ACP positivos tenían valores ligeramente inferiores de hemoglobina y VCM, aunque no hubo diferencias en las dosis de LT4 en los pacientes con hipotiroidismo en dependencia de la presencia de ACP. Por ello, creemos que la determinación de ACP no debería restringirse a los pacientes con anemia o dosis elevadas de LT4. Un hallazgo novedoso de nuestro estudio fue la demostración de que la presencia de valores elevados de ATAS triplicaba la posibilidad de encontrar ACP positivos y multiplicaba por un factor de 7 la posibilidad de encontrar títulos elevados de ACP. Por ello, sugerimos que, si no se realiza sistemáticamente la determinación de ACP, al menos debería contemplarse en los pacientes con ATAS positivos a títulos elevados.
Nuestro estudio tiene varias limitaciones. El número de sujetos fue limitado, por lo que el IC 95% en la estimación de la prevalencia de ACP positivos fue amplio. Además, no realizamos gastroscopias para confirmar la presencia de GA, por lo que no podemos determinar la sensibilidad y especificidad de la presencia de ACP positivos en nuestra población. Por todo ello, debe considerarse un trabajo preliminar.
En conclusión, en pacientes con ETI hemos encontrado una prevalencia de ACP positivos del 20%, especialmente, en aquellos pacientes con ATAS positivos a títulos elevados. Dada la importancia de la detección de GA por su asociación con patologías relevantes, consideramos adecuado su despistaje en pacientes con ETI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.