La prevalencia de hiperandrogenismo (HA), que incluye el síndrome de ovario poliquístico (SOP), es alta en los pacientes transexuales de mujer a hombre (TMH). Este hecho se ha relacionado con el síndrome metabólico (SM), lo que parece aumentar la morbimortalidad cardiovascular a lo largo del tratamiento hormonal cruzado (THC).
ObjetivosDeterminar la prevalencia de HA y SOP en pacientes TMH antes del inicio del THC, y su asociación con el SM y sus componentes, la insulinorresistencia (IR) y otros factores de riesgo cardiovascular (RCV).
Materiales y métodosSetenta y siete TMH fueron valorados clínica y analíticamente para HA antes de iniciar el THC. También se determinaron los factores de RCV, la IR y otros parámetros del SM.
ResultadosLa prevalencia de HA fue del 49,4% (el 73,7% de ellos con SOP [criterios de Rotterdam]), y del total de la muestra el 36,4% presentaron SOP. La prevalencia global de SM fue del 38,4 y 51,7% (criterios ATP-III e IDF, respectivamente). Los pacientes con HA frente a aquellos sin HA presentaban SM (criterios ATP-III e IDF, respectivamente) en el 36,8 y 57,9% frente al 25,6 y 41% (p<0,0001 y p<0,01, respectivamente). El 54,5% de los pacientes tenía normopeso (índice de masa corporal [IMC] 18,5-24,9kg/m2), el 26% sobrepeso (IMC 25-29,9kg/m2) y el 19,5% eran obesos (IMC≥30kg/m2). Al ajustar por el IMC la comparación de parámetros hormonales, metabólicos y antropométricos mostró diferencias estadísticamente significativas en los valores de glucemia, HOMA-IR y perímetro abdominal (p<0,001), así como en los de colesterol-HDL (HDL) (p=0,033), pero no en las concentraciones de testosterona total o de testosterona libre calculada. Del total de la muestra el 27,3% presentaron niveles de HDL por debajo de 50mg/dl.
ConclusionesEl HA y el SOP son muy prevalentes en la población TMH. HA y SOP se relacionan con el desarrollo temprano de SM, IR y otros factores de RCV, de consecuencias desconocidas en la edad adulta.
Prevalence of hyperandrogenism (HA), including the polycystic ovary syndrome (PCOS), in female-to-male transsexuals (FMT) is high. This has been related to metabolic syndrome (MS), which appears to increase cardiovascular morbidity and mortality throughout cross-sex hormone (CSH) therapy.
ObjectivesTo assess the prevalence of HA and PCOS in FMT patients before the start of CSH therapy, and their association to MS and its components, insulin resistance (IR) and other cardiovascular risk (CVR) factors.
Materials and methodsSeventy-seven FMTs underwent clinical and biochemical assessment for HA before the start of CSH therapy. CVR, IR, and other MS parameters were also assessed.
ResultsPrevalence of HA was 49.4% (73.7% were cases of PCOS [Rotterdam criteria]), and prevalence of PCOS in the overall sample was 36.4%. Prevalence of MS was 38.4% and 51.7% according to ATP-III and IDF criteria respectively). MS (according to ATP-III and IDF criteria respectively) was found in 36.8% and 57.9% as compared to 25.6% and 41% of patients with and without HA respectively (p<0.0001 and P<0.01 respectively). Of total patients, 54.5% had normal weight (body mass index [BMI] 18.5-24.9kg.m-2), 26% were overweight (BMI 25-29.9kg.m-2), and 19.5% were obese (BMI≥30kg.m-2). After adjusting for BMI, the comparison of hormonal, metabolic, and anthropometric parameters showed statistically significant differences in plasma glucose, HOMA-IR, and abdominal circumference (P<0.001 for all), as well as HDL cholesterol (HDL) (P=0.033), but not in total testosterone or calculated free testosterone levels. In the total sample, 27.3% had HDL levels less than 50mg/dL.
ConclusionsOverall HA, and PCOS in particular, are highly prevalent in FMTs. HA and PCOS are related to early development of SM, IR, and other CVR factors with unknown consequences in adulthood.
Los trastornos de identidad de género (TIG) ocurren cuando no existe correspondencia entre la diferenciación sexual biológica y la autopercepción del género. Se caracterizan por una fuerte y persistente identificación con el sexo opuesto, y un constante malestar con el sexo biológico o el comportamiento sexual asociado al propio sexo. La etiología de los TIG no está clara, aunque factores endocrinológicos, neuroanatómicos y psicosociales parecen estar involucrados en todos los casos1.
Diversos estudios han encontrado una alta prevalencia de síndrome de ovario poliquístico (SOP) en pacientes transexuales de mujer a hombre (TMH)1–5. Se ha sugerido que el hiperandrogenismo (HA) podría guardar relación con el desarrollo de TIG en el caso de los TMH5,6.
La causa más prevalente de HA, también en los TMH, es el SOP. Afecta al 5-10% de mujeres en edad reproductiva7,8. Las características clínicas más comunes de este síndrome son: irregularidad menstrual (oligo/anovulación) y signos de exceso de andrógenos como hirsutismo, alopecia y acné.
El SOP está asociado con importantes alteraciones metabólicas. Varios trabajos9,10 han encontrado que la prevalencia de diabetes es 10 veces mayor en mujeres con SOP, y que dentro de las mujeres obesas con alteración glucémica (glucemia alterada en ayunas e intolerancia a la glucosa) el 30-50% corresponde a pacientes con SOP. También se relaciona con alteración del perfil lipídico e hipertensión11,12, lo que parece aumentar el riesgo cardiovascular de esta población.
Por otro lado, Gooren et al.13 encontraron una alta prevalencia de componentes del síndrome metabólico (SM) al inicio del tratamiento hormonal cruzado (THC) en los TMH, lo que parece guardar relación con el discreto empeoramiento del riesgo cardiovascular a lo largo del tratamiento.
Un trabajo realizado en nuestra unidad4 demostró cambios a los 3 meses y al año del THC en variables antropométricas (aumento de peso) y factores de riesgo cardiovascular (aumento de proteína C reactiva [PCR] y colesterol-LDL [LDL] y disminución de colesterol-HDL [HDL] y apoproteína A [ApoA]).
El objetivo de este trabajo es determinar la prevalencia de HA y SOP en pacientes TMH antes del inicio del THC, y su asociación con el SM y sus componentes, la insulinorresistencia (IR) y otros factores de riesgo cardiovascular (RCV).
Material y métodosPacientesSe trata de un estudio descriptivo retrospectivo, con 77 pacientes TMH, de 30±4,1 años de edad (entre 18 y 43 años), diagnosticados de disforia de género tras valoración psicológica y endocrinológica en la Unidad de Identidad de Género (UTIG) del Hospital Ramón y Cajal desde mayo de 2007 a diciembre de 2008.
El estudio fue aprobado por el comité ético de investigación clínica del centro, y los participantes firmaron el consentimiento informado. Se recogieron datos de la historia clínica. Se practicó ecografía ginecológica a todos los pacientes. Se realizaron determinaciones analíticas de rutina de nuestra unidad, que incluyen los parámetros de interés para el estudio.
Criterios diagnósticosDefinimos HA bioquímico o hiperandrogenemia, al igual que otros autores2 que estudiaron idéntica población, a las concentraciones de testosterona libre calculada (cTL)≥0,028 nmol/l, establecida con la fórmula de Vermeulen14. Para el diagnóstico del SOP utilizamos los criterios de Rotterdam de 2003 y revisados en 200415,16, que establecen que se deben reunir al menos 2 de los siguientes criterios: 1) oligo o anovulación; 2) clínica y/o bioquímica de HA; y 3) ovarios poliquísticos, todo ello después de excluir otras causas de HA (hiperplasia suprarrenal congénita no clásica, disfunción tiroidea, hiperprolactinemia, síndrome de Cushing, tumores productores de andrógenos, síndrome hyperandrogenism, insulin resistance and acantosis nigricans [HAIRAN], hipertecosis y acromegalia). Para la valoración del hirsutismo se utilizó la escala de Ferriman-Gallwey modificada16. Un valor mayor de 8 corresponde a hirsutismo (HA clínico). Se define como oligoovulación a las menstruaciones irregulares y escasas, y anovulación a la ausencia de menstruación en los últimos 12 meses. Se considera que una ecografía presenta ovarios poliquísticos cuando encontramos al menos un folículo de volumen igual o mayor a 10cc, o 12 o más folículos entre 2-9mm de diámetro. Para el diagnóstico de SM hemos aplicado los criterios ATP-III (2002)17: perímetro abdominal>88cm, triglicéridos (TG) ≥150mg/dl, HDL<50mg/dl, presión arterial (PA)≥130/85mmHg y glucemia en ayunas ≥110mg/dl; 3 o más de estos factores son necesarios para el diagnóstico de SM. Además, hemos utilizado los criterios de la International Diabetes Federation (IDF,) de 200518: perímetro abdominal ≥80cm, más de 2 de los siguientes factores: TG≥150mg/dl, HDL<50mg/dl, PA≥130/85mmHg, glucemia en ayunas≥100mg/dl.
Determinaciones bioquímicasTodas las determinaciones bioquímicas, excepto las hormonales, se realizaron automáticamente en un autoanalizador BM/Hitachi 717, mediante técnicas enzimáticas a punto final. La concentración en suero de glucosa, colesterol total (CT) y TG se determinó mediante un método enzimático colorimétrico. La separación de las partículas HDL del CT se hizo por precipitación con polietilenglicol. La determinación de LDL se calculó usando la fórmula de Friedewald. Se consideraron diabéticos los pacientes con valores de glucemia ≥126mg/dl, y dislipidémicos aquellos con CT o TG>200mg/dl, con HDL<35mg/dl y/o con LDL>160mg/dl.
Para valorar la IR utilizamos el modelo homeostático de Matthews et al.19, conocido como índice HOMA (insulina [μU/ml]×glucosa [mmol/l]/22,5]. Se consideró un índice HOMA-IR≥3,8 como expresión de IR, según propusieron Ascaso et al.20. Las determinaciones hormonales (hormona foliculoestimulante [FSH], hormona luteinizante [LH], estradiol, Δ4-androstenediona (Δ4-A), dehidroepiandrosterona sulfato [DHEA-S], prolactina, globulina transportadora de hormonas sexuales [SHBG], testosterona total (TT), insulina y 17OH progesterona [17OHP]) se realizaron por métodos de quimioluminiscencia (IMMULITE, DPC, LA, CA), excepto la TSH, que se determinó por IRMA (Auto Delfia, Wallac, Gaithersburg, MD). Los coeficientes de variación interensayo e intraensayo para prolactina fueron 6,6 y 10,5%, respectivamente. En los pacientes con valores de prolactina>100ng/ml se efectuó resonancia magnética hipofisaria; con 17OHP>6 nmol/l se realizó estimulación de 17OHP con hormona adrenocorticotropa (ACTH) y con TT>230ng/dl se practicó TAC de suprarrenales.
Análisis estadísticoPara comprobar la bondad de ajuste de la distribución empírica a la normal se realizó la prueba Kolmogorov-Smirnov (K-S) de una muestra, resultando positiva (con z=2,017 y p<0,001). Por consiguiente, se pudieron utilizar análisis paramétricos. Los resultados se muestran como valores medios y desviaciones estándar. Se compararon los datos de diversas características correspondientes a aquellos sujetos con y sin HA, mediante una prueba «t» de Student para muestras independientes. Para los componentes del SM se compararon los porcentajes de los 2 grupos con y sin HA, utilizando una prueba Chi cuadrado a través de una tabla de contingencia. Para los parámetros metabólicos y hormonales se compararon los 3 grupos creados según el IMC, mediante un ANOVA de un factor. Por último se calculó la relación entre el nivel de cTL y 4 parámetros indicadores de obesidad, mediante los coeficientes de correlación de Pearson. Como nivel de significación se consideró válido una p<0,05. Todos los cálculos fueron efectuados con el paquete estadístico SPPSS 17.0 (SPSS Inc. Chicago, IL, EE. UU.).
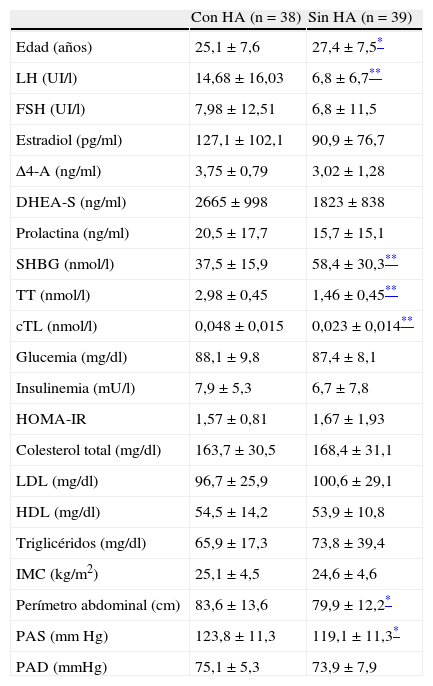
ResultadosEn función de los valores de cTL2 38 de los 77 pacientes TMH (49,4%) que participaron en el estudio presentaron HA. Respecto a la causa del HA ninguno de los pacientes presentaba síndrome HAIRAN, hiperplasia suprarrenal congénita o tumores productores de andrógenos. Las características hormonales, metabólicas y antropométricas diferenciales frente a los que no tenían HA se muestran en la tabla 1. Encontramos diferencias significativas entre ambos grupos con respecto a la edad (p<0,05), a los niveles de LH, SHBG, TT y cTL (p<0,01, en todos ellos) y a las medidas del perímetro abdominal y PAS (p<0,05).
Características hormonales, metabólicas y antropométricas de los sujetos según la presencia o no de HA
| Con HA (n=38) | Sin HA (n=39) | |
| Edad (años) | 25,1±7,6 | 27,4±7,5* |
| LH (UI/l) | 14,68±16,03 | 6,8±6,7** |
| FSH (UI/l) | 7,98±12,51 | 6,8±11,5 |
| Estradiol (pg/ml) | 127,1±102,1 | 90,9±76,7 |
| Δ4-A (ng/ml) | 3,75±0,79 | 3,02±1,28 |
| DHEA-S (ng/ml) | 2665±998 | 1823±838 |
| Prolactina (ng/ml) | 20,5±17,7 | 15,7±15,1 |
| SHBG (nmol/l) | 37,5±15,9 | 58,4±30,3** |
| TT (nmol/l) | 2,98±0,45 | 1,46±0,45** |
| cTL (nmol/l) | 0,048±0,015 | 0,023±0,014** |
| Glucemia (mg/dl) | 88,1±9,8 | 87,4±8,1 |
| Insulinemia (mU/l) | 7,9±5,3 | 6,7±7,8 |
| HOMA-IR | 1,57±0,81 | 1,67±1,93 |
| Colesterol total (mg/dl) | 163,7±30,5 | 168,4±31,1 |
| LDL (mg/dl) | 96,7±25,9 | 100,6±29,1 |
| HDL (mg/dl) | 54,5±14,2 | 53,9±10,8 |
| Triglicéridos (mg/dl) | 65,9±17,3 | 73,8±39,4 |
| IMC (kg/m2) | 25,1±4,5 | 24,6±4,6 |
| Perímetro abdominal (cm) | 83,6±13,6 | 79,9±12,2* |
| PAS (mmHg) | 123,8±11,3 | 119,1±11,3* |
| PAD (mmHg) | 75,1±5,3 | 73,9±7,9 |
Δ4-A: Δ4-androstenediona; cTL: testosterona libre calculada; DHEA-S: dehidroepiandrosterona sulfato; FSH: hormona folículoestimulante; HA: hiperandrogenismo; HDLc: high density lipoprotein cholesterol; HOMA-IR: homeostasis model assessment-insulinorresistencia; IMC: Índice de masa corporal; LDLc: low density lipoprotein cholesterol; LH: hormona luteinizante; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SHBG: globulina transportadora de hormonas sexuales; TT: testosterona total.Los datos son expresados como media±DE.
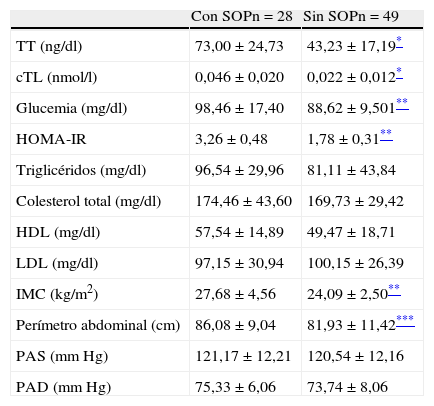
Utilizando los criterios de Rotterdam 28 de los 77 pacientes TMH del estudio (36,4%) fueron diagnosticados de SOP, con oligo/anovulación en 18 (64,3%) de ellos, ecografía ginecológica con criterios de ovario poliquístico en 12 (42,8%) e hirsutismo en 6 (15,8%) casos. Los pacientes con SOP presentaron algunas diferencias significativas frente al grupo sin SOP con respecto a los niveles de TT y cTL (p<0,0001), a los valores de glucemia, HOMA-IR e IMC (p<0,001, para todos) y a los del perímetro abdominal (p<0,05) (tabla 2).
Características hormonales, metabólicas y antropométricas de los sujetos según la presencia o no de SOP
| Con SOPn=28 | Sin SOPn=49 | |
| TT (ng/dl) | 73,00±24,73 | 43,23±17,19* |
| cTL (nmol/l) | 0,046±0,020 | 0,022±0,012* |
| Glucemia (mg/dl) | 98,46±17,40 | 88,62±9,501** |
| HOMA-IR | 3,26±0,48 | 1,78±0,31** |
| Triglicéridos (mg/dl) | 96,54±29,96 | 81,11±43,84 |
| Colesterol total (mg/dl) | 174,46±43,60 | 169,73±29,42 |
| HDL (mg/dl) | 57,54±14,89 | 49,47±18,71 |
| LDL (mg/dl) | 97,15±30,94 | 100,15±26,39 |
| IMC (kg/m2) | 27,68±4,56 | 24,09±2,50** |
| Perímetro abdominal (cm) | 86,08±9,04 | 81,93±11,42*** |
| PAS (mmHg) | 121,17±12,21 | 120,54±12,16 |
| PAD (mmHg) | 75,33±6,06 | 73,74±8,06 |
cTL: testosterona libre calculada; HDL: high density lipoprotein cholesterol; HOMA-IR: homeostasis model assessment-insulinorresistencia; IMC: índice de masa corporal; LDL: low density lipoprotein cholesterol; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SOP: síndrome de ovario poliquístico; TT: testosterona total.
Los datos son expresados como media±DE.
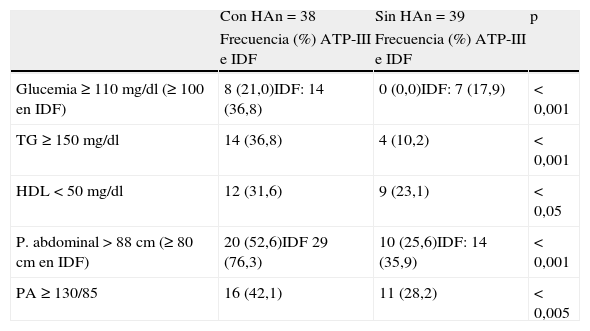
Según criterios ATP-III e IDF 29 y 40 de los 77 pacientes TMH (37,7 y 51,9%, respectivamente) se diagnosticaron de SM. Al ajustar por la presencia o no de HA el diagnóstico de SM fue significativamente diferente entre ambos grupos: 14 de los 38 pacientes con HA (36,8%) frente a 10 de 39 (25,6%) (p<0,01) por criterios ATP-III, y 22 de 38 pacientes con HA (57,9%) frente a 16 de 39 sin HA (41%) (p<0,01) por criterios IDF. En la tabla 3 se muestran las frecuencias de los componentes del SM en ambos grupos, siendo significativamente diferentes los valores de todos ellos.
Frecuencia de componentes del SM en relación con el HA
| Con HAn=38 | Sin HAn=39 | p | |
| Frecuencia (%) ATP-III e IDF | Frecuencia (%) ATP-III e IDF | ||
| Glucemia≥110mg/dl (≥100 en IDF) | 8 (21,0)IDF: 14 (36,8) | 0 (0,0)IDF: 7 (17,9) | <0,001 |
| TG≥150mg/dl | 14 (36,8) | 4 (10,2) | <0,001 |
| HDL<50mg/dl | 12 (31,6) | 9 (23,1) | <0,05 |
| P. abdominal >88cm (≥80cm en IDF) | 20 (52,6)IDF 29 (76,3) | 10 (25,6)IDF: 14 (35,9) | <0,001 |
| PA≥130/85 | 16 (42,1) | 11 (28,2) | <0,005 |
ATP-III: Third Report of the National Cholesterol Education Expert Panel on Detection, Evaluation, and Treatment of high blood cholesterol in adults; HA: hiperandrogenismo; HDL: high density lipoprotein cholesterol; IDF: International Diabetes Federation; PA: presión arterial; SM: síndrome metabólico; TG: triglicéridos.
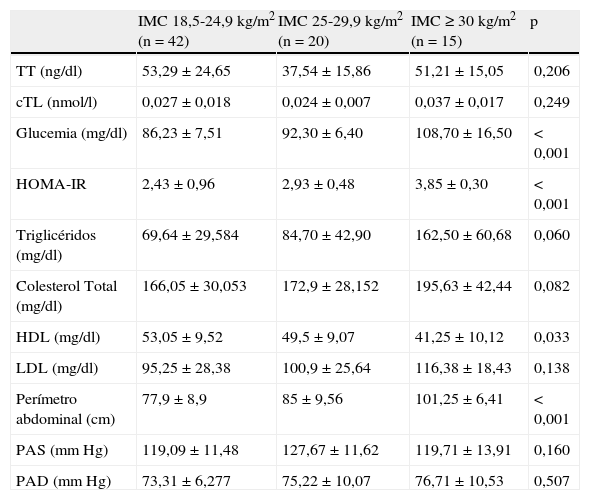
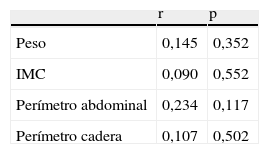
En cuanto al peso corporal, del total de la muestra de 77 pacientes TMH 42 (54,5%) tenían normopeso (IMC 18,5-24,9kg/m2), 20 (26%) sobrepeso (IMC 25-29,9kg/m2), y 15 (19,5%) eran obesos (IMC≥30kg/m2). Al ajustar por el IMC (tabla 4) la comparación de algunas variables hormonales, metabólicas y antropométricas mostró diferencias estadísticamente significativas en los valores de glucemia, HOMA-IR y perímetro abdominal (p<0,001, en todas), así como en los de HDL (p=0,033). Para el resto de los parámetros las diferencias no fueron significativas. Tampoco encontramos correlación entre parámetros de adiposidad y cTL (tabla 5).
Características hormonales, metabólicas y antropométricas ajustadas por el IMC
| IMC 18,5-24,9 kg/m2 (n=42) | IMC 25-29,9 kg/m2 (n=20) | IMC≥30 kg/m2 (n=15) | p | |
| TT (ng/dl) | 53,29±24,65 | 37,54±15,86 | 51,21±15,05 | 0,206 |
| cTL (nmol/l) | 0,027±0,018 | 0,024±0,007 | 0,037±0,017 | 0,249 |
| Glucemia (mg/dl) | 86,23±7,51 | 92,30±6,40 | 108,70±16,50 | <0,001 |
| HOMA-IR | 2,43±0,96 | 2,93±0,48 | 3,85±0,30 | <0,001 |
| Triglicéridos (mg/dl) | 69,64±29,584 | 84,70±42,90 | 162,50±60,68 | 0,060 |
| Colesterol Total (mg/dl) | 166,05±30,053 | 172,9±28,152 | 195,63±42,44 | 0,082 |
| HDL (mg/dl) | 53,05±9,52 | 49,5±9,07 | 41,25±10,12 | 0,033 |
| LDL (mg/dl) | 95,25±28,38 | 100,9±25,64 | 116,38±18,43 | 0,138 |
| Perímetro abdominal (cm) | 77,9±8,9 | 85±9,56 | 101,25±6,41 | <0,001 |
| PAS (mmHg) | 119,09±11,48 | 127,67±11,62 | 119,71±13,91 | 0,160 |
| PAD (mmHg) | 73,31±6,277 | 75,22±10,07 | 76,71±10,53 | 0,507 |
HDL: High density lipoprotein cholesterol; HOMA-IR: homeostasis model assessment-insulinorresistencia; IMC: índice de masa corporal; LDL: low density lipoprotein cholesterol; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
El SOP es una de las endocrinopatías más comunes en las mujeres en edad reproductiva. En esencia es una enfermedad hiperandrogénica15. Sus causas se desconocen con exactitud, pero la mayoría de los expertos coinciden en plantear que es una entidad de origen multifactorial en la que intervienen factores genéticos y ambientales que se conocen solo parcialmente. Por ello se requiere una intensa investigación para determinar qué elementos causales están contribuyendo en la aparición de este cuadro clínico. En un estudio reciente Vassiliadi et al.21 encontraron un aumento en la producción y excreción de andrógenos y cortisol, así como un aumento en la actividad de la 5α-reductasa, que no se explicaba sólo por la obesidad, y postularon la producción de corticoesteroides adrenales como una importante vía metabólica en el SOP. Además, hasta un 20% de las mujeres con SOP muestran evidencias de HA adrenal, con niveles elevados de DHEA-S22. También nosotros, en un trabajo anterior, encontramos que los niveles de DHEA-S eran discretamente mayores en TMH en comparación con las cifras habituales en mujeres4, observando asimismo un aumento relativo en los valores de cortisol y ACTH que podría guardar relación con la hiperactivación del eje adrenal en estos pacientes. En los pacientes de nuestro estudio no hemos podido confirmar estos hallazgos, ni tampoco encontramos diferencias significativas en los niveles de DHEA-S en relación con la presencia o ausencia de HA. Destaquemos por otro lado que los niveles de LH fueron significativamente mayores en el grupo con HA. Debemos por ello asumir que en nuestros pacientes TMH la fuente de los altos niveles de andrógenos es predominantemente ovárica.
Entre las limitaciones de nuestro estudio tenemos que reseñar la ausencia de un grupo control, de difícil obtención salvo con un diseño prospectivo, más complicado de llevar a cabo por la complejidad de la población estudiada. Tampoco pudimos determinar con exactitud el efecto del alcohol y el tabaquismo sobre los parámetros estudiados, ya que no consta esta información en todos los casos, por lo que se descartó en el análisis inicial. También en nuestro estudio, para el diagnóstico de HA, utilizamos un marcador obtenido de un cálculo (cTL) y no directamente, pero quisimos valernos intencionadamente del mismo parámetro que otros autores por su mayor sensibilidad diagnóstica2, y poder comparar con ellos nuestros resultados. Otra limitación podría ser la diferencia significativa encontrada en cuanto a la edad en relación con la presencia o ausencia de HA; sin embargo, no creemos que este hecho pueda haber influido en los resultados globales.
Entre las fortalezas de este trabajo se encuentra el haber sido realizado en transexuales, población de difícil reclutamiento. Describe la prevalencia de HA y SOP, con un tamaño muestral superior al de otros 2 estudios recientes en población transexual; y además los relaciona con el SM y otros factores de RCV. En el estudio de Baba et al.1 analizan 69 pacientes TMH japoneses y encuentran SOP en un 58%. Sin embargo, en el estudio de Mueller et al.2, analizando a 61 pacientes TMH alemanes, estas cifras solo alcanzan un 14,8%, mientras que en el nuestro es del 36,4%. No parece que esta discrepancia sea atribuible a diferencias metodológicas, sino más bien genéticas, aspecto conocido desde hace tiempo y revisado recientemente por Escobar-Morreale et al.23. Nosotros no incluimos un grupo control de sujetos no transexuales como Mueller et al.2, pero tenemos datos de nuestro entorno con población caucásica (similar a la nuestra) donde se apunta una prevalencia del 6,5%7, muy lejos de la encontrada por nosotros y sin clara justificación. Sería necesario llevar a cabo un amplio estudio prospectivo que compare la prevalencia de SOP entre sujetos TMH y mujeres de la población general.
Por otro lado, la mayor prevalencia de SOP del estudio de Baba et al.1 no se acompaña de mayor presencia de HA, que es inferior a la nuestra (39,1 frente al 49,4%), pero ellos son más rigurosos en la valoración de este cuadro y recurren a 4 parámetros hormonales juntos (TT, testosterona libre, Δ4-A y DHEA-S), mientras que nosotros solo consideramos uno (cTL). Sin embargo, Mueller et al.2, utilizando el mismo y único parámetro que nosotros (cTL), señalan mayores niveles de TT y cTL en la población transexual que en el grupo control, con un 44,3% de HA, que representa más del doble que en el grupo control de mujeres no transexuales, y resulta similar a nuestros datos. Ellos explican esta elevada prevalencia de HA por la posible automedicación; sin embargo en nuestro estudio este hecho ha sido investigado minuciosamente y descartado.
En la etiopatogenia del SOP, además de factores genéticos, están implicados factores ambientales como la obesidad o el retraso del crecimiento intrauterino. De este último no disponemos de datos, pero sí de la obesidad, que según algunos trabajos ejerce su efecto a través del eje leptina-neuropéptido Y, que puede asociarse a un aumento del tono opioide para modular tanto la secreción de gonadotropinas como de insulina por el páncreas24. En nuestro trabajo no encontramos ninguna correlación significativa (tabla 5), aunque sí una ligera tendencia al aumento del IMC y de la distribución central del tejido adiposo.
Uno de los factores patogénicos que en los últimos años se han invocado en el SOP es la IR, identificándose múltiples genes implicados en ella25. En mujeres jóvenes con SOP a menudo existen múltiples factores de RCV, como SM, diabetes mellitus tipo 2, dislipidemia, obesidad abdominal e hipertensión arterial, y es necesaria la prevención de futuros eventos cardiovasculares. Por ello, es frecuente el incremento de la adiposidad que promueve la aterosclerosis prematura y la mortalidad cardiovascular, siendo un motivo de preocupación mundial10. Los pacientes TMH son sometidos a tratamiento con andrógenos de por vida, de consecuencias adversas inciertas a largo plazo. Si estos pacientes son además portadores de SOP, este tratamiento podría incrementar de forma importante el RCV. Así, en nuestro estudio, los pacientes con SOP presentaban niveles significativamente mayores de glucemia basal, HOMA-IR, IMC y perímetro abdominal que aquellos sin SOP, datos acordes con otros estudios2.
Aunque la población global de nuestro estudio era de peso normal en algo más de la mitad (54,5%), en el subgrupo con SOP solo encontramos normopeso en el 7,2%. Sin embargo, la población estudiada por Baba et al.1 era mayoritariamente (76,8%) de peso normal, y aquellos con SOP, a diferencia de nuestros hallazgos, tenían normopeso en su gran mayoría (72,5%), discordancia de difícil explicación. Tampoco sabemos explicar cómo, a pesar de mayor prevalencia de IR que en nuestro estudio (30,6 y 18,2%, respectivamente), no encontraron diferencias en el HOMA-IR entre los grupos con y sin SOP, mientras en el nuestro el HOMA-IR no solo era diferente en relación con el grado de obesidad, sino también con la presencia o no de SOP, a pesar de que el punto de corte para el HOMA-IR de nuestro estudio era casi el doble (3,8 frente a 2). También nosotros encontramos diferencias en el perímetro abdominal y en la PAS, relacionado con la presencia de SOP o de HA, respectivamente. Estas diferencias no se señalan en el estudio de Baba et al.1, lo que podría justificarse por el menor número de obesos, o por el menor número de determinaciones del HOMA-IR, ya que no a todos se les calculó (solo a 49 de 69 del total de la muestra).
Además, en nuestro estudio la mayoría de los pacientes TMH con SOP tenía sobrepeso u obesidad, mecanismos involucrados en el HA de estos pacientes, y al igual que en el resto de la población femenina en edad reproductiva. Es la misma conclusión a la que llegan Cupisti et al.26 en su estudio, aunque sin duda existen otras vías fisiopatológicas de IR, como son las citoquinas, el factor de necrosis tisular-alfa, leptina, resistina, etc. Así, no podemos explicar el que no todos los pacientes con SOP tengan HA ni que todos los pacientes con HA sean obesos ni tengan IR.
La asociación entre la alteración del metabolismo hidrocarbonado y el exceso de andrógenos es un hecho bien definido. Algunos estudios9,10 observaron una alta tasa de intolerancia a la glucosa en mujeres con hirsutismo y concentraciones normales de andrógenos, así como en aquellas con HA idiopático. Al determinar la prevalencia de SM en relación con la presencia o no de HA, encontramos que en los pacientes con HA existía una mayor prevalencia de glucemia alterada en ayunas en comparación con los que tenían concentraciones normales de cTL (criterios ATP-III 21 frente al 0%, respectivamente, p<0,001). El 26,3% de los pacientes con HA tenía los 5 criterios de SM, y de ellos, los más observados en el grupo sin HA fueron PA≥130/85 y aumento del perímetro abdominal. De forma global se observó una mayor prevalencia de SM en el grupo con HA (36,8 frente a 25,6%, p<0,001), dato que se mantuvo con ambos criterios de SM utilizados (ATP-III e IDF).
También encontramos diferencias estadísticamente significativas al ajustar los parámetros hormonales, metabólicos y antropométricos por el IMC. Observamos que a mayor IMC, independientemente de las concentraciones de cTL, aumenta la IR. En un estudio que valoraba la función adrenal y alteraciones metabólicas en pacientes con HA idiopático, Atmaca et al.27 señalan que el 16,1% de los pacientes tenía glucemia alterada en ayunas y/o intolerancia a la glucosa. En nuestra serie la prevalencia de IR fue del 18,2%.
Por otro lado, la concentración de HDL es un predictor potente de la enfermedad cardiovascular28. De todos los pacientes TMH el 27,3% presentó niveles de HDL por debajo de 50mg/dl. Y aunque sin diferencias en los niveles medios entre los grupos con y sin HA, o con y sin SOP, la presencia de HDL baja fue significativamente mayor en el grupo con HA; y ajustados por el IMC, las concentraciones de HDL eran menores en los grupos con sobrepeso y obesidad. En la mayoría de los casos el perímetro abdominal fue<80cm, pero aquellos en los que era>80cm tenían peor perfil de riesgo (mayor IR, HDL baja y alteración glucémica) para enfermedad cardiovascular en el futuro. Estos hallazgos son compatibles con otros trabajos realizados en nuestra unidad4, en los que los pacientes TMH presentaban un gran número de marcadores inflamatorios antes del THC y, sobre todo, al año de iniciarlo mostraban aumento de CT, LDL, apoproteína B y TG, así como descenso de HDL y ApoA.
En conclusión, nuestro trabajo señala que el HA y el SOP son muy prevalentes en la población TMH. Este hecho podría demostrar la participación de un factor hormonal en la compleja génesis de la transexualidad de mujer a hombre. HA y SOP se relacionan con el desarrollo del SM y otros factores de RCV. Dado que se trata de una población joven, hay que tener en cuenta que el tratamiento androgénico de por vida podría empeorar la IR y otros factores de riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.