INTRODUCCIÓN
La radioterapia (RT) es un tratamiento efectivo en la acromegalia y, al igual que la cirugía o el tratamiento médico, tiene como objetivo estabilizar o reducir el volumen tumoral y normalizar la excesiva hipersecreción hormonal, obteniendo un control bioquímico. Indudablemente, la optimización en el resultado implica rapidez en la respuesta y una morbilidad tolerable. Para conseguir estos objetivos se han desarrollado nuevas técnicas cuyos resultados son preliminares, pero que constituyen ya el presente.
La indicación de irradiación incluye: imposibilidad quirúrgica, resección parcial y/o persistencia de actividad bioquímica y fracaso del tratamiento médico por resistencia o intolerancia1,2.
TÉCNICAS DE IRRADIACIÓN
Radioterapia convencional bidimensional (RTC)
Esta técnica se refiere a los tratamientos que se simulan de manera "sencilla" con radiografías en 2 planos. Se incluye el volumen tumoral prequirúrgico o el contenido selar si no hay lesión visible, con 1,5-2 cm de margen, según el sistema de inmovilización. Se emplean varias técnicas: 2 campos laterales, 3 campos (laterales y coronal) o arcoterapia. Los fraccionamientos y las dosis han sido variables y han oscilado entre 1,8 y 2,5 Gy/día, con dosis totales de 45-60 Gy. Aunque no se tratara de grandes volúmenes de irradiación, los lóbulos temporales, el hipotálamo y la vía óptica reciben una dosis similar a la lesión. La dosimetría es también bidimensional y no se analiza la relación de dosis y volumen de cada órgano en riesgo (histogramas dosis-volumen)3-8.
Radioterapia planificación conformada tridimensional (RT3D)
Es la técnica estándar en la mayoría de los tratamientos de los últimos años con RT de cualquier localización. Los sistemas de inmovilización son máscaras termoplásticas con un error de posicionamiento variable, pero en general ¾ 0,5-1 cm La valoración del volumen de tratamiento (PTV) y los órganos de riesgo (OR) se realiza con tomografía computarizada (TC) (cortes de 5-10 mm) y/o resonancia magnética (RM) efectuadas en las condiciones de tratamiento, marcando una serie de referencias en el sistema de inmovilización. El volumen tumoral se define más adecuadamente que en el caso anterior por los métodos de imagen empleados, y los márgenes pueden reducirse teniendo en cuenta los errores de posicionamiento y dosimétricos (penumbras). El PTV incluye el tumor visible (GTV) con 1-1,5 cm de margen. Se pueden utilizar varias incidencias con campos fijos conformados con moldes o multiláminas adaptados a la forma (espesor habitual de la lámina de 7-10 mm). Permite una dosimetría en los 3 planos y un análisis de los histogramas dosis-volumen (HDV), tanto del PTV como de los OR. La dosis total y el fraccionamiento son similares a la técnica previa 45-50 Gy1,3.
Radioterapia estereotáxica fraccionada (RTEF)
Utiliza un sistema estereotáxico de localización y planificación. Los sistemas de inmovilización son diversos, pero de una gran precisión (errores de 1-2 mm) y con fijaciones variables (nariz-oído, paladar, mentón, etc.), que son recolocables para realizar tratamientos en varias sesiones. Las pruebas de imagen con TC y resonancia magnética (RM) se realizan cada 1-2 mm (para una mejor definición de la lesión y de las estructuras en riesgo) y en condiciones estereotáxicas. Además, deben poder fusionarse adecuadamente. Pueden emplearse múltiples incidencias con campos fijos no coplanares (en general entre 4 y 7) o arcos no coplanares. Se pueden conformar con colimadores circulares de muy diversos tamaños o de forma más versátil con micromultiláminas (espesor de la lámina de 3 mm). Puede ser un tratamiento "dinámico" y las láminas se modifican cada "x" grados de manera automática, adaptándose a la forma que tiene la lesión vista en cada incidencia. Permite una dosimetría en los tres planos y un análisis de los HDV al igual que en el caso anterior. Debido al mínimo error en el posicionamiento y a la escasa penumbra, los volúmenes de tratamiento se minimizan en relación con la técnica anterior, incluido el residuo macroscópico con márgenes de 2-5 mm. El fraccionamiento y la dosis total en general son las mismas, 45-54 Gy a 1,8-2 Gy/fracción, pero el volumen irradiado es menor y se obtiene un elevado gradiente de dosis entre el volumen tumoral y el tejido sano1,9-12. Sería interesante valorar el empleo de hipofraccionamiento (menor número de fracciones y dosis más elevada en cada fracción), que acorta el tratamiento y en teoría puede aumentar la respuesta.
Todas las técnicas hasta ahora comentadas emplean un acelerador lineal (AL) y no tienen limitación por el tamaño del tumor y por la relación anatómica de éste con las estructuras vecinas, ya que la dosis empleada es bien tolerada por los órganos incluidos. Con lesiones > 6 cm, las ventajas de la RTEF frente a RT3D son escasas.
Radiocirugía
Define la administración de una dosis única elevada de irradiación en un blanco previamente definido; el proceso se realiza en condiciones estereotáxicas de forma similar al anterior. Esta técnica se debe al neurocirujano sueco Dr. Leksell, que en los años sesenta desarrolló la primera unidad gamma con fuentes de cobalto. Sin embargo, no es hasta la década de los ochenta cuando se adapta para AL y se extiende rápidamente. Se utiliza una guía estereotáxica fija a la tabla ósea con anestesia local, y las pruebas de imagen y fusión son superponibles a las realizadas en RTEF. La precisión (al tratarse de una única sesión y con una excelente inmovilización) es muy elevada, con errores < 1 mm, y no se añaden márgenes al considerar que el volumen irradiado es sólo el tumor macroscópico residual, por lo que se minimizan las dosis en el tejido sano1,13. Radiobiológicamente, el fraccionamiento tiene un sentido fundamental en los tumores agresivos, cuyas células están duplicándose de forma continua; por tanto, con fracciones separadas se obtienen mejores resultados, pues se actúa en un número mayor de células en la fase del ciclo más sensible (redistribución) y permite que se repare el tejido sano entre cada fracción. En el caso de los tumores benignos no se produce esta ventaja, ya que son lesiones de respuesta lenta y siguen el modelo lineal cuadrático (*/ß de 2-4), lo que hace que 15-20 Gy en una única fracción equivalgan a 100-150 Gy con un fraccionamiento convencional14,15.
Hay varios sistemas en radiocirugía (RC):
1. Unidad gamma o gamma knife (GK). Emplea 201 fuentes de cobalto-60 que convergen en un punto (isocentro). Dispone de colimadores de diferentes diámetros (4, 8, 14 y 18 mm) y, además, puede bloquear parte de las fuentes para adaptarse mejor a la forma de la lesión o proteger diversos órganos. Generalmente se requieren varios isocentros con la isodosis del 50% para cubrir el volumen tumoral, lo que conlleva un elevada inhomogeneidad dentro de la lesión que no se ha relacionado con un menor control. Tiene como ventaja la gran estabilidad mecánica, pero sus desventajas son el elevado coste y los reemplazamientos periódicos de las fuentes de cobalto. No se utilizan tratamientos fraccionados.
2. Acelerador lineal. Utiliza fotones radiológicos y tiene una gran versatilidad, ya que se trata de unidades que se emplean para otros tipos de tratamientos radioterápicos, aunque están incrementándose los AL diseñados para uso exclusivo de tratamientos estereotáxicos. Dispone de colimadores secundarios circulares de múltiples diámetros o micromultiláminas para adaptarse a la forma de la lesión (fig. 1). La isodosis de tratamiento suele ser la del 80%, con un menor número de isocentros y una mayor homogeneidad. Tiene como ventaja que se utiliza también para RTEF y su coste es menor. La desventaja es la calibración continua para evitar errores mecánicos.
Fig. 1. Utilización de un micromultiláminas acoplado al acelerador para mayor conformación de la forma de la lesión.
3. Partículas pesadas. Se emplean protones o helio, que tienen ventajas radiobiológicas y dosimétricas, pero el coste es muy elevado y hay pocas unidades en todo el mundo; sin embargo, esta técnica fue pionera en el tratamiento de los adenomas de hipófisis13,16.
La indicación de RC incluye tumores bien definidos en la RM o la TC, < 3 cm y a una distancia de 3-5 mm de la vía óptica, ya que esta estructura no debe recibir dosis > 8-10 Gy por el riesgo de neuropatía. Los casos más aptos son los de localización selar o lateroselar al seno cavernoso. La dosis para el control del crecimiento tumoral es relativamente baja (12 Gy), pero no está bien definida la dosis necesaria para el control bioquímico, aconsejándose dosis de 15-18 Gy e incluso superiores a 25 Gy. En tabla 1 se reseñan las características de ambas técnicas.
Se puede asociar a cualquiera de las anteriores una modulación de la intensidad del haz de irradiación, que se conoce con las siglas inglesas IMRT, para adaptarse mejor a la forma de la lesión y disminuir las dosis en los OR.
La elección de la técnica óptima está en función del tamaño de la lesión, de la extensión, de una buena definición en las técnicas de imagen y del tratamiento previo (fig. 2). En pacientes que han sido tratados con RT sin éxito y no tienen alternativa quirúrgica ni respuesta al tratamiento médico, la opción de RC es factible, pero si por tamaño o proximidad a la vía óptica no es posible, habría que considerar la posibilidad de RTEF, aunque la experiencia de reirradiación con fraccionamiento convencional es escasa17,18. En la figura 3 se aprecia el elevado gradiente de dosis en un tratamiento con RTEF.
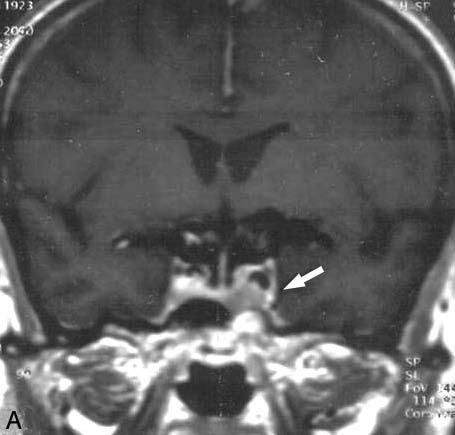
Fig. 2. A: resonancia magnética en la que se observa un mínimo resto lateroselar separado de la vía óptica y con criterios de radiocirugía. B: en la resonancia magnética se observa que la lesión era grande, supraselar y afectaba por compresión el lóbulo temporal, por lo que se optó por la radioterapia estereotáxica fraccionada.
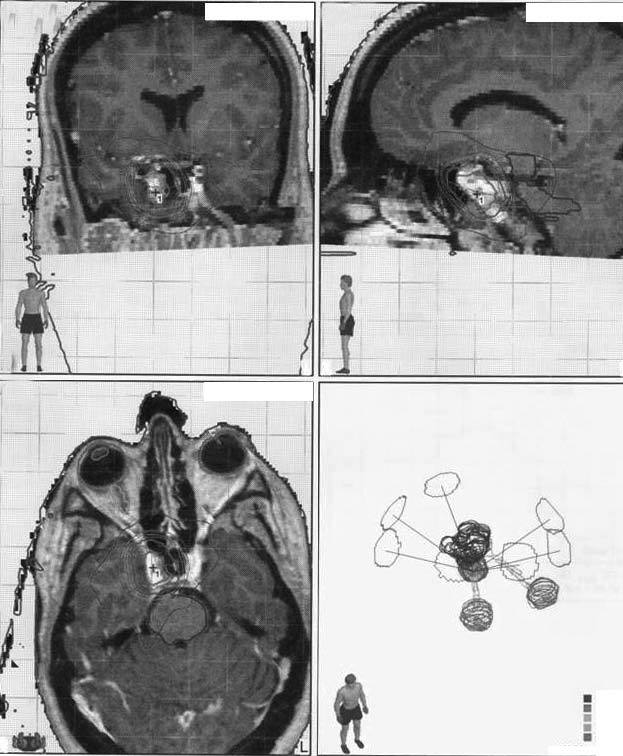
Fig. 3. Curvas de isodosis de un residuo posquirúrgico próximo a la vía óptica tratado con radioterapia estereotáxica fraccionada en 7 campos no coplanares conformados con micromultiláminas. El volumen de tratamiento incluye la lesión con 5 mm de margen.
RESULTADOS
Supone una enorme dificultad valorar los resultados aparecidos en la bibliografía de los años ochenta y noventa por 2 motivos: se trata de series retrospectivas con diversidad de técnicas y dosis, y la variación en los criterios considerados entonces como curativos resultan obsoletos en la actualidad. Sin embargo, estos trabajos tienen como ventaja el seguimiento prolongado. Intentamos reseñar los resultados de series antiguas, pero con técnicas y dosis de RT similares, así como semejantes criterios de curación. El control del crecimiento tumoral considerado como estabilización o reducción es muy elevado con RT convencional o RT3D > 85-90%3-8, y el riesgo de progresión es escaso pero puede ocurrir a 10 o 20 años19. Las probabilidades de control bioquímico (considerado como GH basal < 5 µg/l) oscilan entre el 30 y el 70%, Zaugg et al7 analizan con este criterio a 50 pacientes con RT convencional y en 19 obtienen una respuesta completa con un tiempo medio de 38,8 meses. En el trabajo de Tsang et al6, de 52 casos estudiados con un prolongado seguimiento el 46% está en remisión a los 10 años. Hughes et al4 observan una supervivencia libre de progresión del 66% a los 10 años en 48 pacientes tratados con RT exclusiva, cifra similar al 64% que obtienen con RT postoperatoria, pero no se especifican los criterios de curación. Sasaky et al20 obtienen una normalización de las concentraciones de GH del 71%, con una mediana de seguimiento de 8,2 años. Los valores de GH pre-RT > 30 µg/l influyen de forma significativa en el control21.
Si nos centramos en la bibliografía más actual con criterios de curación que incluyen valores de GH basal < 2,5 µg/l y como parámetro fundamental la normalización de IGF-I ajustada por edad y sexo (en algunos casos también el test de sobrecarga oral de glucosa con GH < 1 µg/l), podemos observar que las diferencias obtenidas según los centros son evidentes. Barkan et al22 obtienen un control de GH < 5 µg/l del 55% a los 2 años y del 65% a los 5 años, pero si se valora el factor de crecimiento similar a la insulina tipo I (IGF-I), sólo 2 pacientes normalizan las cifras y se considera que curación como tal se obtuvo exclusivamente en el 5%, con una mediana de seguimiento de 6,8 años. Similares resultados fueron presentados por Cozzi et al23 en 72 enfermos tratados durante 40 años; en el 16% se normalizaron los valores de IGF-I a los 10 años y en el 12% la GH basal fue < 2,5 µg/l. Estos datos, que ocasionaron un importante impacto pues relegaban la RT a un mero tratamiento "paliativo", fueron puestos al menos en duda por otros estudios, cuyos resultados son más satisfactorios. Poweell et al24 analizan a 47 pacientes tratados en un período más actual (1981-1999) y en el 27% se normalizaron los valores de IGF-I en menos de 6 años, pero con seguimientos más prolongados se alcanzaron criterios de curación en el 69% y en el 44% se obtuvieron valores de GH < 2,5 µg/l. Biermasz et al25 obtienen resultados mejores, con una normalización del IGF-I a los 5, 10 y 15 años del 60, 74 y 84%, respectivamente. En la amplia serie de Barrande et al26 se obtienen datos similares a los hallados con los actuales criterios de curación y se observa, al igual que en los casos anteriores, que el tiempo de evolución incrementa la respuesta, con un 7% a los 2 años, un 35% a los 5 años, un 53% a los 10 años y un 66% a los 15 años; en el último seguimiento los valores de IGF-I se normalizaron en el 79%. Las concentraciones de GH pretratamiento > 20 µg/l fueron el único factor pronóstico. Estos autores encontraron una clara relación, aunque no un resultado absolutamente parejo, entre valores de GH < 2,5 µg/l y la normalización de IGF-I así como valores de GH < 2 µg/l después del test de sobrecarga oral de glucosa.
La discrepancia entre los diferentes estudios puede deberse a varios factores: mejora de las técnicas de RT en los últimos 20 años, incluidas las pruebas de imagen que definen adecuadamente la lesión y las planificaciones tridimensionales, homogeneidad en las dosis, medianas de seguimiento prolongadas y uniformidad en los tests bioquímicos.
Es muy precoz hablar de evolución con RTEF por el escaso número de referencias en la bibliografía, ya que se trata de una técnica de reciente implantación, pero dado que las diferencias con RT convencional o RT3D se basan en la reducción de volumen irradiado, cabe esperar que los resultados sean al menos superponibles o mejores al utilizar técnicas más sofisticadas en la inmovilización y la definición de la lesión. Milkel-Zabel et al12 analizan a 25 enfermos, de los cuales 20 reciben RTEF (mediana de 52,2 Gy) y 5 RC (mediana de 15 Gy), y observan una normalización de la GH en 16 de los 20 pacientes con RTEF (mediana de 26 meses), aunque en 5 de los 16 persiste la elevación de IGF-I; con RC la GH se normalizó en los 5 (mediana de 12 meses) y en 3 de ellos también la IGF-I.
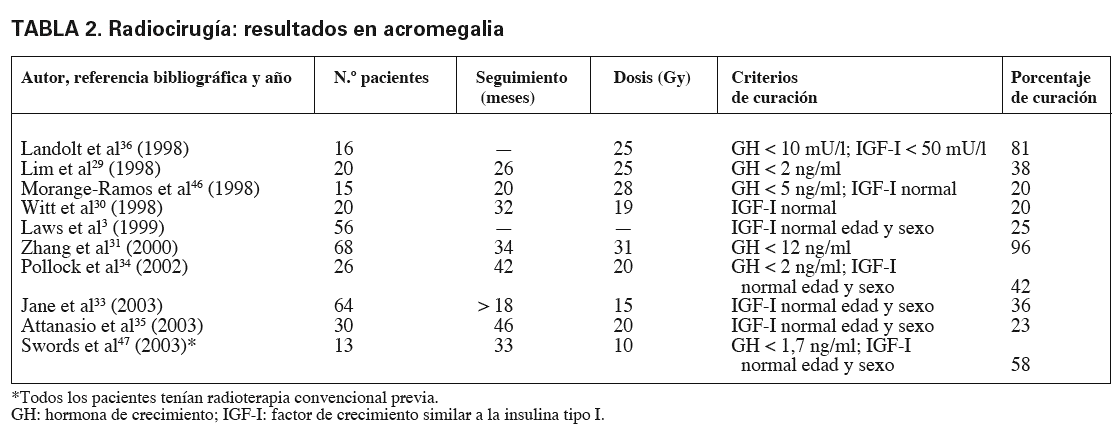
Con RC, uno de los objetivos, además de incrementar la respuesta, es reducir el tiempo de ésta y, aunque el control de crecimiento tumoral es muy elevado, del 90-100%, los resultados en la curación bioquímica son muy dispares. A pesar de tratarse de series recientes, algunas no incluyen criterios adecuados de curación sino de "respuesta parcial", lo que hace prácticamente imposible la comparación con las otras técnicas27-36. Se observa, eso sí, una respuesta más rápida que con fraccionamiento convencional10,12,32. Jane et al33 presentan una de las series más amplias (64 pacientes) y mejor analizadas tratadas con GK; utilizan una dosis media de 15 Gy, con normalización de los valores de IGF-I en el 36% con una mediana de tiempo de 28 meses. Estas cifras son algo menores que las observadas por Pollock et al34, que con dosis más elevadas y una mediana de seguimiento de 42 meses presentan un 42% de curación. En la tabla 2 se exponen los resultados obtenidos en varios estudios.
Uno de los factores que parecen influir negativamente en la respuesta a la irradiación es el tratamiento con análogos de la somatostatina o dopaminérgicos34,36, por lo que es aconsejable suspender la medicación en los 2-3 meses previos y posteriores al tratamiento. En los casos graves en los que la interrupción puede tener consecuencias importantes deberá valorarse este riesgo y/o la posibilidad de instaurar otras terapias, como los antagonistas de los receptores de GH que actúan periféricamente.
COMPLICACIONES
Los efectos agudos de la RT con fraccionamiento convencional son leves, como alopecia, astenia y otitis serosa, y mejoran al finalizar el tratamiento.
Son importantes las complicaciones tardías; la más frecuente es el hipopituitarismo, con afección de uno o varios de los ejes hipotálamo-hipofisarios, y tiene un claro incremento con el tiempo de seguimiento, pudiendo alcanzar el 50% a los 10 años4-8 pero incluso cifras más elevadas a los 20 años25,26. El mecanismo se desconoce y sorprende la baja incidencia observada en otros pacientes que reciben RT por una enfermedad no hipofisaria pero que incluye la hipófisis en dosis similares a las que se administran en caso de adenomas, lo que ha dado lugar a la teoría de que la manipulación quirúrgica, la propia lesión y la inclusión del hipotálamo son posibles causas sobreañadidas. La sensibilidad de los ejes varía. Thalassinos et al37 encuentran en un grupo tratado con RT exclusiva que el eje de las gonadotropinas el más frecuentemente afectado, con un 26%, mientras el resto está alterado en menos del 10%, lo que puede apoyar la teoría de que la cirugía aumenta el riesgo.
Otras complicaciones más graves son raras: necrosis en el 0-3% y alteraciones visuales en el 0-2%; el riesgo de segundos tumores es de 1,5-1,9/100.000 habitantes4-8,19,24-26. Un problema escasamente analizado es la mayor frecuencia de accidentes vasculares. Erfurth et al38, en una serie de 342 pacientes tratados con cirugía y RT, observaron 31 muertes por accidente cerebrovascular agudo (ACVA) y no encontraron ningún parámetro relacionado con las características de la RT (dosis fracción/total, volumen, técnica); sin embargo, sí era significativa una larga historia de hipopituitarismo, sobre todo en mujeres, incluso antes de la cirugía. Brada et al39 comparan el riesgo frente al de la población normal y el riesgo de muerte por ACVA es 1,58 veces superior y más frecuente en adenomas secretores, en mujeres y si la cirugía ha sido parcial o total en comparacion con la ausencia de cirugía o biopsia.
En el caso de alteraciones cognitivas, Noad et al40 comparan a los pacientes tratados con cirugía exclusiva frente a los que han recibido también RT, y observan que en todos hay alteraciones respecto a la población normal, pero la asociación de RT condiciona, además, una modificación de la función ejecutiva, aunque no de otras funciones cognitivas.
Con radiocirugía, los efectos secundarios parecen menores; así, el riesgo de hipopituitarismo oscila entre el 2 y el 30%28-36, pero estos datos pueden variar con seguimientos prolongados, con un amuento de la incidencia incluso hasta del 70% con una mediana de seguimiento de 17 años41, si bien hay que reseñar que con planificaciones y dosis discutibles en la actualidad. Feigl et al42 han encontrado una influencia en la dosis que recibe el tallo hipofisario. Vladyka et al43 analizan el volumen y la dosis que recibe la hipófisis y observan que dosis de 15 Gy alteran el eje de GH y tirotropina (TSH), mientras que la tolerancia, 18 Gy, es mayor para la corticotropina (ACTH). Las alteraciones visuales han sido < 1% y la aparición de neuropatías del 0,5-1%, lo que demuestra la tolerancia de los pares craneales en el seno cavernoso, los signos de radionecrosis < 1% y se han descrito algunos casos aislados de alteraciones vasculares con infartos relacionados con la dosis recibida en la carótida; por ello se recomienda que éstas sean < 30 Gy30 o excluir al menos el 50% del diámetro34. No se han descrito segundos tumores en los tratamientos de RC en adenomas de hipófisis. No podemos conocer la implicación de la RTEF en la posible reducción de los efectos secundarios debido al escaso seguimiento.
DISCUSIÓN
La eficacia de la cirugía como tratamiento primario de la acromegalia es evidente, pero los resultados en macroadenomas invasivos no son satisfactorios, con curaciones del 40-50%. Cuando hablamos de la evolución con análogos de la somatostatina nos referimos a respuestas del 40-60% y a una "medicación indefinida" no exenta de morbilidad44,45. Por ello, hay un grupo no desdeñable de enfermos que no han sido controlados y en los que la irradiación es una excelente alternativa. Es cierto que con RT se requiere de un tiempo prolongado para un control del 50-70%, pero también debemos tener en cuenta que los casos para irradiación son los que han fracasado con otras terapias, lo que suele implicar que tienen factores más desfavorables. Es innegable que un elevado porcentaje de enfermos debe mantener tratamiento médico durante un tiempo variable, pero también es cierto que el número de recidivas una vez obtenida la remisión con RT es escaso y que al tratarse de pacientes en general jóvenes, muchos podrán vivir sin medicación durante años. Con RC parece obtenerse una respuesta más precoz; por ello sería muy interesante realizar también ensayos con RTEF utilizando hipofraccionamiento en los casos donde la RC no esté indicada. Otro de los problemas atribuibles a la RT es el elevado riesgo de hipopituitarismo. Con RC se reduce el riesgo de complicaciones y con RTEF es muy posible que también, ya que los volúmenes irradiados son mucho menores que con los tratamientos convencionales, pero necesitamos en ambos casos disponer de seguimientos prolongados, ya que las probabilidades de efectos secundarios se incrementan con el tiempo. Para valorar adecuadamente el fraccionamiento, la dosis óptima y la técnica más adecuada en cada caso sería ideal realizar estudios aleatorios multicéntricos en los que se comparen distintos esquemas. Si ello no es posible por la dificultad de disponer de amplias series, al menos sí es factible e imprescindible utilizar los criterios de curación que los endocrinólogos tienen por consenso y que deberán ser los mismos para todos. Una metodología correcta y un seguimiento adecuado nos demostraran el impacto en la curación de la acromegalia con los nuevos métodos de irradiación.