INTRODUCCIÓN
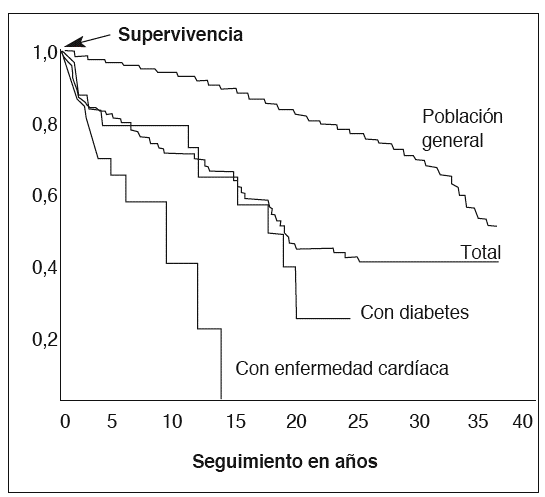
La acromegalia es una enfermedad crónica, deformante y debilitante, que se complica con específicas y graves comorbilidades (vasculares, respiratorias, metabólicas, neurológicas y musculoesqueléticas) que repercuten en la supervivencia de los pacientes1-8 (fig. 1).
Fig. 1. Impacto de la acromegalia en la probabilidad de supervivencia2.
Las complicaciones asociadas son consecuencia de la secreción excesiva de hormona de crecimiento (GH) y del incremento resultante del factor de crecimiento similar a la insulina tipo I (IGF-I), del efecto compresivo del tumor y del hipopituitarismo acompañante.
Otros factores determinantes de la supervivencia son el tiempo transcurrido desde la aparición de los síntomas hasta la confirmación del diagnóstico, la duración de enfermedad, así como la presencia de enfermedad cardiovascular, diabetes mellitus e hipertensión arterial, cuando se realiza el diagnóstico.
La acromegalia mal controlada o activa se asocia con un incremento de 2-4 veces en la tasa de mortalidad (generalmente por enfermedades cardiovasculares, respiratorias y neoplasias), y una reducción de la esperanza de vida alrededor de 10 años2.
En diversas publicaciones se ha demostrado que la reducción/normalización de los valores de GH2-5 y de IGF-I3,6, mejora el pronóstico de estos pacientes y reduce la mortalidad.
El objetivo final del tratamiento en la acromegalia es alcanzar un riguroso control, para eliminar la morbilidad y reducir la tasa de mortalidad a la esperada para su edad y sexo.
En la actualidad los objetivos del tratamiento de la acromegalia son:
--Normalizar la secreción de GH y de IGF-I (en algunostratamientos sólo normalizar IGF-I).
--Eliminar el tumor y prevenir o revertir el síndrome compresivo.
--Preservar el resto de la función hipofisaria.
--Revertir los signos y síntomas de la acromegalia y la comorbilidad.
Los criterios aceptados para curación/control de la enfermedad7 son conseguir:
--Valores de GH tras sobrecarga oral de glucosa (SOG) < 1 µg/l.
--IGF-I normal para edad y sexo.
--Ausencia de tumor (se excluye para el control).
Si se alcanzan estas metas, la enfermedad clínicamente estará inactiva, con la consiguiente reducción de la morbimortalidad y mejora de la expectativa de vida.
El Consenso de Cortina7 clasifica a los pacientes según el grado de control de la enfermedad en:
--Controlado: nadir de GH < 1 µg/l, IGF-I normal para su edad y sexo y no actividad clínica.
--Control inadecuado: nadir de GH > 1 µg/l, IGF-I elevada y no actividad clínica.
--Mal control: nadir de GH > 1 µg/l, IGF-I elevada y actividad clínica.
El criterio de curación/control, desde el punto de vista bioquímico, en algunos pacientes es evidente: si la GH tras SOG es < 1 µg/l y la IGF-I es normal, está curado; cuando la GH no se frena por debajo de estos valores y la IGF-I persiste elevada, es indudable que sigue en actividad. En otros casos, el problema es más complicado, si la GH tras SOG es > 1 µg/l y la IGF-I es normal, se considera curado y con alto riesgo de recidiva (no ha recuperado la regulación neurosecretora). En la actualidad se puede considerar la IGF-I como el mejor marcador de actividad de la acromegalia, y el objetivo primordial de su tratamiento es conseguir la reducción a la normalidad de los valores de IGF-I8.
Los avances en el tratamiento de la acromegalia, como son la mejoría en los resultados quirúrgicos (progresos técnicos y mayor experiencia de los cirujanos), la mejora en la eficiencia de la radioterapia y la menor morbilidad (radioterapia estereotáxica y radiocirugía) y la disponibilidad actual de fármacos eficaces permiten hoy día virtualmente controlar de forma adecuada a todos los pacientes con acromegalia, aunque muchos de ellos precisarán varios procedimientos terapéuticos.
En la actualidad, la primera opción terapéutica en el tratamiento de la acromegalia es la cirugía, pero sólo consigue un nadir de GH < 1 µg/l e IGF-I normal en el 80-90% de los microdenomas y en el 50% de los macroadenomas9-11. En muchos pacientes hay que recurrir a un segundo o tercer escalón terapéutico, como la radioterapia y/o el tratamiento farmacológico.
El tratamiento farmacológico en general se utiliza como tratamiento coadyuvante, en caso de fallo de la cirugía y en espera de la radioterapia, pero puede indicarse como tratamiento primario en caso de contraindicación o rechazo de la cirugía y/o radioterapia y en pacientes de edad avanzada, con un tumor pequeño y un cuadro clínico benigno.
Las primeras tentativas de tratamiento médico de la acromegalia datan de 1920, en que se prescriben preparados de yodo, arsénico, estricnina y cafeína que eran totalmente ineficaces. Posteriormente, en 1936, se utilizan los estrógenos, con la esperanza de mejorar las alteraciones del metabolismo de los hidratos de carbono, pero la posibilidad de medición de la GH demostró que no reducían los valores de dicha hormona. En la década de los sesenta se emplean la medroxiprogesterona y la clorpromazina, o la asociación de ambas (suprimen la respuesta de GH a la insulina en el hipotálamo), y aunque en algunos pacientes reducen las concentraciones de GH y mejoran los rasgos morfológicos, su beneficio es muy limitado.
Los agonistas dopaminéricos (AD) como L-dopa y bromocriptina, se introducen en el tratamiento de la acromegalia en 1972 y, durante más de 10 años, la bromocriptina fue el único tratamiento médico de esta enfermedad. Desde 1998 se dispone de dos nuevas moléculas interesantes en la práctica clínica, la cabergolina y la quinagolida, con mayor actividad sobre los receptores de dopamina tipo 2 (D2) y menos efectos secundarios.
El verdadero avance en el tratamiento de esta enfermedad se produce en 1992, con la disponibilidad de un análogo de la somatostatina (AS), la octreótida, de vida media muy corta. Posteriormente, con la finalidad de obviar las múltiples inyecciones, se desarrollan formulaciones de acción retardada, como lanreótida (1995), octreótida de liberación prolongada (1997) y lanreótida-autogel (2001).
El último progreso en el tratamiento de esta enfermedad es la disponibilidad del pegvisomant (2003), análogo de la GH humana, obtenido por ingeniería genética, que actúa como antagonista selectivo del receptor de la GH, fármaco muy efectivo en el control del IGF-I.
En la actualidad es evidente que los AS de acción prolongada y los antagonistas del receptor de GH son muy efectivos en el tratamiento de la acromegalia.
En los recientes algoritmos terapéuticos de la acromegalia se evidencia que el tratamiento farmacológico se sitúa en el segundo nivel de actuación, en detrimento de la radioterapia.
AGONISTAS DOPAMINÉRGICOS
En sujetos normales, la administración de AD estimula la secreción de GH, a través del sistema nervioso central, pero paradójicamente la inhibe o atenúa en pacientes con adenomas secretores de GH12, probablemente por estimulación de los receptores D2 implicados en la regulación de la prolactina en sujetos normales y en pacientes con prolactinomas12.
Los AD suprimen la liberación de GH mediante un acoplamiento negativo de los receptores de dopamina con la adenilato-ciclasa, lo que origina una supresión directa de la GH en casi la mitad de los pacientes con acromegalia12.
La utilización de AD, con respecto a otro tipo de fármacos, tiene ventajas, como son la administración por vía oral y el bajo coste, e inconvenientes, como la eficacia limitada, el requerimiento de dosis elevadas y los efectos secundarios.
Los AD son ante todo efectivos en tumores cosecretores de GH-PRL, y alrededor de 1 de cada 3 pacientes tiene adenomas hipofisarios de células acidófilas y cosegregan prolactina13,14.
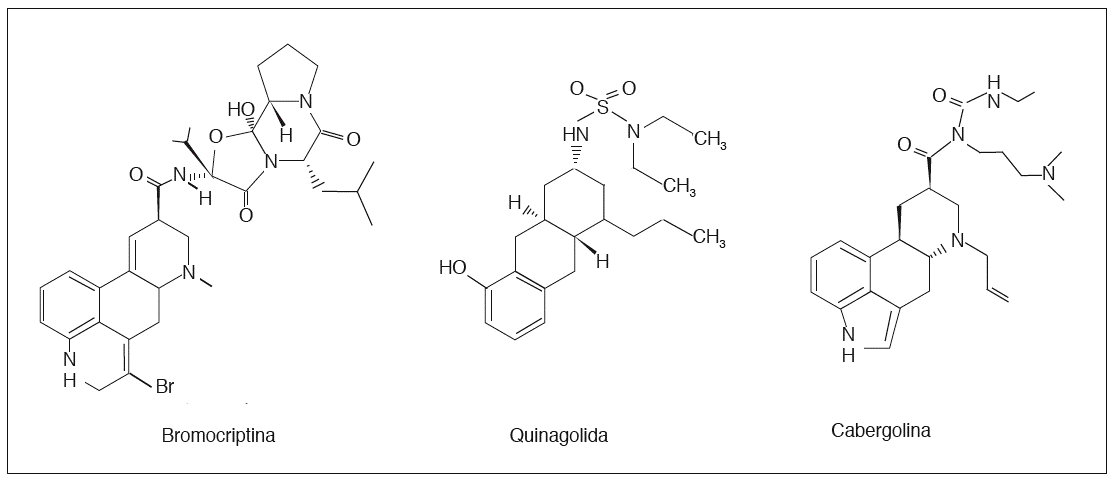
Los más utilizados son la bromocriptina, la cabergolina y la quinagolida (fig. 2).
Fig. 2. Estructura química de los agonistas dopaminérgicos.
Bromocriptina (2 bromo-*-ergotamina) (Parlodel®)
Es un análogo de los alcaloides del cornezuelo de centeno. Se trata de un AD no específico, ya que estimula los receptores D2, pero también actúa sobre los receptores D1 y los receptores adrenérgicos y serotoninérgicos. Suprime la secreción de prolactina y en los pacientes con acromegalia tiene un efecto inhibidor de la secreción de GH.
La bromocriptina es el AD más investigado de los utilizados en el tratamiento de la acromegalia y se prescribe desde hace más de 30 años.
Se presenta en comprimidos de 2,5 mg y cápsulas de 5 mg y se administra por vía oral. La dosis total diaria oscila entre 7,5 y 80 mg. Muy pocos pacientes se benefician de la administración de dosis superiores a 20-30 mg/día y, en caso de utilizar dosis elevadas, los efectos secundarios suelen ser un factor limitante.
Se recomienda repartir la dosis total diaria en 3-4 tomas, ya que la supresión de la GH es corta.
Los efectos secundarios suelen ser dependientes de la dosis y son más intensos cuando se administran dosis elevadas. Los más frecuentes son trastornos gastrointestinales (náuseas, vómitos, estreñimiento, dispepsia y digestiones pesadas), cefalea, hipotensión ortostática, anorexia, sequedad de boca, congestión nasal, somnolencia y, con mucha menor frecuencia, vasoespasmo periférico inducido por el frío, vértigos y alucinaciones.
Estas alteraciones generalmente se resuelven con el tiempo, pero pueden persistir en un significativo número de pacientes. Se pueden mitigar o evitar iniciando el tratamiento con dosis bajas: se recomienda una dosis de inicio de 1,25 mg/día, después de cenar y posteriormente un incremento gradual de 1,25 mg cada 4-6 días, hasta alcanzar la dosis máxima eficaz.
De la efectividad de las muchas publicaciones en la bibliografía hemos elegido 2 revisiones de series.
Jaffe et al13, en una revisión de 28 series en las que se incluye a 549 pacientes con acromegalia tratados con bromocriptina, extraen los siguientes resultados:
-- Valores de GH < 10 µg/l, en el 50% de los casos y < 5 µg/l en sólo el 10-20% de los casos.
-- Normalización de IGF-I en 10% (evaluada en 116 pacientes).
-- Mejoría sintomática en el 70%.
-- Reducción del tamaño tumoral de un 10-15%.
Melmed et al15 analizan 34 estudios publicados entre 1975 y 1990, en los que se incluye a 616 pacientes tratados con bromocriptina (7,5-80 mg/día), y observan:
-- Valores plasmáticos de GH < 5 µg/l en el 21% de los pacientes
-- Normalización de los valores de IGF-I sólo en el 10% de los pacientes.
-- Disminución del tamaño tumoral generalmente inefectiva, aunque algunos registraron disminución del tamaño de un 10-20%.
En conclusión, se requieren dosis elevadas, es infrecuente que se normalicen los valores de GH y de IGF-I, y un 30% de los pacientes no responde en absoluto aun con el empleo de dosis altas y mantenidas durante meses.
La bromocriptina LAR (no disponible en España) es una formulación de bromocriptina ligada a microesferas de ácido poliacrílico que se administra por vía intramuscular a intervalos mensuales y tiene efectos colaterales menos graves.
En 2 publicaciones16,17 en las que se incluyó a 11 pacientes tratados con bromocriptina LAR no se consiguieron normalizar los valores de GH/IGF-I, aunque las concentraciones de GH se redujeron significativamente (> 50%) en 5 pacientes. En un trabajo posterior realizado por Colao et al18, en el que evaluaron diferentes AD en el tratamiento de la acromegalia, se observó que la bromocriptina LAR, administrada en 7 pacientes (100 mg/mes, 6-12 meses), reducía significativamente los valores de GH e IGF-I, sin llegar a normalizarlos, consiguiendo un descenso de GH de un 72,4%, significativamente mayor que el logrado en el grupo tratado con cabergolina (48,5%).
Cabergolina (1-[(6-alelilergolina-8ß-y1)carbonil]-1-[3-(dimetilamino) propil]-3-etil-urea) (Dostinex®)
Es un nuevo derivado del cornezuelo de centeno, con propiedades AD, muy específico, que se une selectivamente a los receptores D2, es muy potente y de acción prolongada.
La cabergolina, en comparación con la bromocriptina, tiene una capacidad de unión más específica a los receptores D2, una vida media más larga y menos efectos secundarios, por lo que es mejor tolerada.
Se presenta en comprimidos de 0,5 mg y se administra por vía oral; la dosis máxima recomendada es de 3,5 mg/semana.
El estudio multicéntrico publicado por Abs et al19 en el que se incluyó a 64 pacientes acromegálicos (16 cosecretores de GH y PRL) tratados con cabergolina en una dosis máxima de 3,5 mg por semana, los resultados fueron esperanzadores (tabla 1):
-- Normalización de IGF-I en 39% y reducción significativa en un 28% de los casos.
-- Enfermedad benigna e IGF-I basal < 750 mg/l; en el 53% se normalizaron los valores del IGF-I.
-- Reducción del tamaño tumoral en 13/21 pacientes; de ellos, 5 eran cosecretores de PRL.
La tolerancia fue buena y sólo en 2 pacientes se interrumpió el tratamiento por mareos.
Los mejores resultados se obtuvieron en los pacientes con valores de IGF-I pretratamiento moderadamente elevados y en los adenomas cosecretores de GH y PRL.
Cozzi et al20 administraron cabergolina a 18 pacientes con acromegalia (10 con sensibilidad demostrada a AD y 8 resistentes a los AS). Las concentraciones de GH descendieron de 6,6 a 3,5 µg/l y el IGF-I de 720 a 375 µg/l. Los valores de GH se redujeron a menos de 2 µg/l en 5 pacientes y a 2-5 µg/l en otros 5; los valores basales de IGF-I se redujeron en más del 50% en 8 pacientes y en 5 (27%) se normalizaron.
Se evalúa de forma retrospectiva la eficacia de cabergolina frente abromocriptina en 10 pacientes, y se observa que la cabergolina es significativamente más eficaz, ya que disminuye los valores de IGF-I en un 46,8%, frente al 31% de la bromocriptina.
Los autores concluyen que la cabergolina es un fármaco que se debe tener en cuenta a la hora de tratar la acromegalia, ya que induce descensos de IGF-I y supresión de GH comparables a los AS, se administra por vía oral y es menos costosa.
En el trabajo referenciado anteriormente18, la administración de cabergolina en dosis de 1-2 mg/semana no consigue normalizar los valores de GH e IGF-I y el descenso de GH (48,5%) fue inferior al conseguido con bromocriptina LAR y quinagolida.
Melmed et al15,20, en una revisión de 6 estudios publicados entre 1988 y 1990 en la que se incluyó a 112 pacientes con acromegalia tratados con cabergolina en dosis de 0,3-7 mg/semana, la normalización de la IGF-I se observa en el 34% de los casos; estos autores concluyen que la cabergolina es más eficaz y tiene menos efectos secundarios que la bromocriptina, pero señalan que los datos disponibles actualmente son limitados y que el margen de eficacia en estos estudios varía entre el 0 y el 100%.
Los datos disponibles indican que la cabergolina es más eficaz y tiene menos efectos secundarios que la bromocriptina y, aun tomando en consideración lo señalado por Melmed et al, la cabergolina debe ser considerada como el fármaco oral de elección, especialmente en los pacientes con valores de IGF-I moderadamente elevados y en los adenomas cosecretores de GH y PRL.
Quinagolida (octahidrobenzo[g]quinolina) (Norprolac®)
Es una superposición de apomorfina y el radical quinólico de la ergolina, no tiene estructura ergólica. Es un AD selectivo de los receptores D2, de acción prolongada, lo que permite su administración 1 vez al día y se tolera mejor que la bromocriptina.
Se presenta en comprimidos de 25, 50 y 75 µg. La dosis empleadas son de 300-600 µg/día.
La quinagolida consigue una supresión más prolongada de los valores de GH que la bromocriptina21. Administrada en dosis de 0,3-0,6 mg/día, a los 3 meses consigue normalizar los valores de GH e IGF-I en 7/16 pacientes (43,8%) y en 5 de los 11 restantes (31,3%) se normalizan a los 6 meses.
CONCLUSIONES
Los nuevos compuestos AD (cabergolina y quinagolida) son similares en cuanto a actividad en la acromegalia y tienen menos efectos secundarios que la bromocriptina, por lo que deben ser considerados en pacientes con adenomas cosecretores de PRL y en algunos pacientes con enfermedad benigna y valores de IGF-I pretratamiento < 750 µg/l, teniendo en cuenta que carecen prácticamente de efectos adversos relevantes y su coste es bajo.
En pacientes no respondedores o que responden mal al tratamiento con AS, se podría ensayar la administración de AD solos o en combinación con AS.
Otro aspecto importante es considerar si los AD pueden ser útiles en combinación con los AS.
En estudios realizados in vitro con células procedentes de tumores humanos secretores de GH se demostró un efecto aditivo dependiente de la dosis de la bromocriptina, con dosis fijas de octreótida o lanreótida; con guinagolida se obtuvieron resultados similares22.
En diversas publicaciones de pacientes seleccionados con resistencia al tratamiento crónico con AS, el tratamiento combinado de un AD (bromocriptina, quinagolida y cabergolina) y un AS (octreótida LAR y lanreótida) induce una mayor inhibición de GH e IGF-I que ambos fármacos por separado, y el 10-20% de los pacientes con resistencia a los AS presenta supresión de GH y/o IGF-I cuando se añade un agonista dopaminérgico al AS23-26.
ANÁLOGOS DE LA SOMATOSTATINA
Somatostatina y receptores de somatostatina
Brazeau, en 1973, describió un tetradecapéptido de hipotálamo bovino que inhibía la secreción de GH en células adenohipofisarias cultivadas. Esta sustancia recibió inicialmente el nombre de hormona inhibidora de la liberación de GH (GH-RIH), y es lo que actualmente conocemos por somatostatina27.
En el organismo hay dos formas de somatostatina: la SMS-14 y la SMS-28. Ambas están codificadas por el mismo gen, situado en el cromosoma 3q28, que codificaría la preprosomatostatina, un péptido de 116 aminoácidos. Cambios postraslacionales originarían las 2 formas de somatostatina. La forma SMS-14 es la predominante en el cerebro, incluido el hipotálamo, y la SMS-28 en el tracto gastrointestinal28.
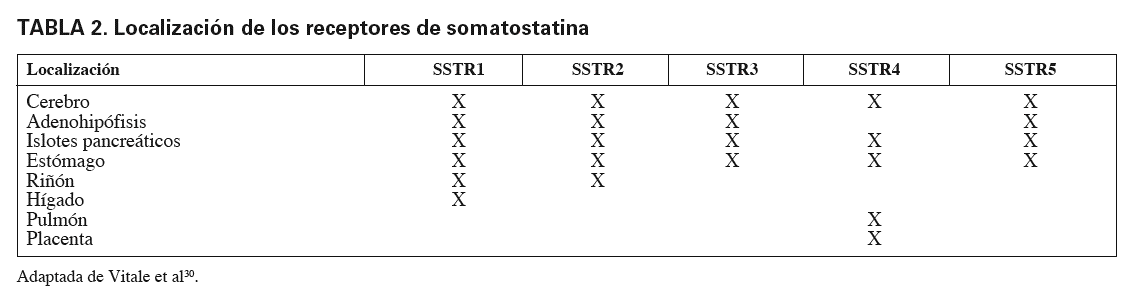
La somatostatina ejerce su acción a través de receptores específicos situados en la superficie celular, que se expresan, entre otros lugares, en sistema nervioso central, las leptomeninges, la adenohipófisis, la mucosa gastrointestinal y las células endocrinas y exocrinas del páncreas. Se han identificado 5 subtipos de receptores de somatostatina llamados SSTR-1 a SSTR-5, todos los cuales hacen intervenir en su acción proteínas G, que inhiben la adenilato-ciclasa, abren los canales de K y cierran los de calcio, estimulando la tirosín-fosfatasa y la proteincinasa activada por mitógenos. La acción antisecretora se ha relacionado con la disminución intracelular de AMPc y calcio, y la acción antiproliferativa con la acción sobre la tirosín-fosfatasa y la proteincinasa29.
En la tabla 2 se muestra la distribución de los receptores de somatostatina28,30, y en la tabla 3 las acciones de las somatostatina en los diferentes tejidos27,28.
Las principales limitaciones del uso potencial de la somatostatina han sido su vida media, que es de alrededor de 1-2 min31,32, y la baja especificidad de su acción.
Octreótida
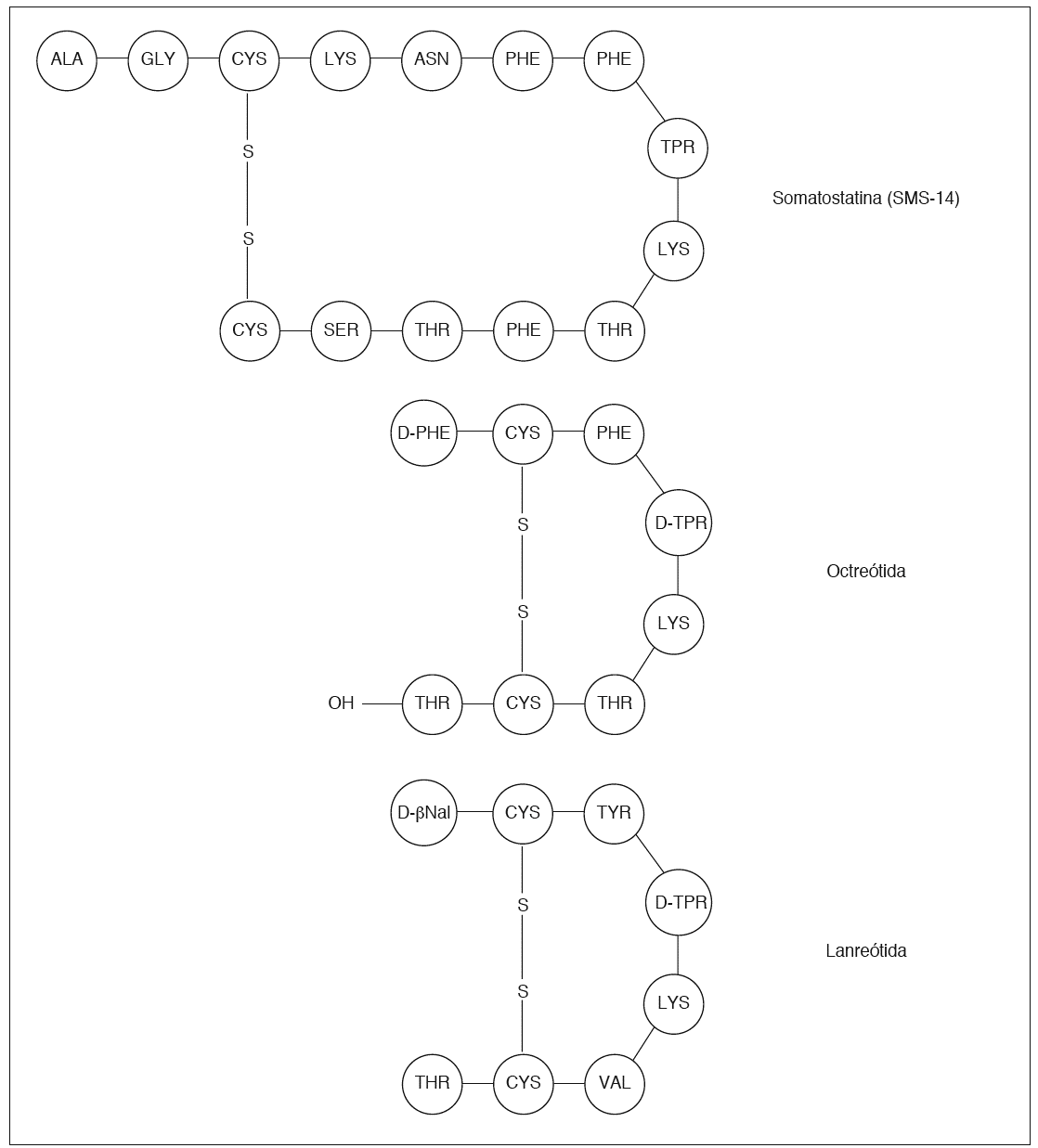
La octreótida (Sandostatin®, Novartis Pharma) es un octapéptido sintético que fue el primer AS utilizado en la clínica31,33. Su potencia en la inhibición de la secreción de GH es 45 veces mayor que la de la somatostatina nativa SMS-14. Además, la afinidad de la octreótida por los receptores difiere de la de la somatostatina nativa: mientras la somatostatina se une con igual afinidad a todos ellos, la octreótida se une con alta afinidad a SSTR-2 y SSTR-5, baja a SSTR-3, y no se une a SSTR-1 y SSTR-431. La afinidad para el receptor SSTR-2 es unas 10 veces superior a la del receptor SSTR-5.
En la figura 3 se muestra la estructura de la octreótida. La presencia de D-triptófano, un aminoácido no fisiológico, estabiliza la molécula y reduce la degradación enzimática, lo que alarga la vida media del análogo, en comparación con la molécula nativa32. La vida media de la octreótida es de unos 110 min. Administrada por vía subcutánea, el comienzo de acción es rápido y la duración del efecto se prolonga entre 4 y 12 h, lo que obliga a administrar el producto cada 8 h en general. Las dosis utilizadas han sido de 50 a 500 µg, 3 veces al día. También se puede administrar en infusión continua subcutánea o intravenosa.
Fig. 3. Composición de la somatostatina y los análogos comercializados. Las siglas representan abreviaturas de los aminoácidos componentes. D-ß-Nal: D-ß-Naftil-alanina.
Las indicaciones aprobadas para su utilización en España son: tratamiento de la acromegalia, tratamiento de tumores gastroenteropancreáticos, prevención de complicaciones surgidas tras la cirugía pancreática y el tratamiento de las varices esofágicas sangrantes. Es un fármaco de diagnóstico hospitalario y actualmente se presenta en ampollas de 0,05, 0,1 y 1 mg.
Análogos de acción retardada
La octreótida en infusión continua es más eficaz para disminuir la secreción de GH que en régimen subcutáneo, y la incomodidad para el paciente de la administración 3 veces al día ha hecho que se desarrollaran esfuerzos para conseguir preparados de acción prolongada. Entre estos preparados están: octreótida LAR, lanreótida de liberación lenta (SR) y lanreótida autogel.
Octreótida LAR (Sandostatin LAR®)
Consiste en octreótida incorporada en microesferas de un polímero biodegradable34-36. Esta forma de liberación se había empleado ya anteriormente con éxito para un preparado de bromocriptina (Parlodel LAR®).
Tras la administración intramuscular de octreótida LAR, los valores de octreótida se elevan rápidamente en las primeras 2 h, lo que reflejan la liberación del fármaco de la superficie de las microesferas; posteriormente, los valores se reducen con rapidez y se mantiene bajos durante los 7 días siguientes a la administración. Después, entre los días 7 y 14, los valores vuelven a subir y se mantienen elevados durante 28-42 días, aunque las concentraciones estacionarias se obtienen al cabo de 2-3 inyecciones. Las dosis de octreótida LAR eficaces para reducir los valores de GH oscilan entre 10 y 30 mg al mes. En general se inicia con 20 mg, y se modifica posteriormente la dosis pasando a 10 o 30-40 mg por dosis según los valores de GH e IGF-I.
En España se presenta en 3 dosis: 10, 20 y 30 mg. Las indicaciones aprobadas son: tratamiento de la acromegalia y tratamiento sintomático de tumores endocrinos gastroenteropancreáticos. Es un fármaco de diagnóstico hospitalario.
Lanreótida de liberación prolongada (Somatulina SR®)
La lanreótida es un octapéptido sintético. Al igual que la octreótida, un aminoácido D-Trp estabiliza la molécula. La farmacocinética es similar a la de la octreótida, con una vida media de eliminación de 1,3 h. Por ello que se desarrollaron formulaciones de liberación prolongada, que son las que se comercializaron. Estas formulaciones consisten en la encapsulación del péptido en microesferas de un polímero biodegradable. Tras su administración intramuscular mantiene valoares elevados de lanreótida durante 11 días, por lo que suele precisar su administración cada 10-14 días37-39. En España se presenta en dosis de 30 mg (Somatulina 30®), en forma de polvo. Para la administración es necesario preparar la suspensión siguiendo exactamente las indicaciones del fabricante, para evitar la precipitación del preparado en la aguja de inyección. Las indicaciones aprobadas en España son: tratamiento de la acromegalia y tratamiento sintomático de los tumores neuroendocrinos. También es de diagnóstico hospitalario.
Lanreótida autogel (Somatulina Autogel®)
La formulación autogel de lanreótida consiste en una solución sobresaturada de acetato de lanreótida, que hace que adquiera una estructura tipo cristal líquido. A diferencia de la preparación de liberación prolongada (formulación SR), no requiere reconstitución. Como único excipiente lleva agua, se puede administrar por vía subcutánea y el volumen inyectado es reducido (0,3-0,5 ml). La farmacocinética es similar, ya se administre por vía intramuscular o subcutánea, y consigue mantener concentraciones superiores a 1 µg/l, límite terapéutico, durante al menos 28 días40-42. Las presentaciones actuales son de 60, 90 y 120 mg. Las indicaciones y las condiciones administrativas de prescripción son las mismas que para la Somatulina 30®.
La formulación autogel ha demostrado ser igual de eficaz que la SR42,43 y la dosis se ajustará en función de la sintomatología y los valores de GH e IGF-I. La dosis inicial puede ser de 60 a 120 mg cada 28 días, pero se recomiendo comenzar por la de 60 mg. Si el paciente estaba previamente en tratamiento con Somatulina 30® según precisara una inyección cada 14, 10 o 7 días pasaríamos, respectivamente, a Somatulina Autogel® 60, 90 o 120 mg cada 28 días.
Eficacia de los análogos de la somatostatina
Los receptores SSTR-2 y SSTR-5 son los más comunes en los adenomas hipofisarios productores de GH, precisamente los receptores por los que más afinidad presentan los AS disponibles en la actualidad. La expresión variable o la densidad reducida de estos receptores en algunos tumores pueden explicar la resistencia observada en algunos pacientes44,45.
Una cuestión importante a la hora de evaluar la eficacia terapéutica de los AS es la de los criterios utilizados. Muy pocos estudios han utilizado como criterio un valor de GH tras la sobrecarga de glucosa < 1 µg/l. En general se han utilizado valores de GH basales o medias de varias muestras, considerando en general como controlado un valor < 2 o 2,5 µg/l. A su vez, los métodos actuales de medida de GH son más específicos que los utilizados hace unos años. Con RIA policlonal, un valor de GH < 2,5 µg/l se asocia epidemiológicamente a una reducción de mortalidad, y es el criterio de normalomegálicos el tratamiento con AS reduce los valores de GH e IGF-I, el porcentaje de pacientes controlados dista mucho de ser el que desearíamos44,45. En el tratamiento con AS tras tratamiento con cirugía y/o radioterapia, para un seguimiento variable de 6 a 36 meses y un número de pacientes de 8 a 149, la normalización de GH (< 2 µg/l, < 2,5 µg/l, o tras frenación con glucosa < 1 µg/l) ocurrió, con octreótida LAR, en el 47-75%, y con lanreótida SR en el 14-78%. La normalización de IGF-I fue, para octreótida LAR, del 41-75% y para lanreótida SR del 30-63%. Estos datos se exponen en la tabla 444,45. Hay que señalar que la mayoría de los pacientes que participaron en los estudios realizados con octreótida LAR fueron preseleccionados por su respuesta a octreótida subcutánea, y esto sólo ocurrió en una pequeña parte de pacientes que participaron en los estudios realizados con lanreótida SR, lo que podría haber hecho que los resultados fueran aparentemente mejores con octreótida LAR que con lanreótida SR. Cuando se ha comparado octreótida LAR y lanreótida autogel se han obtenido resultados similares47.
Los estudios comparativos entre octreótida y octreótida LAR, en general retrospectivos, han mostrado similar eficacia de ambos preparados. La mayor comodidad posológica de los preparados de acción retardada hace prever un mejor cumplimiento por parte del paciente y, en la práctica, mejores resultados44,45.
En cuanto a la mejoría clínica, se ha descrito una mejoría de signos y síntomas en el 64-74% de pacientes tratados con los AS de acción prolongada45; en particular cabe destacar la mejoría en la estructura y la función cardíacas con octreótida y lanreótida, asociados a la normalización de IGF-I, y con octreótida se ha descrito una mejoría del síndrome de apnea del sueño48.
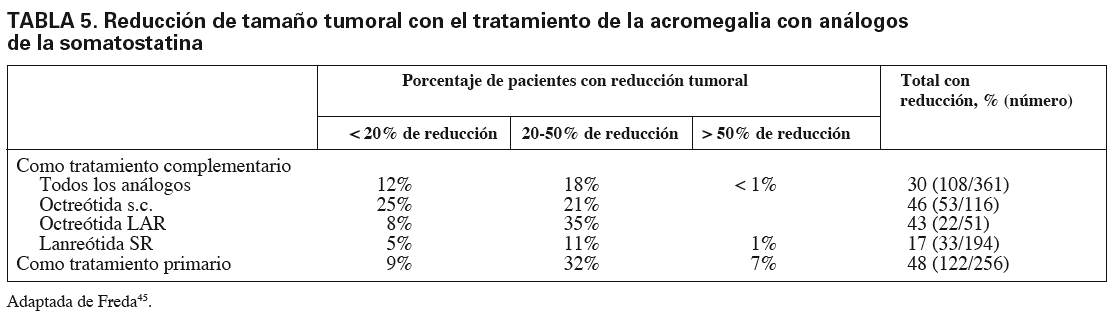
Finalmente, el tamaño tumoral aumenta en menos del 1% de los casos tratados con AS y se reduce en aproximadamente 50%. La reducción oscila entre el 20 y el 50%. En la tabla 5 se resume la influencia de los análogos de somatostatina sobre el tamaño tumoral45. Nuevamente, hemos de señalar que en los estudios con octreótida el 90% de los pacientes fueron preseleccionados por su respuesta a octreótida subcutánea, lo que sólo ocurrió en 10% de los casos tratados con lanreótida y es posible que haya favorecido los resultados de la octreótida44,45.
Tratamiento con análogos de somatostatina como primera opción terapéutica
El tratamiento primario con AS ofrece resultados similares a los observados cuando se trata de un tratamiento complementario (tabla 4). En 50% de casos se obtiene supresión de GH y en 60% se consigue la normalización de IGF-I. La reducción de tamaño tumoral se consigue en el 48% de casos (tabla 5)44,45,49,50.
En caso de que haya compromiso de campo visual o alteración neurológica, el tratamiento único con AS quedaría excluido, ya que este tratamiento no asegura una reducción de tamaño tumoral suficiente, aunque se pueden utilizar como tratamiento prequirúrgico y, en casos de elevado riesgo quirúrgico o edad avanzada, habría que prescindir de la cirugía y considerar el tratamiento con análogos de somatostatina como primera opción44,45. Asimismo, si resulta improbable que la cirugía pueda eliminar completamente el tumor y no hay compromiso visual, el tratamiento médico por sí mismo sería tan eficaz bioquímica y clínicamente como la combinación de tratamiento quirúrgico seguido de AS49.
Puesto que la eficacia de los análogos de acción retardada es similar a la de la octreótida subcutánea y se asocia con una mejor cumplimiento terapéutico, hoy día está plenamente aceptado que son los análogos de acción retardada los que se utilizarían en caso de decidirse por el tratamiento con análogos como primera opción. A pesar de ello, el tratamiento inicial con octreótida subcutánea podría conseguir una rápida reducción del valor de GH, aunque la respuesta represiva aguda de GH a la octreótida no garantiza la eficacia posterior a largo plazo51.
Tratamiento perioperatorio con análogos de la somatostatina
Considerando criterios rigurosos de curación (GH ¾ 1 µg/l e IGF-I normal) en manos de un equipo neuroquirúrgico experto, aproximadamente el 90% de los pacientes con microadenomas son controlados, y esta cifra pasa al 50% para los macroadenomas. El tratamiento posterior con análogos asciende esta última cifra al 81%10,11.
Hay datos que sugieren que el tratamiento previo con radioterapia hace que aparezca una cierta resistencia al tratamiento con análogos, observada por una menor respuesta a éstos en el valor de GH, pero no de IGF-I, en comparación con sujetos tratados con análogos como tratamiento primario. Esta resistencia parcial no parece producirse con la cirugía52.
El tratamiento preoperatorio con AS podría ser beneficioso por varios motivos10:
-- Reducción de tamaño tumoral.
-- Control de la enfermedad previo a la cirugía.
No hay estudios controlados en los que se haya estudiado la influencia de la reducción tumoral sobre la facilidad de resección completa, y en la bibliografía podemos encontrar resultados discordantes. La opinión general al respecto es que los excelentes resultados de los microadenomas no se beneficiarían de este tratamiento en este aspecto, y sí los macroadenomas10,53.
La acromegalia se asocia con alteraciones metabólicas, cardiovasculares y respiratorias que sería conveniente controlar antes de una cirugía general, que puede ser la dirigida hacia la resección del adenoma hipofisario, u otra cirugía con anestesia general. No hay suficientes datos que prueben la existencia de una mayor morbilidad y mortalidad de los pacientes con acromegalia durante el tratamiento neuroquirúrgico de ésta, pero es razonable suponer que el mayor deterioro asociado con la duración de la enfermedad y la edad avanzada del paciente conllevan un mayor riesgo de complicaciones cardiovasculares54,55. Se han publicado mejoras de la función cardíaca en la acromegalia con octreótida, octreótida LAR y lanreótida56-58. Lo mismo se puede decir de otras alteraciones en la función respiratoria48. Hay datos que indican un menor tiempo de hospitalización con el tratamiento preoperatorio con análogos59. La disminución de GH inducida por los análogos de somatostatina, que podría mejorar la tolerancia glucídica alterada en la acromegalia, se ve contrarrestada por una inhibición de la secreción de insulina y, aunque a largo plazo el efecto sea beneficioso, a corto plazo el efecto sobre el metabolismo de los hidratos de carbono es incierto, por lo que el beneficio en este aspecto como tratamiento preoperatorio puede ser menor, puesto que también la diabetes se asocia con una mayor frecuencia de complicaciones perioperatorias10,59.
Así, aunque se requieren estudios controlados al respecto, los datos disponibles sugieren que es conveniente evaluar adecuadamente el riesgo quirúrgico y, en general, el control de la enfermedad con AS sería beneficioso para el paciente como tratamiento previo a la cirugía10,53,59.
Efectos secundarios
Los efectos secundarios son aproximadamente similares para todos los análogos comercializados45. Los más frecuentes son los gastrointestinales (diarrea, náuseas, molestias abdominales difusas), en general transitorios, y las molestias locales en el lugar de la inyección (4-31%). Otro efecto secundario importante es la litiasis biliar. Se han descrito nuevos cálculos biliares en el 15% de los pacientes, en general en el primer año de tratamiento. No se recomienda la realización sistemática de ecografías periódicas si el paciente está asintomático, pero sí sería conveniente la realización de un estudio ecográfico previo al tratamiento. Los efectos adversos relacionados con el metabolismo de los hidratos de carbono han sido: hipoglucemia en el 2% e hiperglucemia en el 7-15%. Otros efectos más raros son: pérdida transitoria de cabello (3-6%), hipotiroidismo (2%), bradicardia sinusal, déficit de vitamina B12 y alteración de absorción de otros medicamentos. Los efectos secundarios motivan la retirada del tratamiento en el 3-5% de casos.
Nuevas perspectivas
Los análogos disponibles actúan fundamentalmente por su acción sobre el receptor SSTR-2. Los trabajos del grupo de Melmed mostraron que el receptor SSTR-5 tiene una gran importancia en la secreción de GH, tirotropina (TSH) y PRL. La combinación de análogos selectivos de los receptores SSTR-2 y SSTR-5 era más eficaz en la reducción de GH que utilizados por separado, y en tumores secretores únicamente de prolactina, los análogos selectivos de SSTR-5 suprimían la secreción de PRL, pero no los selectivos de SSTR-260.
Las perspectivas que se vislumbran en el desarrollo de nuevos análogos de somatostatina son las siguientes33:
-- Análogos selectivos de los receptores de somatostatina61,62. Se incluirían BIM-23268, selectivo de SSTR-5 y BIM-23244, selectivo de SSTR-2 y SSTR-5.
-- Análogos híbridos de somatostatina y dopamina. El análogo BIM-23A387 tiene alta afinidad por los receptores SSTR-2 y por el receptor de dopamina DA2.
-- Análogos ligandos universales de los receptores de somatostatina. Aunque no es universal, podemos incluir aquí el análogo SOM-230, que se une con alta afinidad a los receptores SSTR-1, 2, 3 y 5, y con baja afinidad al SSTR-4. Este análogo podría tener un papel en el tratamiento de la acromegalia, en especial en los pacientes resistentes a octreótida y en los adenomas productores de GH y PRL63-65. Los efectos antiproliferativos asociados a la acción sobre los receptores SSTR-1 y SSTR-3 pueden hacerlo también útil en carcinoides inoperables, tumores de los islotes y otros tumores con receptores de somatostatina: mama, próstata, colon, linfomas y otros tumores sólidos. Finalmente, se ha sugerido un posible efecto sobre el control metabólico en la diabetes mellitus tipo I (hiperglucemia nocturna), las complicaciones crónicas relacionadas con IGF-I (retinopatía y nefropatía) y otros procesos, como fístulas entéricas y diarreas secretorias33,66.