Evaluar la relación entre el grado de control metabólico (CM) y la frecuencia de la automonitorización de la glucemia capilar (AGC) en pacientes con diabetes mellitus (DM) tipo 1 (DM1) y 2 (DM2) tratados con insulina, y analizar factores asociados al CM.
Material y métodosEstudio observacional multicéntrico transversal en el que endocrinólogos incluyeron a pacientes con DM tratados con insulina que utilizaban un glucómetro. El punto de corte para definir un CM fue una HbA1c ≤ 7% y no control>7%. Se valoró en una escala analógica visual (EAV) el grado de aceptación del glucómetro.
ResultadosFueron evaluables 341 pacientes (53,5% varones), con una edad media ± DE de 52,8 ± 16,3 años, HbA1c media de 7,69 ± 1,25%, 128 (37,5%) con DM1 y 211 (61,9%) con DM2. El 86,1% de los pacientes utilizaron el glucómetro al menos una vez en la semana. No se observó ninguna relación entre el CM y la AGC ni en la muestra total (p=0,678), ni en DM1 (p=0,940) ni DM2 (p=0,343). En el modelo de regresión logística, se asociaron a un mal CM en la muestra total y en DM2 los episodios de hiperglucemias (Exp-b [riesgo] 1,794, p=0,022, y Exp-b 2,538, p=0,004, respectivamente), las concentraciones de HbA1c falsamente elevadas (Exp-b 3,182 p=0,005, y Exp-b 3,125, p=0,012), y la EAV (Exp-b 1,269, p=0,008, y Exp-b 1,316, p=0,026), y en la DM1 el índice de masa corporal (Exp-b 1,143, p=0,046).
ConclusionesEn este estudio observacional no controlado en pacientes con DM tratados con insulina que utilizan un glucómetro no se observa ninguna relación entre el grado de CM y la frecuencia de su uso en el último mes.
To assess the relationship between metabolic control (MC) and frequency of self-monitoring of blood glucose (SMBG) in insulin-treated patients with type 1 (T1DM) and type 2 (T2DM) diabetes mellitus, and to analyze the factors associated to MC.
Material and methodsA multicenter, cross-sectional, observational study was conducted in which endocrinologists enrolled diabetic patients treated with insulin who used a glucometer. The cut-off value for MC was HbA1c ≤ 7%. Grade of acceptance of the glucometer was assessed using a visual analogue scale (VAS).
ResultsA total of 341 patients (53.5% males) with a mean age (SD) 52.8 (16.3) years, mean HbA1c of 7.69% (1.25) and 128 (37.5%) with T1DM and 211 (61.9%) with T2DM were evaluable. SMBG was done by 86.1% at least once weekly. No relationship was seen between MC and SMBG (P=.678) in the overall sample or in the T1DM (P=.940) or T2DM (P=.343) subgroups. In the logistic regression model, hyperglycemic episodes (Exp-b [risk] 1.794, P=0.022), falsely elevated HbA1c values (Exp-b 3.182, P=.005), and VAS (Exp-b 1.269, P=.008) were associated to poor MC in the total sample. Hyperglycemic episodes (Exp-b 2.538, P=.004), falsely elevated HbA1c values (Exp-b 3.125, P=.012), and VAS (Exp-b 1.316, P=.026) were associated to poor MC in the T2DM subgroup, while body mass index (Exp-b 1.143, P=.046) was associated to poor MC in the T1DM subgroup.
ConclusionsIn this retrospective, non-controlled study on patients with DM treated with insulin who used a glucometer, no relationship was seen between the degree of metabolic control and frequency of use of the glucometer.
En el año 2010, el 2,5% de todas las muertes producidas en el mundo se atribuyeron a la diabetes mellitus (DM)1. La prevalencia de DM en España es del 13,8% y conviene resaltar que cerca de la mitad de los pacientes desconocen que están afectados2. Este aspecto adquiere especial relevancia, pues el buen control glucémico ha demostrado reducir las complicaciones microvasculares3. Es bien conocido que la DM constituye un importante problema de salud pública, tanto por su prevalencia y sus comorbilidades asociadas, como por el enorme coste sanitario directo e indirecto derivado de su atención. Se comprende pues que todas aquellas medidas destinadas a obtener un buen control glucémico van a ayudar a reducir los costes destinados al paciente con DM, que en España genera un gasto económico superior al del paciente no diabético4. Una de estas medidas, tanto en pacientes con DM tipo 1 (DM1) como con tipo 2 (DM2) que están en tratamiento con insulina, es el control glucémico efectuado mediante la automonitorización de la glucemia capilar (AGC). La AGC constituye un procedimiento ampliamente reconocido para manejar correctamente el control glucémico del paciente con DM tratado con insulina5, ya que permite determinar la glucemia en diversas circunstancias, detectar hipoglucemias y las excursiones glucémicas6.
No obstante, un aspecto poco estudiado en el paciente con DM tratado con insulina es si el autoanálisis mediante la AGC efectuado en la práctica clínica diaria tiene un impacto según el paciente consiga un buen control metabólico o no, determinado por la concentración plasmática de hemoglobina glucosilada (HbA1c). Así pues, el objetivo principal de presente estudio pretendió evaluar la relación entre el control metabólico y la frecuencia de la AGC en el último mes en pacientes con DM tratados con insulina. También se analizan los factores de riesgo asociados a un mal control metabólico y la aceptación de los instrumentos de medida de la glucemia por parte del paciente.
Material y métodosSe ha realizado un estudio observacional multicéntrico transversal en el que se incluyó a pacientes con DM1 y DM2 tratados con insulina. El estudio fue llevado a cabo por endocrinólogos en consultas externas en centros hospitalarios de España de todas las comunidades autónomas.
Criterios de selección y objetivosSe incluyó a pacientes: a) mayores de 18 años; b) controlados por endocrinológicos; c) en tratamiento con al menos 2 dosis de insulina, o insulinas premezcladas, durante un año como mínimo, y d) que hubieran utilizado un glucómetro al menos 3 meses. Se excluyó a pacientes que no firmaron el consentimiento informado. El objetivo principal del estudio fue evaluar la relación entre los resultados de la concentración de HbA1c en el momento de la recogida de los datos (control metabólico) y la frecuencia de la AGC en el último mes en pacientes controlados frente a pacientes no controlados. Los objetivos secundarios fueron: a) identificar los factores predictivos de un mal control metabólico, y b) evaluar el grado de aceptación de los instrumentos de AGC empleados por los pacientes. Todos los resultados se analizaron en la muestra total de pacientes con DM evaluables y en los subgrupos con DM1 y DM2.
Desarrollo del estudioLos investigadores recogieron información retrospectiva en una sola visita de datos demográficos, antropométricos, factores de riesgo cardiovascular asociados, presencia o no de comorbilidades, datos relacionados con la DM, información del tratamiento con insulina, descompensaciones glucémicas (hipoglucemias e hiperglucemias) y posibles concentraciones falsas de HbA1c. Se invitó a participar a 35 endocrinólogos, que debieron recoger 10-11 pacientes cada uno con DM1 y DM2. Los endocrinólogos pertenecían a Servicios de Endocrinología de centros hospitalarios. El presente estudio fue evaluado y aprobado por el Comité Ético de Investigación Clínica del SERGAS de Galicia y los pacientes firmaron la hoja de consentimiento informado antes de participar en el mismo.
Definiciones y procedimientosSe ha estableció como punto de corte para considerar que un paciente estaba bien controlado cuando la concentración de HbA1c era ≤ 7,0% y no controlado cuando era >7,0%. Las descompensaciones glucémicas hacían referencia a las presentadas en los 6 últimos meses. Para hipoglucemia, se esscogió un nivel de glucosa en sangre <50mg/dl, inferior al habitual, como indica la European Medicines Agency cuando se quiere aumentar la especificidad de la prueba en pacientes que están en tratamiento farmacológico7. Se consideró hiperglucemia un nivel >200mg/dl e hipoglucemia grave aquella en la que el paciente precisó de ayuda. Se consideró una concentración de HbA1c falsamente elevada cuando se asoció a ingesta de salicilatos, enfermedad renal crónica (estadio 3 a 5, menos el estadio 5D, que precisa de diálisis), anemia por déficit de vitamina B12 o ácido fólico o hierro, o alcoholismo crónico, y falsamente disminuida cuando se asoció a embarazo, enfermedad renal crónica en estadio 5D, sangrado activo, esplenectomía o hemoglobinopatías. La pauta de insulina descrita en los pacientes correspondió a una de las opciones utilizadas en la práctica clínica habitual. Para analizar el uso del glucómetro por parte del paciente, se estudió la frecuencia de uso y el número de tiras reactivas utilizadas. Para la frecuencia se interrogó al paciente si el número de mediciones era<3 veces al mes, 1-3 veces por semana, 3-6 veces por semana, 1-3 veces al día o>3 veces al día, y para las tiras reactivas se le preguntó si utilizaba 1 al día, 2 al día, 3 al día o más de 3 al día. Para valorar el grado de satisfacción del paciente con el glucómetro, se utilizó una escala analógica visual8 (EAV) de 10cm, en el que el punto 0 correspondía al máximo grado de insatisfacción y el punto 10 al máximo grado de satisfacción.
Análisis estadísticoPara los análisis univariantes, las variables cuantitativas se han descrito como medidas de centralización y de dispersión: media ± desviación estándar (DE). Para los análisis bivariantes y multivariantes, se utilizó el estadístico paramétrico t-test o no paramétrico de Mann-Whitney. Para la comparación de proporciones se utilizó el test de la chi al cuadrado o el test exacto de Fisher. Para la variable principal, esto es la relación entre HbA1c y el uso de la AGC, se han descrito las frecuencias absolutas y relativas de los pacientes controlados y no controlados según la frecuencia de las AGC, por un parte, y del uso de tiras reactivas, por otra parte (como se ha descrito previamente). Para estudiar el primer objetivo secundario, los factores predictivos de un mal control metabólico, se usó el modelo de regresión logística. Las variables de regresión logística bivariantes incluidas han sido: edad, índice masa corporal (IMC), tipo de diabetes, tiempo de tratamiento, hiperglucemias, hipoglucemias, hipoglucemias severas, concentraciones «falsamente altas» o «falsamente bajas» de HbA1c, tratamiento con insulina, tratamiento con antidiabéticos por vía oral, modificaciones en la dieta, ejercicio físico, número de tiras utilizadas con el glucómetro la última semana, frecuencia de la medición de la glucemia capilar con el glucómetro en las últimas 4 semanas, puntuación en la EAV. Las variables con un p-valor<0,3 se consideraron como factores de riesgo de posible mal control metabólico. Se efectuó una selección stepwise considerando como variable dependiente el control metabólico. Para el segundo objetivo secundario, el grado de aceptación de los instrumentos de AGC empleados por el paciente, se ha calculado la puntuación de la EAV. Se han calculado los intervalos de confianza del 95% para las variables de resultados asociadas a los objetivos secundarios. Se consideró significación estadística un p-valor inferior a 0,05. Para el cálculo del tamaño muestral, se procedió a estratificar según el tipo de diabetes. Con un test de significación bilateral y un riesgo alfa de 0,05, y considerando una potencia del 80% para detectar cambios en la pendiente de 0,00 (hipótesis nula o de no correlación) a 0,26 (hipótesis alternativa), asumiendo una desviación estándar de 2,2 en el número de mediciones que realizan los pacientes y una desviación estándar de 2,0% en el valor de HbA1c, según un trabajo previo de Schütt et al.9, sería necesaria una muestra de 91 pacientes con DM1 y una muestra de 248 pacientes con DM2, de acuerdo con las estimaciones de DM1 y DM2 en España2.
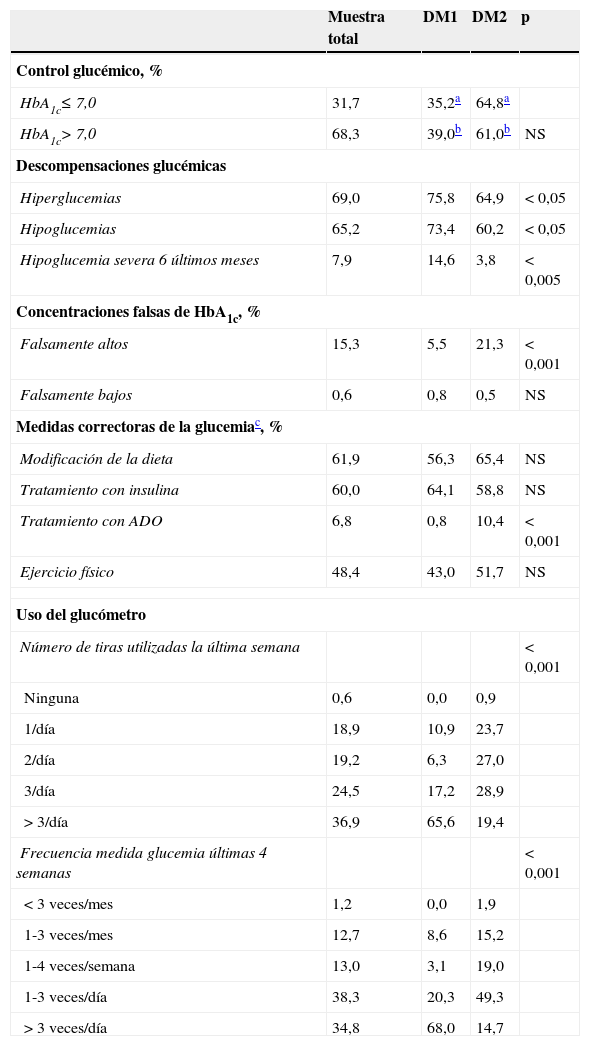
ResultadosDatos basales de la muestraParticiparon 33 endocrinólogos que incluyeron, entre el 3 de enero del 2013 y el 30 de marzo del 2014, un total de 341 pacientes evaluables, con una edad media ± DE de 52,8 ± 16,3 años, el 53,5% hombres. El 96,7% eran de raza caucásica y el IMC medio de 28,9 ± 5,6 kg/m2. Los factores de riesgo o enfermedades cardiovasculares asociados fueron hipertensión arterial (77,1% de los pacientes), dislipidemia (77,1%), enfermedad cardiovascular previa (23,4%), tabaquismo (14,2%), cardiopatía isquémica (16,5%), enfermedad arterial periférica (10,4%) y enfermedad cerebrovascular (7,8%). La concentración media de HbA1c fue de 7,69 ± 1,25% y el tiempo de tratamiento medio con insulina de 90,0 ± 99 (límites 2-540) meses. La muestra total estaba formada por 128 pacientes con DM1 (37,5%), 211 con DM2 (61,9%) y 2 pacientes con ambos diagnósticos excluidos del análisis comparativo. La edad de ambos subgrupos fue de 37,1 ± 12,7 años y 62,1 ± 9,8 años, respectivamente (p<0,001). El grado de control glucémico, las descompensaciones glucémicas, las concentraciones «falsas» de HbA1c, las medidas correctoras de la glucemia, el uso del glucómetro y las pautas de insulinización, en la muestra total y en los subgrupos DM1 y DM2, se recogen en la tabla 1. No se observaron diferencias en el control glucémico entre ambos subgrupos, pero sí fueron más frecuentes en los pacientes con DM1 los episodios de hiperglucemias (p<0,05), hipoglucemias (p<0,05) e hipoglucemias graves (p<0,005). Se apreció un uso del glucómetro más frecuente en pacientes con DM1 (p<0,001) (tabla 1).
Datos sobre la glucemia y uso del glucómetro
| Muestra total | DM1 | DM2 | p | |
|---|---|---|---|---|
| Control glucémico, % | ||||
| HbA1c≤ 7,0 | 31,7 | 35,2a | 64,8a | |
| HbA1c> 7,0 | 68,3 | 39,0b | 61,0b | NS |
| Descompensaciones glucémicas | ||||
| Hiperglucemias | 69,0 | 75,8 | 64,9 | < 0,05 |
| Hipoglucemias | 65,2 | 73,4 | 60,2 | < 0,05 |
| Hipoglucemia severa 6 últimos meses | 7,9 | 14,6 | 3,8 | < 0,005 |
| Concentraciones falsas de HbA1c, % | ||||
| Falsamente altos | 15,3 | 5,5 | 21,3 | < 0,001 |
| Falsamente bajos | 0,6 | 0,8 | 0,5 | NS |
| Medidas correctoras de la glucemiac, % | ||||
| Modificación de la dieta | 61,9 | 56,3 | 65,4 | NS |
| Tratamiento con insulina | 60,0 | 64,1 | 58,8 | NS |
| Tratamiento con ADO | 6,8 | 0,8 | 10,4 | < 0,001 |
| Ejercicio físico | 48,4 | 43,0 | 51,7 | NS |
| Uso del glucómetro | ||||
| Número de tiras utilizadas la última semana | < 0,001 | |||
| Ninguna | 0,6 | 0,0 | 0,9 | |
| 1/día | 18,9 | 10,9 | 23,7 | |
| 2/día | 19,2 | 6,3 | 27,0 | |
| 3/día | 24,5 | 17,2 | 28,9 | |
| > 3/día | 36,9 | 65,6 | 19,4 | |
| Frecuencia medida glucemia últimas 4 semanas | < 0,001 | |||
| < 3 veces/mes | 1,2 | 0,0 | 1,9 | |
| 1-3 veces/mes | 12,7 | 8,6 | 15,2 | |
| 1-4 veces/semana | 13,0 | 3,1 | 19,0 | |
| 1-3 veces/día | 38,3 | 20,3 | 49,3 | |
| > 3 veces/día | 34,8 | 68,0 | 14,7 | |
DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; NS: no significativo estadísticamente; p: grado de significación entre grupos DM1 y DM2.
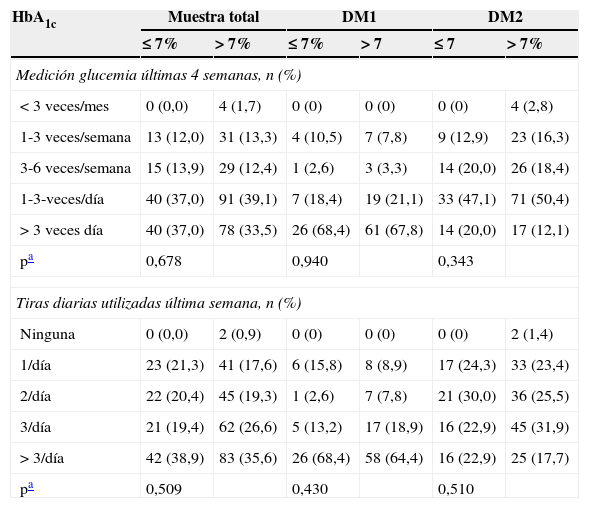
No se observó ninguna relación en la muestra global entre el control metabólico y la AGC en las últimas 4 semanas (p=0,678) o el número de tiras reactivas diarias utilizadas en la última semana (p=0,509). Tampoco se observó ninguna relación en los subgrupos de pacientes con DM1 (p=0,940 y p=0,430, respectivamente) o con DM2 (p=0,343 y p=0,510, respectivamente) (tabla 2).
Uso del glucómetro según el control o no control metabólico
| HbA1c | Muestra total | DM1 | DM2 | |||
|---|---|---|---|---|---|---|
| ≤ 7% | > 7% | ≤ 7% | > 7 | ≤ 7 | > 7% | |
| Medición glucemia últimas 4 semanas, n (%) | ||||||
| < 3 veces/mes | 0 (0,0) | 4 (1,7) | 0 (0) | 0 (0) | 0 (0) | 4 (2,8) |
| 1-3 veces/semana | 13 (12,0) | 31 (13,3) | 4 (10,5) | 7 (7,8) | 9 (12,9) | 23 (16,3) |
| 3-6 veces/semana | 15 (13,9) | 29 (12,4) | 1 (2,6) | 3 (3,3) | 14 (20,0) | 26 (18,4) |
| 1-3-veces/día | 40 (37,0) | 91 (39,1) | 7 (18,4) | 19 (21,1) | 33 (47,1) | 71 (50,4) |
| > 3 veces día | 40 (37,0) | 78 (33,5) | 26 (68,4) | 61 (67,8) | 14 (20,0) | 17 (12,1) |
| pa | 0,678 | 0,940 | 0,343 | |||
| Tiras diarias utilizadas última semana, n (%) | ||||||
| Ninguna | 0 (0,0) | 2 (0,9) | 0 (0) | 0 (0) | 0 (0) | 2 (1,4) |
| 1/día | 23 (21,3) | 41 (17,6) | 6 (15,8) | 8 (8,9) | 17 (24,3) | 33 (23,4) |
| 2/día | 22 (20,4) | 45 (19,3) | 1 (2,6) | 7 (7,8) | 21 (30,0) | 36 (25,5) |
| 3/día | 21 (19,4) | 62 (26,6) | 5 (13,2) | 17 (18,9) | 16 (22,9) | 45 (31,9) |
| > 3/día | 42 (38,9) | 83 (35,6) | 26 (68,4) | 58 (64,4) | 16 (22,9) | 25 (17,7) |
| pa | 0,509 | 0,430 | 0,510 | |||
DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2.
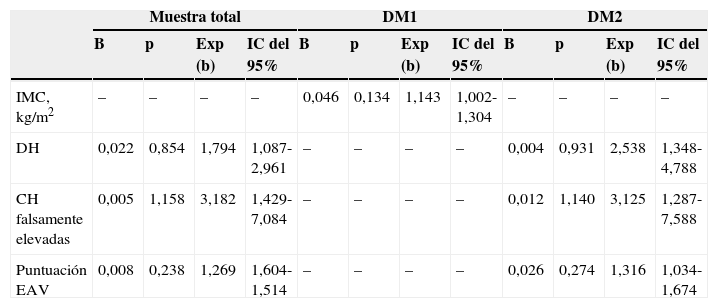
En la tabla 3 se recogen los factores predictores de un mal control metabólico procedentes de las variables de los modelos bivariantes con un p-valor < 0,3 incluidas en el modelo final. En la muestra total fueron las hiperglucemias (riesgo: 1,794, p=0,022), las concentraciones falsamente elevadas de HbA1c (riesgo: 3,182, p=0,005) y la EAV (riesgo: 1,269, p=0,008). Esto es, el riesgo de no estar controlado es 1,8 veces superior en los pacientes que presentan hiperglucemias, 3,2 veces superior en los pacientes con valores falsamente elevados de HbA1c y, finalmente, 1,3 veces superior por cada punto de insatisfacción que aumenta en la EAV. En los pacientes del subgrupo con DM1, la única variable asociada fue el IMC (riesgo: 1,143, p=0,046), de forma que por cada unidad que aumenta el IMC el riesgo de no estar controlado aumenta 1,1 veces. En los pacientes del subgrupo DM2, al igual que en la muestra total, las variables asociadas a un mal control metabólico han sido las hiperglucemias (riesgo: 2,538, p=0,004), los niveles falsamente elevados de HbA1c (riesgo: 3,125, p=0,012) y la EAV (riesgo: 1,316, IC del 95%, 1,034-1,674, p=0,026).
Factores asociados a mal control metabólico. Variables significativas en el modelo de regresión logística final
| Muestra total | DM1 | DM2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B | p | Exp (b) | IC del 95% | B | p | Exp (b) | IC del 95% | B | p | Exp (b) | IC del 95% | |
| IMC, kg/m2 | – | – | – | – | 0,046 | 0,134 | 1,143 | 1,002-1,304 | – | – | – | – |
| DH | 0,022 | 0,854 | 1,794 | 1,087-2,961 | – | – | – | – | 0,004 | 0,931 | 2,538 | 1,348-4,788 |
| CH falsamente elevadas | 0,005 | 1,158 | 3,182 | 1,429-7,084 | – | – | – | – | 0,012 | 1,140 | 3,125 | 1,287-7,588 |
| Puntuación EAV | 0,008 | 0,238 | 1,269 | 1,604-1,514 | – | – | – | – | 0,026 | 0,274 | 1,316 | 1,034-1,674 |
CH: concentraciones de HbA1c; DH: descompensaciones hiperglucémicas, definidas como una glucemia > 200 mg/dl; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; EAV: escala analógica visual; Exp (b): medida equivalente a la odds ratio o al riesgo, cuantifica el riesgo de no estar controlado; IC del 95%: intervalos de confianza del 95% de la Exp (b); p: significación estadística.
El grado de aceptación en la muestra global mostró una puntuación media en la EAV de 8,10 (1,46) puntos (IC del 95%, 7,94-8,25), y en DM1 de 8,09 (1,64) puntos (IC del 95%, 7,80-8,37) y DM2 de 8,11 (1,34) puntos (IC del 95%, 7,93-8,29), no existiendo diferencia significativa estadísticamente entre ellos (p=0,631).
DiscusiónLos datos del presente estudio en pacientes con DM en tratamiento con insulina no muestran relación entre el control metabólico y la frecuencia de la AGC por el propio paciente en el último mes, o con el número de tiras reactivas utilizadas al día. Esta relación tampoco se observa al separar a los pacientes en DM1 o DM2. Los factores de riesgo asociados a un mal control glucémico en todos los pacientes evaluados, así como en aquellos con DM2, son las hiperglucemias, las concentraciones falsamente elevadas de HbA1c y el estar más insatisfecho con el uso del glucómetro, mientras que en pacientes con DM1 el factor de riesgo asociado es un IMC más elevado. En general, los pacientes se muestran muy satisfechos con el uso del glucómetro para evaluar su control glucémico.
Está bien establecido el papel de la AGC en el paciente con DM en tratamiento con insulina. Sin embargo, la frecuencia de las mediciones propuestas es muy variable según el tipo de DM, la pauta de insulinoterapia y la estabilidad del paciente, como recogen las diferentes guías europeas y americanas, con diferencias entre ellas10-14. En el presente estudio, no se asocia la frecuencia de las mediciones y el uso de tiras reactivas con el hecho de que el paciente presente o no un buen control metabólico, tanto en pacientes con DM1 como en DM2. En diferentes estudios efectuados en pacientes con DM1 se ha demostrado que cuando la frecuencia de la AGC es mayor se consigue una mayor reducción en la concentración de HbA1c8,15-17. En pacientes con DM2, en los que la AGC está bien establecida en nuestro medio18, los resultados son más dispares. Así, Harris19, en un estudio observacional en el que incluyeron a pacientes con DM tratados con insulina o con antidiabéticos por vía oral, no observaron que un aumento de la frecuencia de las AGC mejore el control metabólico. Por el contrario, Karter et al.16 aprecian que cuanto mayor es el número de AGC, el control glucémico es mejor, independientemente del tipo de DM. No obstante, estos y otros trabajos que examinan este aspecto presentan importantes diferencias metodológicas, lo que hace difícil la comparación entre ellos. Alguna explicación para las diferencias observadas entre DM1 y DM2 es que los primeros suelen efectuar más mediciones, como también se observa en el presente trabajo. Un aspecto que se debe considerar en el diseño del presente estudio es que se establece un punto de corte en la concentración de HbA1c, esto es, según los pacientes estén o no controlados, destacando que ni en DM1 ni en DM2 se observa una asociación entre la frecuencia de las mediciones y el buen control metabólico. Se pueden destacar 2 aspectos derivados de estos resultados. Por una parte, las implicaciones en los costes que han de afrontar los proveedores de salud con este procedimiento, pues la AGC supone el 40% del coste total en relación con la farmacia de los pacientes con DM tratados con insulina20. Pero por otra parte, la AGC, en la práctica clínica habitual en consultas de Endocrinología en España, no parece que aporte un beneficio cuando se aumentan las mediciones, o al menos sería independiente de la cantidad total de mediciones. Podría considerarse que la AGC en nuestro medio no se utiliza con la eficiencia que sería deseable, en parte porque faltan medios para una mejor implementación en uso del AGC. En este sentido, una AGC de forma estructurada parece ser superior a la AGC que se efectúa en la práctica clínica habitual21,22, lo que podría explicar los resultados aquí expuestos, aunque la naturaleza retrospectiva y de no intervención del presente estudio no nos permite evaluar este aspecto. La importancia de una AGC de forma estructurada implica una intervención activa por parte del paciente y un compromiso del paciente con su enfermedad, precisándose para ello de los recursos educativos y de organización necesarios. Este compromiso puede observarse con procedimientos más recientes con participación activa del paciente, como la monitorización continua de la glucosa en pacientes con DM1 con infusión subcutánea de insulina, con en el que se mejora el control metabólico23. Es interesante destacar del presente estudio que uno de los factores de riesgo asociado al no control metabólico, tanto en la muestra total evaluada, como en los pacientes con DM2, es el grado de satisfacción del paciente con el glucómetro, de forma que cuanto más satisfecho, mejor va a ser su control metabólico. Se podría considerar que la administración generalizada de glucómetros, sin haber dialogado de forma estructurada con el paciente, y no conociendo sus necesidades y limitaciones, podría constituir un instrumento con menos validez del que formalmente se le atribuye. Por todo ello, los datos del presente estudio se han de examinar con precaución y se ha de tener presente lo que indican las guías en este sentido. La American Diabetes Association puntualiza que en los pacientes en tratamiento con insulina la AGC debe emplearse después de asegurarse de que el paciente ha recibido instrucciones del uso de la técnica y de que se efectúa un seguimiento de la misma24, aspectos que no se han valorado en el presente estudio. Por otra parte, el documento de posicionamiento sobre la eficiencia de las tecnologías aplicadas al manejo de la diabetes de la Sociedad Española de Endocrinología y Nutrición25, recientemente publicado, establece que en pacientes en tratamiento con insulina la frecuencia óptima del autoanálisis no está bien establecida en términos de coste-efectividad, a pesar de que en pacientes con DM1 hay una estrecha relación entre la frecuencia de las mediciones capilares y un control metabólico. En general, para todos los pacientes diabéticos en insulinoterapia se aconseja un esquema de AGC que ha de individualizarse, abarcando desde 4 automonitorizaciones al día en pautas con insulina basal-bolos, a otras más adaptadas a las circunstancias del paciente.
Este estudio presenta ciertas limitaciones en su diseño que conviene considerar al interpretar los resultados. Se trata de una recogida de variables clínicas retrospectivas, sin un grupo control. Por otra parte, al tratarse de un estudio de no intervención, no se ha diferenciado de aquellos pacientes que utilizan la AGC solo para autoanálisis, de aquellos que además la utilizan para autorregulación, que podrían estar más implicados y obtener un rendimiento superior a la técnica. Tampoco se alcanzó el tamaño muestral previsto, siendo la muestra evaluable inferior a la de otros estudios que evalúan este aspecto16,19. Finalmente, otra limitación que se debe considerar es que no se ha recogido información de la eficiencia del autoanálisis, como el nivel de educación diabetológica o los cambios de tratamiento inducidos por el autoanálisis. No obstante, el hecho de llevarse a cabo en el contexto de la clínica habitual es un punto positivo que se debe considerar.
En conclusión, los pacientes con DM en tratamiento con insulina muestran un alto grado de aceptación con el uso del glucómetro para autoevaluar el control glucémico. Sin embargo, no se aprecia ninguna relación entre el control metabólico y la frecuencia de su uso en el último mes, o con el número de tiras utilizadas diariamente, ya sean pacientes con DM1 o con DM2. Los factores de riesgo asociados a un mal control metabólico en pacientes con DM2 son, como era de esperar, las hiperglucemias y las concentraciones falsamente elevadas de HbA1c, pero también el estar más insatisfecho con el uso del glucómetro, mientras que en pacientes con DM1 el factor de riesgo asociado es un IMC más elevado.
FinanciaciónEl estudio ha sido financiado por Sanofi-Aventis España.
Conflicto de interesesEl Dr. Soto ha recibido financiación por ponencias y/o ensayos clínicos de GlaxoSmithKline, Novo-Nordisk, Sanofi-Aventis, Janssen-Cilag, Pfizer, AstraZeneca, Merck, Almirall y Novartis.
A todos los médicos participantes en el estudio, sin cuya colaboración hubiera sido imposible la realización del estudio. La redacción del manuscrito ha sido realizada con la ayuda del Dr. José Mora Maciá, Medical Writer financiado por Sanofi-Aventis España.