La utilización casi generalizada de análogos de insulina está basada no solo en la farmacocinética de estos preparados, mucho más cercana a la fisiología de la secreción de insulina en condiciones normales, sino, además, en su eficacia y seguridad. Se ha publicado una posible asociación entre el uso de un análogo lento de insulina (glargina) y la aparición de cáncer de mama, lo que ha condicionado una inquietud en la comunidad médica sobre la seguridad de estos análogos.
Para explicar el mecanismo del aumento de la actividad tumoral de los análogos de insulina es que actúan a través de los receptores de insulina (IR) y del factor de crecimiento insulínico–1 (IGF-1R) estimulando el crecimiento celular e inhibiendo la apoptosis. En este sentido, existen dos mecanismos principales: el aumento del tiempo de unión de la insulina al IR y la activación aumentada del IGF-1R. Por tanto, para evaluar la seguridad de un análogo hay que descartar su disociación más lenta al IR así como un aumento de su afinidad por el IGF-1. Esto equivale a un índice de actividad mitogénica/metabólica menor a 1. Evaluar estos aspectos sólo es posible mediante el estudio de líneas celulares y la experimentación animal, modelos reduccionistas que no siempre son extrapolables al ser humano. Hasta el momento no existen datos para poner en duda la seguridad de los análogos de insulina en general, si bien la observación de un potencial riesgo de mitogenicidad con la administración de glargina basada en estudios observacionales y en algunos estudios in vitro ha causado cierta alarma en la comunidad médica. A la espera de datos que descarten o confirmen este riesgo, es fundamental poder evaluar los datos existentes de forma crítica con el objeto de proporcionar información objetiva.
The widespread use of insulin analogues is based not only on the pharmacokinetics of these preparations, which is much closer to the physiology of insulin secretion under normal conditions, but also on their safety and effectiveness. The publication of a possible association between the use of a long-acting insulin analogue (glargine) and breast cancer has caused uneasiness among the medical community regarding the safety of these analogues.
The mechanism of increased tumor activity of insulin analogues is explained by the fact that they act through insulin receptors (IR) and insulin-like growth factor-1 (IGF-1R), stimulating cell growth and inhibiting apoptosis. There are two major mechanisms: an increase in the binding time of insulin to IR and increased activation of IGF-1R. Therefore, to evaluate the safety of an analogue, the slower dissociation rate from its insulin receptor must be excluded, as well as the increased affinity for the IGF-1 receptor. This is equivalent to an index of mitogenic/metabolic activity of less than 1. These aspects can only be evaluated through study of cell lines and animal testing, which are reductionist models that cannot always be extrapolated to humans. To date, there are no data to question the safety of insulin analogues in general. However, the results of observational studies and some in vitro studies, suggesting a potential risk of mitogenicity with the administration of glargine, have caused some alarm among the medical community. Until now, there are no data to refute or confirm this risk and, therefore, evaluation of the existing data is crucial to obtain objective information.
Los análogos de insulina están sustituyendo de forma progresiva a las insulinas humanas debido a su farmacocinética más fisiológica. Los análogos de insulina de acción lenta, la insulina glargina y la insulina detemir, desarrollados mediante ingeniería genética en los últimos años, mejoran ostensiblemente la farmacocinética de la insulina neutral protamine Hagedorn (NPH) ya que, al carecer de un pico de acción, imitan la secreción basal continua de insulina. Los análogos de acción rápida lispro, aspart y glulisina tienen una acción más rápida y breve que la insulina regular, y se asemejan en mayor medida que esta a la secreción de insulina en respuesta a la ingesta.
El propósito de desarrollar análogos de insulina es el de conseguir un perfil de absorción de estos que se corresponda de manera lo más aproximada posible al perfil fisiológico de secreción de insulina. Este objetivo debe tener en cuenta no solo las características farmacocinéticas del análogo en cuestión, sino dos aspectos adicionales fundamentales: eficacia y seguridad. El análogo debe proporcionar una disminución de la glucemia comparable a la obtenida con insulina humana, y debe hacerlo con un perfil de seguridad igual o mejor que el de esta.
La reciente publicación de cuatro estudios observacionales1–4 en Diabetologia, junto con el editorial resultante5, han creado cierta inquietud en la comunidad médica. En efecto, el hallazgo de tres de los cuatros estudios sobre una posible asociación entre el uso de insulina glargina y la aparición de cáncer, especialmente de mama, sumado al conocimiento ya existente de una aumentada acción mitogénica de este análogo en líneas celulares específicas encendió un acalorado debate sobre la seguridad de esta insulina.
Mientras el debate continúa, a la espera de más datos que puedan confirmar o descartar una asociación causal entre el aumento de incidencia de cáncer y el uso de glargina, es fundamental ahondar en tres áreas clave: 1) ¿cuáles son los mecanismos conocidos a través de los cuales un análogo de insulina puede causar aumento de mitogenicidad?; 2) ¿qué herramientas poseemos para medir la acción de los análogos sobre estos mecanismos?, y 3) ¿cómo interpretar los datos proporcionados por estas herramientas?
En el caso de los análogos de insulina, el concepto de seguridad debe dividirse en dos partes: seguridad metabólica (riesgo de hipoglucemias) y seguridad molecular (riesgo de genotoxicidad y de mitogenicidad). En cuanto a la seguridad metabólica, todos los análogos (rápidos y basales) han demostrado una clara mejora con respecto al riesgo de hipoglucemias6.
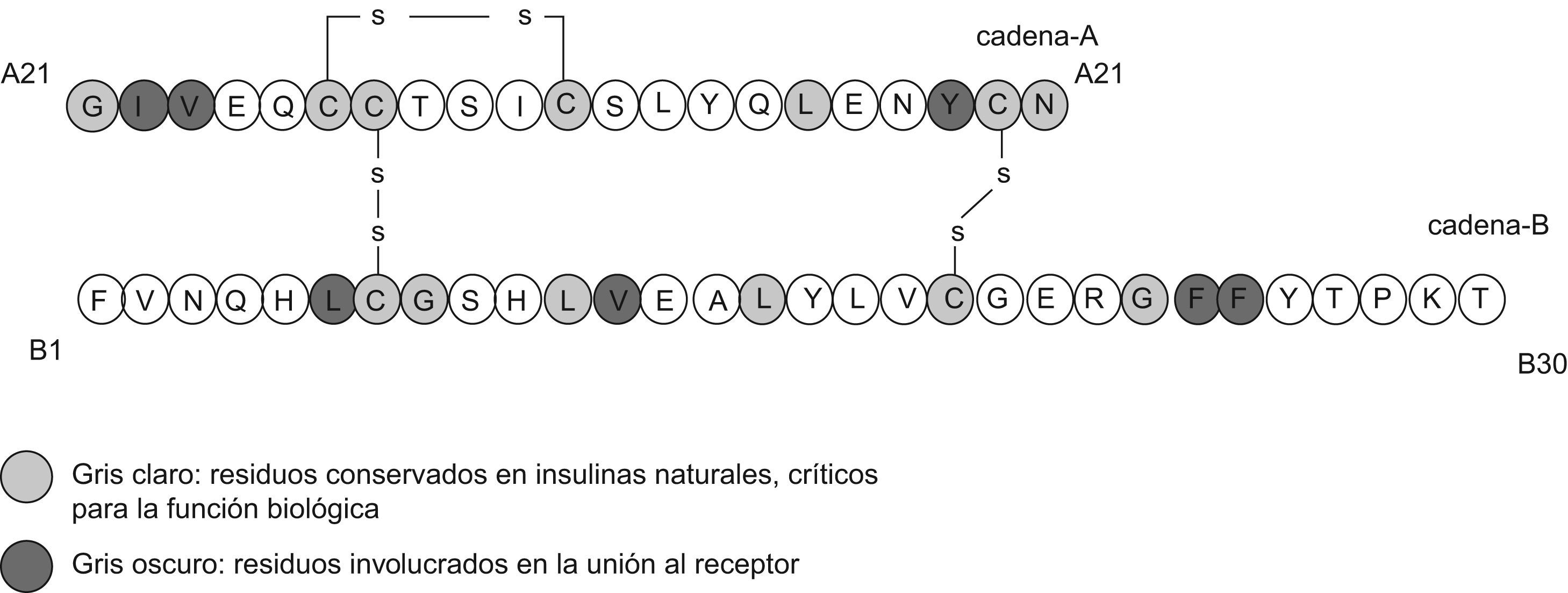
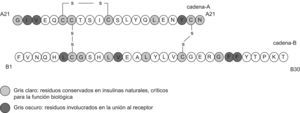
Respecto a la seguridad molecular, es preciso recordar que hay pocos aminoácidos en regiones muy específicas de la molécula nativa de insulina que pueden ser reemplazados, modificados o adicionados, sin alterar la eficacia o la seguridad del péptido resultante. La figura 1 muestra cuáles son esas regiones y también los cambios que se han hecho para cada análogo. Hasta el momento no se han descrito hallazgos de genotoxicidad en los estudios preclínicos realizados con análogos de insulina, ni en el uso de estos en humanos; incluso en algún caso está indicado su uso en el embarazo (el análogo rápido, aspart). En este sentido, cabe resaltar que hasta el momento, solo en glargina se ha demostrado un aumento de mitogenicidad en varias líneas celulares, como consta en la revisión farmacológica y toxicológica de la Food and Drug Administration del año 20007, el mismo año en que se aprobó su comercialización en Estados Unidos y Europa.
¿Qué determina la seguridad molecular de los análogos?La hipótesis más plausible para explicar el mecanismo entre la relación de la insulina (humana y análogos) y péptidos relacionados con el aumento de la actividad tumoral es que actúan a través de los receptores de insulina (IR) y del factor de crecimiento insulínico–1 (IGF-1R), estimulando el crecimiento celular e inhibiendo la apoptosis8. De hecho, fue el estudio de diversos análogos de insulina, con distintas modificaciones moleculares y distintas características de unión a receptores, lo que permitió identificar dos mecanismos principales: el aumento del tiempo de unión de la insulina al IR y la activación aumentada del IGF-1R.
Hansen et al demostraron que durante el desarrollo de un análogo de insulina (análogo AspB10 de Novo Nordisk), un retraso en la disociación del análogo al IR estaba correlacionado con aumento de 7 veces de la actividad mitogénica comparado con la insulina humana9. Actualmente, se especula que un aumento de la internalización del complejo análogo-receptor sin una disociación intracelular consiguiente podría sobreestimular las vías de la kinasa MAP resultando en aumento de actividad mitogénica10.
En cuanto a la acción mitogénica resultante de la activación del IGF-1R, varios estudios de casos-control han comunicado una asociación entre aumento de niveles plasmáticos del factor de crecimiento insulínico–1 (IGF-1), cáncer de próstata11,12 y cáncer de mama13–16, si bien algunos de estos estudios no han podido establecer una asociación definitiva entre ambos fenómenos. En un modelo murino de cáncer de próstata (LNCaP), la administración de una dieta alta en carbohidratos resultó en altos niveles plasmáticos de insulina (1,45 vs. 0,45ng/ml; p=0,039) y en un aumento significativo del crecimiento tumoral (0,88 vs. 0,51g; p=0,04). En estos animales se observó un aumento en el número de IR y de IGF-1R en el tejido neoplásico, así como un incremento de la señalización intracelular causada por la activación de estos receptores17. La activación del IGF-1R parece estar asociada a un mal pronóstico en el caso de las neoplasias mamarias. En un estudio de más de 400 casos de cáncer invasivo de mama, cubriendo varios subtipos de neoplasias, Law et al observaron que los niveles de IGF-1R fosforilado se asocian a un aumento de la mortalidad18.
En consecuencia, al evaluar la seguridad de un análogo de insulina es necesario descartar una disociación más lenta de este al IR así como un aumento de la afinidad del análogo por el IGF-1R; dicho de otra manera, es fundamental mantener un índice de actividad mitogénica/metabólica menor a 1.
¿Qué herramientas existen para evaluar la seguridad molecular de los análogos?Uno de los paradigmas clave de la medicina moderna ha sido el poder explicar procesos patológicos a través de la comprensión de los procesos biológicos a nivel molecular. En este sentido, las herramientas tradicionales han sido las del laboratorio: líneas celulares, principalmente, y modelos animales. Ambas deben ser evaluadas con cierto grado de cautela, ya que representan modelos reduccionistas y no siempre trasladables a la complejidad de la fisiología humana.
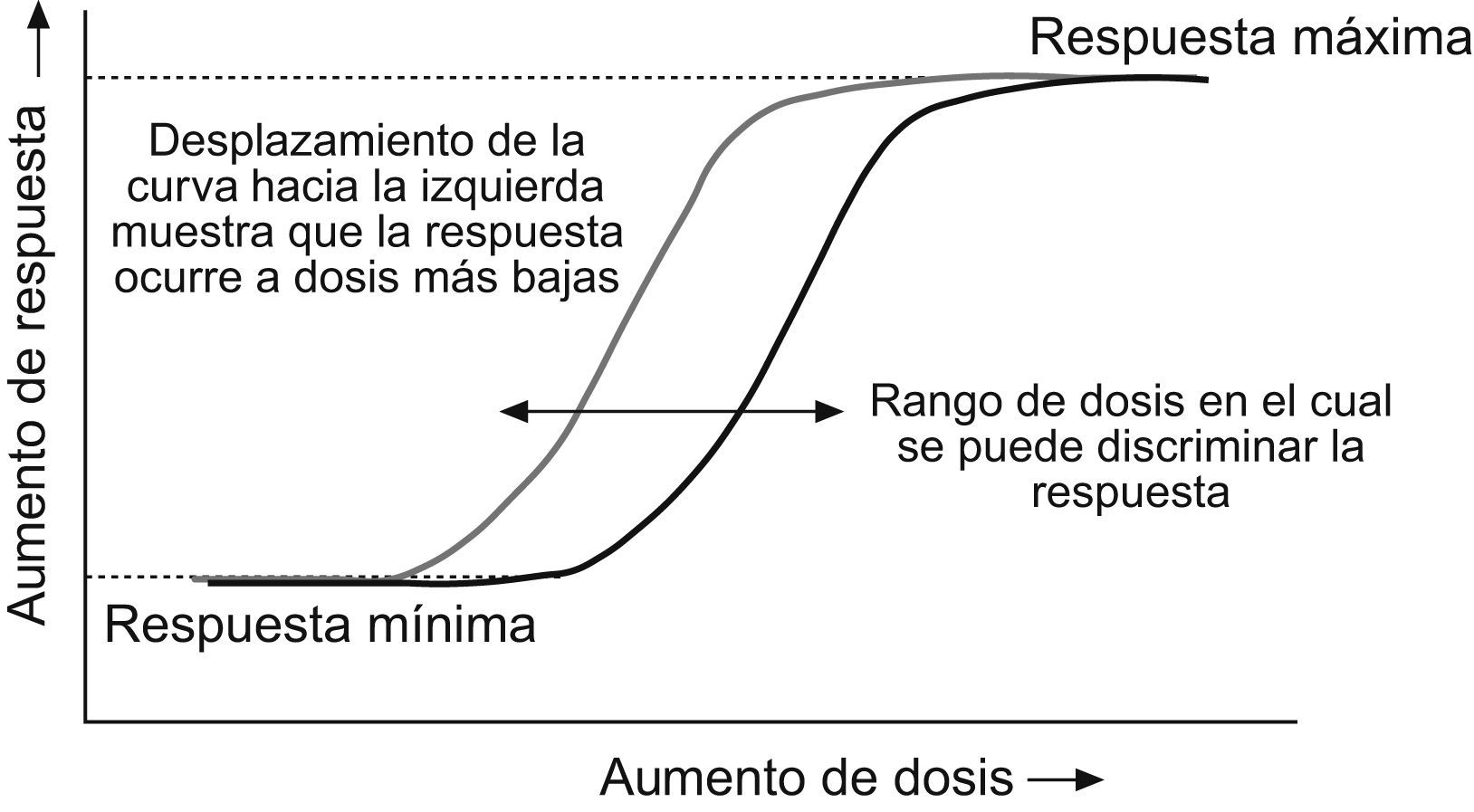
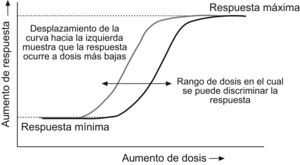
En el caso de las líneas celulares es importante tener en cuenta dos aspectos. El primero es que las propiedades mitogénicas están presentes en algunas de estas líneas mientras que en otras no. Es decir que habrá que elegir aquellas líneas en las que exista la posibilidad de activar o estimular su actividad mitogénica. En este caso, los efectos por medir tienden a ser más claros en líneas celulares con una alta proporción de IGF-1R respecto a los IR19. El segundo aspecto tiene que ver con el nivel máximo de respuesta mitogénica de cualquier tipo de célula a la actividad de la insulina y de cualquier molécula similar a la insulina, como el IGF-1. Cuando estas hormonas se suministran en concentraciones lo suficientemente altas (aunque la concentración efectiva varíe de acuerdo con la hormona) se obtiene una respuesta mitogénica de la célula. Por lo tanto, es fundamental evaluar un amplio rango de concentraciones del análogo en estudio para determinar su efecto mitogénico. Sobre la base de la construcción de curvas similares a las de la figura 2, se puede determinar la relación entre la actividad metabólica y mitogénica del análogo. Todos aquellos ensayos en los que se evalúe una sola dosis del análogo en estudio no permiten establecer en qué parte de la curva dosis-respuesta se encuentra y, por lo tanto, pueden proporcionar resultados equívocos.
El uso de modelos animales está más limitado y existe una especie en la que fueron realizados la mayoría de los estudios de genotoxicidad y mitogenicidad de los distintos análogos de insulina: la rata Sprague-Dawley. Este animal se caracteriza por tener una alta incidencia de tumores mamarios espontáneos, lo que la convierte en un modelo muy sensible para evaluar potenciales efectos mitogénicos de los análogos. Fue en este tipo de rata en el que se confirmaron los hallazgos de Hansen et al con el uso del análogo AspB10 ya comentado9, ya que la administración de este análogo aumentó de forma significativa la incidencia de neoplasias mamarias.
Teniendo en cuenta estas herramientas, lo ideal sería poder establecer si los mecanismos postulados anteriormente tienen una relación causal con el desarrollo o estimulación de la actividad tumoral. Posiblemente el diseño de experimentos dirigidos a bloquear los IR y los IGF-1R en líneas celulares y modelos animales en los que el uso de un análogo haya resultado en aumento de neoplasias sea el camino por seguir. Mientras tanto es importante evaluar los estudios existentes.
¿Qué estudios existen sobre la seguridad de los análogos y cómo interpretarlos?Ya en el año 2000, Kurtzhals et al reportaron un aumento de la actividad mitogénica de glargina 7 veces superior a la correspondiente a la insulina humana en una línea celular maligna de osteosarcoma (Saos/B10)20, caracterizada por una alta expresión de IGF-1R. Más recientemente, Kohn et al confirmaron este hallazgo comparando glargina con una serie de análogos no comercializados21, caracterizados por la introducción de aminoácidos con cargas positivas (Arg o Lys) en distintas regiones de la molécula, lo que proporciona cambios en el punto isoeléctrico de la insulina. El propósito de estos cambios era evaluar el perfil farmacocinético de cada análogo y su afinidad al IGF-1R y al IR. Tanto glargina como todos aquellos análogos con adición de Arg o Lys en la parte C terminal de la cadena A y/o B de la molécula de insulina mostraron un aumento de su afinidad por el IGF-1R. Esta mayor afinidad se vio luego en un aumento de la actividad mitogénica de células epiteliales mamarias. Shukla et al estudiaron el efecto mitogénico de una serie de análogos comercializados y de la insulina humana en dos líneas celulares19: una benigna (MCF10A) y una maligna (MCF7). Mientras ningún análogo mostró diferencias con respecto a la insulina humana en la línea benigna, solo la administración de glargina resultó en un aumento de entre 1,6 y 3,1 veces del potencial proliferativo de las células malignas. Este aumento fue explicado por la activación de la kinasa MAP, ya que la administración subsiguiente de un inhibidor específico de esta kinasa resultó en una normalización de la actividad mitogénica de las células. Sin embargo, en otras líneas celulares, con menor relación de IGF-1R/IR, como el músculo esquelético, glargina no presenta grandes diferencias con respecto a la insulina humana en promover la síntesis de ADN22.
En otro estudio, Weinstein et al evaluaron solo dos dosis de cada uno de los análogos glargina, detemir, aspart y lispro en tres líneas celulares diferentes23. En dosis muy altas (equivalente para los cuatro análogos) todos activaron la proliferación celular de las distintas líneas. Sin embargo, en dosis 10 veces menores solo glargina activó tanto el IR como el IGF-1R. Los datos obtenidos de este estudio indican que cada análogo puede actuar de forma particular, pudiendo fosforilar diferentes mediadores citoplasmáticos, de manera más o menos específica. Solo glargina, al menos in vitro, tiene el potencial de actuar como insulina o como IGF-1 en las células cancerosas estudiadas. Una amplia y documentada revisión de los estudios de análogos de insulina en diferentes líneas celulares ha sido publicado recientemente24.
Además de los estudios in vitro, es necesario mencionar que varios de los análogos mencionados fueron estudiados en modelos animales. Las dosis de glargina administradas a las ratas Sprague Dawley no alcanzaron los niveles del análogo AspB10 en los cuales se habían observado cambios tumorales, ya que al ser un análogo de acción lenta, esos niveles de dosis causaban la muerte de los animales por hipoglucemia25.
Se ha escrito extensamente sobre los estudios observacionales mencionados al inicio de este escrito. Lo que muchas de las publicaciones críticas con estos estudios soslayan es que la población total estudiada ascendiera a más de 200.000 pacientes y que existían datos previos que podrían proporcionar una posible explicación mecanística a la asociación observada entre glargina y cáncer en estas cohortes de pacientes. El análisis posthoc de incidencia de cáncer en el estudio de Rosenstock et al26,27, que evaluaba la progresión de retinopatía a 5 años en pacientes tratados con glargina, proporciona datos en la dirección contraria, si bien ha de tenerse en cuenta que el estudio no fue diseñado para evaluar la incidencia de cáncer con glargina vs. NPH, que la cantidad de casos de cáncer fue baja y que la población estudiada fue relativamente pequeña comparada con el número total de los cuatro estudios observacionales. Recientemente, Dejgaard et al han publicado un metaanálisis de todos los estudios con el uso de detemir28, encontrando una disminución de la incidencia de cáncer con detemir con respecto a NPH (0,36 frente a 0,92 eventos/100 pacientes-años de exposición; p<0,05). La diferencia entre detemir y glargina fue de menos casos para detemir, si bien no alcanzó significación estadística.
ConclusiónLos análogos de insulina han demostrado ser una herramienta eficaz para conseguir la optimización del control metabólico de los pacientes diabéticos, liberándolos en la mayoría de las ocasiones de horarios rígidos y, especialmente, de las temidas hipoglucemias. Hasta el momento no existen datos para poner en duda la seguridad de los análogos en general, si bien la observación de un potencial riesgo de mitogenicidad con la administración de glargina, basada en estudios observacionales y en estudios in vitro ha causado cierta alarma en la comunidad médica. A la espera de datos que descarten o confirmen este riesgo, es fundamental poder evaluar los datos existentes de forma crítica con el objeto de proporcionar información objetiva.
Conflicto de interesesUno de los autores, Danilo Verge, actualmente trabaja para Novo Nordisk A/C.