Las neoplasias oncocíticas u oncocitomas generalmente surgen en órganos como el riñón, la tiroides, la paratiroides, las glándulas salivales o la hipófisis. Los oncocitomas de la corteza suprarrenal son extremadamente raros y generalmente descubiertos como hallazgos incidentales. Se presenta el caso de una paciente con síndrome de Cushing causado por un oncocitoma suprarrenal benigno.
Se trata de una mujer de 61 años de edad remitida en febrero de 2014 a la consulta de Endocrinología por obesidad. En la anamnesis dirigida refería que, a pesar de haber presentado desde los 30 años una tendencia al sobrepeso, dicha tendencia se había exacerbado en el último año, en el que había ganado 10kg de forma aparentemente injustificada. También presentaba HTA desde hacía 8 años, en tratamiento actual con 5 fármacos antihipertensivos (ARA II, betabloqueante, alfabloqueante, tiazida y calcioantagonista).
Entre sus antecedentes personales destacaba haber presentado la menopausia a los 50 años; no tenía otros antecedentes personales o familiares de interés.
En la exploración física destacaban un peso de 96,4kg con IMC de 38,6kg/m2, TA 130/90mmHg, plétora facial con ligera apariencia de «luna llena», hirsutismo facial, piel atrófica, aumento de grasa cervical posterior y supraclavicular, incremento del perímetro abdominal con redistribución de la grasa y atrofia muscular en los miembros inferiores.
En la analítica solicitada inicialmente se objetivó hemograma con hemoglobina 16,7g/dl, hematocrito 51,8%, y el resto era normal; bioquímica con glucosa 107mg/dl, y el resto, normal; sobrecarga oral con 75g de glucosa: 106-280mg/dl; cortisol plasmático 15,9mcg/dl tras 1mg de dexametasona, y cortisol libre urinario 233,9mcg/24h (N=0-100).
Con la sospecha de síndrome de Cushing se llevaron a cabo las siguientes determinaciones, algunas repetidas en 2 días consecutivos: cortisol plasmático a las 8h: 14,1 y 13,9mcg/dl, cortisol plasmático a las 23h: 12,3 y 10,9mcg/dl, ACTH:<5 y<5pg/ml. Frenación débil con dexametasona (0,5mg/6h 2 días): cortisol plasmático 13,7mcg/dl, cortisol libre urinario 160mcg/24h.
Las catecolaminas y metanefrinas en orina de 24h fueron normales, así como el resto de los andrógenos determinados (testosterona 0,27ng/ml, androstendiona 2,04ng/ml, DHEAS 1,3mcg/ml). Respecto a las gonadotrofinas y el estradiol, sus valores fueron: FSH 42,80mUI/ml, LH 7,21mUI/ml y estradiol 13pg/ml.
En la TC abdominal con contraste se objetivó una lesión ovalada, bien definida y homogénea, dependiente de la glándula suprarrenal izquierda, de unos 33×30mm. Las unidades Hounsfield (UH) fueron: sin contraste 23UH, tras la inyección intravenosa de contraste a los 65s 102UH y a los 10min 40UH, lo cual evidencia benignidad por producirse un lavado superior al 50%, a pesar de presentar un comportamiento de bajo contenido lipídico y ser más denso de lo normal.
La paciente fue sometida a una suprarrenalectomía laparoscópica izquierda. Se administraron 100mg de hidrocortisona intravenosa antes de la intervención quirúrgica, que discurrió sin incidentes; la evolución fue favorable, con alta hospitalaria al sexto día postoperatorio. A los 3 meses de la intervención quirúrgica las cifras de TA eran normales sin tratamiento hipotensor, había perdido 4kg y su aspecto facial pletórico mejoró ostensiblemente. A los 11 meses la paciente continúa en tratamiento sustitutivo con hidrocortisona 30mg/día, ya que en la última analítica el cortisol tras ACTH pasaba de 3,4 a 7,6mcg/dl.
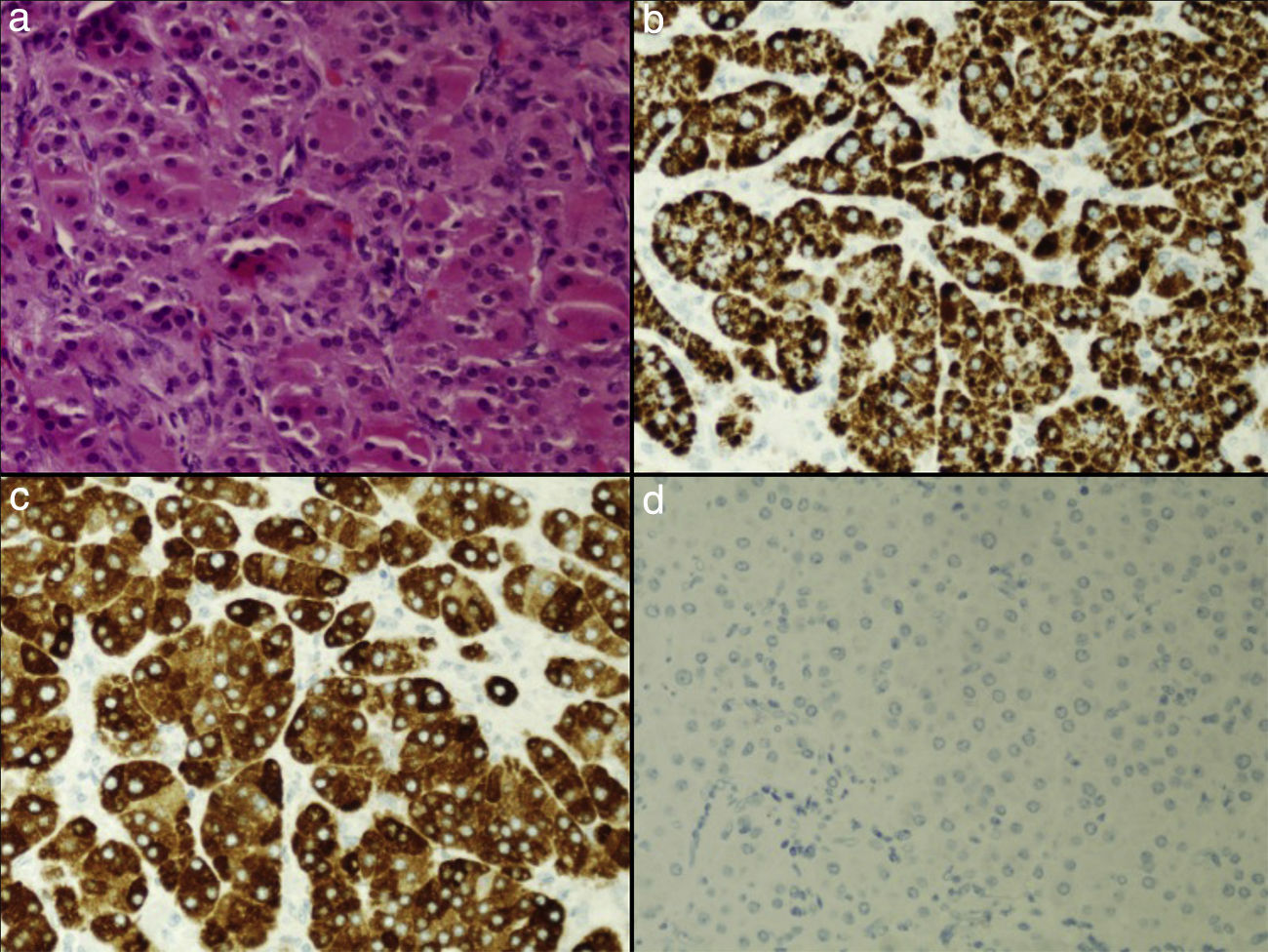
El estudio anatomopatológico de la pieza de adrenalectomía mostró, en el examen macroscópico, un tumor redondeado, bien delimitado y encapsulado, de 3cm de eje mayor y coloración marrón-mahogany al corte. Al microscopio se observaba una población tumoral con un patrón de crecimiento sólido; más del 50% de las células tumorales presentaban citoplasma eosinofílico y granular. Estas células oncocíticas tenían núcleos con pleomorfismo leve, sin encontrar figuras mitóticas. El estudio inmunohistoquímico resultó positivo para vimentina, alfa-inhibina y melan-A, positivo débil para calretinina y focalmente positivo para sinaptofisina, con ausencia de tinción para cromogranina, S-100, EMA y CD10. El índice de proliferación celular era inferior al 1% (fig. 1).
a. Proliferación de células tumorales con amplio citoplasma eosinofílico y granular, con un patrón de crecimiento difuso, en las que se observa pleomorfismo nuclear. b, c y d. El citoplasma de las células tumorales muestra una tinción fuerte y difusa con melan-A y alfa-inhibina, siendo negativo con cromogranina.
El oncocitoma es una neoplasia que se caracteriza por estar formada exclusiva o predominantemente por oncocitos, unas células grandes, con citoplasma abundante eosinofílico y granular como consecuencia de la acumulación de mitocondrias. El oncocitoma adrenocortical es extremadamente infrecuente; hasta el momento, y desde su primera descripción en 1986, han sido publicados aproximadamente 148 casos en la literatura1, en su mayoría, benignos y no funcionantes. Debido a estas características se suelen diagnosticar de forma incidental2. Se han descrito en todas las edades, sin una clara preferencia (edad media 47 años, rango 3-77 años), más frecuentemente en mujeres (2,5:1) y en la glándula suprarrenal izquierda (3,5:1). No obstante, alrededor del 20% de los oncocitomas adrenales pueden presentar cierto grado de malignidad, y en el 17% de los casos existe hiperproducción hormonal3,4.
La presencia de síndrome de Cushing asociada a un oncocitoma suprarrenal ha sido publicada en muy pocas ocasiones5–8. En nuestro caso, la paciente fue diagnosticada de síndrome de Cushing de origen adrenal, por lo que fue sometida a tratamiento quirúrgico, que es la alternativa terapéutica generalmente indicada9, con resolución del hipercorticismo. En el estudio de la pieza quirúrgica hemos aplicado la descripción de Bisceglia et al.10 para tumores suprarrenales oncocíticos, según la cual los tumores suprarrenales compuestos por más del 90% de células oncocíticas se consideran oncocíticos puros (A), aquellos que presentan entre 50-90% de células oncocíticas se consideran oncocíticos mixtos (B), y los que tienen menos del 50% de células oncocíticas se incluyen dentro de los tumores adrenocorticales convencionales con diferenciación oncocítica (C). Nuestro caso se incluye en la categoría B. El perfil inmunohistoquímico del tumor que presentamos es superponible al de las neoplasias adrenocorticales oncocíticas. Estas son típicamente positivas con vimentina, melan-A, alfa-inhibina, sinaptofisina y calretinina, presentando tinción negativa con CK20, cromogranina, S-100, EMA y CD101. Existen varias clasificaciones para determinar el comportamiento de las neoplasias adrenales oncocíticas; entre ellas, la que tiene más aceptación es la de Lin-Weiss-Bisceglia2. Este sistema propone unos criterios mayores y menores, de tal manera que la presencia de al menos uno de los 3 criterios mayores (índice mitótico mayor de 5 por 50 campos de alto aumento, mitosis atípicas e invasión venosa) indica malignidad, al menos uno de los 4 criterios menores (tamaño mayor de 10cm y/o más de 200g de peso, necrosis microscópica, invasión capsular e invasión sinusoidal) comporta un potencial maligno incierto, y la ausencia de criterios mayores y menores implica potencial benigno. En nuestro caso no se han encontrado criterios mayores o menores, por lo cual estamos ante un tumor de potencial benigno.
En el diagnóstico diferencial del síndrome de Cushing de origen suprarrenal, o incluso también del incidentaloma adrenal, ya que la mayoría de los oncocitomas son no funcionantes, debería considerarse el oncocitoma adrenal.