El síndrome de Cushing dependiente de ACTH supone aproximadamente el 80% de todos los síndromes de Cushing.
Diferenciar el origen hipofisario del ectópico sigue siendo un problema diagnóstico en determinados casos, especialmente en los carcinoides bronquiales, ya que, aproximadamente, un 50% pueden presentar supresión de las concentraciones de cortisol tras dexametasona y suelen ser de pequeño tamaño y, por lo tanto, difíciles de detectar en la radiografía de tórax.
Presentamos el caso de una paciente con síndrome de Cushing dependiente de ACTH, de difícil localización con las pruebas diagnósticas habituales.
ACTH dependent Cushing syndrome accounts for approximately 80% of all Cushing syndrome.
Distinguishing the pituitary origin from ectopic one is still a diagnosis problem in some cases, especially in bronchial carcinoids, because approximately 50% show cortisol suppresion after dexametasone and may be small and, therefore, difficult to detect in chest radiography.
We present a case of a patient with ACTH dependent Cushing syndrome of difficult localization with usual diagnosis tests.
El síndrome de Cushing (SC) es el cuadro clínico que resulta de una exposición prolongada a cantidades excesivas de glucocorticoides. La incidencia es de 5-6 casos por millón de habitantes1. La causa más común es la administración exógena de corticoides. En cuanto a la producción endógena, la causa más frecuente es la enfermedad de Cushing (EC) (producción excesiva de corticotropina [ACTH] de la hipófisis), seguida de la producción ectópica de ACTH. El SC dependiente de ACTH supone aproximadamente el 80% de todos los SC2,3. Las causas de SC independiente de ACTH (el 20% de todos los SC) son el adenoma y el carcinoma adrenal y la hiperplasia micronodular y macronodular.
Es importante diferenciar el SC del seudosíndrome de Cushing, que puede aparecer con obesidad, alcoholismo o depresión, donde se detectan determinados rasgos del SC y aumento de producción de corticoides.
CASO CLÍNICOMujer de 35 años, sin antecedentes familiares ni personales de interés, enviada para estudio por aumento de peso y otros cambios físicos. La paciente refería una historia de 6 meses de evolución de astenia, edemas en manos y tobillos, alteraciones menstruales, aparición de hirsutismo y acné, ganancia ponderal involuntaria de 6 kg, debilidad proximal con imposibilidad para levantarse de una silla sin la ayuda de los brazos e hipertensión arterial diagnosticada 1 mes antes de la consulta, tratada con atenolol (50 mg al día). No presentaba cefalea ni alteraciones visuales. En la exploración física, mostraba un fenotipo con obesidad cushingoide, con índice de masa corporal (IMC) de 28,32, perímetro de cintura de 95 cm y presión arterial (PA) de 152/101 mmHg.
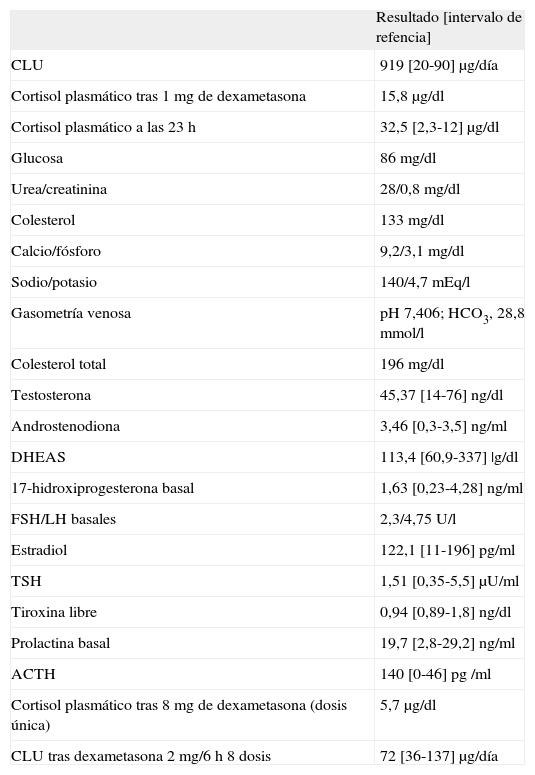
Se realizó un estudio analítico general, gasometría venosa y determinaciones de cortisol libre urinario (CLU), cortisol plasmático tras supresión con 1 mg de dexametasona, cortisol plasmático a las 23 h y otras determinaciones hormonales (tabla 1). Con estos resultados se confirmó la sospecha clínica de hipercortisolismo.
Resultados analíticos en el diagnóstico
| Resultado [intervalo de refencia] | |
| CLU | 919 [20-90] μg/día |
| Cortisol plasmático tras 1 mg de dexametasona | 15,8 μg/dl |
| Cortisol plasmático a las 23 h | 32,5 [2,3-12] μg/dl |
| Glucosa | 86 mg/dl |
| Urea/creatinina | 28/0,8 mg/dl |
| Colesterol | 133 mg/dl |
| Calcio/fósforo | 9,2/3,1 mg/dl |
| Sodio/potasio | 140/4,7 mEq/l |
| Gasometría venosa | pH 7,406; HCO3, 28,8 mmol/l |
| Colesterol total | 196 mg/dl |
| Testosterona | 45,37 [14-76] ng/dl |
| Androstenodiona | 3,46 [0,3-3,5] ng/ml |
| DHEAS | 113,4 [60,9-337] |g/dl |
| 17-hidroxiprogesterona basal | 1,63 [0,23-4,28] ng/ml |
| FSH/LH basales | 2,3/4,75 U/l |
| Estradiol | 122,1 [11-196] pg/ml |
| TSH | 1,51 [0,35-5,5] μU/ml |
| Tiroxina libre | 0,94 [0,89-1,8] ng/dl |
| Prolactina basal | 19,7 [2,8-29,2] ng/ml |
| ACTH | 140 [0-46] pg /ml |
| Cortisol plasmático tras 8 mg de dexametasona (dosis única) | 5,7 μg/dl |
| CLU tras dexametasona 2 mg/6 h 8 dosis | 72 [36-137] μg/día |
ACTH: corticotropina; CLU: cortisol libre urinario; DHEAS: deshidroepiandrosterona; FSH: folitropina; HCO3: bicarbonato; LH: lutropina; TSH: tirotropina.
Para el estudio de localización se midió la ACTH plasmática y, posteriormente, el cortisol en plasma tras supresión con 8 mg de dexametasona en dosis única y con cortisol libre urinario tras supresión con dexametasona 2 mg/6 h durante 48 h, con una supresión del 83 y el 85%, respectivamente, respecto al basal (tabla 1). Con estos porcentajes de supresión y la mayor probabilidad pretest del origen hipofisario se diagnosticó de probable EC.
La resonancia magnética (RM) hipofisaria describía una imagen puntiforme hipocaptante entre la adenohipófisis y la neurohipófisis de 1 mm, de dudosa significación patológica.
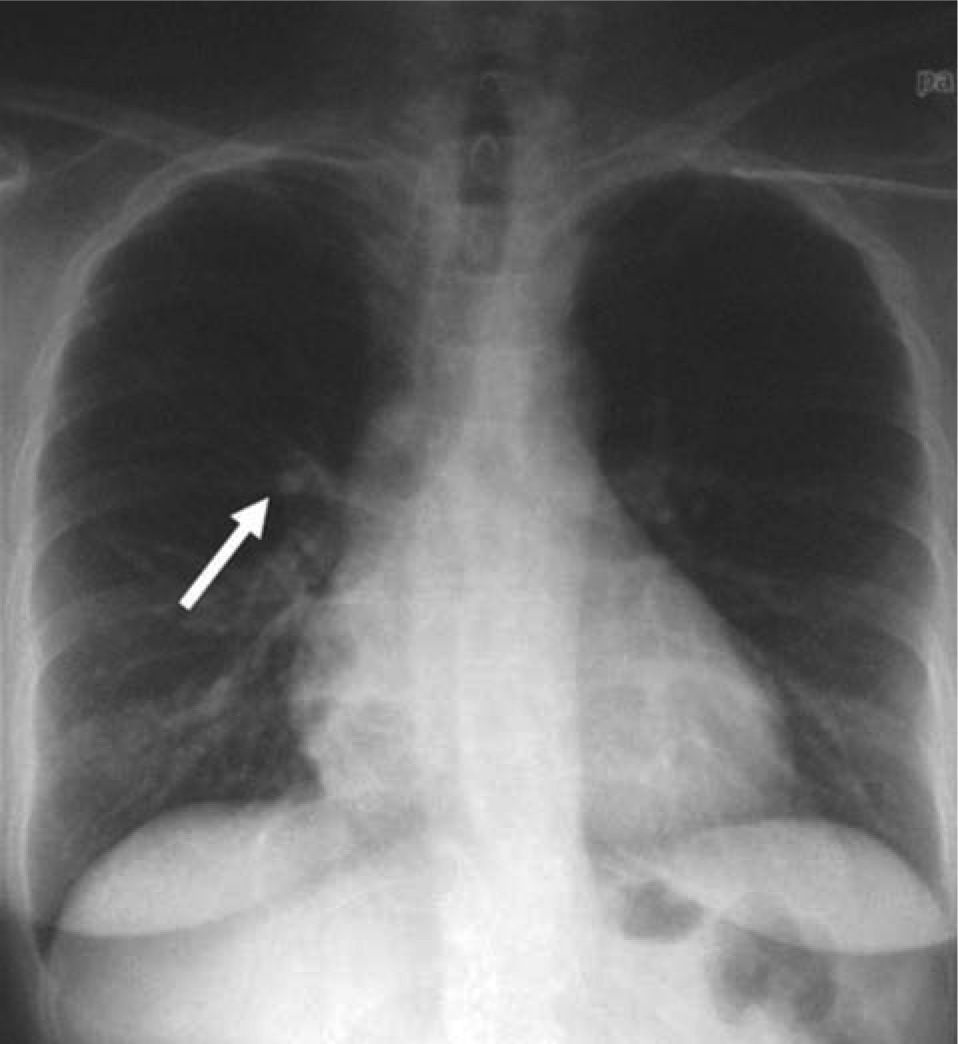
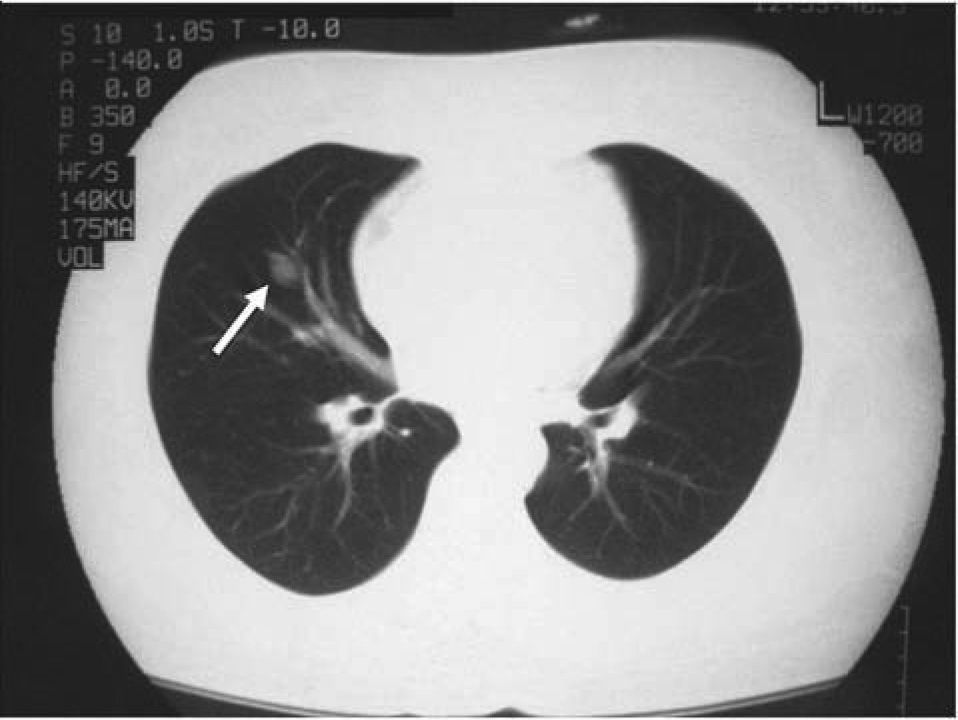
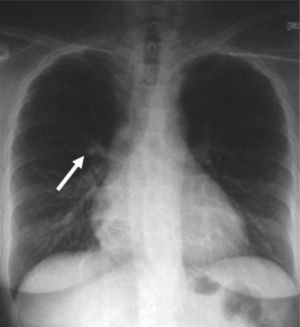
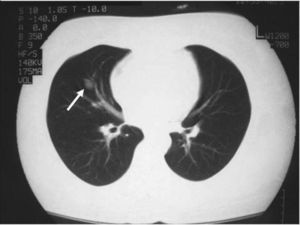
La paciente fue intervenida quirúrgicamente mediante cirugía transesfenoidal. El informe de anatomía patológica de la pieza fue de hipófisis normal. En la primera revisión tras la cirugía persistía la clínica y la bioquímica de hipercortisolismo. El informe de la radiografía de tórax de la consulta preanestésica describía una imagen de aspecto seudonodular en probable relación con falsa imagen secundaria a superposición de estructuras óseas y vasculares. En la radiografía de control persistía la imagen nodular de menos de 1 cm (fig. 1), que se confirma en la tomografía computarizada (TC) torácica, y se describía como un nódulo sólido de 11,6 × 16 mm en el lóbulo medio (fig. 2).
La nueva situación clínica indicaba SC por producción ectópica de ACTH de probable origen bronquial y se solicitó gammagrafía de receptores de la somatostatina (OctreoScan), que resultó negativo, y cromogranina A en suero con un resultado de 318,3 ng/ml [19,4-98].
El servicio de neumología realizó una broncoscopia con biopsia transbronquial con el resultado de tumor carcinoide e inmunohistoquímica (IHQ) con fenotipo neuroendocrino.
La paciente fue remitida al servicio de cirugía torácica. Se realizó toracotomía y lobectomía media reglada. El informe de anatomía patológica de la pieza quirúrgica correspondía a un carcinoide típico que respetaba los bordes quirúrgicos de resección. En la IHQ se observaba una neoformación con fenotipo neuroendocrino, congruente con tumor carcinoide pulmonar productor de calcitonina (escasa) bombesina y péptido intestinal vasoactivo (VIP) en células aisladas. La IHQ para ACTH fue negativa en el estudio realizado.
Tras la cirugía torácica la paciente presentó hipocortisolismo posquirúrgico (tabla 2) y una mejora evidente del fenotipo, con importante pérdida de peso y normalización de la PA sin tratamiento antihipertensivo. Precisó hidrocortisona a dosis decrecientes durante 6 semanas.
DISCUSIÓNEl diagnóstico del SC se basa en tres pasos: a) comprobar el hipercortisolismo, b) diferenciar si es dependiente de ACTH o independiente y, en el caso de ser dependiente de ACTH, y c) diferenciar la producción hipofisaria de la ectópica.
Para comprobar el hipercortisolismo se dispone de diferentes técnicas cuyas sensibilidad y especificidad dependen del punto de corte y la técnica utilizada, de entre ellas, las más utilizadas son el CLU (sensibilidad, 73,2-100%; especificidad, 85,3-100%4,5), la supresión tras 1 mg de dexametasona a las 23 h (sensibilidad, 89,2-100%; especificidad, 90,9-100%4,5) y el cortisol plasmático o salival a las 0 h (sensibilidad, 91-97,1%; especificidad, 96,4-97,2%, y sensibilidad, 92,7-100%; especificidad, 93,1-100%, respectivamente4,6-8). Otros factores que determinan la elección de la técnica son los falsos positivos y negativos, la facilidad de la obtención de la muestra (claramente a favor del cortisol salival y en contra del CLU) y la disponibilidad de las pruebas en cada centro. Los falsos positivos ocurren por obesidad, alcoholismo, depresión, ovario poliquístico, ingesta abundante de agua (diuresis mayor de 3 l/día), en el caso del CLU, y por alcoholismo, fármacos que inducen la enzima del citocromo P450 3A4 (CYP3A4), como la fenitoína, el fenobarbital, la carbamazepina, la rifampicina, la etosuximida, la primidona o la naloxona en el caso de la supresión con 1 mg de dexametasona. Los falsos negativos pueden ocurrir por enfermedad hepática grave o por ketoconazol. Para diferenciar si es dependiente o independiente de ACTH la determinación de ACTH plasmática tiene muy buenas sensibilidad (99,89%) y especificidad (97%)9,10, aunque puede ser útil repetir la medición si está en 5-15 pg/ml.
Las técnicas que se utilizan para diferenciar la etiología en los dependientes de ACTH son, fundamentalmente, la supresión con dexametasona: 8 mg en dosis única o 2 mg/6 h 8 dosis (sensibilidad, 77-92%; especificidad, 57-100%, y sensibilidad, 65-100%; especificidad, 60-100%, respectivamente11), el cateterismo de senos petrosos (sensibilidad, 92,2%; especificidad, 90%12), el estímulo con corticoliberina (CRH) (para ACTH, sensibilidad, 70-86%; especificidad, 57-90%, y para cortisol, sensibilidad, 61-83%; especificidad, 70-78%13,14) y desmopresina (sensibilidad, 62-95%; especificidad, 100%15,16). En los casos de producción ectópica de ACTH, en general no se consigue suprimir la producción con 8 mg o 2 mg/6 h 8 dosis. El punto de corte establecido difiere de unos estudios a otros y, según el punto de corte, se consiguen diferentes sensibilidad y especificidad; supresiones mayores del 50-69% del cortisol plasmático respecto al basal para 8 mg en dosis única y supresiones mayores del 80-90% del cortisol libre urinario respecto al basal para 2 mg/6 h 8 dosis son indicativos de enfermedad de Cushing.
La mayoría de los pacientes con enfermedad de Cushing responden a la infusión intravenosa de CRH y vasopresina, en que aumentan la ACTH y el cortisol tras su administración. Hay múltiples puntos de corte según los estudios y se escapan del objetivo de este artículo.
El cateterismo de senos petrosos documenta de forma directa un gradiente de ACTH central-periférico. Un gradiente central-periférico ≥ 2 antes de administrar CRH o uno ≥ 3 después de CRH son diagnósticos de enfermedad de Cushing.
Las pruebas de imagen en el estudio del SC incluyen: la RM hipofisaria sólo en el caso de sospecha de EC, ya que tiene sensibilidad (70-86%) y especificidad limitadas (87%). La TC y la RM de tórax y abdomen sólo tienen utilidad si se sospecha que es ectópico. El OctreoScan detecta lesiones milimétricas, aunque la expresión de receptores de somatostatina no es frecuente.
Diferenciar si la producción de ACTH es hipofisaria o ectópica es sencillo en los casos en que claramente no hay supresión con dexametasona: 8 mg o 2 mg/6 h 8 dosis, hay alteraciones hidroelectrolíticas, las concentraciones plasmáticas de ACTH son muy elevadas o la clínica es de desarrollo más brusco17.
Las causas de síndrome de Cushing dependiente de ACTH son: la enfermedad de Cushing (producción hipofisaria, que supone el 85% de todos los SC dependientes de ACTH) y la producción ectópica de ACTH y CRH (en general tumores carcinoides que surgen de células neuroendocrinas bronquiales, pancreáticas o tímicas y suponen el 15% de todos los SC dependientes de ACTH. La producción de CRH es excepcional).
Los carcinoides bronquiales suponen el 1-2% de todas las neoplasias pulmonares y son la causa más frecuente de producción ectópica de ACTH. Los tumores carcinoides bronquiales suponen un problema diagnóstico en el SC porque, además de que aproximadamente en un 50% se suprime la producción de cortisol con dexametasona (aunque no hay series grandes en la literatura), la mayoría de los que producen SC son pequeños (menores de 2 cm) y, por lo tanto, difíciles de detectar en la radiografía de tórax.
La falta de positividad para ACTH en la IHQ en nuestro caso podría interpretarse como la producción de una sustancia ACTH-like, aunque lo más probable es que se trate de un falso negativo. La producción ectópica de CRH, dada su baja frecuencia, es una causa poco probable.