El síndrome de Cushing se debe a una hipersecreción de cortisol, asociado a una mayor mortalidad y una elevada morbilidad, que no es totalmente reversible a pesar del control bioquímico, presentando un conjunto de manifestaciones sistémicas similares a las que aparecen en el envejecimiento. El estrés crónico, que también conlleva una hiperestimulación del eje adrenal, se ha relacionado con el acortamiento telomérico acelerado, el daño oxidativo y el envejecimiento celular. A pesar de que el envejecimiento prematuro de los pacientes con síndrome de Cushing podría relacionarse con factores ambientales, no puede descartarse que la exposición crónica al hipercortisolismo determine un acortamiento telomérico y, por lo tanto, envejecimiento. En esta revisión se repasan las evidencias existentes que podrían relacionar el síndrome de Cushing y el envejecimiento celular prematuro.
Cushing's syndrome is due to excess cortisol secretion and is associated to increased mortality and severe morbidity that are not fully reversible despite biochemical control. The syndrome consists of a set of systemic manifestations similar to those found in aging. Chronic stress, which also causes hyperstimulation of the hypothalamic-pituitary-adrenal axis, has been related to accelerated telomere shortening, oxidative damage, and cell aging. Although premature aging in patients with Cushing's syndrome could be related to environmental factors, the possibility that chronic exposure to hypercortisolism causes telomere shortening, and thus premature aging, cannot be ruled out. This review discusses the available evidence supporting a link between Cushing's syndrome and cell aging.
El síndrome de Cushing es una enfermedad endocrina rara causada por una hipersecreción de cortisol, ya sea de origen exógeno (iatrogénico) o endógeno, debido a un tumor hipofisario productor de ACTH (enfermedad de Cushing) y, menos frecuentemente, a un tumor adrenal productor de cortisol o a un tumor que determina secreción ectópica de ACTH. La incidencia anual del síndrome de Cushing endógeno se estima que es alrededor de 2/106 habitantes. Se asocia a una importante morbilidad y al aumento de la mortalidad.
Las manifestaciones sistémicas que afectan mayormente a los pacientes con síndrome de Cushing son aquellas relacionadas con enfermedades cardiovasculares o bien con otros problemas asociados al propio envejecimiento1. Así, fenotípicamente, estos pacientes suelen presentar obesidad central (cara de luna llena y atrofia de extremidades), aumento de la masa grasa y reducción de la masa ósea y magra, debilidad muscular, aumento de la susceptibilidad a las infecciones, fragilidad capilar, hematomas, típicas estrías rojovinosas, hirsutismo, hipogonadismo, disminución de la líbido y características del síndrome metabólico (hipertensión, diabetes mellitus e insulinoresistencia, dislipidemia, enfermedad vascular, aterosclerosis, etc.) con aumento del riesgo cardiovascular, así como depresión, atrofia cerebral y alteración de la calidad de vida relacionada con la salud1,2.
A pesar de que el hipercortisolismo se puede curar después de la cirugía (se consiguen controlar los niveles de cortisol hasta en el 90% de los sujetos operados) y con medicación, evidencias recientes muestran que estos pacientes permanecen con un elevado riesgo de padecer complicaciones cardiovasculares, osteopenia y alteraciones funcionales y estructurales cerebrales acompañadas de una baja calidad de vida relacionada con la salud3.
Por otro lado, el enjevecimiento biológico se caracteriza por una pérdida progresiva y predecible de las funciones tisulares y celulares coordinadas, conduciendo a un riesgo creciente de vulnerabilidad y enfermedad. Inicialmente este deterioro es objetivado por la pérdida de la capacidad y la habilidad para mantener la homeostasis en situaciones de estrés y, en fases más avanzadas, incluso en situaciones de reposo4. Este proceso es específico de cada especie y los cambios producidos se manifiestan en múltiples órganos y sistemas, aunque los mecanismos que contribuyen al envejecimiento no son del todo conocidos.
Aunque es probable que el exceso de hipercortisolismo esté relacionado con estos procesos, los mecanismos exactos por los cuales esto pasa no están claros. En esta revisión se intentarán exponer las hipótesis y los mecanismos propuestos hasta la actualidad que relacionan el hipercortisolismo y el envejecimiento.
¿Reversibilidad de la morbilidad específica tras la resolución del hipercortisolismo?Inicialmente se pensaba que la resolución del hipercortisolismo iba seguida de una normalización de la morbilidad causada por el mismo, pero en la última década se ha visto que esta normalización de la morbilidad no ocurre a pesar de resolverse el hipercortisolismo. El riesgo cardiovascular persiste elevado en el síndrome de Cushing bioquímicamente curado incluso 5 años después de la curación5. La recuperación completa de la densidad mineral ósea (DMO) es más controvertida. Algunos estudios muestran mejoría, incluso normalización6,7, pero otros no8,9. Se ha observado que tanto la duración del hipercortisolismo endógeno como la duración del tratamiento sustitutivo con glucocorticoides exógenos después de un tratamiento quirúrgico eficaz del síndrome de Cushing se correlacionan negativamente con la DMO en mujeres 11 años después de la remisión del Cushing cuando se comparan con controles10. Se ha demostrado una persistente acumulación de grasa central en pacientes curados con un perfil desfavorable de adipoquinas (disminución de los niveles de adiponectina, elevación de los niveles plasmáticos de sTNF-R1 e interleuquina 6), dando lugar a un estado de inflamación de bajo grado11. Este «estado inflamatorio» puede determinar daño vascular, contribuyendo a la aterosclerosis y a la enfermedad cardiovascular en estos pacientes años después de la remisión. En el síndrome de Cushing se ha observado un incremento del estrés oxidativo y de la disfunción endotelial12. Se han demostrando niveles altos de aniones superóxido, de ciclooxigenasa-1 (COX-1) y de la sintetasa del óxido nítrico endotelial en los microvasos causantes de la disfunción endotelial y del aumento de la resistencia vascular periférica13. Asimismo, recientemente se ha demostrado que los glucocorticoides pueden activar de forma directa la vía de señalización de los receptores de los mineralocorticoides, independientemente de los niveles circulantes de aldosterona14, sugiriendo que pueden contribuir a este daño vascular y endotelial objetivado en estos pacientes a través de las propiedades profibróticas de la aldosterona15.
Además, tal y como se ha mencionado, el hipercortisolismo afecta al comportamiento, al estado de ánimo, a la actividad neuronal, a la memoria y a otros procesos del sistema nervioso central1,2. En estudios con RM de 3 Teslas se ha objetivado una mayor atrofia cerebral en comparación con los controles normales de la misma edad que no parece totalmente reversible a pesar de la normalización del cortisol. La psicopatología (sobretodo depresión atípica), muy prevalente en la enfermedad activa, mejora el primer año después del tratamiento pero a menudo persisten síntomas residuales16. Los niveles altos de cortisol se han asociado a alteraciones en las funciones de algunos neurotransmisores como una disminución de la síntesis cerebral de serotonina, un aumento de la actividad noradrenérgica y niveles bajos de ácido 5-hidroxiindolacético en el líquido cefaloraquídeo, todos ellos relacionados con la patogenia de la depresión17. La cognición18 y la calidad de vida relacionada con la salud tampoco parecen normalizarse después de la curación del hipercortisolismo, sugiriendo que todos estos cambios no son completamente reversibles19,20. Varios estudios reflejan que la hipersecreción de cortisol tiene un efecto envejecedor en el comportamiento cognitivo21,22 pero los mecanismos por los cuales los glucocortidoides afectan al sistema cognitivo no están claros. Se formulan varias hipótesis entre las que cabe citar las alteraciones hipocampales objetivadas en ratas y la localización anatómica de gran cantidad de receptores de glucocorticoides en el cerebro, sobretodo en el hipocampo, la amígdala y los lóbulos prefrontales, que favorecerían cambios morfológicos en estas zonas como ocurre en el envejecimiento23, o una reducción importante del metabolismo de la glucosa cerebral (visible por atrofia y muerte neuronal propias del envejecimiento). Estas alteraciones de la función cognitiva son evidentes incluso después de eliminar el efecto causado por la depresión, muy común en el hipercortisolismo y que puede interferir de forma clara en la función cognitiva. El motivo por el cual el hipercortisolismo crónico produce estas consecuencias a largo plazo a pesar de su normalización bioquímica no está claro pero sugiere un efecto neurotóxico poco reversible.
Estrés crónico e hipercortisolismoEl estrés crónico determina una hiperestimulación del eje hipotalámico-hipofisario-adrenal e hipercortisolismo endógeno. Además, se sabe que más de la mitad de los pacientes con depresión crónica tienen hiperactividad del eje adrenal, y representan otro modelo de hipercortisolismo endógeno24.
El estrés crónico inferido por el córtex cerebral determina asimismo, a nivel hipotalámico, la secreción de corticorelina (CRH) con la consecuente activación del eje hipotalámico-hipofisario adrenal y, por lo tanto, la liberación de cortisol en la sangre. Se han objetivado niveles altos de CRH en el líquido cefaloraquídeo y de su RNAm en las regiones límbicas cerebrales de pacientes con depresión mayor crónica25,26. Asimismo, se ha observado que a menudo la remisión clínica del trastorno depresivo mayor va acompañada de una reversibilidad en las anormalidades del cortisol. En cambio, la sintomatología depresiva puede persistir a pesar de la resolución del síndrome de Cushing27. De forma contraria, también se ha sugerido que las elevaciones crónicas de cortisol, especialmente nocturnas (típicas del hipercortisolismo endógeno), podrían tener un papel importante en la patogenia de la depresión y en el estrés crónico28. Por otro lado, el papel de la 11-beta-hidroxiesteroide deshidrogenasa (11b-HSD), enzima reguladora del metabolismo de los glucocorticoides a nivel intracelular, ha sido sugerido como uno de los posibles mecanismos por los cuales el hipercortisolismo podría producir efectos deletéreos en el sistema nervioso y en el comportamiento. Existen 2 isoformas distintas de 11b-HSD: la tipo 1, que aumentaría los niveles intracelulares de cortisol (en el hígado, el tejido graso y el cerebro), y la tipo 2, que inactivaría los glucocorticoides (de cortisol a una molécula inactiva de cortisona)29. En las células del hipocampo únicamente se expresan la 11b-HSD tipo 1, aumentando por tanto los niveles de cortisol. Debido a que la 11-HDS tipo 2 no se expresa en el hipocampo, el cortisol se une a los receptores de mineralcorticoides (situados en el hipocampo y en las regiones límbicas) con una elevada afinidad (10 veces superior a la de los receptores de glucocorticoides), pudiendo tener un efecto importante en la patogenia de la depresión, en el estrés crónico30 y también contribuir en la patogenesis del síndrome metabólico (por el aumento de la acción de la isoforma tipo 1 observado en el hígado y el tejido graso)31.
Asimismo, el estrés crónico se relaciona con un bajo índice de salud, incluyendo un aumento de los factores de riesgo cardiovascular y una alteración de la función inmunitaria, similar a lo que ocurre en los pacientes con síndrome de Cushing; sin embargo los mecanismos exactos por los cuales esto pasa están aún por descubrir.
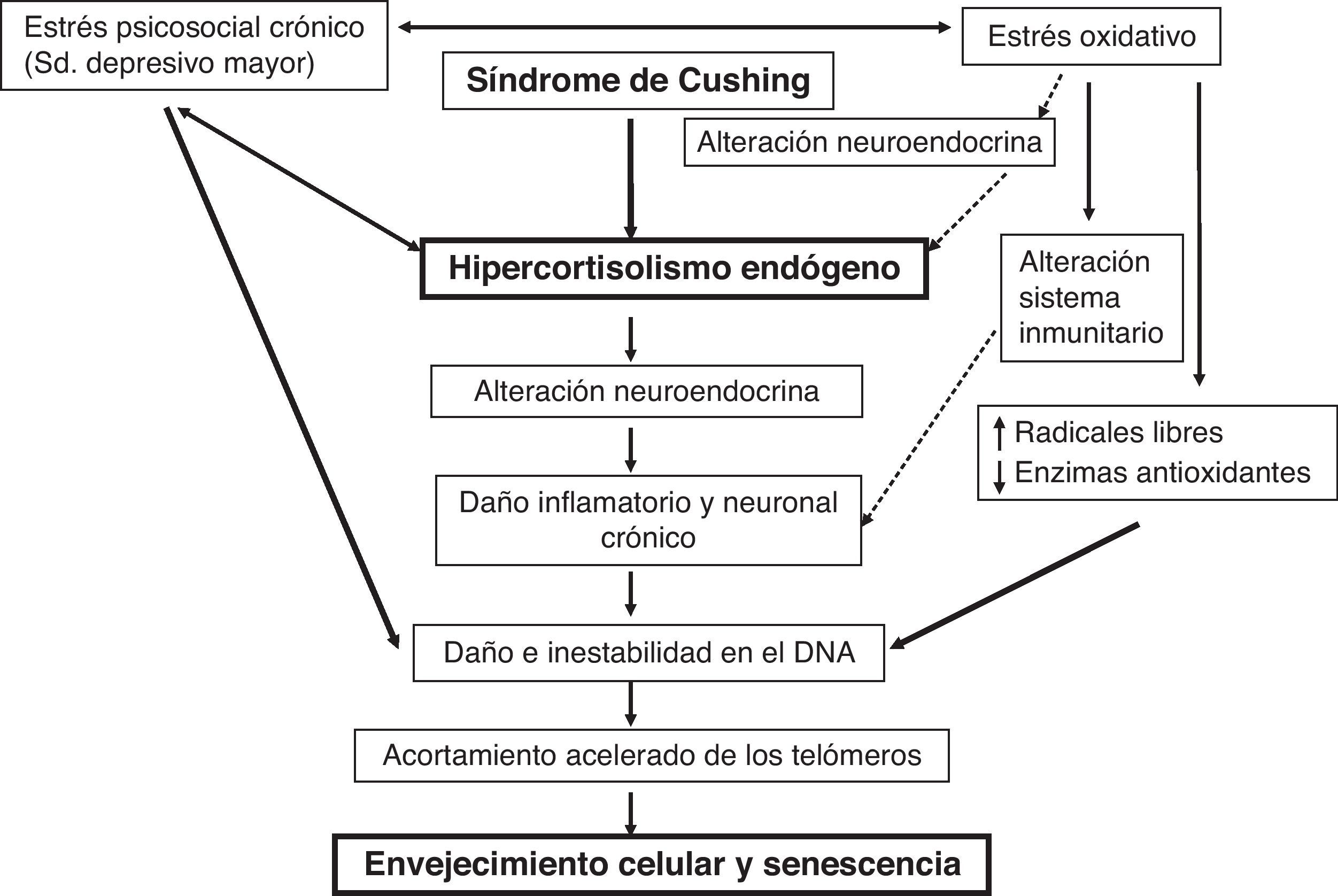
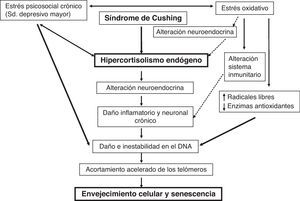
Parece ser que el estrés crónico podría afectar a la salud y al envejecimiento celular por distintos mecanismos no excluyentes entre sí y aún no bien definidos. Este produciría una alteración en la función inmunológica a través del estrés oxidativo (respuesta neuroendocrina con un hipercortisolismo secundario al estrés que aumentaría el daño neuronal y disminuiría las enzimas antioxidantes) y, finalmente, provocaría una alteración en la actividad de la telomerasa (disminución de su función) (fig. 1)32.
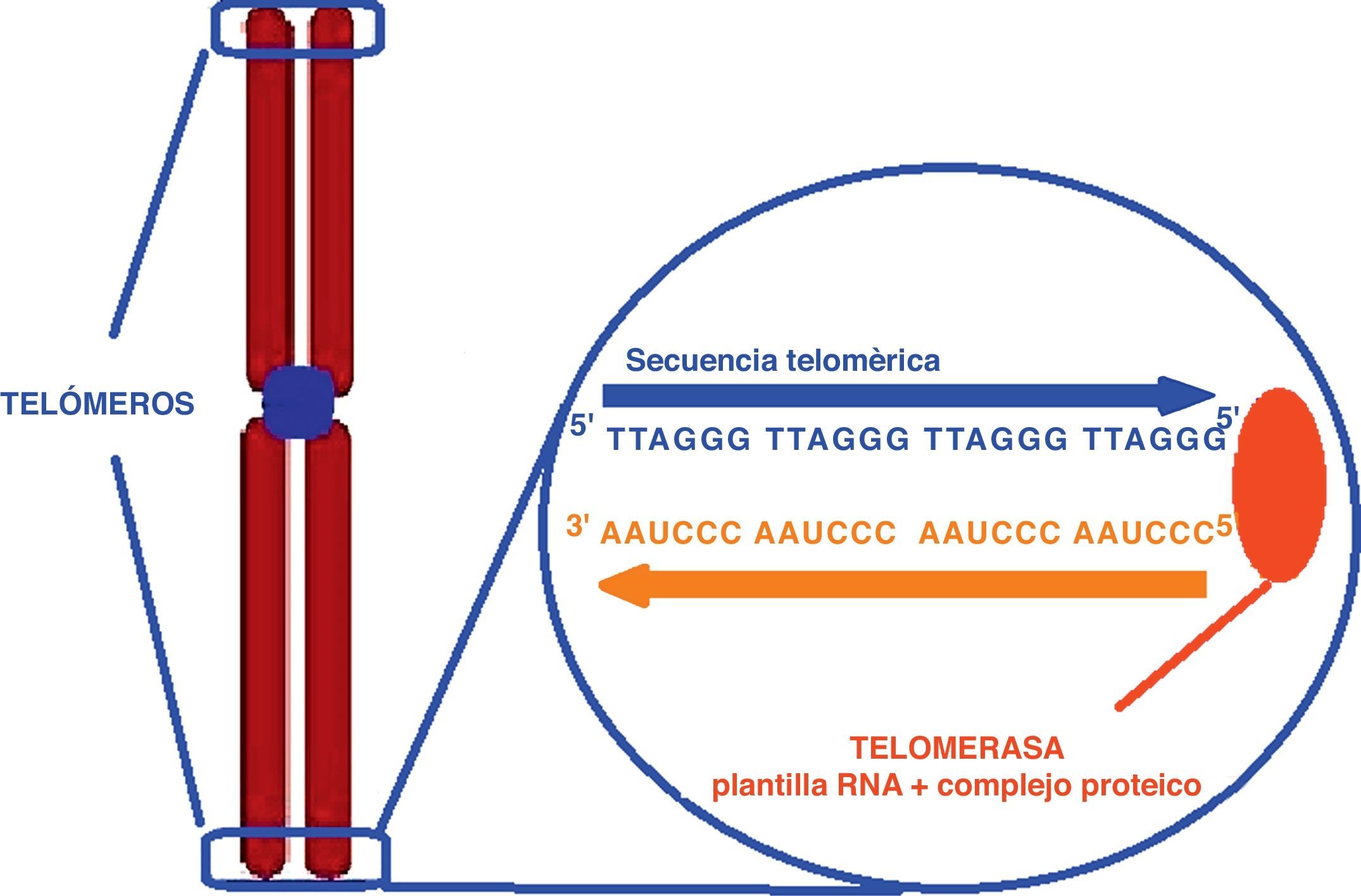
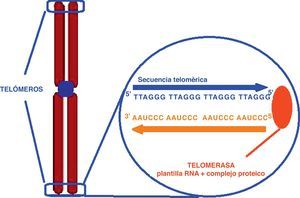
Actividad telomérica y envejecimiento celularEl daño oxidativo celular y el severo estrés psicosocial se han relacionado con el acortamiento telomérico. Por lo tanto, el estrés crónico asociado a las alteraciones del estado de ánimo podría contribuir al exceso de vulnerabilidad a enfermedades propias del envejecimiento, tales como las enfermedades cardiovasculares (a través de un envejecimiento acelerado del organismo). Actualmente, una forma ampliamente aceptada de evaluar el envejecimiento celular es a través de la medición de la longitud telomérica33. Los telómeros son secuencias de DNA no codificante que en el caso de los humanos y en otros vertebrados están formados por repeticiones en tándem de una secuencia rica en guaninas TTAGGG (5’→3’). Están situados en los extremos de los cromosomas formando una estructura que protege a los mismos de la erosión que tiene lugar de forma natural durante la replicación de las moléculas lineales de DNA en cada división de la célula eucariota (fig. 2)34. Sin telómeros el material genético podría perderse cada vez que la célula se dividiese35. Cuando llegan a una longitud críticamente corta se paran las divisiones celulares, las células entran en un proceso de senectud y finalmente mueren. Para evitar este desgaste telomérico las células germinales, las células hematopoyéticas y especialmente las células madre adultas producen telomerasa (niveles elevados en el embrión que van disminuyendo a partir del nacimiento), una enzima que cataliza la síntesis de DNA para mantener la longitud telomérica y evitar así la senescencia y la apoptosis celular35,36. En cambio, la actividad de la telomerasa es detectada a niveles muy bajos y no uniforme en las células somáticas y en el resto de los tejidos.
Los telómeros pueden acortarse con la exposición acumulada al estrés oxidativo, a los estresantes genotóxicos, a los estímulos nocivos y tras el estrés psicosocial crónico, aunque este acortamiento telomérico se ha visto que no es uniforme para todos los tipos celulares y tejidos37.
La disfunción del sistema telomérico conlleva importantes consecuencias clínicas. Las enfermedades causadas por la alteración y las anormalidades del sistema telomérico representan un amplio espectro de manifestaciones clínicas: anemia aplástica adquirida (mutaciones en el complejo de la telomerasa), disqueratosis congénita (mutación en la disquerina, una proteína esencial para el funcionamiento telomérico), fibrosis pulmonar idiopática (el 15% tienen mutaciones en el complejo de la telomerasa), etc35.
Asimismo, el acortamiento telomérico se ha relacionado con procesos de envejecimiento prematuro (p. ej.: aterosclerosis, enfermedad de Alzheimer, osteopenia o diabetes mellitus tipo 2), aumento del riesgo de enfermedad cardiovascular, de inflamación y de transformación maligna (p. ej.: cáncer colorectal, enfermedad inflamatoria intestinal, esófago de Barret, etc.), mayor mortalidad en pacientes con enfermedad coronaria, infarto de miocardio prematuro e incluso se ha relacionado con el engrosamiento de la íntima carotídea y la mortalidad prematura38,39.
Es probable que el papel de las alteraciones de la biología telomérica en la enfermedad humana esté actualmente infraestimado, quedando aún mucho camino por investigar.
Estrés y envejecimiento: ¿se relacionan con los telómeros?El trastorno depresivo mayor se asocia a una elevada morbimortalidad con un aumento de enfermedades relacionadas con el envejecimiento (cardiovasculares, cáncer, etc.). El estrés causado por estas enfermedades se considera una amenaza para la homeostasis corporal, generando una respuesta crónica al estrés (para recuperar el equilibrio) que puede inducir adaptaciones y cambios que determinen daño biológico a largo plazo.
La hipótesis de que el estrés tiene impacto en la salud modulando la tasa de envejecimiento celular también está respaldada por la evidencia que asocia el estrés psicológico al elevado estrés oxidativo (activación autonómica y respuesta neuroendocrina al estrés), la disminución de la actividad de la telomerasa y el acortamiento de la longitud telomérica, todos ellos conocidos como determinantes de la senescencia y la longevidad celular40. Estos efectos son evidentes a mayor duración y exposición al estrés. Se ha confirmado que el estrés psicosocial crónico afecta a la longitud telomérica; se analizaron pacientes con severo estrés crónico (madres cuidadoras de hijos crónicamente enfermos) y se observó que una mayor duración del estrés, así como una mayor percepción de los niveles de estrés se correlacionaban de forma significativa con un acortamiento de la longitud telomérica y con una menor actividad de la telomerasa en comparación con los controles apareados por edad y sexo, representando aproximadamente el equivalente a unos 10 años de envejecimiento biológico acelerado41. En pacientes con depresión mayor crónica (que frecuentemente presentan hipercortisolismo) se han encontrado resultados similares. En otro estudio de 647 mujeres con hermanas afectas de cáncer de mama se evaluó la relación entre la longitud telomérica (marcador de envejecimiento celular), el estrés percibido por estas mujeres y el nivel de hormonas de estrés (cortisol y metanefrinas) en la orina. Se objetivó una tendencia a un mayor acortamiento de los telómeros en las mujeres con un mayor índice de estrés percibido, aunque estas diferencias únicamente fueron significativas en mujeres mayores de 55 años, mujeres con un importante estrés psicosocial reciente y con mayores niveles de catecolaminas en la orina. Se encontró una tendencia a un mayor acortamiento telomérico con mayores niveles de cortisoluria sin alcanzar la significación estadística42. El impacto biológico de estos resultados en cuanto a la longitud telomérica no está claro dado el amplio rango de variación en la longitud telomérica de la población general, lo que dificulta su interpretación. Todavía quedan muchas incógnitas por aclarar en la relación entre la longitud telomérica, el envejecimiento y el riesgo de enfermedad.
Se ha visto que hay personas que tienen una resistencia fisiológica al estrés oxidativo, muy probablemente debido a variantes genéticas aún no bien conocidas, lo que aumentaría su esperanza de vida. Por otro lado, también se postula que esta resistencia fisiológica al estrés oxidativo (que cursaría con menor hipercortisolismo, menor alteración del sistema telomérico e inmunológico, etc.) esté relacionada con la resistencia psicológica al estrés, en cuyo caso no sería tan evidente que el acortamiento telomérico pudiera ser una secuela de una exposición prolongada a un estrés psicológico40.
A pesar de la cantidad de trabajos que relacionan el estrés oxidativo, el estrés psicosocial crónico y el hipercortisolismo con la longitud mediana de los telómeros, recientemente algunos autores consideran que quizás el porcentaje de telómeros cortos podría ser un marcador más sensible de envejecimiento celular que la longitud media telomérica en situaciones de estrés agudo41. Se basan en el hecho de que el acortamiento de la longitud telomérica no es uniforme para todas las células y tejidos e incluso para los cromosomas de una misma célula. Mediante una técnica recientemente introducida (Universal STELA: Single Telomere Length Assay) se ha observado en cultivos celulares in vitro que la medición del porcentaje de telómeros cortos se correlaciona de forma positiva con marcadores bien conocidos de senescencia celular como la betagalactosidasa pero no siendo así con la longitud media de los telómeros42. Por lo tanto, parece que este nuevo método aporta más información, ayudando a conocer mejor la biología telomérica y su papel en el envejecimiento y el cáncer.
Hipercortisolismo y acortamiento de telómerosAlgunos estudios demuestran que la exposición a niveles altos de cortisol se asocia a una reducción significativa de la actividad de la telomerasa de los linfocitos T36, pudiendo ser uno de los mecanismos por los cuales los pacientes con hiperestimulación del eje adrenal por estrés crónico, o bien por síndrome de Cushing, tienen alterada la inmunidad celular y, por tanto, mayor susceptibilidad a padecer infecciones.
Poco se sabe sobre los mecanismos biológicos del exceso de morbimortalidad asociados a las alteraciones del estado de ánimo, pero en la depresión crónica mayor existen evidencias que asocian las alteraciones de los sistemas biológicos relacionados con el estrés (sistema neuroendocrino, sistema telomérico, etc.) como uno de los mecanismos que contribuyen a su exceso de morbimortalidad.
Como ocurre en el síndrome de Cushing endógeno, el estrés crónico también determina una hiperestimulación del eje hipotalámico-hipofisario-adrenal e hipercortisolismo; más de la mitad de los pacientes crónicamente deprimidos con estrés crónico importante se sabe que tienen hiperactividad del eje adrenal y representan un modelo de hipercortisolismo endógeno35,43,44.
Por lo tanto, teniendo en cuenta que las alteraciones del estado de ánimo (trastornos depresivos) se asocian a una elevada morbilidad, una mayor mortalidad y un envejecimiento celular, se podría hipotetizar que el acortamiento telomérico podría estar detrás tanto de la morbilidad aumentada como del envejecimiento prematuro, paradigmas del hipercortisolismo endógeno45. Es interesante el hecho de que se haya asociado el acortamiento de la longitud telomérica leucocitaria con una elevada excreción urinaria nocturna de cortisol46. En la misma línea, y más recientemente, un estudio in vitro en el que se aplicó cortisol a linfocitos T se objetivó una reducción significativa de la actividad de la telomerasa en forma de dosis dependiente36. Pero hasta el momento, según nuestros conocimientos, no se ha evaluado el sistema telomérico en la situación más típica de hipercortisolismo endógeno como es el síndrome de Cushing. Únicamente ha sido evaluado en situaciones de seudocushing (depresión mayor crónica y estrés psicosocial crónico).
Papel del acortamiento de telómeros en las complicaciones del síndrome de CushingEl «link» biológico entre el síndrome de Cushing (caracterizado por el clúster de complicaciones sistémicas mencionadas anteriormente), el aumento del riesgo cardiovascular y el distrés neuropsicológico es la hipersecreción de cortisol, capaz de inducir diferentes mecanismos patogénicos, dando lugar al daño cardiovascular, a un envejecimiento prematuro y a un aumento de la mortalidad. Por lo tanto, podría ser que los niveles elevados de glucocorticoides contribuyeran a un envejecimiento prematuro. Tampoco se puede descartar que los factores ambientales determinen un envejecimiento prematuro.
¿Sería posible que la exposición previa crónica al hipercortisolismo determinara en estos pacientes un envejecimiento prematuro a través del acortamiento de los telómeros? ¿Podría el mecanismo de desgaste telomérico observado en el estrés crónico o en las alteraciones severas del estado de ánimo acontecer también en pacientes con síndrome de Cushing y contribuir a su envejecimiento prematuro, a su aumentada morbilidad residual y mortalidad? Que sepamos, hasta ahora no se ha evaluado el funcionamiento del sistema telomérico en el paradigma más típico de hipercortisolismo endógeno como es el síndrome de Cushing.
En resumen, el síndrome de Cushing es una enfermedad rara que, a pesar de que bioquímicamente se controle el hipercortisolismo mediante tratamiento, se asocia a un envejecimiento prematuro con mayor morbimortalidad. Los mecanismos exactos por los cuales esto pasa no están claros. Si bien los factores ambientales pueden tener un papel en estas consecuencias desfavorables, no se puede descartar que la exposición crónica al hipercortisolismo determine un acortamiento telomérico acelerado y, por tanto, un envejecimiento prematuro. Aclarar estos mecanismos podría ser el primer paso para la prevención y la mejoría de las consecuencias clínicas de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.