Los feocromocitomas son tumores neuroendocrinos poco frecuentes que derivan de las células cromafines adrenales. Se presentan con signos y síntomas derivados del exceso de catecolaminas y su diagnóstico puede suponer un reto condicionado por la sensibilidad y especificidad de las pruebas diagnósticas1.
Se presenta el caso de una mujer de 41 años que consultó por episodios de palpitaciones de minutos de duración, asociados a elevación de la tensión arterial, que ocurrían en relación con la menstruación, desde hacía 2 años, no acompañados de cefalea. Era fumadora, previamente sus menstruaciones transcurrían sin incidencias y había tenido 2 gestaciones a término normales. El estudio cardiológico (electrocardiograma, Holter de electrocardiograma y de tensión arterial y ecocardiograma), así como la radiografía de tórax fueron normales, incluso en los periodos sintomáticos. En la exploración física no destacaba ningún hallazgo significativo. Tenía un peso de 60kg, talla 169cm, tensión arterial 130/60mmHg y frecuencia cardiaca 80 lpm. La exploración ginecológica ecográfica fue normal.
Como parte del diagnóstico diferencial de las palpitaciones y la hipertensión arterial, se solicitó una analítica completa con proteinograma, hormonas y marcadores tumorales: glucemia 89mg/dl, perfil hepático normal, beta-2-microglobulina 1,4mg/l, proteinograma e inmunoglobulinas en rango normal, triptasa 7,07 ng/ml (< 11,5), TSH 1,45 uU/ml, calcio 9,8mg/dl, calcitonina 2mg/dl (2-11,5), renina 8 pg/ml (3-33), aldosterona 137 pg/ml (97-626), cromogranina A 0,8 nmol/l (< 6). Se solicitaron las metanefrinas fraccionadas en orina, que fueron normales en 2 determinaciones diferentes. Por persistencia de los síntomas varios meses después, incluso en el periodo intermenstrual, se repitió el análisis y se observó una discreta elevación: cociente normetanefrina/creatinina 167 ug/g (< 560), cociente metanefrina/creatinina 333,3 ug/dl (< 260) y cociente ácido vanilmandélico/creatinina 3,74 ug/g (< 10), con una cromogranina A entonces de 12 nmol/l.
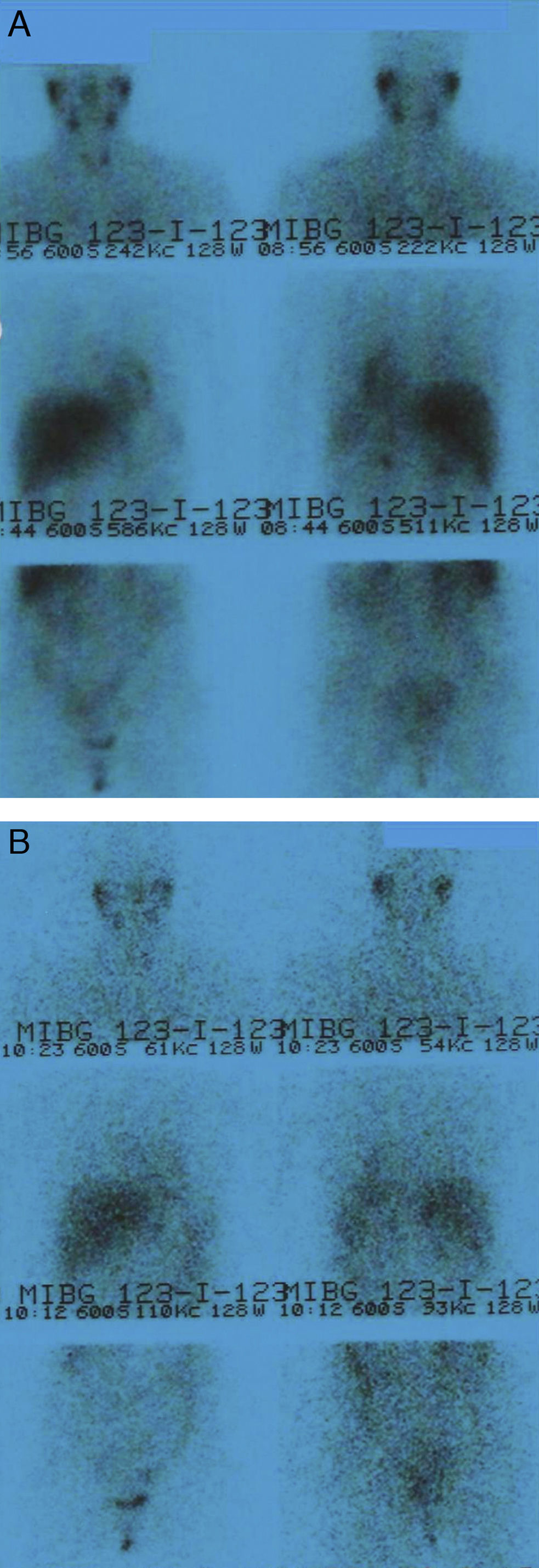
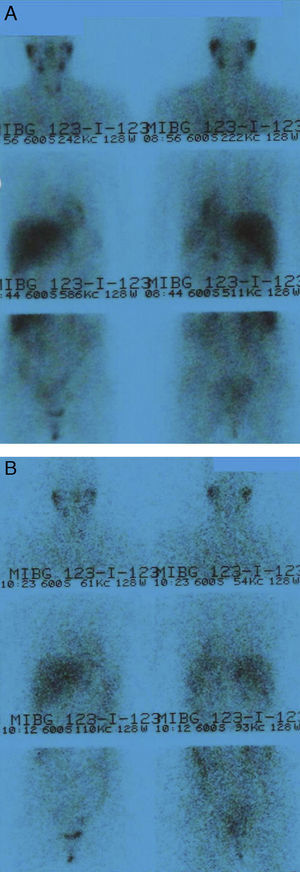
Ante la sospecha de un feocromocitoma o paraganglioma de posible localización ginecológica, se solicitó una tomografía computerizada (TC) abdominal, que fue normal, y una gammagrafía con 123I-metayodobencilguanidina (123I-MIBG), que no mostró captación patológica (fig. 1). Se amplió el estudio con una nueva TC de cuello-mediastino y tórax que mostró un nódulo tiroideo, cuya punción-aspiración con aguja fina guiada por ecografía fue de benignidad.
Gammagrafía con 123I-MIBG (dosis de 185 MBq). Proyecciones anterior y posterior de cuello-tórax-abdomen a las 24 h (A) y anterior y posterior de cuello-tórax-abdomen a las 48 h (B). No se observan hallazgos patológicos. Las imágenes obtenidas muestran una distribución del radiofármaco compatible con la distribución fisiológica desde las primeras adquisiciones.
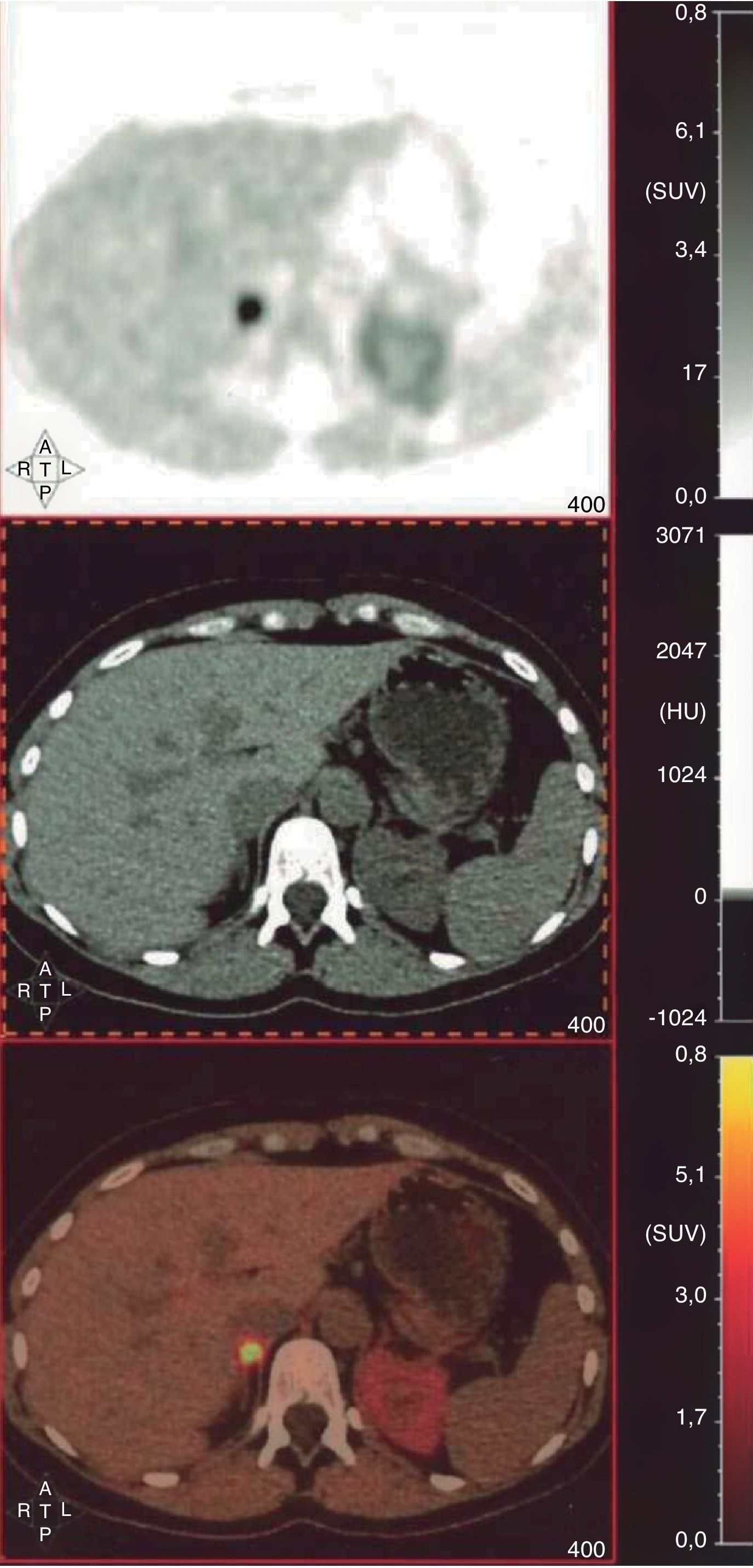
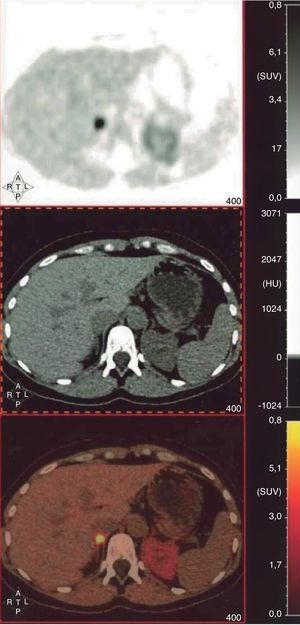
A pesar de los resultados bioquímicos poco concluyentes y la repetida negatividad de las pruebas de localización, la clínica de la paciente animó a solicitar la realización de tomografía por emisión de positrones con 18F-dihidroxifenilalanina (18F-DOPA-PET-TC). Se observó un aumento de la captación en la glándula suprarrenal derecha (SUV máx 9,59) (fig. 2), compatible con la existencia de feocromocitoma. Se inició entonces el bloqueo alfa-adrenérgico, con buen control de la tensión arterial, y posterior bloqueo beta, previo a la cirugía. La anatomía patológica confirmó la sospecha y no se encontraron datos sugerentes de agresividad histológica (Ki67 < 2% e inmunohistoquímica positiva para ENE, S-100, cromogranina A, sinaptofisina, CD56, PGP 9,5 y vimentina). Se ha solicitado el estudio genético.
Tomografía por emisión de positrones con 18F-dihidroxifenilalanina (18F-DOPA-PET-TC). Cortes axiales a nivel abdominal (SPECT, TC y fusión). Se observa un marcado aumento de captación de la glándula suprarrenal derecha (SUVmáx=9,59), en ausencia de un aumento estructural de la glándula en el estudio TC, compatible con feocromocitoma. La actividad de la glándula suprarrenal izquierda es de características normales. No se aprecian depósitos focales en la región cervical, torácica, abdominal y pélvica sugerentes de paraganglioma y/o metástasis.
El diagnóstico de los feocromocitomas se basa en datos clínicos, bioquímicos y en estudios de localización. Los síntomas no son específicos y presentan gran variabilidad interindividual; pueden remedar otras muchas patologías más frecuentes, por lo que, aunque en ocasiones pueda sospecharse la existencia de un tumor de este tipo, no siempre se diagnostica2.
La prueba de elección para el despistaje de un tumor productor de catecolaminas es la determinación de metanefrinas libres en plasma o fraccionadas en orina3. Lo ideal sería disponer de ambas, pero dado que en ocasiones la medición en orina es la única disponible y accesible, se recurre a esta como única determinación4. En ocasiones se pueden obtener resultados equívocos, como ocurrió inicialmente en esta paciente, y plantea la duda entre continuar con el algoritmo diagnóstico o catalogarlo como falso positivo2.
Si la clínica y la bioquímica son compatibles, está indicado realizar el estudio de localización, comenzando a nivel abdominal4. Suele ser necesario complementar las imágenes anatómicas de la TC o resonancia magnética (RM) (sensibilidad 90-100%, pero especificidad baja) con las pruebas funcionales de medicina nuclear, entre las que destacan la gammagrafía marcada con 123I-MIBG (especificidad del 99%)5 y la marcada con el análogo de somatostatina 111In-pentetreótide, menos empleada por su menor rentabilidad6.
Sin embargo, no siempre se logra identificar la localización tumoral mediante dichas técnicas, debido a la limitación de la resolución espacial. En estos casos, la imagen obtenida mediante PET puede resultar más útil7. Para ello se han empleado diferentes radiotrazadores, como 18F-dopamina (18F-FDA), 18F-DOPA y 18F-deoxiglucosa (18FDG), que se basan, respectivamente, en la capacidad de estos tumores de incorporar aminoácidos y posteriormente decarboxilarlos, y en la incorporación celular de glucosa a través de la vía GLUT-1. Además, recientemente se han diseñado otros basados en la presencia de receptores de somatostatina (68Ga-DOTA-Tyr3-octreotide [68Ga-DOTATOC] y DOTA-Nal-octreotide [68Ga-DOTANOC]), con resultados prometedores, aunque aún no se dispone de estudios comparativos suficientes6.
Varios autores han concluido que la rentabilidad de la 18F-DOPA-PET es superior y que si se implementara como técnica de rutina, condicionaría el manejo y tratamiento del paciente7. En algunas series se describen tasas de falsos positivos del 0% y sensibilidades de hasta 100%, superando las de otras pruebas funcionales, incluso aunque la determinación de metanefrinas no se encuentre en rango muy elevado5,6,8, como ocurrió en nuestra paciente. Otra ventaja respecto a la 123I-MIBG es que, al tener la 18F-DOPA una vida media menor, permite una dosis mayor y una obtención de imágenes más precoz9. Además, se realza la diferenciación respecto del tejido normal adyacente, pues la médula adrenal sana no capta el radiotrazador6,9, una característica que algunos autores han propuesto optimizar mediante el tratamiento previo con carbidopa10.
Es interesante recordar, no obstante, que, dada la heterogeneidad y baja prevalencia de los feocromocitomas y paragangliomas, establecer la mejor prueba diagnóstica es difícil, pues vendrá determinada por las características individuales del paciente en relación al perfil secretor, la localización de sospecha, las características histológicas de diferenciación celular, el comportamiento biológico y la posible asociación con una mutación genética6,11.
Es necesario adaptarse a la modernización de las técnicas de imagen y plantear la posibilidad de que en aquellos centros en los que esté disponible, la 18F-DOPA-PET podría remplazar, al menos en parte, a la 123I-MIBG, por su mayor precisión, comodidad de realización y menores efectos adversos para el paciente, si bien serán necesarios estudios de coste-efectividad que evalúen su utilización.