La infección crónica por el virus de la hepatitis C puede acompañarse de manifestaciones extrahepáticas. En especial se ha relacionado la enfermedad tiroidea con el tratamiento con interferón alfa. Se presenta el caso de una mujer de 40 años con infección por el virus de la hepatitis C, que desarrolló un cuadro de tiroiditis subaguda durante el tratamiento con interferón alfa pegilado y ribavirina.
Chronic hepatitis C virus infection may be associated with extrahepatic manifestations. Thyroid disease related to chronic hepatitis C virus infection has been associated with interferon-alpha treatment. We present the case of a 40-year-old woman with chronic hepatitis C virus infection, who developed subacute thyroiditis during treatment with pegylated interferon-alpha plus ribavirin.
La infección crónica por el virus de la hepatitis C (VHC) se acompaña, en un 40-70% de los casos, de manifestaciones extrahepáticas1. Éstas pueden llegar a ser la afección predominante en el curso de la enfermedad, e incluso llevar al diagnóstico de infección por el VHC.
La enfermedad tiroidea se ha relacionado con la infección por el VHC2, especialmente en los pacientes que han recibido tratamiento con interferón alfa (IFNα)3,4. Se presenta el caso de una mujer de 40 años con infección crónica por el VHC, que desarrolló tiroiditis subaguda 5 meses después del inicio de tratamiento combinado con IFNα pegilado y ribavirina (RBV).
CASO CLÍNICOMujer de 40 años remitida al servicio de endocrinología por tirotoxicosis, observada en el sexto mes del tratamiento por hepatitis crónica por el VHC genotipo viral 3, conocida 15 años antes y en relación con consumo de drogas por vía parenteral. Había recibido hacía 10 años tratamiento con IFNα sin respuesta virológica. Se desconocía si tenía antecedentes personales y familiares de enfermedad tiroidea. Antes de iniciar un nuevo ciclo con IFNα en combinación con RBV (interferón alfa pegilado 2b-Pegintron®, Laboratorio Schering, de 80 μg, 0,5 μg/kg/semana, vía subcutánea y RBV Rebetrol®, Schering, de 200 mg, 800 mg/día), se determinaron función tiroidea y autoanticuerpos tiroideos (AAT), que estaban dentro de la normalidad: tiroxina libre (T4L), 1,2 (intervalo de normalidad, 0,7-148) ng/dl; tirotropina (TSH), 0,953 (0,35-4,94) mU/l. La carga viral inicial del VHC era de 61.500 U/ml. Al segundo mes de tratamiento, presentaba una función tiroidea normal: T4L, 1,11 ng/dl; TSH, 1.282 mU/l. Al sexto mes comenzó con cuadro de nerviosismo, irritabilidad, pérdida de 4 kg de peso, hiperorexia, temblor distal, intolerancia al calor y aumento del número de deposiciones. No refería clínica cervical. En la exploración destacaban: índice de masa corporal (IMC), 26; frecuencia cardíaca, 130 lat/min; temblor fino distal, piel sudorosa y caliente, seudoexoftalmos y bocio de grado Ia. En la analítica mostraba: anticuerpos antitiroperoxidasa (TPO), 355,4 U/ml; anticuerpos antitiroglobulina (AcTG), 37,8 U/ml; T4L, 3,11 ng/dl; TSH, 0,0075 mU/l; anticuerpos antirreceptor de TSH (TRAK) < 2,5 U/l (0-14); velocidad de sedimentación globular (VSG), 45 mm/h. El estudio gammagráfico tiroideo no detectó captación del trazador en lecho tiroideo (fig. 1). En la ecografía se observó una glándula tiroides de ecogenicidad no homogénea y discretamente hipoecoica. Se mantuvo tratamiento sintomático con propranolol a dosis de 20 mg/8 h, con mejoría de la clínica, y se suspendió el tratamiento con IFNα pegilado y RVB. La carga viral de VHC determinada mediante reacción en cadena de la polimerasa (PCR) fue negativa. Al mes la concentración de T4L disminuyó a 1,38 ng/dl con una TSH de 0,0037 mU/l. Un mes más tarde las concentraciones hormonales fueron: T4 L, 0,4 ng/dl; TSH, 4.413 mU/l, y tiroglobulina (TG), 807 ng/ml. Se inició tratamiento con levotiroxina a dosis de 50 μg/día, que se retiró a los 3 meses, en que presentó los siguientes resultados analíticos: TG, 8,51 ng/ml; T4L, 1,21 ng/dl; TSH, 2,93 mU/l; TPO, 111,6 U/ml; anticuerpos TG, 640,2 U/ml. Dos años después, y sin necesidad de tratamiento, la paciente permanece eutiroidea y con carga viral indetectable para VHC.
DISCUSIÓNMujer de 40 años con infección crónica por el VHC genotipo 3, que presenta cuadro compatible con tiroiditis subaguda, en el sexto mes del tratamiento con IFNα pegilado y RBV.
La infección crónica por VHC se puede asociar a manifestaciones extrahepáticas. Se ha descrito la aparición de fenómenos autoinmunitarios y enfermedades autoinmunitarias francas y/o reumáticas, la relación con linfoproliferación benigna de células B y la posibilidad de aparición de linfoma no hodgkiniano. Estas manifestaciones pueden dar lugar al diagnóstico de la infección por VHC y ser la afectación clínica predominante1.
La evolución clínica de la infección por VHC ha cambiado desde la introducción del tratamiento con IFNα. Esta molécula confiere resistencia a las células contra la infección viral, además de tener propiedades inmunomoduladoras, antiangiogénicas, antiproliferativas, antitumorales y reguladoras del crecimiento y diferenciación5.
Con el tratamiento actual, que combina IFNα pegilado y RBV, se consiguen respuestas virológicas mantenidas de un 50-60% de los casos6,7. Sin embargo, los efectos secundarios, que comprenden desde síndrome seudogripal hasta efectos hemáticos, síntomas neuropsiquiátricos y enfermedad tiroidea, obligan a reducciones de dosis hasta en un 40% y a su retirada en un 14% de los casos8.
La asociación de la enfermedad tiroidea con el tratamiento con IFNα se describió por primera vez en pacientes con cáncer de mama y tumores carcinoides, en relación con las elevadas dosis que recibían9. Clásicamente, se ha dicho que la mayor prevalencia de enfermedad tiroidea en pacientes con VHC era secundaria al tratamiento con IFNα3. Revisiones recientes han puesto en evidencia la implicación de la infección por el VHC en una mayor prevalencia de la enfermedad tiroidea2. Antonelli et al2, en una revisión de estudios controlados, observaron que en los pacientes con VHC, respecto al grupo control, había una mayor prevalencia de enfermedad autoinmunitaria tiroidea (el 16 frente al 10%; odds ratio [OR] = 1,6; intervalo de confianza [IC], 1,4-1,9) e hipotiroidismo (el 9 frente al 2%; OR = 4,1; IC, 2,1-7,8), aunque no de hipertiroidismo2. Los principales factores de riesgo para desarrollar hipotiroidismo fueron el sexo femenino y la positividad para anticuerpos TPO.
El VHC también podría estar implicado en una mayor incidencia de carcinoma diferenciado de tiroides10.
El IFNα puede inducir la aparición tanto de tiroiditis autoinmunitaria (positivización de los autoanticuerpos tiroideos, tiroiditis de Hashimoto y enfermedad de Graves) como de mecanismos no autoinmunitarios (tiroiditis subaguda e hipotiroidismo no autoinmunitario)4. En pacientes con el VHC tratados con IFNα se ha descrito, en estudios prospectivos, desde un 3,4 hasta un 15% de incidencia de enfermedad tiroidea y desde un 1,9 a un 40% de alteraciones autoinmunitarias tiroideas4. Los efectos secundarios del IFNα pueden confundirse con la clínica del hipotiroidismo. Esto puede llevar a un retraso en el diagnóstico, subestimar la prevalencia de enfermedad tiroidea e incluso llegar a suspender erróneamente el IFNα.
Se han descrito múltiples factores etiopatogénicos en la enfermedad tiroidea en relación con la infección por el VHC y el tratamiento con IFNα. La respuesta del organismo a la infección viral puede elevar las concentraciones de IFNα endógeno, y se produce una mayor prevalencia de enfermedad tiroidea en pacientes genéticamente dispuestos. Por medio de diversas quimiocinas inducidas por la elevación del IFNγ, como la CXCL10, la célula tiroidea podría convertirse en célula presentadora de antígeno2. También se ha descrito la presencia del VHC en la glándula tiroidea, aunque las implicaciones de este hecho no están claras11. Se ha detectado reactividad cruzada entre los autoanticuerpos tiroideos con la lipoproteína del VHC, la CYP2D6 (el autoantígeno LKM1), y la TPO en el 86% de los pacientes con VHC y LKM1 positivo, y trastornos tiroideos concomitantes12. Además, la incidencia de tiroiditis inducida por IFN es mayor en pacientes con VHC que en los tratados con infección por VHB13.
Otra de las posibles explicaciones de la relación entre la infección por el VHC tratada y la aparición de enfermedad y/o autoinmunidad tiroidea es una posible susceptibilidad genética14. El genotipo del VHC parece no influir en la aparición de enfermedad autoinmunitaria tiroidea inducida por IFNα15. Respecto al régimen terapéutico, la adición de RBV al IFNα pegilado parece que aumenta la frecuencia de hipotiroidismo autoinmunitario16.
El IFNα, además de poder causar enfermedad tiroidea al inducir o activar un proceso inmunitario, puede afectar de forma directa al tiroides4. No está claro si esta afectación directa está en relación con un efecto tóxico del IFNα en las células tiroideas o por inducción de una alteración de la expresión y/o la función de las enzimas implicadas en la captación y la organificación del yodo.
Todavía se desconoce cómo el IFNα induce autoinmunidad tiroidea, aunque se ha implicado, entre otros, a: activación de la expresión de antígenos de histocompatibilidad de clase I en las células tiroideas y de las células T citotóxicas; aumento de la expresión de moléculas de adhesión celular; aumento de la actividad de interleucina (IL) 6; modulación de la producción de inmunoglobulinas; inhibición de las células T reguladoras, y aumento de la actividad de los linfocitos T-helper 14.
La quimiocina CXCL10 es liberada por los linfocitos intrahepáticos por la inducción mediada por el IFNγ, en respuesta a la infección viral. Rotondi et al17 han descrito que las concentraciones séricas de CXCL10 se correlacionan con una menor carga viral, y que las concentraciones previas al tratamiento de esta quimiocina eran más bajas en los pacientes con respuesta virológica al IFNα y en los que desarrollaron enfermedad tiroidea. Se observó también que la aparición de trastornos tiroideos inducidos por IFNα se correlacionó con una tasa de respuesta al tratamiento antiviral hasta 3 veces mayor17.
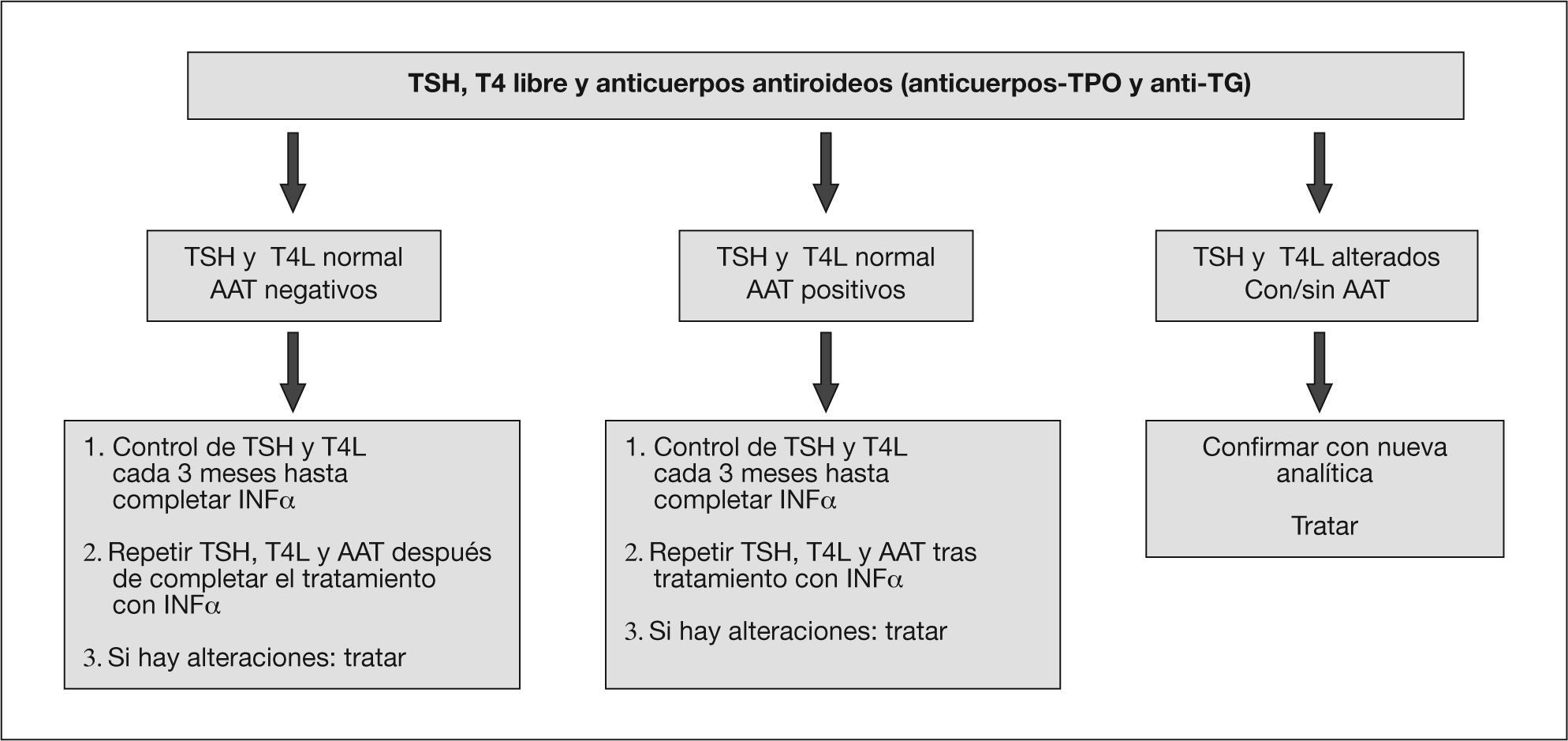
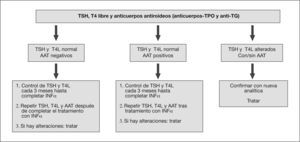
Por lo tanto, se aconseja realizar una valoración tiroidea en los pacientes con infección por el VHC, especialmente en aquellos que recibirán tratamiento con IFNα, antes, durante y tras su finalización (fig. 2).
Procedimiento ante un paciente con hepatitis C que ha de recibir tratamiento con interferón alfa (IFNα). AAT: autoanticuerpos tiroideos; T4L: tiroxina libre; TG: tiroglobulina; TPO: tiroperoxidasa; TSH: tirotropina. Adaptado de Mandac et al4.
En caso de aparición de enfermedad tiroidea, el manejo será el de la enfermedad específica. La mayoría de los autores coinciden que el IFNα no ha de retirarse cuando se detecte hipotiroidismo. Sin embargo, en los casos de hipertiroidismo por IFNα, algunos autores aconsejan considerar su retirada según la gravedad del cuadro, aunque esto no parece dar lugar a un cese del hipertiroidismo18. Además, la aparición de trastornos tiroideos inducidos por el IFNα se correlaciona con una mayor respuesta al tratamiento antiviral17.
En conclusión, dada la relación de enfermedad tiroidea e infección por el VHC, especialmente con el tratamiento con IFNα y RBV, se aconseja realizar un cribado periódico cada 3 meses durante el tratamiento antiviral (fig. 2) para detectar estas alteraciones de forma precoz y evitar una disminución de la calidad de vida de estos pacientes y una posible confusión con los efectos secundarios del IFNα pegilado. En esta paciente con genotipo 3 y baja carga viral inicial el tratamiento durante 6 meses se considera completo, según las guías clínicas6, y presenta respuesta viral mantenida en la evolución.