Los adenomas hipofisarios clínicamente no funcionantes son los macroadenomas más frecuentes en adultos. Se caracterizan por no acompañarse de hipersecreción hormonal detectable en plasma y diagnosticarse cuando aparece sintomatología compresiva o déficits hormonales. El tratamiento de elección es la resección quirúrgica, pero es frecuente que no sea curativa o haya recidivas y se requieran tratamientos adicionales. Los fármacos tienen escasa eficacia y solo han conseguido pequeñas reducciones tumorales en algunos pacientes. Debe considerarse tratamiento con RT postquirúrgica en pacientes con grandes restos o crecimiento de los restos durante el seguimiento. Las técnicas estereotáxicas se han desarrollado para disminuir las complicaciones de la irradiación. En los microadenomas el crecimiento no es frecuente, por lo que solo se recomienda observación.
Se revisan los resultados del tratamiento médico, quirúrgico y radioterápico de estos tumores.
Clinically nonfunctioning adenomas are the most frequent pituitary macroadenomas in adults. These tumors are characterized by the absence of detectable hormonal hypersecretion and are diagnosed when compression symptoms or hormonal deficiencies occur. The treatment of choice of macroadenomas is surgery, but tumoral resection is often incomplete or the patient develops tumoral recurrence. Medical therapy has been shown to produce modest tumoral reduction in some patients. Postoperative irradiation should be considered in patients with large tumoral remnants or enlargement of remnants during follow-up. Stereotactic radiotherapy has been developed to diminish the long-term complications of radiotherapy. Microadenomas tend to remain small and surveillance alone is recommended. The present article reviews the results of medical, surgical and radiation treatments.
Son los macroadenomas hipofisarios más frecuentes, con una prevalencia de 70–90 casos por millón. Son el 50% de los tumores hipofisarios en grandes series quirúrgicas1. Adenoma clínicamente no funcionante es una definición clínica basada en la ausencia de hipersecreción hormonal detectable en plasma. Desde el punto de vista histológico incluye diferentes tipos de tumores.
La mayoría producen gonadotropinas y sus subunidades, biológicamente inactivas, aunque pueden producir trazas de folitropina (FSH) y lutropina (LH) intactas activas. La entidad también incluye los adenomas de «células nulas» o «null cell» y los tumores de células oncocíticas, tumores en los cuales la inmunohistoquímica es negativa para hormonas hipofisarias, pero la mayoría expresa factor esteroidogénico-1, lo que los localiza citogenéticamente en la familia de adenomas gonadotropos2. Los tumores de células oncocíticas se caracterizan por tener abundantes mitocondrias. Algunas publicaciones los relacionan con menor sensibilidad a la radiación3.
Se denominan adenomas silentes a los tumores con inmunohistoquímica positiva para hormonas hipofisarias, pero sin hipersecreción hormonal. Los más frecuentes son los adenomas corticotropos silentes, que tienen inmunohistoquímica positiva para corticotropina (ACTH) y fragmentos de proopiomelanocortina. Son de evolución agresiva4,5 y suelen presentarse en mujeres jóvenes. También se han descrito algunos casos de adenomas productores de hormona de crecimiento (GH) sin actividad biológica (GH silentes).
Pese a algunas diferencias de respuestas terapeúticas descritas para algunos subtipos histológicos, la mayoría de series no detallan las características histopatológicas de los tumores clínicamente no funcionantes. Los microadenomas hipofisarios clínicamente no funcionantes no producen ninguna sintomatología y a menudo se descubren de forma casual en pruebas radiológicas realizadas por otros propósitos (incidentalomas). Los macroadenomas se expresan clínicamente debido al efecto masa del tumor, aunque también pueden ser detectados de forma incidental. La cefalea ocurre en más del 40% de pacientes y es debida al aumento de presión intracraneal o a la distensión de la duramadre. Las alteraciones visuales se presentan en más del 60% de los pacientes, típicamente hemianopsia bitemporal por compresión de las fibras inferonasales, situadas en la parte anterior del quiasma óptico. En la mayoría de pacientes existe además hipopituitarismo por compresión de la hipófisis sana6.
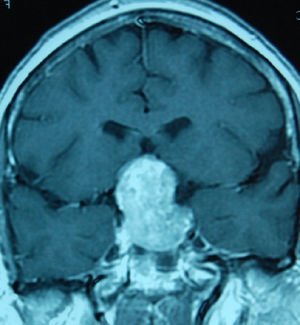
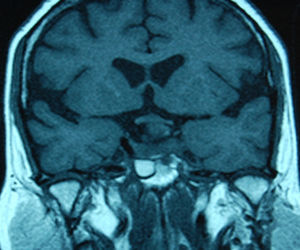
Tratamiento de los macroadenomasLa decisión terapeútica en estos tumores depende de su efecto masa, la función endocrinológica, el crecimiento durante el seguimiento y también del conocimiento de la historia natural que siguen estos tumores (figs 1 y 2).
En los pacientes con clínica compresiva es necesaria la cirugía. En pacientes sin compresión del quiasma óptico puede no indicarse cirugía por motivos de edad, función hipofisaria, deseo de fertilidad o elección del paciente. Hay que conocer que esta decisión puede conllevar la aparición de nuevos defectos visuales (hasta en 25% de los casos según una publicación reciente)7, apoplejía hipofisaria e hipopituitarismo. En esta opción conservadora debe realizarse estudio de la función hipofisaria cada 6–12 meses y resonancia magnético nuclear (RMN) anual o cada 2 años si el tumor está alejado del quiasma y no hay progresión en las RMN previas anuales. Puede intentarse un tratamiento con algún agonista dopaminérgico o análogo de somatostatina, aunque suelen reducirse menos del 20% de tumores.
Existe riesgo de empeoramiento visual durante el embarazo, por lo que una resección previa a este puede estar indicada.
Los tumores mayores de un centímetro tienen propensión a crecer. Las series más recientes7–11, con mayor número de pacientes y seguimiento más prolongado (mayor de 3 años), demuestran que el tamaño de los macroadenomas aumenta en aproximadamente el 50% de los casos. En la mitad de los pacientes en los que hubo crecimiento tumoral se produjo además empeoramiento clínico. Así pues, solamente la observación no parece un procedimiento seguro para estos tumores y solo debe considerase en caso de alto riesgo quirúrgico. Este dato está en consonancia con el crecimiento a largo plazo, cercano al 50% de los casos, de restos tumorales tras cirugía incompleta (tabla 1). En el 11% de los tumores está descrita la regresión espontánea del volumen, quizá por isquemia silente12. Puede ocurrir apoplejía hipofisaria en el 10% de macroadenomas hallados incidentalmente y seguidos durante 5 años. Los anticoagulantes pueden predisponer a esta complicación9.
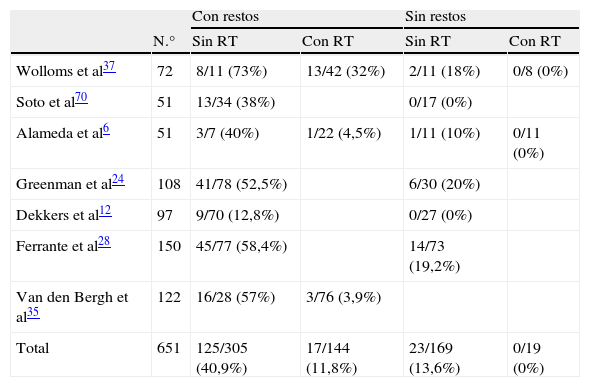
Crecimiento tumoral tras cirugía según presencia o no de restos posquirúrgicos y tratamiento o no con radioterapia
| Con restos | Sin restos | ||||
| N.° | Sin RT | Con RT | Sin RT | Con RT | |
| Wolloms et al37 | 72 | 8/11 (73%) | 13/42 (32%) | 2/11 (18%) | 0/8 (0%) |
| Soto et al70 | 51 | 13/34 (38%) | 0/17 (0%) | ||
| Alameda et al6 | 51 | 3/7 (40%) | 1/22 (4,5%) | 1/11 (10%) | 0/11 (0%) |
| Greenman et al24 | 108 | 41/78 (52,5%) | 6/30 (20%) | ||
| Dekkers et al12 | 97 | 9/70 (12,8%) | 0/27 (0%) | ||
| Ferrante et al28 | 150 | 45/77 (58,4%) | 14/73 (19,2%) | ||
| Van den Bergh et al35 | 122 | 16/28 (57%) | 3/76 (3,9%) | ||
| Total | 651 | 125/305 (40,9%) | 17/144 (11,8%) | 23/169 (13,6%) | 0/19 (0%) |
RT: radioterapia.
Dada la evolución natural de estos tumores, en los macroadenomas deberá optarse primero por cirugía transesfenoidal. Un porcentaje importante de pacientes permanecerán con restos tumorales de crecimiento potencial tras la cirugía. En caso de ausencia de restos tumorales posquirúrgicos o si estos son pequeños se vigilarán por técnicas de imagen. Si crecen se optará por la radioterapia (RT) adicional. En caso de remanente tumoral mayor de 1cm tras la cirugía o restos localizados en zonas donde un crecimiento tumoral pueda comprometer estructuras importantes se administrará RT posquirúrgica.
Tratamiento quirúrgicoLa cirugía transesfenoidal es la técnica quirúrgica de elección para los macroadenomas hipofisarios no funcionantes. Dado que frecuentemente presentan extensión supra o paraselar, a menudo, no es curativa y los restos tumorales pueden aumentar de tamaño a lo largo del seguimiento. Es imprescindible su ejecución por un neurocirujano experimentado, ya que ello disminuye los riesgos y aumenta el porcentaje de éxito. Puede emplearse microscopio o tecnología endoscópica. Los tumores gigantes también pueden ser intervenidos por abordaje transesfenoidal, en lugar de transcraneal, aunque presentan mayor mortalidad que los adenomas más pequeños.
Tras la cirugía la cefalea desaparece y la visión mejora en el 75% de pacientes con visión afectada, demostrándose en los primeros días tras la cirugía. La mejoría puede continuar hasta 1 año después de la cirugía. La falta de mejoría de los defectos visuales tras la cirugía se correlaciona con la gravedad y persistencia del defecto previo, por lo que conviene intevenir precozmente si existe afectación visual.
En contraste con la mejoría visual, la función hipofisaria no suele recuperarse tras la cirugía transesfenoidal. En un estudio de 51 pacientes con adenomas hipofisarios no funcionantes sólo un 15% presentaron función hipofisaria normal prequirúrgica, siendo los déficits más frecuentes los de GH y gonadotropinas6. Tras la cirugía solo 11% presentaban una función normal, sin mejoría global significativa de la función endocrinológica. Otros estudios también han demostrado que se observa una función posquirúrgica normal tras cirugía transesfenoidal en menos del 20% de pacientes13.
Tras la cirugía presentan hipopituitarismo de nueva aparición un 5–10% de los casos, se produjo fístula de líquido cefalorraquídeo en el 1–2% de casos. Hasta un 30% pueden presentar poliuria postoperatoria, aunque la diabetes insípida tras cirugía transesfenoidal ocurre en menos del 1% de casos13.
Pueden producirse también hematomas, meningitis y perforaciones del septo nasal. En las series de cirugía endoscópica, en comparación con las de cirugía microscópica, parece existir un mayor riesgo de fístulas, y, por tanto, de meningitis. La mortalidad oscila entre 0,3–0,5% y es mayor en tumores grandes. Los pacientes con tumores gigantes (de más de 4cm de diámetro) presentan bajos índices de curación y elevada morbimortalidad.
La cirugía transesfenoidal endoscópica se inicia con luxación o resección del cornete medio, dejando una abertura de 1cm del tabique posterior nasal para trabajar por las dos fosas nasales simultáneamente. Los endoscopios tienen diferentes angulaciones (0°, 35° o 45°) para tener mejor visión de la zona. Es una ruta más rápida y menos invasiva que la cirugía microscópica, con menor pérdida de sangre y no es necesario el taponamiento nasal posquirúrgico, lo que produce menos dolor y mayor confortabilidad del paciente en el postoperatorio. Como desventaja presenta dificultades técnicas que requieren entrenamiento del neurocirujano y no es posible la visión tridimensional. Además hay necesidad de reenfocar constantemente, porque el endoscopio entra en conflicto con el sistema de limpieza y la cámara se enturbia con frecuencia. Pueden usarse RM intraoperatoria o neuronavegador durante la cirugía, pero son técnicas de las que no se dispone de forma rutinaria. Aunque hay grupos que han publicado que el abordaje endoscópico se asocia a menor estancia hospitalaria (en 48h), en otras publicaciones no hay diferencia si la cirugía microscópica se realiza por neurocirujanos con mucha experiencia14. En tumores intervenidos previamente mediante abordaje microscópico, con resección tumoral incompleta de las extensiones supra o paraselares, el uso de endoscopio muestra, en muchos casos, que la visión más panorámica que proporciona, permitiendo la ampliación de la exposición tumoral en el campo, facilita su resección. En los tumores intraselares existen menos diferencias entre ambas tecnologías. El porcentaje de resección macroscópicamente completa publicada en series con experiencia es similar entre las técnicas microscópica y endoscópica14 (entre 80–90%). La extirpación se dificulta en ciertos casos con invasión intracavernosa, consistencia fibrosa del tumor o invasión extensa de la base del cráneo. Si se excluyen los pacientes con invasión del seno cavernoso, se consigue resección mácroscopicamente completa en un 96% de tumores con extensión supraselar.
La apoplejía hipofisaria se debe a hemorragia o infarto del tumor hipofisario. Debe iniciarse tratamiento con glucocorticoides precozmente, por el riesgo de aparición de insuficiencia suprarrenal. Deben evaluarse las otras hormonas hipofisarias y sus déficits ser tratados apropiadamente. En pacientes con pérdida visual total o casi total está indicada la cirugía para resolver los déficits visuales y las paresias. En casos leves, puede hacerse manejo conservador de la apoplejía y los síntomas se suelen resolver espontáneamente en semanas o meses.
La RM posquirúrgica para valorar restos tumorales conviene demorarla unos 4 meses tras la cirugía. Antes no es valorable por los cambios quirúrgicos. Posteriormente debe realizarse cada 1–2 años para detectar recrecimiento y a continuación cada 3–5 años si no hay restos o estos son estables y se encuentran alejados de estructuras importantes.
En las series más recientes15,16 la resección tras cirugía transesfenoidal es macroscópicamente completa en un porcentaje mayor de pacientes (superior al 80%) que lo publicado en series más antiguas17,18. Pero la invasión microscópica de la duramadre está presente en el 94% de todos los macroadenomas con extensión supraselar, así que la impresión del neurocirujano o la RM posquirúrgica pueden infraestimar el tumor residual.
El riesgo de recrecimiento es menor si la resección es macroscópicamente total respecto a aquellos con evidencia de tumor residual (20% vs 52%)19. La tabla 1 resume los resultados de las series publicadas más importantes. Puede comprobarse que un 10–20% de pacientes sin restos radiológicos presentan recidiva tumoral y entre 40–50% de pacientes con restos presentan crecimiento tumoral. El crecimiento parece ser menor en ancianos, incluso tras cirugías con resección incompleta. Los factores que pueden predecir recidiva tumoral tras tratamiento quirúrgico son aún desconocidos. Los adenomas con inmunohistoquímica positiva para ACTH se comportan de forma más agresiva y recidivan más que el resto, aunque algunos autores no encuentran necesidad de utilizar diferentes protocolos para estos casos. Las atipias citológicas no son marcadores de comportamiento tumoral20. La elevación de los marcadores de proliferación, como el antígeno de proliferación celular Ki-67, el antígeno nuclear de proliferación celular PCNA, Bcl-2 y p5321, no se correlacionan de forma consistente con la invasividad o recurrencia. La presencia de mitosis y un Ki-67 mayor de 3% pueden indicar agresividad, pero solo una minoría de pacientes presentan esta características22. Las expansiones extraselares se asocian con los mayores índices de recurrencia (odds ratio 3,73), mientras que la recurrencia es poco frecuente si no hay tumor residual postoperatorio y el riesgo es intermedio para los restos intraselares23,24. Todavía carecemos de una adecuada correlación entre variables clínicas y patológicas que nos facilite la predicción de agresividad de estos adenomas.
La cirugía transesfenoidal repetida para tratar recurrencias o restos tumorales tiene resultados variables. Benveniste et al25 publicó que los defectos visuales mejoraban en el 57% de los pacientes reintervenidos. Persistía tumor en el 75% de los pacientes y aparecían recidivas en el 15% de pacientes.
RadioterapiaLa RT no se usa como tratamiento inicial, salvo que en el paciente esté contraindicada la cirugía. Es un tratamiento adicional postquirúrgico.
Radioterapia convencionalSe basa en un acelerador de fotones rayos X y se inmoviliza al paciente con una máscara. Se administran entre 25 y 30 sesiones (5 días por semana durante 5 semanas aproximadamente).
En macroadenomas, la alta recurrencia tras las craneotomías iniciales en series antiguas (35–75%), condujo a la recomendación de RT convencional posquirúrgica sistemática. La indicación se apoyaba en las excelentes tasas de control del crecimiento tumoral a los 15 años (93% con ella vs. 33% sin ella)26. Sin embargo la frecuencia de efectos secundarios a largo plazo ha reducido su uso indiscriminado. Con el desarrollo de la cirugía transesfenoidal, se comprobó que este procedimiento puede ser curativo en muchos casos y que, incluso cuando ocurre recrecimiento del tumor residual, la RT sigue siendo efectiva para estabilizar o inducir regresión, sin que la demora tenga efecto deletéreo sobre el pronóstico27, por lo que se utiliza frecuentemente el procedimiento de «observar y esperar». En los casos de pequeños restos intraselares (<1cm), que no estén cerca de zonas en donde el crecimiento pueda causar clínica rápidamente (ej: quiasma óptico), la RT puede reservarse a los casos en que exista crecimiento de la lesión. Con estas restricciones más estrictas para la RT, muchos pacientes no se exponen a sus efectos a largo plazo y, si se precisa por recidiva, se demoran varios años los posibles efectos secundarios. Una indicación clara de RT posquirúrgica en adenomas hipofisarios no funcionantes es el paciente con grandes restos residuales y panhipopituitarismo.
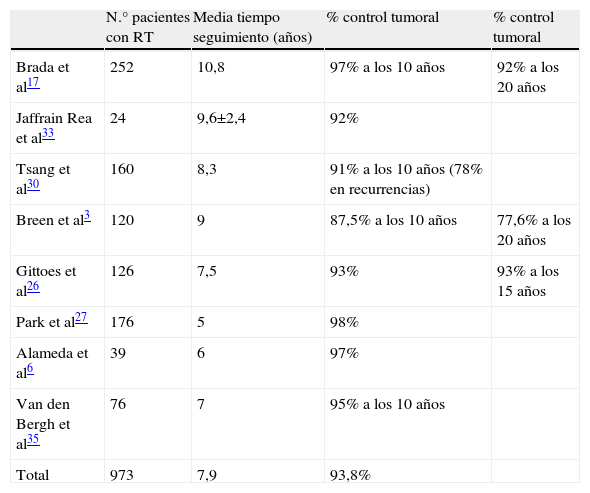
El control tumoral en caso de recurrencias, con resecciones quirúrgicas repetidas e irradiación postoperatoria ha sido del 80–90% de los casos a los 15 años, lo cual permite que la RT no se administre de forma rutinaria y pueda reservarse para posibles futuras recurrencias. No parecen existir marcadores específicos de agresividad tumoral que indiquen el uso de RT convencional sistemática. En una importante publicación de Ferrante et al28 que revisa 226 tumores hipofisarios no funcionantes, seguidos más de 5 años, el 19% de tumores sin restos posquirúrgicos no irradiados recidivaron. En los pacientes con restos posquirúrgicos no irradiados, el 58% de tumores crecieron. De los pacientes con restos tumorales que recibieron RT posquirúrgica solo un 18% crecieron en un seguimiento mayor de 8 años. La tabla 2 muestra los resultados de control tumoral en varias series que publican datos con RT convencional3,17,26–37.
Control tumoral tras radioterapia convencional posquirúrgica en adenomas hipofisarios no funcionantes¿
| N.° pacientes con RT | Media tiempo seguimiento (años) | % control tumoral | % control tumoral | |
| Brada et al17 | 252 | 10,8 | 97% a los 10 años | 92% a los 20 años |
| Jaffrain Rea et al33 | 24 | 9,6±2,4 | 92% | |
| Tsang et al30 | 160 | 8,3 | 91% a los 10 años (78% en recurrencias) | |
| Breen et al3 | 120 | 9 | 87,5% a los 10 años | 77,6% a los 20 años |
| Gittoes et al26 | 126 | 7,5 | 93% | 93% a los 15 años |
| Park et al27 | 176 | 5 | 98% | |
| Alameda et al6 | 39 | 6 | 97% | |
| Van den Bergh et al35 | 76 | 7 | 95% a los 10 años | |
| Total | 973 | 7,9 | 93,8% |
RT: radioterapia.
Los efectos secundarios de la RT a largo plazo son: aumento de los déficits hormonales, atrofia del nervio óptico, segundos tumores cerebrales y deterioro neurocognitivo.
Limitando la dosis se puede prevenir el daño por radiación a los nervios ópticos, pero hasta ahora ningún método ha demostrado prevenir el deterioro de la función hormonal. Se produce aumento de los déficits hormonales en más del 50% de pacientes. Se inician por deterioro de las vías hipotálamo-hipofisarias y más tarde se produce daño hipofisario directo. El hipopituitarismo parece incrementar la mortalidad cardiovascular y cerebrovascular38 y también se asocia a desmineralización ósea y cambios metabólicos que pueden disminuir la calidad de vida. Debido a que la deficiencia de GH puede jugar un papel en dichas complicaciones debe ofrecerse tratamiento sustitutivo con GH una vez que el tumor está controlado, especialmente a pacientes jóvenes. El tratamiento sustitutivo del resto de hormonas hipofisarias deficitarias de por vida es obligado.
Son complicaciones bastante más infrecuentes la atrofia del nervio óptico y deterioro visual. La incidencia de neuropatía óptica por RT que resulta en déficit visual es de un 1–5%.
La incidencia acumulada de tumores cerebrales (especialmente meningioma y astrocitoma), 20 años tras la RT es de aproximadamente un 2%.
Está por aclarar si el aumento de mortalidad cerebrovascular en pacientes tras RT para tumores hipofisarios es un efecto directo o si está causada por el hipopituitarismo inducido. En algunas series se ha encontrado un aumento de mortalidad por accidente cerebrovascular (4 veces mayor que en la población general)39.
Aunque se conoce que la RT en campo amplio en niños se ha asociado con compromiso neurocognitivo, el efecto de la irradiación sobre un volumen pequeño en un cerebro adulto no se asocia de forma tan evidente a deterioro cognitivo. Se necesitan más estudios para determinar el impacto de las técnicas modernas de RT sobre la disfunción neurocognitiva.
Las técnicas estereotáxicas (radiocirugía, RT estereotáxica fraccionada) se han desarrollado para disminuir las complicaciones a largo plazo, al irradiar zonas más localizadas, con mayor gradiente entre el tumor y el tejido adyacente. No se han podido demostrar todavía menos efectos secundarios que con RT convencional, porque no hay suficientes datos a 15–20 años. Es probable que la disminución del volumen irradiado produzca menos tumores, la exclusión del hipotálamo menos déficits hormonales y la exclusión del hipocampo menos alteraciones de la memoria precoz. La precisión con estas técnicas es de 1–2mm, a diferencia de la de la RT convencional que es de 3–5mm, ya que se utilizan guías para fijar la cabeza del paciente. En el caso de RT estereotáxica fraccionada las guías son recolocables en cada sesión. Con tomografía computerizada (TC) o RM se localiza el tumor para una administración precisa.
La RT conformacional permite adaptar mejor la radiación administrada a la forma del tumor.
RadiocirugíaLa radiocirugía puede administrase de diferentes formas:
- a)
una única dosis mediante acelerador lineal modificado: con acelerador lineal de fotones rayos X y guía estereotáxica.
- b)
mediante Gammaknife: con Cobalto-60 y guía estereotáxica.
- c)
CiberKnife: acelerador lineal de fotones rayos X y máscara esterotáxica que permite hipofraccionamiento en 3–5 sesiones.
La dosis es aplicada en una única sesión, y puede variar de 9Gy a 30Gy. La dosis habitual de tratamiento en adenomas hipofisarios es de 25Gy, pero algunos autores utilizan dosis menores (16Gy) para los adenomas no funcionantes, ya que, aunque tienden a ser más grandes, el crecimiento tumoral puede ser controlado con dosis menores de radiación. En los adenomas secretores se aplica una dosis mayor de radiación (25Gy) sobre un menor volumen con el objetivo de controlar temprana y definitivamente la hipersecreción hormonal.
En adenomas no funcionantes residuales o recurrentes se consigue control del volumen tumoral en más del 90% de los casos a partir de los 5 años de seguimiento40. Los efectos a largo plazo sobre la función hipofisaria y la función visual no se han podido establecer debido a que la mayoría de las series todavía tienen un seguimiento corto. Pero comienzan a describirse aumentos en los déficits de hormonas hipofisarias en más del 40% de pacientes, tras 5 años de su administración, que parecen ser más frecuentes en jóvenes. Según una serie de Pollock et al41, el riesgo de nuevos déficits hormonales es de 41% a 5 años. En una revisión más reciente se establecen diferencias de porcentaje de déficits según el tamaño tumoral, un 18% en tumores irradiados de menos de 4 cm y del 58% en tumores más de 4 cm42.
Se han descrito complicaciones, incluyendo déficits de pares craneales o neuropatía óptica en menos del 5% de los casos. Son raros empeoramientos visuales, pero, pese a ser una técnica que se aplica a tumores alejados del quiasma óptico, existe algún caso de neuropatía óptica. Para la radiocirugía en dosis única la tolerancia óptica se ha estimado en 8–10Gy, con aumento del riesgo de neuropatía óptica en pacientes cuyo aparato óptico recibe más de 10–12Gy. Por ello esta técnica se ofrece habitualmente para tumores de menos de 3 cm y alejados más de 3–5mm del quiasma óptico. Con el sistema Cyberknife pueden darse varias sesiones (hipofraccionamiento en 3–5 sesiones) en pacientes con tumores que no son susceptibles de radiocirugía por cercanía al quiasma óptico.
La radiocirugía no se puede aplicar como primera opción RT a pacientes con defectos de campo visual, porque tarda meses en hacer efecto y podría ocasionar que las deficiencias visuales se hicieran definitivas.
Los pares craneales que atraviesan el seno cavernoso (III, IV, V, VI) son mucho más radiorresistentes que el quiasma óptico por lo que la radiocirugía puede utilizarse para restos tumorales en los senos cavernosos.
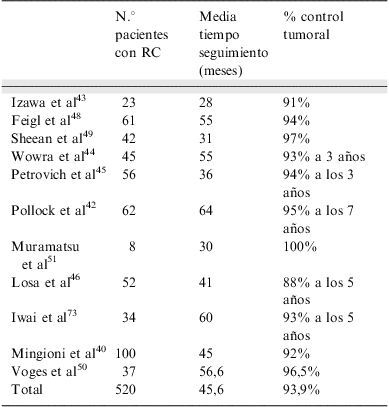
En la tabla 3 se resumen los resultados de las series publicadas de tratamiento con radiocirugía en adenomas hipofisarios no funcionantes40,42–51. La reducción de tamaño ocurre en el 60% de los tumores, mientras que en el 30% no se modifica.
Control tumoral tras radiocirugía posquirúrgica en adenomas hipofisarios no funcionantes¿
| N.° pacientes con RC | Media tiempo seguimiento (meses) | % control tumoral | |
| Izawa et al43 | 23 | 28 | 91% |
| Feigl et al48 | 61 | 55 | 94% |
| Sheean et al49 | 42 | 31 | 97% |
| Wowra et al44 | 45 | 55 | 93% a 3 años |
| Petrovich et al45 | 56 | 36 | 94% a los 3 años |
| Pollock et al42 | 62 | 64 | 95% a los 7 años |
| Muramatsu et al51 | 8 | 30 | 100% |
| Losa et al46 | 52 | 41 | 88% a los 5 años |
| Iwai et al73 | 34 | 60 | 93% a los 5 años |
| Mingioni et al40 | 100 | 45 | 92% |
| Voges et al50 | 37 | 56,6 | 96,5% |
| Total | 520 | 45,6 | 93,9% |
RC: radiocirugía.
Se recomienda suspender tratamiento con análogos de somatostatina 2–3 meses antes de la RT, porque las células en fase G0 responden peor a ella. Se reanudarían pasados 2–3 meses de la RT.
Son indicaciones de radiocirugía52:
- 1)
Tumores de menos de 2–3cm.
- 2)
Tratamiento de rescate tras RT fraccionada.
- 3)
Tumor intraselar con riesgo o rechazo quirúrgico.
- 4)
Crecimiento de restos tumorales.
- 5)
Restos tumorales mayores de 1cm alejados de la vía óptica al menos 3–5mm.
- 6)
Invasión tumoral del seno cavernoso no extirpable.
La radioterapia estereotáxica fraccionada FSRT se administra como la RT convencional, en 25–30 sesiones (dosis diarias de 2Gy, hasta llegar a 48–54Gy), o bien, en hipofraccionamiento en 3–5 sesiones, mediante acelerador lineal de fotones rayos X y guías o máscaras estereotáxicas recolocables.
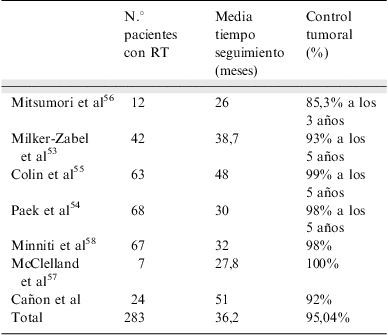
Consigue controlar la progresión del tumor en más del 95% de pacientes a partir de los 5 años de seguimiento. En la tabla 4 se resumen los resultados de las series publicadas de tratamiento con FSRT en adenomas hipofisarios no funcionantes53–58.
Control tumoral tras radioterapia estereotáxica fraccionada posquirúrgica en adenomas hipofisarios no funcionantes¿
| N.° pacientes con RT | Media tiempo seguimiento (meses) | Control tumoral (%) | |
| Mitsumori et al56 | 12 | 26 | 85,3% a los 3 años |
| Milker-Zabel et al53 | 42 | 38,7 | 93% a los 5 años |
| Colin et al55 | 63 | 48 | 99% a los 5 años |
| Paek et al54 | 68 | 30 | 98% a los 5 años |
| Minniti et al58 | 67 | 32 | 98% |
| McClelland et al57 | 7 | 27,8 | 100% |
| Cañon et al | 24 | 51 | 92% |
| Total | 283 | 36,2 | 95,04% |
RT: radioterapia.
La frecuencia de hipopituitarismo parece ser similar a la de la radiocirugía (más de un 30% a los 4 años).
Se ha descrito neuropatía óptica en 1–3% de pacientes.
Dado el corto período de seguimiento de las series no hay datos publicados de accidentes cerebrovasculares, segundos tumores ni disfunción neurocognitiva.
No parece haber diferencias en la eficacia y seguridad respecto a la radiocirugía, pero a diferencia de esta, no hay restricciones en tamaño y posición de los tumores para la FSRT en dosis estándar como en la radiocirugía.
Son indicaciones de FSRT52:
- 1)
Resto tumoral >2–3cm.
- 2)
Lesión extensa supraselar o de difícil delimitación.
- 3)
Crecimiento de restos tumorales.
- 4)
Resto tumoral cercano a la vía óptica.
La radioterapia de intensidad modulada (IMRT) se administra en 25–30 sesiones, mediante acelerador lineal de fotones de rayos X y usando una máscara para inmovilizar al paciente. Representa una forma avanzada de RT conformacional en 3 dimensiones, con el potencial de conseguir mucha menos irradiación a los tejidos adyacentes. Es especialmente útil para formas complejas y regiones cóncavas, cerca de estructuras críticas; usa múltiples subcampos creados por colimador multiláminas (MLC) que se mueven bajo control de ordenador creando campos modulados. La radiación puede ser administrada como campos MLC estáticos (step—and— shoot) o dinámicos (sliding window). Existen muy pocos datos acerca de resultados a largo plazo de la IMRT en tumores hipofisarios, por lo que todavía no es posible concluir que ofrezca ventajas sobre el control tumoral o la toxicidad59.
FármacosLos fármacos agonistas dopaminérgicos, los análogos de somatostatina y los análogos de GnRH pueden producir reducciones modestas de los tumores en unos pocos pacientes, pero su escasa eficacia impide que sean tratamiento de primera línea. Además son estudios con duración insuficiente para poder sacar conclusiones definitivas de su efectividad en el tratamiento60.
Agonistas dopaminérgicosDe entre los fármacos estudiados, la cabergolina, que tiene mayor duración de acción y más especificidad y afinidad por el receptor dopaminérgico D2 (presentes en prolactinomas y gonadotropinomas), ha abierto nuevas vías de estudio. Sin embargo, su papel como tratamiento coadyuvante tras cirugía no curativa de adenomas no funcionantes no está todavía establecido.
En un estudio de Pivonello et al,61 los receptores D2 se expresaron en un 67% de los casos. La expresión de la isoforma D2 corta se ha asociado con la respuesta más favorable al tratamiento con cabergolina. Los receptores D4 están presentes en el 17% de adenomas no funcionantes. En la revisión de Colao et al60 de diferentes estudios en que utilizaron agonistas dopaminérgicos en adenomas clínicamente no funcionantes, la visión mejoró en más del 20% de pacientes y se estabilizó en más del 70%. El volumen tumoral disminuyó en el 25% de los casos y se estabilizó en más del 60%. Considerando exclusivamente los estudios con cabergolina hubo reducción tumoral en más del 40% de los pacientes. Por todo ello debe esperarse que al menos la cabergolina pueda tener utilidad en el tratamiento de los adenomas no funcionantes. Su utilización después de la cirugía podría retrasar el crecimiento tumoral, aunque no es una práctica habitual y requiere de más estudios que confirmen los los resultados62.
En caso de aplicar un tratamiento con cabergolina deben hacerse ecocardiogramas periódicos, dado el aumento de incidencia de enfermedad valvular cardíaca en pacientes con enfermedad de Parkinson, aunque, dadas las dosis menores que se utilizan para el tratamiento de tumores hipofisarios, no se han asociado en general a lesiones clínicamente significativas63.
Análogos de somatostatinaLas series publicadas de tratamiento con análogos de somatostatina son pequeñas y con un seguimiento demasiado corto. La reducción tumoral ocurre solo en un 12%, mientras que hubo crecimiento en el 5%. La cefalea mejora aunque no haya reducción del volumen tumoral. Las alteraciones visuales también mejoraron en un 33% de los casos60.
La presencia de receptores de la somatostatina del subtipo sst2 predice la respuesta a análogos de somatostatina. Esta ejerce su efecto antiproliferativo reduciendo la secreción y acción del factor de crecimiento endotelial vascular (VEGF). El pasireotide (SOM230) actúa sobre receptores de la somatostatina sst1-3 y sst5 y altera el crecimiento del endotelio vascular en tumores no funcionantes.
En un estudio con 25 tumores64 no funcionantes se probó la respuesta a somatostatina y SOM230 en cultivos celulares. Todos expresaron VEGF; 22 expresaban el subtipo de receptor VEGF-R1 y 23 expresaban VEGF-R2. Tras un tratamiento in vitro con somatostatina hubo respuesta en 13 cultivos y no la hubo en 12. Se consideraba respuesta si el VEGF se reducía un 15%.
En los tumores respondedores el porcentaje de los distintos tipos de receptores expresados fue de 77% sst1, 92% sst2, 70% sst3, 54% sst4 y ninguno sst5. La secreción de VEGF se redujo un 24% tras somatostatina y 31% tras SOM230.
En los tumores no respondedores también un 58% expresaba receptores sst1, 85% sst2, 67% sst3, 75% sst4 y 75% sst5. El tratamiento con somatostatina o SOM230 no influyó significativamente en la secreción de VEGF.
La viabilidad celular se redujo un 15% con somatostatina y un 16,5% con SOM230 en los cultivos respondedores y no hubo respuesta a somatostatina o SOM230 en los no respondedores. El grupo respondedor no expresaba receptores sst5, que es donde ejerce mayor afinidad SOM230 respecto a somatostatina, por lo que los mecanismos de estos fármacos sobre los receptores están todavía por aclarar.
Tratamiento combinado de agonistas dopaminérgicos y análogos de somatostatinaLa combinación de cabergolina y análogos de somatostatina en un estudio realizado con 10 pacientes condujo a la reducción de defectos visuales en un 30%60. Pero se requieren estudios con mayor número de pacientes.
Parece que los receptores D2 y sst5 podrían interactuar creando un nuevo receptor. La quimera BIM-23A760 tiene efectos similares a la cabergolina, siendo un análogo de somatostatina y se ha probado su efecto en cultivos celulares de adenomas hipofisarios no funcionantes65.
Análogos de GnRHHan sido probados sin éxito en adenomas hipofisarios no-funcionantes60.
TemozolamidaEs un agente quimioterápico utilizado como opción de tratamiento en carcinomas hipofisarios y adenomas agresivos resistentes a tratamientos convencionales. Estudios recientes han demostrado que la respuesta a dicho fármaco depende de la inmunoexpresión de O6−metilguanina ADN metiltransferasa (MGMT)66.
En un estudio comparativo entre 24 tumores recidivantes y progresivos y 21 libres de tumor (grupo control) se observó una baja expresión de MGMT (<50%) antes de la cirugía en el 50% de pacientes en el grupo de tumores agresivos frente a 24% en el grupo control. Después de cirugías repetidas se observó una distribución de MGMT similar. Hubo un intervalo más corto entre cirugías en pacientes con expresión baja de MGMT. Los datos sugieren que la mitad de los pacientes con tumores agresivos podrían ser potencialmente candidatos a temozolamida cuando cirugías repetidas, radiocirugía y RT fallan.
En un macroadenoma no funcionante tratado con temozolamida se obtuvo una reducción tumoral del 55% (máxima tras 10 ciclos)67. Clínicamente mejoró la cefalea y el campo visual. El tumor medía 45×43mm antes del inicio de temozolamida, tras 5 cirugías y tratamiento con octreotide y cabergolina. El tejido tenía escasa positividad para MGMT y una expresión de antígeno de proliferación celular ki-67 de 2%.
Seguimiento de los macroadenomasDebe realizarse nueva valoración hormonal a los 2 meses de la cirugía. Si la concentración de cortisol tras 24h sin hidrocortisona es mayor de 10μg/dl se debe confirmar la integridad del eje suprarrenal con la prueba de hipoglucemia insulínica, midiendo además GH. Si el cortisol basal es menor (y sobre todo si el déficit era previo) no es preciso hacer la prueba de hipoglucemia insulínica, y la secreción de GH se valorará por otros estímulos. Si el paciente ha precisado desmopresina se debe suspender el tratamiento y medir la diuresis nocturna. No suele ser necesario realizar la prueba de deprivación de agua. Si el ciclo menstrual no se reanuda en mujeres premenopaúsicas se instaurará un tratamiento con estrógenos y progesterona. En varones, si la testosterona está disminuida se iniciará tratamiento sustitutivo. En caso de déficit de tiroxina (T4) previo a la cirugía se debe disminuir la dosis de levotiroxina (LT4) para medir T4 libre (la tirotropina [TSH] no tiene valor). La función hipofisaria debe reevaluarse anualmente68.
Después de la cirugía los materiales de relleno, el engrosamiento de la mucosa y la sangre dificultan la valoración de restos posquirúrgicos, por lo que la primera RM se debe evaluar 4 meses tras cirugía. Posteriormente su frecuencia depende de los hallazgos acerca de volumen residual y distancia al quiasma. En general se aconseja realizar una RM anual tras la cirugía los primeros 3–5 años, aumentando la frecuencia si existe crecimiento69. En ausencia de progresión se pueden espaciar los intervalos a 2–3 años. Los tumores corticotropos silentes (inmunohistoquímica positiva para ACTH) pueden seguirse más frecuentemente que el resto por su especial agresividad.
Debe hacerse seguimiento oftalmológico posquirúrgico: el primero semanas después de la cirugía y luego al año y 2 años; es poco predictivo en tumores alejados del quiasma. Si el tumor está cerca del quiasma se deben mantener los estudios oftalmológicos periódicos.
En tumores radiados, dado que la RT no previene la recidiva, en todos los casos debe también realizarse seguimiento con RM. En pacientes en los que se decide un tratamiento conservador es razonable realizar RMN cada 1–2 años. Se ha estimado que el crecimiento usual es de solo 0,6mm/año, que está por debajo del límite de detección habitualmente usado en RM. Por ello es un abordaje seguro realizar las RM cada 2 años. Hay que comparar RM antiguas, puesto que el aumento puede ser pequeño para detectarlo entre 2 RM consecutivas. Debe realizarse seguimiento durante al menos 10 años en todos los pacientes70.
La calidad de vida está claramente comprometida en pacientes con adenomas hipofisarios no funcionantes, influida sobre todo por las deficiencias hormonales, aunque no alcanza al nivel de la de los adenomas funcionantes71.
Los estudios sobre mortalidad muestran que está ligeramente aumentada, comparada con la población general, principalmente debido a enfermedades respiratorias, cardiovasculares y cerebrovasculares, pero el intervalo de confianza no permite conclusiones definitivas. Parece deberse a varios factores, incluidos la cirugía, el hipopituitarismo y la RT28.
Manejo de los microadenomasEn seguimientos radiológicos de microadenomas hipofisarios se comprueba que el crecimiento no es frecuente. En una revisión de 18.631 hipófisis estudiadas por autopsia se encontraron un 10% de adenomas y solo 7 de ellos fueron macroadenomas72, lo que también apoya la afirmación de que la progresión de micro a macroadenoma es rara. No obstante, una serie reciente7 demostró que un 19% crecieron aunque ninguno desarrolló compromiso visual.
Por lo tanto, en los microadenomas se recomienda observación periódica, con RM al año y a los 2 y 5 años.
ConclusionesEn los macroadenomas, en general, se aconseja realizar una cirugía transesfenoidal. Si no hay restos tumorales posquirúrgicos o estos son pequeños se vigilarán por técnicas de imagen; si crecen se optará por RT. En caso de remanente posquirúrgico mayor de 1cm o de restos localizados en zonas donde un crecimiento tumoral pueda comprometer estructuras importantes se administrará RT posquirúrgica, puesto que el riesgo de crecimiento a largo plazo es superior al 50% y con RT se reduce a menos del 20% de pacientes.
En los microadenomas se recomienda seguimiento por pruebas de imagen, dado que el crecimiento no es frecuente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.