Los tumores carcinoides derivan de las células neuroendocrinas. Son poco frecuentes (2-5 casos por 100.000 habitantes y año)1, aunque en las últimas décadas su incidencia ha aumentado, en parte gracias al perfeccionamiento de las técnicas diagnósticas. Los tumores localmente invasivos o metastásicos suelen producir un síndrome carcinoide, y una vez establecido éste, más de la mitad de los casos desarrolla síntomas de afectación cardíaca (cardiopatía carcinoide), que en general afecta a las válvulas derechas2.
Presentamos el caso de un varón de 73 años en estudio por diarreas y episodios de rubefacción y sofocos. Tenía antecedentes de tabaquismo, hipertensión arterial, diabetes mellitus y cardiopatía isquémica clínicamente estable. A la exploración física destacaba telangiectasias faciales, hipoventilación pulmonar generalizada, soplo sistólico de regurgitación tricúspide, desdoblamiento del segundo tono cardíaco y hepatomegalia nodular no dolorosa a 10cm del reborde costal. El hemograma objetivaba anemia microcítica ferropénica, los tiempos de coagulación y la función hepática eran normales, y los marcadores tumorales Ca 19.9 (44,5 U/mL [0,1-35]) y enolasa neuronal específica (24,4 ng/mL [0,1-13]) estaban elevados.
Se realizó una ecografía abdominal que mostraba múltiples lesiones hepáticas ocupantes de espacio. La tomografía computerizada (TC) tóraco-abdominal las caracterizaba como sólidas, sugerentes de metástasis, algunas con necrosis central, sin poder identificar el tumor primario. La gastroscopia y la colonoscopia fueron normales. La punción-aspiración con aguja fina de las lesiones hepáticas mostraba células de origen neuroendocrino, con inmunohistoquímica positiva para sinaptofisina. El Ki-67 era normal (inferior a 2%). Las concentraciones de ácido 5-hidroxiindolacético en orina estaban elevadas (cociente 5-HIAA/creatinina en orina 297,4mg/g de creatinina [0,1-10]), así como las concentraciones de gastrina (244 pg/mL [13-115]) y cromogranina A (348 ng/mL [< 100]) plasmáticas.
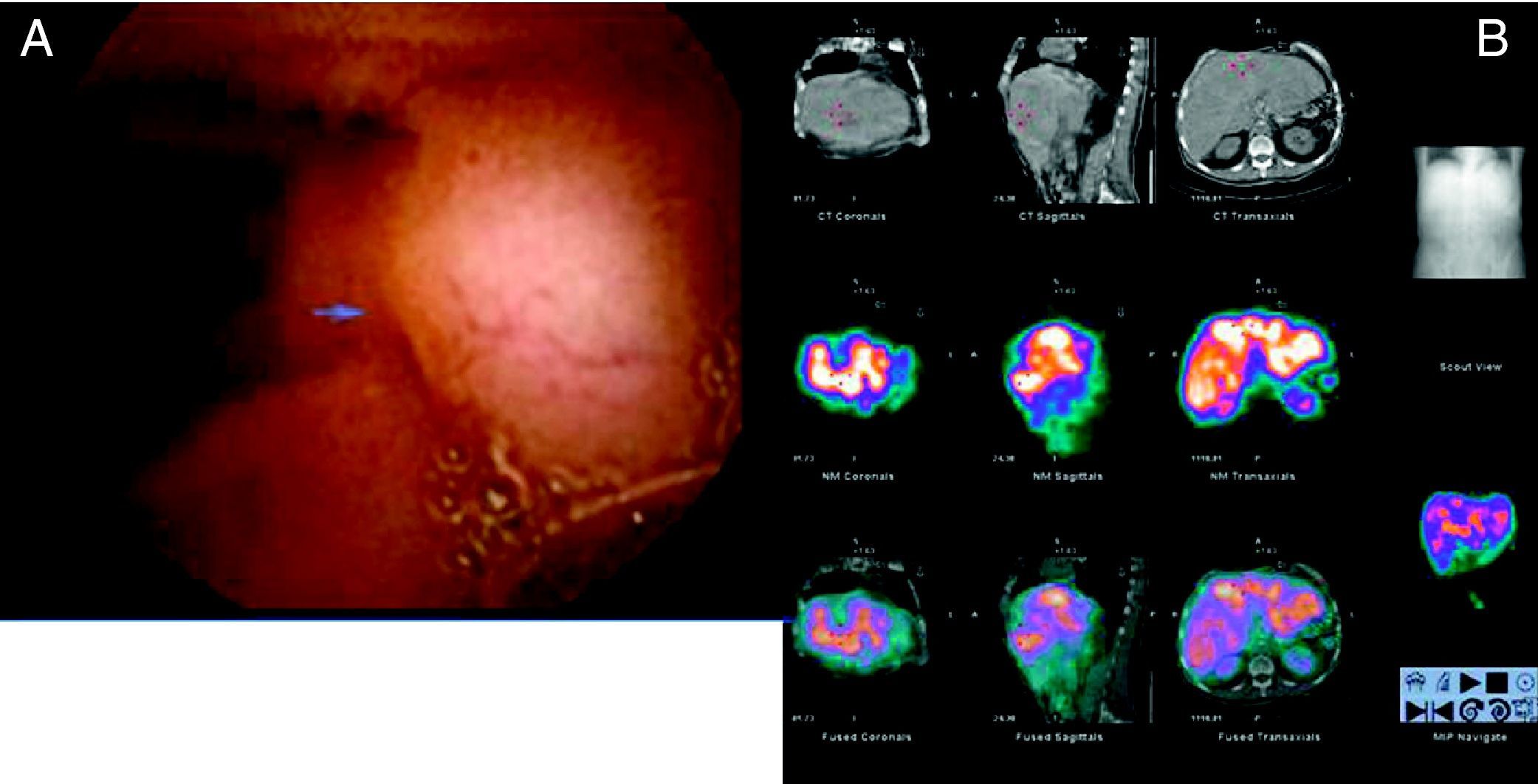
Ante la sospecha de un tumor neuroendocrino intestinal, se realizó una vídeo-cápsula endoscópica (fig. 1A), que identificó una lesión submucosa en el yeyuno, que no obstruía la luz intestinal, con vascularización superficial, compatible con un tumor carcinoide. Se valoró la extensión de la enfermedad y la presencia de receptores de somatostatina mediante una gammagrafía corporal total y SPECT-TC con 111In-DTPA-D-Phe-octreótida (fig. 1B), que mostraba una importante actividad del radiotrazador en múltiples áreas del parénquima hepático, siendo este hallazgo muy sugerente de afectación metastásica, sin evidencia de afectación extrahepática.
A partir de la clínica y las pruebas complementarias realizadas se diagnosticó al paciente de tumor carcinoide de bajo grado estadio IV, y se inició tratamiento con análogos de somatostatina para el control del síndrome carcinoide.
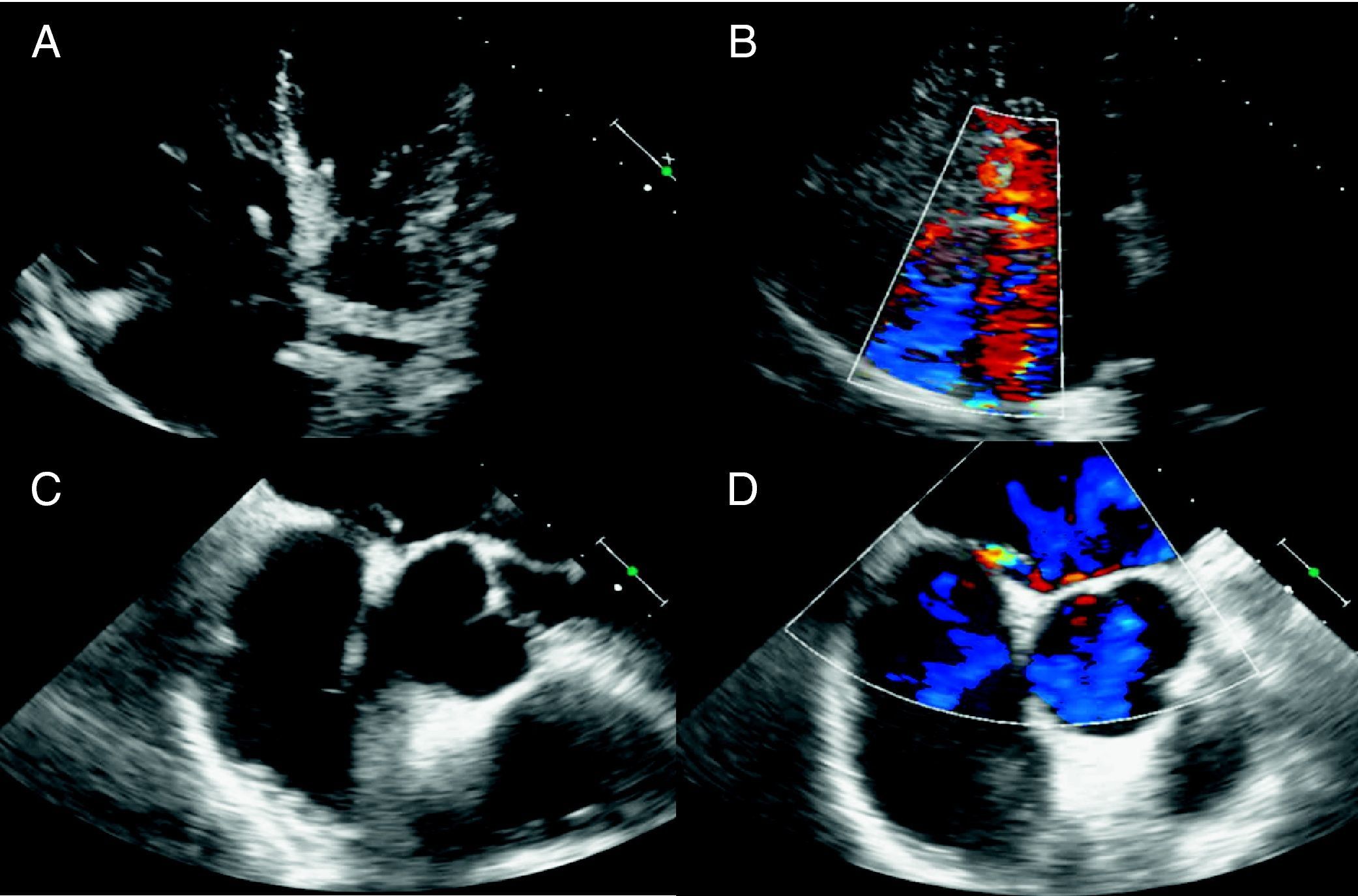
El paciente presentaba disnea, especialmente en la bipedestación, con mejoría parcial en el decúbito supino. La gasometría arterial con oxígeno ambiental mostraba una intensa hipoxemia (pO2 47mmHg), que no remontaba tras la administración de oxígeno al 100% (pO2 70mmHg), sugiriendo la existencia de un cortocircuito entre las circulaciones derecha e izquierda. La TC pulmonar y la gammagrafía de ventilación-perfusión descartaron la posibilidad de tromboembolismo pulmonar. El ecocardiograma transtorácico (fig. 2A y B) mostraba una insuficiencia tricúspide moderada, una estenosis tricúspide moderada y una dilatación moderada de las cavidades cardíacas derechas, sin afectación de las izquierdas. Se intuía, además, un abombamiento del septo interauricular. Mediante un ecocardiograma transesofágico (fig. 2C y D) se confirmó la presencia de un foramen oval permeable (FOP) de 2cm de diámetro, que permitía un cortocircuito intracardíaco derecha-izquierda.
El cateterismo cardíaco derecho descartaba la presencia de hipertensión pulmonar, pero objetivaba una elevación importante de las presiones diastólicas de las cavidades derechas tras el inflado de un balón a través del FOP.
Mediante esternotomía media y circulación extracorpórea se procedió a la sustitución valvular tricúspide con una prótesis biológica y al cierre del FOP, con una evolución posterior satisfactoria y sin complicaciones.
La cardiopatía carcinoide se debe al engrosamiento y deformidad del aparato valvular, predominantemente derecho, y es una de las principales causas de morbimortalidad por insuficiencia cardíaca derecha2. Las evidencias actuales apoyan la hipótesis de que la cardiopatía no se debe a la afectación directa metastásica, sino a la liberación de sustancias vasoactivas que inducen una fibrosis endomiocárdica2,3. Para que se desarrolle la cardiopatía carcinoide es necesaria la presencia de metástasis hepáticas que impidan la inactivación de dichas sustancias por el metabolismo hepático.
Respecto al tratamiento, no se ha demostrado que el control de la secreción humoral provoque una regresión de las lesiones cardíacas. Tampoco se ha evidenciado que la cirugía del tumor primario o de las metástasis resulte curativa una vez establecida la fibrosis endomiocárdica. El tratamiento de elección de la cardiopatía carcinoide es el recambio valvular, que mejora la calidad de vida global del paciente y su supervivencia2.
La persistencia del FOP en adultos es frecuente, con una prevalencia de hasta el 25% en la población general. En la mayoría de los casos se trata de un hallazgo sin repercusiones clínicas, pero cuando existe otra afectación cardíaca asociada puede provocar un síndrome de platipnea-ortodesoxia4, en el que el paciente presenta disnea con la bipedestación. En el caso de la cardiopatía carcinoide, puede contribuir, además, al desarrollo de alteraciones valvulares y endomiocárdicas en las cámaras cardíacas izquierdas debido al paso de las sustancias vasoactivas a través del FOP. La afectación izquierda es excepcional en otras circunstancias distintas del FOP, limitándose a los carcinoides bronquiales, metástasis pulmonares o a una intensa secreción endocrina que sobrepase la capacidad de depuración pulmonar3,5. Por eso, la presencia del FOP se ha llegado a considerar como un marcador de progresión de la cardiopatía carcinoide, y algunos autores sugieren evaluar su presencia de forma sistemática en los pacientes con un síndrome carcinoide6.
Para ello se aconseja la “prueba de las burbujas” mediante ecocardiografía transtorácica6. Pero si la sospecha clínica es alta, por ejemplo por la existencia de un síndrome de platipnea-ortodeoxia, como en el caso de este paciente, y la ecocardiografía transtorácica no es concluyente, algunos autores sugieren recurrir a métodos más sensibles como la ecocardiografía transesofágica, que sirvió para el diagnóstico en este paciente, o el Doppler transcraneal7.
Cuando coexisten el FOP y la cardiopatía carcinoide, el cierre del FOP puede mejorar la disnea y la hipoxemia si se asocia a un recambio valvular tricúspide. Así, se evita la dilatación progresiva de la aurícula derecha, se resuelve el FOP y se previene el desarrollo de una mayor hipertensión pulmonar. De no realizarse esta doble intervención, empeoraría la restricción al llenado del ventrículo derecho, y con ello la insuficiencia cardíaca derecha. Además, la precarga del ventrículo izquierdo disminuiría y ocasionaría una insuficiencia cardíaca izquierda por bajo gasto añadida8.
Las escasas series publicadas hasta la fecha sostienen que la disnea de los pacientes con cardiopatía carcinoide y FOP mejora significativamente tras la doble intervención descrita. Esta circunstancia se ha observado también en este caso. Sin embargo, algunos autores sugieren que puede persistir cierto grado de cortocircuito intracardíaco residual que no descarta la posibilidad de una futura afectación del corazón izquierdo9.
Por tanto, a pesar de que los tumores carcinoides se diagnostiquen en fases avanzadas y con gran afectación sistémica, como en el caso que presentamos, se debe mantener el tratamiento médico, que mejora los síntomas del síndrome carcinoide10. Además, se debe resolver la cardiopatía carcinoide, pero previamente es imprescindible descartar la presencia de un FOP, muy prevalente en la población general. Las guías clínicas actuales recomiendan emplear la ecocardiografía transtorácica6; sin embargo, cuando ésta no sea concluyente y la sospecha clínica sea elevada, sugerimos emplear otros métodos más sensibles, como los citados anteriormente. De este modo, en caso de existir un FOP, será necesario su cierre asociado al recambio valvular para conseguir una mayor supervivencia global. No identificar el FOP e intervenir únicamente sobre la válvula puede empeorar el pronóstico del paciente.