En el carcinoma papilar de tiroides, la detección de metástasis linfáticas (ML) en la región cervical es frecuente, observándose en cerca de la mitad de los casos en el momento del diagnóstico. El objetivo del estudio es analizar mediante técnica inmunohistoquímica la expresión combinada de diversas moléculas con el fin de establecer las características de aquellos casos con mayor tendencia a desarrollar ML.
Pacientes y métodosTreinta y cinco pacientes con carcinoma papilar de tiroides fueron distribuidos en 2 grupos. El grupo i incluyó 19 pacientes que no presentaron ML al diagnóstico. En el grupo ii se incluyeron 16 pacientes en los cuales se había demostrado la presencia de ML. En todos los casos se practicó tinción inmunohistoquímica para RET/PTC, receptor del factor de crecimiento epidérmico (EGFR), p16INk4a, p21cip1, p27kip1, BCL2 y pAKT.
ResultadosNo se apreciaron diferencias en ambos grupos en relación a p21cip1, p27kip1, p16INk4a, Bcl-2 y pAKT. No obstante, se observaron diferencias de expresión para RET/PTC y para EGFR, siendo ambas más frecuentes en los pacientes con ML. Asimismo se vio que la doble positividad de RET/PTC y el EGFR discriminaba de manera significativa los casos con ML. Finalmente, la triple combinación: RET/PTC negativo, EGFR negativo y p16INk4a negativo no se daba en ningún paciente del grupo ii y en casi la mitad del grupo i.
ConclusionesEl estudio de la expresión de diversas moléculas de manera combinada puede resultar eficaz en la caracterización fenotípica del carcinoma papilar de tiroides. Con ello se podría mejorar el manejo de los pacientes con cáncer de tiroides.
Regional lymph node metastases (LNM) are a common finding in papillary thyroid cancer (PTC). Approximately half of patients have LNM at diagnosis. The aim of this study was to analyze immunohistochemically the combined expression of different PTC-related molecules in order to identify cases with a tendency to show LNM.
Patients and methodsThirty-five patients were included in the study. The patients were distributed in two groups. Group I included 19 patients with no histological evidence of LNM at diagnosis. Group II included 16 patients with histological evidence of cervical LNM. Samples were stained for RET/PTC, EGFR, p16INk4a, p21cip1, p27kip1, BCL2, and pAKT.
ResultsExpression of p21cip1, p27kip1, p16INk4a, Bcl-2, and pAKT showed no differences between the two groups. However, RET/PTC and EGFR expression showed significant differences: in both cases, staining was more frequent in patients with LNM. Simultaneous positivity of RET/PTC and EGFR was a discriminative marker in patients with LNM. Finally, the combination of RET/PTC negative, EGFR negative and p16INk4a negative was found in none of the patients with LNM but in nearly half of those in group I.
ConclusionsImmunohistochemical analysis of several molecular markers could be useful in the phenotypic characterization of PTC. Application of these markers could enhance diagnosis and improve the management of patients with thyroid cancer.
El carcinoma papilar de tiroides (CPT) es la neoplasia endocrina más frecuente. Se caracteriza por su excelente pronóstico con supervivencias que superan el 90% a los 10 años de seguimiento1. No obstante, las recidivas de la enfermedad no son infrecuentes llegando a alcanzar en algunas series hasta el 20% de los casos2. Una de las formas de presentación más frecuente de la recurrencia es la invasión de los ganglios regionales. De hecho, el CPT se caracteriza por la elevada facilidad con que se propaga por vía linfática, de modo que más del 30% de los pacientes suelen presentarse con afectación ganglionar en el momento del diagnóstico3. A pesar de ello, algunos autores han descrito que la presencia de metástasis linfáticas (ML) en la región cervical, ya sea al inicio o con posterioridad, no implica obligatoriamente un empeoramiento del pronóstico4.
Por otro lado, en los últimos años se han empezado a dilucidar las bases genéticas que determinan la transformación tumoral de las células tiroideas normales hasta el CPT. Así, se han descrito diversas mutaciones algunas de las cuales son altamente específicas en este tipo de neoplasia. Entre ellas cabe destacar rearranged in transformation/papillary thyroid carcinomas (RET/PTC) que es el resultado del reordenamiento cromosómico del gen RET y que se considera como una alteración inicial en el desarrollo del CPT5. Asimismo, diversos autores han demostrado la importancia de ciertas familias de oncogenes, cuya implicación se había puesto de manifiesto en tumores de otras localizaciones y que pueden tener su papel en el carcinoma diferenciado de tiroides. De este modo, se han podido analizar diferentes moléculas reguladoras del ciclo celular, factores relacionados con la apoptosis o receptores con actividad tirosina cinasa.
El objetivo del presente estudio es analizar la expresión inmunohistoquímica de diferentes moléculas en pacientes con CPT en relación a la presencia de metástasis ganglionares iniciales. Para ello, comparamos la expresión de RET/PTC, receptor del factor de crecimiento epidérmico (EGFR), p16INk4a, p21cip1, p27kip1, BCL-2 y pAKT en muestras tumorales de pacientes afectos de CPT con y sin metástasis ganglionares en el momento del diagnóstico.
Material y métodoPacientesSe realizó una revisión sistemática de los pacientes tratados de CPT en nuestro centro. Se seleccionaron aquellos casos de los cuales se dispusiera de toda la información clínica e histológica, que tuvieran un seguimiento posterior al tratamiento superior a los 5 años y que no presentaran metástasis a distancia en el momento del diagnóstico. En todos los casos el tratamiento inicial consistió en tiroidectomía total con vaciamiento linfático central, seguida de ablación de restos con yodo 131. Así se incluyeron 35 pacientes que fueron distribuidos en 2 grupos:
Grupo I: incluyó 19 pacientes (15 mujeres y 4 varones) con una media±desviación típica de edad al diagnóstico del tumor de 38,6±10 años. El tiempo de seguimiento desde el tratamiento fue de 13,2±4,3 años. En ningún caso se demostró afectación ganglionar en el momento de la cirugía inicial.
Grupo II: incluyó 16 pacientes (11 mujeres y 5 varones) con una edad inicial de 30,6±18 años. El tiempo de seguimiento fue de 12,9±5,3 años. Todos los pacientes presentaban ML cervicales, demostradas histológicamente, en el momento del diagnóstico.
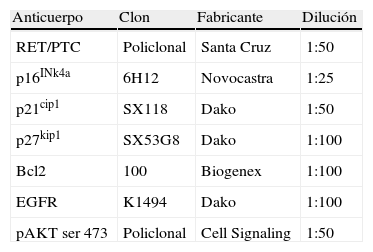
MetodologíaDe los casos seleccionados, se revisó la histología para confirmar el diagnóstico y se seleccionaron 3 zonas representativas del tumor. De los bloques de matrices de tejidos se realizaron cortes de 3μ que fueron desparafinados y rehidratados con pases sucesivos en xilol y alcoholes. Posteriormente, se bloqueó la actividad de la peroxidasa endógena mediante peróxido de hidrógeno. El desenmascaramiento antigénico se realizó mediante calor con tampón citrato a pH 6. El anticuerpo primario utilizado así como la dilución empleada en cada caso están indicados en la tabla 1. Para visualizar la reacción se usó el sistema Envision (Dako, Glostrup, Dinamarca). Para todos los anticuerpos se utilizaron casos controles positivos conocidos y se realizaron controles negativos omitiendo el anticuerpo primario.
Anticuerpos utilizados para las tinciones immunohistoquímicas con la dilución empleada en cada caso
| Anticuerpo | Clon | Fabricante | Dilución |
| RET/PTC | Policlonal | Santa Cruz | 1:50 |
| p16INk4a | 6H12 | Novocastra | 1:25 |
| p21cip1 | SX118 | Dako | 1:50 |
| p27kip1 | SX53G8 | Dako | 1:100 |
| Bcl2 | 100 | Biogenex | 1:100 |
| EGFR | K1494 | Dako | 1:100 |
| pAKT ser 473 | Policlonal | Cell Signaling | 1:50 |
EGFR: receptor del factor de crecimiento epidérmico.
Para todos los anticuerpos se evaluó la localización de la tinción, la intensidad de la misma así como el porcentaje de células positivas. Los anticuerpos con tinción nuclear (p16INk4a, p21cip1, p27kip1, pAKTn) se evaluaron utilizando el histoscore calculado de la siguiente manera: porcentaje de células con intensidad fuerte×3+porcentaje de células moderadas×2+porcentaje de células débiles×1. Los resultados posibles van de 0–300 y se consideró una muestra positiva cuando el histoscore era superior a 10. Los marcadores con positividad citoplasmática (p16INk4a, bcl2, pAKTc, y RET/PTC) se evaluaron en 4 posibles valores: negativo, 1+ (débil), 2+ (moderado) y 3+ (fuerte). El marcador de expresión de membrana EGFR se evaluó como negativo (ausencia de expresión), 1+ (expresión focal de parte de la membrana), 2+ (expresión de toda la membrana pero débil) y 3+ (expresión intensa en toda la membrana). Para el estudio estadístico se consideró una muestra positiva cuando el valor fue de 2+ – 3+.
El análisis estadístico se realizó mediante la prueba exacta de Fisher en el estudio univariante, y mediante el test de la t de Student para comparar variables continuas entre los grupos. Se consideró con significación estadística una p inferior o igual a 0,05.
ResultadosNo hubo diferencias significativas en las características de los 2 grupos en cuanto a edad al diagnóstico, sexo o tiempo de evolución de la enfermedad.
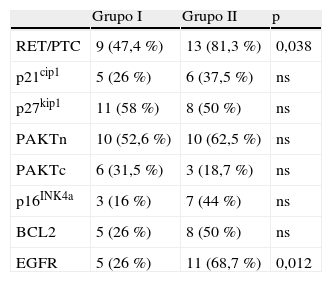
La tabla 2 resume los hallazgos de las tinciones inmunohistoquímicas. No se apreciaron diferencias en ambos grupos en relación a los marcadores de ciclo celular (p21cip1, p27kip1 y p16INk4a). Aunque no alcanzó significación estadística, la positividad para p16INk4a fue superior en el grupo ii (44% frente a 16%; p=0,06). Tampoco se apreciaron diferencias en la actividad de AKTn, AKTc y en Bcl-2. No obstante, el estudio inmunohistoquímico puso de manifiesto diferencias de expresión para RET/PTC y para EGFR. En el caso de RET/PTC, 9 de los 19 pacientes del grupo i (47,3%) fueron portadores de la alteración genética, mientras que en los pacientes del grupo ii la positividad se elevó a 13 de las 16 muestras (81,3%) (p=0,038). Por otro lado, tan solo en 5 casos (26%) del grupo i se observó tinción para EGFR y, en cambio, 11 casos resultaron positivos en el grupo ii (68,7%) (p=0,01).
Positividad de las tinciones immunohistoquímicas de las diferentes moléculas estudiadas para cada uno de los dos grupos
| Grupo I | Grupo II | p | |
| RET/PTC | 9 (47,4 %) | 13 (81,3 %) | 0,038 |
| p21cip1 | 5 (26 %) | 6 (37,5 %) | ns |
| p27kip1 | 11 (58 %) | 8 (50 %) | ns |
| PAKTn | 10 (52,6 %) | 10 (62,5 %) | ns |
| PAKTc | 6 (31,5 %) | 3 (18,7 %) | ns |
| p16INK4a | 3 (16 %) | 7 (44 %) | ns |
| BCL2 | 5 (26 %) | 8 (50 %) | ns |
| EGFR | 5 (26 %) | 11 (68,7 %) | 0,012 |
EGFR: receptor del factor de crecimiento epidérmico; ns: no significativo.
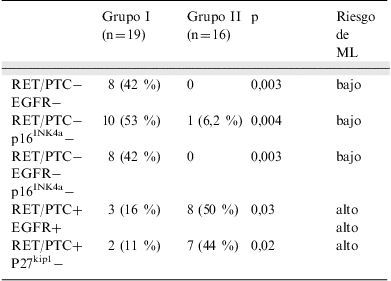
En el estudio combinado se observó que la doble positividad de RET/PTC y EGFR tan solo estaba presente en 3 (16%) pacientes sin metástasis ganglionares iniciales, mientras que se encontraba en 8 (50%) de los pacientes con afectación ganglionar (p=0,03). Paralelamente, la doble negatividad de ambos marcadores se encontró en 8 casos del grupo i (42%), no habiendo ningún caso en el grupo ii con este fenotipo (p=0,003). Finalmente, la triple combinación más discriminatoria fue RET/PTC negativo, EGFR negativo y p16INk4a negativo, que no se da en ningún paciente del grupo ii y en casi la mitad, 8 de 19 (42%), del grupo i (p=0,003). En la tabla 3 se resumen los fenotipos más característicos para cada uno de los 2 grupos.
Análisis combinado. Fenotipos con expresión significativamente diferente en función del grupo estudiado
| Grupo I (n=19) | Grupo II (n=16) | p | Riesgo de ML | |
| RET/PTC− | 8 (42 %) | 0 | 0,003 | bajo |
| EGFR− | ||||
| RET/PTC− | 10 (53 %) | 1 (6,2 %) | 0,004 | bajo |
| p16INK4a− | ||||
| RET/PTC− | 8 (42 %) | 0 | 0,003 | bajo |
| EGFR− | ||||
| p16INK4a− | ||||
| RET/PTC+ | 3 (16 %) | 8 (50 %) | 0,03 | alto |
| EGFR+ | alto | |||
| RET/PTC+ | 2 (11 %) | 7 (44 %) | 0,02 | alto |
| P27kip1− |
EGFR: receptor del factor de crecimiento epidérmico; ML: metástasis linfática.
El CPT suele tener un buen pronóstico aunque en alrededor de 1 de cada 5 pacientes se detecta una recurrencia de la enfermedad2. En muchos casos se halla la afectación de ganglios linfáticos. Las metástasis ganglionares están presentes en el momento del diagnóstico en un porcentaje que supera el 30% de los casos3. Existe una cierta controversia si la extensión linfática regional empeora el pronóstico a medio o largo plazo4. Por otro lado, en los últimos 10 años hemos asistido a un avance muy importante en el conocimiento de las bases moleculares que subyacen a la tumorogénesis del CPT. En este estudio hemos analizado, mediante tinciones inmunohistoquímicas, las posibles diferencias de expresión de algunas de estas moléculas en muestras de CPT según tuvieran afectación linfática inicial.
RET/PTC fue una de las primeras alteraciones descritas en el CPT6. Se trata de una inversión pericentromérica en el cromosoma 10 cuyo resultado es la activación no constitutiva del dominio enzimático del receptor tirosincinasa RET. Su presencia es extraordinariamente variable según las series (5−80%)7. Algunos trabajos apuntan que es más frecuente en aquellos casos con metástasis ganglionares8–10, aunque los resultados no son concluyentes11. En nuestro estudio existe una diferencia claramente significativa entre ambos grupos, de tal forma que la positividad se asocia a casos con afectación ganglionar al diagnóstico.
El EGFR es otro receptor transmembrana con actividad tirosinacinasa. Diversos estudios publicados en la década de los 90 del siglo pasado apuntaban que EGFR se encuentra sobrexpresado en un porcentaje elevado de carcinomas de tiroides, especialmente en las variantes más agresivas como el carcinoma indiferenciado12–14. Por otro lado, se ha visto que su localización celular es diferente según se trate de CPT o de carcinoma folicular de tiroides 15,16. Chen et al12 han observado que la coexpresión de EGFR y de la proteína p53 en el CPT se asocia a un mayor riesgo de afectación linfática y a un mayor tamaño del tumor. Nuestro estudio corrobora esta primera afirmación. Algunos artículos recientes indican que RET/PTC podría inducir la proliferación celular a través de la activación de EGFR17. En el presente trabajo, la doble positividad de RET/PTC y EGFR es una de las combinaciones más discrinatorias para la presencia de metástasis ganglionares. La aparición de fármacos específicos que bloquean la actividad de receptores tirosincinasa refuerza la importancia del estudio de estas moléculas18–20.
En los últimos años se ha podido comprobar como diferentes proteínas que intervienen en la regulación del ciclo celular están implicadas en la tumorogénesis de diversas neoplasias21. De las numerosas sustancias que participan en él, cabe destacar los inhibidores de las ciclina cinasas y particularmente los miembros de la familia CIP/KIP, p21cip1 y p27kip1 y el miembro de la familia INK4, p16INk4a. Las 3 moléculas son consideradas como genes supresores tumorales debido a que inhiben la progresión del ciclo celular de las células neoplásicas. Han sido estudiadas en numerosos cánceres humanos y los resultados han sido poco concluyentes. Los pocos estudios publicados en cáncer de tiroides no permiten establecer su posible utilidad en esta neoplasia22. En nuestro trabajo no observamos ninguna relación con las ML cuando se analizan de forma individual, aunque la positividad para p16INk4a fue superior en el grupo ii sin que alcanzara la significación estadística, probablemente debido al tamaño de la muestra. No obstante, el estudio de reguladores de ciclo celular en combinación con otras moléculas ayuda a definir aquellos pacientes con mayores probabilidades de extensión inicial de la enfermedad.
El balance entre proliferación y apoptosis desempeña un papel fundamental en la capacidad de crecimiento tumoral. Bcl-2 es considerada una molécula inhibidora de apoptosis a través de preservar la integridad de la membrana mitocondrial. Para la mayoría de autores que han analizado la molécula, su baja expresión se correlaciona con un mayor grado de indiferenciación celular y por ello, con un peor pronóstico23,24. En el trabajo actual no encontramos ninguna utilidad de Bcl-2 como marcador de afectación ganglionar, en concordancia con otros autores25,26.
Otra de las vías moleculares que interviene en la regulación del balance entre la apoptosis y la supervivencia celular es la conocida como PI3K-AKT. Se ha descrito un aumento de su actividad en numerosas neoplasias. Larson et al27 han encontrado un incremento de expresión en los componentes de la vía en las zonas de tiroides con cáncer en comparación al tejido tiroideo peritumoral. Por su lado, Vasko et al28 han confirmado una alta expresión de la actividad de AKT (determinada como fosforilación de AKT o pAKT) en muestras tumorales de CDT. Asimismo, han observado que la positividad se localizaba en el núcleo celular (pAKTn) en el caso de los carcinomas foliculares mientras que era citoplasmática (pAKTc) en los CPT. Finalmente, los autores comprobaban como la presencia de pAKT nuclear se asociaba a la expresión citoplasmática de p27kip1. En el presente estudio, la actividad de AKT, tanto nuclear como citoplasmática, no se correlaciona con el estadio inicial del CPT.
En el momento actual, no existe ningún marcador molecular que sea utilizado de manera sistemática en el estudio clínico del CPT. El motivo es que ninguno de ellos ha demostrado que pueda mejorar los criterios clásicamente establecidos en el manejo del carcinoma. Es por ello que muchos autores opinan que la utilidad de los marcadores inmunohistoquímicos pasa por la combinación de varios de ellos, para establecer paneles de múltiples moléculas que definan de manera más precisa las características fenotípicas de cada caso29,30. En el presente estudio la combinación de diversos marcadores como RET/PTC, EGFR y p16INk4a ha mostrado un valor discriminatorio en los casos con CPT y ML iniciales.
En resumen, nuestro trabajo establece la utilidad de la tinción inmunohistoquímica de ciertas moléculas en relación al riesgo de ML iniciales en el CPT. Asimismo, proponemos la mayor efectividad de la técnica cuando se combinan diferentes proteínas con la finalidad de caracterizar de manera más correcta el tumor y con ello, poder establecer pautas de tratamiento y seguimiento mucho más específicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.