Determinar las concentraciones plasmáticas de renina y aldosterona en mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos (SOPQ).
MétodosSe seleccionaron mujeres con SOPQ obesas (índice de masa corporal (IMC)>30 Kg/m2; grupo A, n=34) y no obesas (IMC<25kg/m2; grupo B, n =13). El grupo control (grupoC, n=47) consistió en mujeres de edades similares, con menstruaciones regulares y ovarios normales por ecografía. Se analizaron las concentraciones de lutoprina, folitropina, androstendiona, testosterona, globulina fijadora de hormonas sexuales, glucosa sérica, insulina, renina, actividad de la renina plasmática y aldosterona.
ResultadosLas mujeres con SOPQ obesas y no obesas presentaron concentraciones más elevadas de lutoprina, folitropina, testosterona, androstendiona e insulina comparado con las mujeres del grupo control (p<0,05). Se observó que las mujeres con SOPQ presentaron concentraciones significativamente más altas de renina (grupo A: 50,2±4,9 picoU/ml, grupo B: 39,9±2,7 picoU/ml y grupo C: 24,6±2,6 picoU/ml; p<0,05), actividad de la renina plasmática (grupo A: 3,7±0,3ng/ml/h, grupo B: 3,6±0,3ng/ml/h y grupo C: 2,2±0,4ng/ml/h; p<0,05) y aldosterona (grupo A: 31,2±3,3ng/dl, grupo B: 29,3±2,9ng/dl y grupo C: 22,2±3,9ng/dl grupo C; p<0,05) comparado con los controles.
ConclusiónExisten diferencias significativas en las concentraciones plasmáticas de aldosterona y renina entre las mujeres con SOPQ obesas y no obesas respecto a los controles normales.
To assess plasma renin and aldosterone levels in obese and non-obese women with polycystic ovary syndrome (PCOS).
MethodsObese women (body mass index [BMI]>30kg/m2; group A, n=34) and non-obese women (BMI<25kg/m2; group B, n=13) with PCOS were selected. The control group (groupC, n =47) consisted of age-matched women with regular menses and normal ultrasonographic ovaries. Luteinizing hormone, follicle-stimulating hormone, androstenedione, testosterone, sex hormone-binding globulin, serum glucose, insulin, renin, plasma renin activity, and aldosterone levels were measured.
ResultsObese and non-obese women with PCOS had higher luteinizing hormone, follicle-stimulating hormone, androstenedione, testosterone, and insulin levels as compared to women in the control group (p<0.05). Women with PCOS had significantly higher renin levels (group A: 50.2±4.9 picoU/mL, group B: 39.9±2.7 picoU/mL, and group C: 24.6±2.6 picoU/mL), plasma renin activity (group A: 3.7±0.3ng/mL/h, group B: 3.6±0.3ng/mL/h, and group C: 2.2±0.4ng/mL/h), and aldosterone levels (group A: 31.2±3.3ng/dL, group B: 29.3±2.9ng/dL, and group C: 22.2±3.9ng/dL) as compared with controls.
ConclusionSignificant differences exist in plasma renin and aldosterone levels between obese and non-obese women as compared with polycystic ovary syndrome and normal controls.
El síndrome de ovarios poliquísticos (SOPQ) es un entidad endocrinológica caracterizada por oligo o anovulación crónica, hallazgos característicos en los ovarios en la evaluación ecográfica e hiperandogenismo1. Es la endocrinopatía más común en mujeres, afectando del 5 al 10% de estas en edad reproductiva2. Está comúnmente asociada con diferentes factores de riesgo para enfermedades cardiovasculares, tales como resistencia a la insulina, obesidad, dislipidemia e hipertensión3,4. Existe controversia sobre si la insulino-resistencia es producto del SOPQ o de la obesidad4.
La renina, que previamente era considerada como una enzima, es una hormona que incrementa la producción del inhibidor 1 del activador de plasminógeno e induce hipertrofia celular y fibrosis vascular5–7. Estos hallazgos sugieren que la renina juega un papel importante en el desarrollo del daño de los órganos diana. Se ha propuesto que la alta actividad plasmática de la renina podría ser un factor de riesgo adicional para las enfermedades cardiovasculares en pacientes con hipertensión esencial8. Los mecanismos fisiopatológicos de esta asociación aún se desconocen, aunque datos experimentales y clínicos han revelado la relación entre una elevada actividad de la renina plasmática y el daño vascular9.
La aldosterona es un factor de riesgo cardiovascular reconocido por un papel importante en la fisiopatología de la hipertensión, hipertrofia ventricular izquierda e insuficiencia cardíaca10. Se ha demostrado que promueve la fibrosis miocárdica y vascular, altera la remodelación cardíaca e induce inflamación perivascular11. El mecanismo por el cual la aldosterona provoca estos cambios puede ser por la activación del estado inflamatorio caracterizado por la presencia de estrés oxidativo e inflamación12. Las concentraciones elevadas de aldosterona están asociadas con una alta prevalencia de intolerancia a la glucosa, diabetes mellitus y síndrome metabólico13,14.
Debido a que las pacientes con SOPQ son consideradas como de alto riesgo para padecer enfermedades cardiovasculares, el objetivo de la investigación fue determinar las concentraciones plasmáticas de renina y aldosterona entre mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos.
MétodoEntre septiembre 2009 y enero 2011, se incluyeron en el estudio mujeres que asistieron a la consulta de Medicina Interna, Endocrinología y Ginecología del Hospital Central ‘Dr. Urquinaona’ con diagnóstico de SOPQ. El Comité de Ética del hospital aprobó el estudio, y se obtuvo consentimiento por escrito de todas las pacientes.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligoanovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (concentraciones de testosterona plasmática por encima del límite superior normal y relación LH [lutoprina]/FSH [folitropina] anormal>2), y ovarios normales o aumentados de tamaño (>10ml) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2-9 milímetros de diámetro en la evaluación ecográfica abdominal1.
Se seleccionaron mujeres con SOPQ y obesidad (índice de masa corporal>30Kg/m2; grupo A, n=34) y no obesas (índice de masa corporal<25kg/m2; grupo B, n=13). Las pruebas hormonales y la ecografía abdominal se realizaron durante la fase folicular temprana, entre el tercer y quinto día del ciclo menstrual espontáneo. El grupo control (grupo C, n=47) consistió en mujeres de edades similares con menstruaciones regulares y ovarios normales por ecografía, que asistieron a la consulta por patologías diferentes a SOPQ. Todos los controles se estudiaron del día 3 al 5 de su ciclo menstrual. Se excluyeron las mujeres con enfermedad tiroidea o suprarrenal, presencia de hiperprolactinemia, mujeres con hipertensión secundaria o hipertensión grave (definida como presión arterial diastólica>120mm de Hg), insuficiencia renal con aclaramiento de creatinina<30ml/min por 1,73m2 de superficie corporal, excreción de proteína urinaria mayor de 1g/día, ángor pectoris, infarto del miocardio o enfermedad cerebrovascular reciente, y a aquellas mujeres que no aceptaron participar en el estudio. Las formas secundarias de hipertensión arterial fueron excluidas sobre la base de estudios clínicos y de laboratorio. Las pacientes que tomaban fármacos antihipertensivos fueron excluidas del estudio, y a las que tomaban fármacos hipolipemiantes se les solicitó que los suspendieran por 4 semanas antes del estudio. Ninguna paciente tomaba fármacos que afectaran las concentraciones de aldosterona o renina.
La presencia de hipertensión se definió si la presión arterial sistólica era>140mm de Hg y/o la presión arterial diastólica era>90mm de Hg. Las mediciones se realizaron al menos dos veces en dos ocasiones diferentes. La presión arterial se midió con un esfingomanómetro de mercurio, después de reposo en posición supina durante 15 minutos, con un manguito del tamaño adecuado. Las presiones arteriales sistólica y diastólica se establecieron con el primer y quinto ruido de Korotkoff, respectivamente. Se tomó el promedio de tres mediciones obtenidas en 5 minutos.
El hiperaldosteronismo primario se definió por la demostración de un incremento de la relación aldosterona-renina en presencia de una concentración de aldosterona>150pg/ml, y confirmado por la falta de supresión de la aldosterona posterior a la administración de solución salina endovenosa.
La evaluación ecográfica se realizó con un ecógrafo Logiq Pro 3 Marca General Electric usando un transductor abdominal convexo de 3,5MHz, y un transductor vaginal de 5MHz. El índice de masa corporal (IMC) se calculó por el peso dividido por la talla al cuadrado (kg/m2), mientras que la relación cintura cadera (RCC) se calculó por la división de la circunferencia de la cintura entre la circunferencia de la cadera. Se midió la circunferencia de la cintura y la cadera en la región más estrecha del abdomen y en la parte más ancha de la región glútea, respectivamente.
Todas las muestras de sangre venosa se tomaron en ayunas, en la primera semana posterior a la menstruación espontánea o inducida. Todas se manejaron de forma similar y se almacenaron a -8° C por 1 a 3 días. Las concentraciones de FSH, LH, estradiol, androstendiona y testosterona se midieron por radioinmunoanálisis y quimioluminiscencia usando kits comerciales (Immulite 2000, Diagnostic Product Corp, EE.UU.). Los coeficientes de variación intra e inter ensayo fueron de 4 y 7% para FSH, 6 y 7% para LH, 7 y 9% para estradiol, 6 y 10% para androstenodiona y 4 y 7% para testosterona, respectivamente. La globulina fijadora de hormonas sexuales (GFHS) se cuantificó por inmunoensayo (Perkin-Elmer Auto-DELFIA Immunoassay analyzer); el coeficiente de variación inter-ensayo fue de 3% e intra-ensayo de 4%, respectivamente. La glucosa sérica se cuantificó por el método de la glucosa-oxidasa (Pointe Scientific Inc., EE.UU.). Los coeficientes de variación intra e inter-ensayo fueron 1,4 y 1,9%. La insulina se determinó por radioinmunoanalisis (Coat-a-Count, Diagnostic Products Corp, EE.UU.). Los coeficientes de variación intra e inter-ensayo fueron 1,6 y 5,5%, respectivamente.
Para la determinación de las concentraciones de renina y aldosterona las muestras de sangre se tomaron entre las 8 y las 9 horas de la mañana, en un cuarto aislado después de que la paciente permaneciera en posición de decubito durante 1 hora. El consumo de sodio en la dieta de las mujeres no fue estandarizado. La muestra de plasma venoso se recolectó 10 minutos después de la inserción de la aguja en un tubo de vidrio pre-enfriado que contenía EDTA-potasio y fue inmediatamente centrifugado a -4° C. Se utilizó radioinmunoanálisis para la determinación aldosterona y renina (Coat-a-Count Aldosterone, Diagnostic Products Corp, EE.UU. y OBI-DSLCherwll innovation Centre, Reino Unido, respectivamente) con anticuerpos policlonales de conejo altamente específicos. El coeficiente de variación fue menor del 9 y 10%, respectivamente. Los procedimientos se realizaron a temperatura ambiente en las 2 horas siguientes a la extracción de la muestra para evitar la crioactivación de la renina. La actividad de la renina plasmática (Renin Riabead, ABBOTT Laboratories, Diagnostics Division, Illinois, EE.UU.) fue medida por la tasa de modificación de angiotensina I de acuerdo al método de Sealey15, y expresada en nanogramos de angiotensina I formada por mililitro de plasma por hora de incubación (ng/ml/h). El coeficiente de variación fue menor del 10%.
Los datos se presentan como media±desviación estándar. El análisis estadístico se realizó con la prueba de ANOVA con post prueba de Dunnett entre los grupos de mujeres con SOPQ (grupo A y B), tomando como controles a las mujeres del grupo C. Los coeficientes de correlación entre las concentraciones de renina, actividad plasmática de la renina y aldosterona con los parámetros de laboratorio se evaluaron usando la prueba de Pearson. Se realizó un análisis de regresión lineal entre los diferentes parámetros de laboratorio y las concentraciones de renina, actividad plasmática de la renina y aldosterona. Se consideró un valor p<0,05 como estadísticamente significativo.
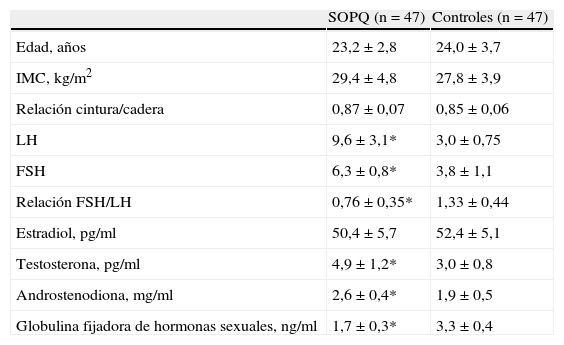
ResultadosLas características clínicas y endocrinas de las mujeres con SOPQ y los controles se muestran en la tabla 1. Los grupos eran similares en edad e índice de masa corporal. Los hallazgos confirmaron las diferencias entre las mujeres con SOPQ y los sujetos controles. Las concentraciones de LH, FSH y la relación FSH/LH estaban significativamente más elevadas en las mujeres con SOPQ comparado con las mujeres del grupo control (p<0,05). No se encontraron diferencias estadísticamente significativas en las concentraciones de estradiol. Los valores de testosterona y androstendiona fueron significativamente más altos en las mujeres con diagnóstico de SOPQ (p<0,05). Los valores de globulina fijadora de hormonas sexuales fueron significativamente menores en las mujeres con SOPQ comparado con los controles.
Características generales de los grupos de estudio
| SOPQ (n=47) | Controles (n=47) | |
| Edad, años | 23,2±2,8 | 24,0±3,7 |
| IMC, kg/m2 | 29,4±4,8 | 27,8±3,9 |
| Relación cintura/cadera | 0,87±0,07 | 0,85±0,06 |
| LH | 9,6±3,1* | 3,0±0,75 |
| FSH | 6,3±0,8* | 3,8±1,1 |
| Relación FSH/LH | 0,76±0,35* | 1,33±0,44 |
| Estradiol, pg/ml | 50,4±5,7 | 52,4±5,1 |
| Testosterona, pg/ml | 4,9±1,2* | 3,0±0,8 |
| Androstenodiona, mg/ml | 2,6±0,4* | 1,9±0,5 |
| Globulina fijadora de hormonas sexuales, ng/ml | 1,7±0,3* | 3,3±0,4 |
FSH: folitropina; IMC: índice de masa corporal; LH: lutotropina; SOPQ: síndrome de ovarios poliquísticos; * p<0,05 comparado con los controles.
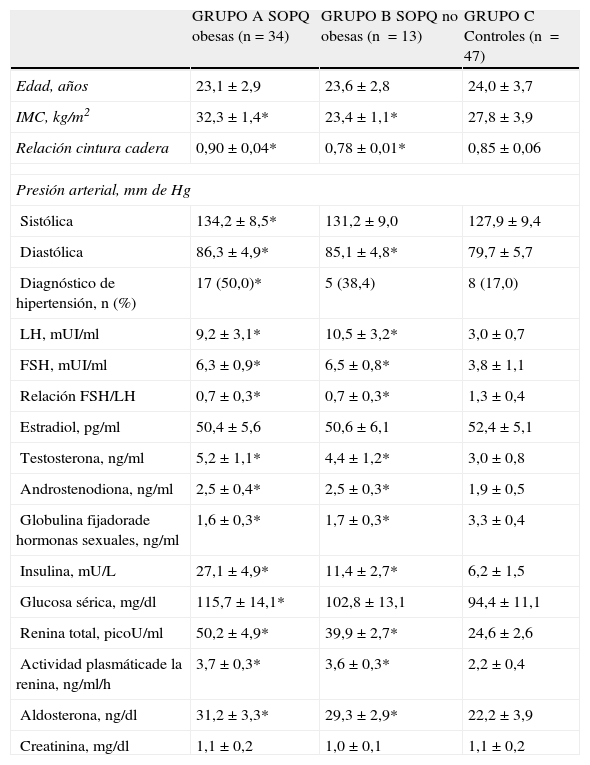
En la tabla 2 se observan las características de las mujeres con síndrome de ovario poliquísticos obesas, mujeres con SOPQ y no obesas y los controles. Las mujeres de los tres grupos no mostraron diferencias estadísticamente significativas con relación a la edad (p=ns). Las pacientes del grupo A presentaron valores de presión arterial sistólica significativamente más altos que las pacientes del grupo C. Con respecto a la presión arterial diastólica, las mujeres del grupo A y B presentaron valores significativamente más altos comparado con las mujeres del grupo control (p<0,05). Con respecto a la frecuencia del diagnóstico de hipertensión arterial en cada grupo, en el grupo A se encontraron 17 mujeres (50,0%) comparado con 8 mujeres (17,0%) en el grupo C (p<0,05). En el grupo B se encontraron 5 mujeres (38,4%), por lo que no se encontró una diferencia estadísticamente significativa al compararlo con el grupo C (p=ns).
Características de las pacientes con síndrome de ovarios poliquísticos y los controles
| GRUPO A SOPQ obesas (n=34) | GRUPO B SOPQ no obesas (n =13) | GRUPO C Controles (n =47) | |
| Edad, años | 23,1±2,9 | 23,6±2,8 | 24,0±3,7 |
| IMC, kg/m2 | 32,3±1,4* | 23,4±1,1* | 27,8±3,9 |
| Relación cintura cadera | 0,90±0,04* | 0,78±0,01* | 0,85±0,06 |
| Presión arterial, mm de Hg | |||
| Sistólica | 134,2±8,5* | 131,2±9,0 | 127,9±9,4 |
| Diastólica | 86,3±4,9* | 85,1±4,8* | 79,7±5,7 |
| Diagnóstico de hipertensión, n (%) | 17 (50,0)* | 5 (38,4) | 8 (17,0) |
| LH, mUI/ml | 9,2±3,1* | 10,5±3,2* | 3,0±0,7 |
| FSH, mUI/ml | 6,3±0,9* | 6,5±0,8* | 3,8±1,1 |
| Relación FSH/LH | 0,7±0,3* | 0,7±0,3* | 1,3±0,4 |
| Estradiol, pg/ml | 50,4±5,6 | 50,6±6,1 | 52,4±5,1 |
| Testosterona, ng/ml | 5,2±1,1* | 4,4±1,2* | 3,0±0,8 |
| Androstenodiona, ng/ml | 2,5±0,4* | 2,5±0,3* | 1,9±0,5 |
| Globulina fijadorade hormonas sexuales, ng/ml | 1,6±0,3* | 1,7±0,3* | 3,3±0,4 |
| Insulina, mU/L | 27,1±4,9* | 11,4±2,7* | 6,2±1,5 |
| Glucosa sérica, mg/dl | 115,7±14,1* | 102,8±13,1 | 94,4±11,1 |
| Renina total, picoU/ml | 50,2±4,9* | 39,9±2,7* | 24,6±2,6 |
| Actividad plasmáticade la renina, ng/ml/h | 3,7±0,3* | 3,6±0,3* | 2,2±0,4 |
| Aldosterona, ng/dl | 31,2±3,3* | 29,3±2,9* | 22,2±3,9 |
| Creatinina, mg/dl | 1,1±0,2 | 1,0±0,1 | 1,1±0,2 |
FSH: folitropina; IMC: índice de masa corporal; LH: lutotropina; SOPQ: síndrome de ovarios poliquísticos; * p<0,05 comparado con el grupo control.
Las mujeres de ambos grupos de estudio (tabla 2) presentaron valores más elevados de LH, FSH, relación FSH/LH, testosterona y androstenodiona comparado con las mujeres del grupo control (p<0,05). No se encontraron diferencias significativas en las concentraciones de estradiol entre las mujeres del grupo A y B comparado con las mujeres del grupo C (p=ns). Por otro lado, las concentraciones de globulina fijadora de hormonas sexuales fueron más bajas en ambos grupos de mujeres con diagnóstico de SOPQ comparado con los controles (p<0,05). Con respecto a las concentraciones de insulina, las mujeres de los grupos A y B presentaron concentraciones significativamente más altas que las mujeres del grupo C. Las mujeres con SOPQ obesas presentaron concentraciones de glucosa sérica significativamente más altas que los controles, mientras que las mujeres con SOPQ no obesas no presentaron diferencias significativas.
Se observó que las mujeres con SOPQ obesas y no obesas presentaron concentraciones más altas de renina comparado con los controles. Con respecto a la actividad de la renina plasmática, esta fue superior en las mujeres de los grupos A y B comparado con las mujeres del grupo C (p<0,05). Las concentraciones de aldosterona también fueron significativamente más altas en las mujeres con SOPQ obesas y no obesas comparado con las mujeres controles. Las concentraciones de creatinina plasmática fueron similares en los tres grupos de mujeres.
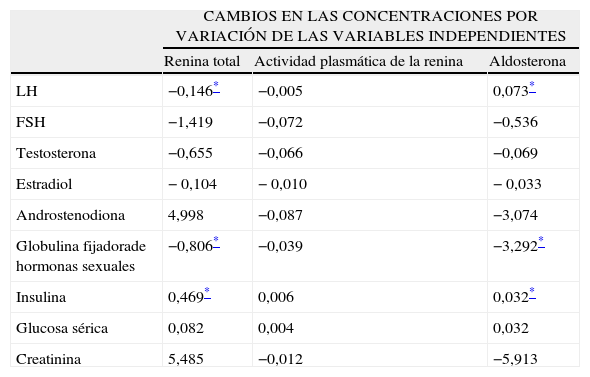
Al analizar el grupo de pacientes con SOPQ obesas y no obesas, se observó que las concentraciones de renina total presentaban una correlación significativa con las concentraciones de insulina, globulina fijadora de hormonas sexuales (r=-0,189), FSH (r=0,177) y LH (r=0,151). La aldosterona se correlacionó en forma significativa (p<0,05) con las concentraciones de insulina (r=0,032), globulina fijadora de hormonas sexuales (r=-0,124), LH (r=0,114) y FSH (r=0,107). El análisis de regresión lineal (tabla 3) mostró que los factores que afectaban la concentración plasmática de renina fueron las concentraciones de androstendiona e insulina, y de las concentraciones de aldosterona fueron las concentraciones de androstendiona, globulina fijadora de hormonas sexuales y creatinina.
Análisis de regresión entre las concentraciones de renina, aldosterona y actividad plasmática de renina con los parámetros de laboratorio en pacientes con síndrome de ovarios poliquísticos
| CAMBIOS EN LAS CONCENTRACIONES POR VARIACIÓN DE LAS VARIABLES INDEPENDIENTES | |||
| Renina total | Actividad plasmática de la renina | Aldosterona | |
| LH | −0,146* | −0,005 | 0,073* |
| FSH | −1,419 | −0,072 | −0,536 |
| Testosterona | −0,655 | −0,066 | −0,069 |
| Estradiol | − 0,104 | − 0,010 | − 0,033 |
| Androstenodiona | 4,998 | −0,087 | −3,074 |
| Globulina fijadorade hormonas sexuales | −0,806* | −0,039 | −3,292* |
| Insulina | 0,469* | 0,006 | 0,032* |
| Glucosa sérica | 0,082 | 0,004 | 0,032 |
| Creatinina | 5,485 | −0,012 | −5,913 |
FSH: folitropina; LH: lutotropina.
Los resultados de la investigación demuestran que las mujeres con SOPQ, tanto obesas como no obesas, presentan concentraciones más elevadas de renina, actividad de renina plasmática y aldosterona comparada con las mujeres controles.
Los andrógenos en la mujer provienen alrededor de un 50% de la médula adrenal y un 50% de los ovarios. Las mujeres con SOPQ presentan, por un lado producción excesiva de andrógenos en la células tecales en los ovarios, y por otro lado, disminución de la síntesis de GFHS en el hígado. Ambos causan aumento de los índices de testosterona libre, llevando a un hiperandrogenismo2. El mecanismo por el cual el hiperandrogenismo predispone al desarrollo de enfermedad cardiovascular e hipertensión aún no está claro, pero se ha propuesto que la testosterona estimula el sistema renina-angiotensina en los túbulos renales proximales, lo cual aumenta el volumen de reabsorción renal de sodio, con el consiguiente aumento del volumen extracelular y aumento de la presión arterial. Además, la testosterona induce insulinorresistencia en los adipositos13. Debido a esto, el nivel de testosterona libre en sangre podría considerarse como un marcador de la hiperfunción del sistema renina-angiotensina, en lugar de como un estímulo de dicha función per se2,14.
Varios estudios en animales han sugerido la presencia de un sistema de renina-angiotensina local en tejidos como el cerebro, glándulas suprarrenales y testículos13. La identificación de receptores de renina y angiotensina en el ovario sugieren que el ovario puede tener un sistema renina-angiotensina ovárico funcional. Las pacientes con SOPQ presentan una mayor actividad del sistema renina-angiotensina en plasma y ovarios (tanto en las células tecales como de la granulosa), lo cual causa un aumento en la síntesis de andrógenos. Este puede tener un papel significativo en la fisiología y procesos ováricos como el desarrollo folicular, esteroidogénesis, maduración del ovocito, ovulación y atresia folicular16.
Los resultados de la investigación indican que en las pacientes con SOPQ, tanto obesas como no obesas, presentan una mayor actividad de la renina plasmática que se asocia con altas concentraciones de insulina. También se ha observado que en el análisis de regresión lineal las concentraciones de insulina en ayunas producen modificaciones significativas en la actividad de la renina plasmática. Las concentraciones más altas de insulina observadas en las pacientes con SOPQ obesas y no obesas podría ser una de las posibles explicaciones para las alteraciones encontradas en estas pacientes. La posible razón para la elevación de la actividad de la renina plasmática podría ser el aumento concomitante en las concentraciones circulantes de catecolaminas durante la hiperinsulinemia17. El incremento de la actividad plasmática de renina relacionada con la hiperinsulinemia en este estudio confirma la observaciones previas de Rooney et al.18.
El mecanismo específico que explicaría la asociación entre la actividad plasmática de la renina y los factores de riesgos metabólicos y cardiovasculares es desconocido. Sin embargo, varios estudios no han confirmado la asociación entre la elevada actividad de la renina plasmática y las complicaciones cardíacas19. Alderman et al.8 confirmaron la asociación entre la actividad plasmática de la renina y el infarto del miocardio, aunque ese estudio no demostró una asociación causal. La actividad plasmática de la renina podría ser un factor de riesgo cardiovascular en mujeres con SOPQ, o quizás actúe como un marcador de otros factores de riesgo como incremento de la actividad simpática u otras anomalías metabólicas.
La aldosterona tiene acciones pro-inflamatorias cardiovasculares bien conocidas. Varios estudios han confirmado la hipótesis que las concentraciones elevadas de la aldosterona circulante inducen inflamación seguida de fibrosis reparadora11,20. Este fenotipo pro-inflamatorio está basado en la inducción de estrés oxidativo12. Más aún, se ha demostrado que la aldosterona podría contribuir directamente al estrés oxidativo y en la aparición de lesiones ateroscleróticas21. En la presente investigación se encontró que las pacientes con SOPQ tanto obesas como no obesas presentaron concentraciones de aldosterona más altas que los controles normales. Se ha demostrado que la aldosterona puede llevar al desarrollo de enfermedades cardiovasculares, involucrando un mecanismo independiente a sus efectos sobre la presión arterial. La pared vascular no solo representa un órgano diana para los efectos de la aldosterona, sino que las células vasculares parecen también ser capaces de producir aldosterona a nivel local22.
Es posible que las altas concentraciones de aldosterona en mujeres con SOPQ y con síndrome metabólico estén de alguna forma relacionadas con las concentraciones de insulina. Se ha descrito que las altas concentraciones de insulina incrementan la secreción de aldosterona in vivo y en estudios experimentales23. Por otro lado, la aldosterona podría ejercer un efecto directo sobre los receptores de insulina, y experimentos recientes indican que la aldosterona podría disminuir la sensibilidad a la insulina en los adipositos24. Estudios previos13 han sugerido la alteración del metabolismo de la glucosa y las acciones de la insulina inducidas por las concentraciones elevadas de aldosterona. Se ha descrito un efecto negativo sobre las concentraciones de glucosa y aumento en la prevalencia del síndrome metabólico en sujetos con hiperaldosteronismo primario14. Todos estos datos apoyan la hipótesis que la elevación de las concentraciones de insulina u otras citocinas funcionan como un secretagogo para la aldosterona.
Los resultados de la investigación son similares a los reportados por Uncu et al.25 que demostraron que las concentraciones de renina fueron más altas en las mujeres con SOPQ obesas y no obesas comparado con los controles. El concepto de que las altas concentraciones de renina contribuyen a la resistencia a la insulina puede tener implicaciones en las anomalías hormonales y metabólicas del SOPQ. Se ha demostrado que las altas concentraciones de renina, en la circulación o en los tejidos, incrementa la producción de angiotensina II, la cual inhibe la actividad de la cinasa PI-3, agravando la resistencia a la insulina26. Además, es posible que el incremento de las concentraciones de renina pueda también contribuir a la disfunción endotelial, una anomalía reconocida en las pacientes con SOPQ27,28.
En la investigación se encontró diferentes grados de correlación entre las concentraciones de renina, aldosterona y actividad de plasmática de la renina con las concentraciones de gonadotropinas y globulina fijadora de hormonas sexuales. Los resultados de la correlación entre las concentraciones de LH y renina ya han sido descritos previamente25. Sealey15 demostró que la elevación inicial de las concentraciones de LH precede al incremento inicial de las concentraciones de renina durante el ciclo menstrual, por lo que las muestras de sangre fueron tomadas en la fase folicular temprana para evitar las fluctuaciones en las concentraciones. Investigaciones previas han documentado que la producción de renina por el ovario está sujeta a una regulación compleja que puede involucrar factores regulatorios paracrinos y autocrinos, lo cual sugeriría la posibilidad de un aumento de la actividad del sistema renina-angiotensina en el ovario, contribuyendo a la producción excesiva de andrógenos29.
En conclusión, estas observaciones aportan evidencia de la elevación de las concentraciones plasmáticas de aldosterona y renina en las mujeres con SOPQ obesas y no obesas. El aumento de las concentraciones de aldosterona y renina está asociado con alteración de las concentraciones de insulina en ayunas. Estos resultados pueden ser relevantes para entender, parcialmente, el mecanismo subyacente que contribuya a un mayor riesgo de enfermedades cardiovasculares en las pacientes con SOPQ, reconocidas por ser hiperinsulinémicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.