Evaluar en un modelo de retraso del crecimiento (enanismo por desnutrición [ED]) el efecto de diferentes dosis de propranolol (P) sobre las variables antropo-morfométricas y biomecánicas del esqueleto apendicular.
Materiales y métodosRatas macho Wistar de 21 días se dividieron en grupos: control (C), C+P3,5 (CP3,5); C+P7 (CP7); C+P10,5 (CP10,5); C+P14 (CP14); ED, ED+P3,5 (EDP3,5); ED+P7 (EDP7); ED+P10,5 (EDP10,5) y ED+P14 (EDP14). Los animales controles con/sin P recibieron una dieta para roedores ad libitum; las ratas ED con/sin P recibieron por cada 100 g de peso corporal un 80% de la misma dieta durante 4 semanas (T4). Propranolol 3,5; 7; 10,5 y 14mg/kg/día fue inyectado intraperitonealmente 5 días/semana durante 4 semanas en CP3,5 y EDP3,5; CP7 y EDP7; CP10,5 y EDP10,5 y CP14 y EDP14, respectivamente.
ResultadosA T4, la restricción energética produjo efectos negativos sobre el crecimiento global, el fémur y su competencia mecánica. Propranolol mejoró la rigidez ósea en los animales ED con dosis de 7 y 10,5mg/kg/día, con un máximo de respuesta a 7mg/kg/día.
ConclusionesEl propranolol 7mg/kg/día sería la dosis más efectiva en la incorporación modelatoria de hueso con incremento de su eficiencia estructural y mecánica en el presente modelo animal de retraso del crecimiento. Dicho efecto podría ser el resultado del mantenimiento de la viabilidad del mecanosensor, de modificaciones de su sensibilidad, del punto de referencia biomecánico y/o de la respuesta de los efectores en las ratas ED.
To assess in a growth retardation (GR) model the impact of different propranolol (P) doses on anthropomorphometric and biomechanical variables of the appendicular skeleton.
Materials and methodsTwenty-one day-old male Wistar rats were divided into the following groups: control (C), C+P3.5 (CP3.5); C+P7 (CP7); C+P10.5 (CP10.5); C+P14 (CP14); ED, ED+P3.5 (EDP3.5); ED+P7 (EDP7); ED+P10.5 (EDP10.5), and ED+P14 (EDP14). Control animals with/without P were fed a rodent diet ad libitum. GR rats with/without P were given 80% of the same diet per 100g body weight for 4 weeks (T4). Propranolol 3.5, 7, 10.5, and 14mg/kg/day was intraperitoneally injected 5 days/week for 4 weeks to the CP3.5 and EDP3.5; CP7 and EDP7; CP10.5 and EDP10.5, and CP14 and EDP14 groups respectively.
ResultsAt T4, energy restriction had negative effects upon overall growth, femur, and its mechanical competence. Propranolol improved bone rigidity in GR animals at doses of 7 and 10.5mg/kg/day, with a maximum response at 7mg/kg/day.
ConclusionsPropranolol 7mg/kg/day would be the most effective dose for modeling incorporation of bone, as shown by the increased skeletal structural and mechanic efficiency in this animal model of growth retardation. Such effect may result from maintenance of mechanosensor viability, changes in its sensitivity, the biomechanical reference point and/or effector response in GR rats.
La calidad del esqueleto axial y apendicular está determinada por numerosos factores, siendo la condición nutricional de gran importancia. La malnutrición calórico-proteica durante el desarrollo del individuo, principalmente durante los períodos críticos del crecimiento, contribuye al deterioro del mismo con el consiguiente riesgo de osteoporosis y fragilidad ósea en la edad avanzada1–6. Si bien la osteoporosis, la afección más frecuente de remodelado óseo, se presenta con mayor frecuencia en la edad adulta, la calidad del hueso de un individuo está en relación directa con el pico de la masa ósea, el cual, a su vez, está influenciado por los factores endógenos y exógenos condicionantes del crecimiento y desarrollo7,8.
Determinadas creencias y prácticas impuestas por los padres a sus hijos pueden restringir la nutrición del niño al punto de inducir una enfermedad de origen nutricional conocida como enanismo por desnutrición (ED). El ED se caracteriza por presentar una desaceleración en el crecimiento corporal con retraso en el desarrollo puberal, sin evidencia de fallo orgánico ni alteraciones en los marcadores bioquímicos de desnutrición9–12.
En nuestro laboratorio hemos descrito un modelo de estrés nutricional en ratas en crecimiento, el cual recrea el ED humano, una forma de desnutrición manifestada como un déficit de los índices peso y talla para la edad con un índice peso para la talla dentro de límites normales. Este modelo animal de enanismo por desnutrición se logró por administración crónica de una dieta balanceada a ratas recién destetadas, la restricción global fue del 20% comparada con los requerimientos energéticos de animales de idéntica edad13.
Dado que el ED presenta alteraciones neuroendocrinas secundarias al estrés nutricional14,15, la adquisición de hueso durante las etapas críticas del crecimiento puede verse sensiblemente afectada. En efecto, en estudios previos realizados en nuestro laboratorio, hemos observado un deterioro del diseño arquitectónico con disminución de la aptitud mecánica para soportar fuerzas deformantes en el fémur de ratas con ED2,3,16,17.
Estudios in vivo e in vitro evidenciaron la participación del sistema nervioso simpático (SNS) en la modulación del metabolismo óseo. Se demostró la existencia de inervación simpática esquelética, la presencia de fibras simpáticas en la médula ósea y el incremento de la osteoclastogénesis con aumento de la resorción y/o disminución de la formación ósea por incremento de la actividad del SNS18–23. Asimismo, se evidenció la presencia de receptores β-adrenérgicos en las células óseas, de cuya activación resultó un incremento de la expresión de RANKL con aumento de la resorción ósea24.
Sin embargo, estudios de simpatectomía química o quirúrgica arrojaron resultados controvertidos respecto del papel del SNS en el metabolismo óseo, sugiriendo que éste posee un efecto anabólico sobre el mismo25,26.
Si bien es sabido que los β-bloqueantes son ampliamente utilizados en enfermedades cardiovasculares, numerosos hallazgos sugieren las probables implicaciones preventivas y/o terapéuticas de los mismos a través de un efecto protector de la masa ósea frente a diversas situaciones de estrés, tanto en humanos27,28 como en animales de experimentación29,30. En efecto, se ha evidenciado en ratones macho adultos de la cepa C57BL/6 que la administración crónica de propranolol (P) previno la reducción del volumen óseo causada por la ingesta de una dieta restringida en un 40%, pero con compensación de calcio y fosfato31. Estudios realizados por Bonnet et al.30 demostraron que bajas dosis de P mejoran la competencia biomecánica ósea de ratas ovariectomizadas sin modificaciones hemodinámicas.
En estudios previos realizados en nuestro laboratorio se observó un aumento de la calidad ósea en ratas con ED tratadas con P en forma crónica32. Sin embargo, existen algunas inconsistencias respecto del efecto de β-bloqueantes como el P sobre el incremento de la masa ósea y la disminución del riesgo de fractura a partir de datos obtenidos en otros estudios experimentales26,33 y clínicos34,35, tanto en individuos jóvenes como adultos.
Debido a la relación existente entre la condición nutricional y la aptitud biomecánica del hueso, y a la evidencia de un control β-adrenérgico de la masa ósea, el objetivo del presente estudio fue evaluar en un modelo animal de retraso del crecimiento de origen nutricional, ED, el efecto de diferentes dosis del β-bloqueante P sobre las variables antropo-morfométricas y biomecánicas óseas. Asimismo, se determinó la dosis más adecuada que permita alcanzar la rigidez estructural apropiada como para soportar la estimulación mecánica habitual y/o máxima conservando la integridad del hueso.
Materiales y métodosAnimales de experimentaciónSe emplearon ratas macho de la cepa Wistar desde el destete de 21-23 días de edad (peso inicial: 48,90g±1,60; media±ES) provistas por la Cátedra de Bioquímica General y Bucal de la Facultad de Odontología, UBA. Los animales fueron mantenidos en jaulas galvanizadas en condiciones higiénicas apropiadas para evitar la coprofagia. Se respetaron los ciclos 12:12 horas de luz-oscuridad. La temperatura ambiental se mantuvo a 21±1 oC, con una humedad relativa del 50-60%. El uso, cuidado y tratamiento de los animales experimentales se realizó de acuerdo con los normas del «National Institutes of Health»36 y aprobado por el Comité de Etica de la Facultad de Odontología de la Universidad de Buenos Aires.
DietaLos animales de experimentación se alimentaron con una dieta especial (Purina en pellets) para roedores con la siguiente composición centesimal (g/100g de dieta): proteína: 22,70; lípidos: 7,09; fibra: 6,00; Ca: 1,30; P: 0,80; cenizas: 6,50; agua: 7,60; dextrina csp 100.
Diseño experimentalOchenta ratas fueron distribuidas aleatoriamente en 10 grupos de 8 animales cada uno según hayan recibido vehículo o P (P; Laboratorios Richmond, Argentina) en dosis de 3,5 (P3,5); 7 (P7); 10,5 (P10,5) y 14 (P14) mg/kg/día: control+vehículo (C); control+P3,5 (CP3,5); control+P7 (CP7); control+P10,5 (CP10,5); control+P14 (CP14); experimentales ED+vehículo (ED); experimentales ED+P3,5 (EDP3,5); experimentales ED+P7 (EDP7); experimentales ED+P10,5 (EDP10,5) y experimentales ED+P14 (EDP14). Propranolol fue inyectado intraperitonealmente 5 días por semana durante 4 semanas en las dosis mencionadas. El grupo control y ED recibieron solución salina con idéntico régimen. El grupo control con/sin P fueron alimentados con una dieta estándar en condiciones de libre demanda; ED con/sin P recibieron un 80% de la dieta consumida por C el día previo corregido por el peso corporal (consumo en g/100g peso corporal/día), durante 4 semanas. Se realizó el registro diario de la ingesta de alimento, y cada 2 y 4 días, el del peso y de la longitud corporales, respectivamente. Los animales fueron sacrificados por inyección intramuscular de hidrocloruro de ketamina: 0,1mL/100g de peso corporal, Holliday Lab. y xilazina: 0,02mL, Konig Lab. Buenos Aires, Argentina, a las 4 semanas experimentales (T4). Inmediatamente, los fémures de cada animal fueron disecados evitando lesionar el periostio. Ambos huesos fueron pesados y medidos con un calibre digital y empleados para el estudio de las propiedades biomecánicas óseas.
Evaluación del crecimientoAntropometríaSe midieron el peso (p) y la longitud (l) corporales. Para el registro del peso se utilizó una balanza Mettler PC 4000 con una precisión de±1mg, con una frecuencia de medición de 4 días, guardando un ayuno mínimo de dos horas y máximo de 4 horas, previo a la determinación. La longitud corporal fue registrada en función de la distancia entre el hocico y los pelos de la base de la cola.
Ingesta dietéticaLa ingesta de dieta se midió diariamente con una balanza Mettler con una precisión de±1mg. La medida de consumo se determinó por la diferencia de peso del comedero de dos días consecutivos. Este se expresó en 100g de rata/día.
Evaluación de la morfometría de fémurSe realizó la ablación de los huesos y se los liberó de tejido muscular y tendinoso. Se los pesó y se registró su longitud mediante un calibre micrométrico digital con una precisión de 0,05mm.
Evaluación de las propiedades biomecánicas de la diáfisis femoralSe evaluó la calidad mecánica de los huesos mediante un ensayo mecánico de flexión a tres puntos en un equipo Instron modelo 444237. El fémur fue colocado en posición horizontal, con la cara anterior mirando hacia abajo sobre dos soportes equidistantes de sus extremos, separados por una distancia constante de 13mm. La diáfisis fue cargada centralmente a una tasa creciente, a razón de 50N a una velocidad de 5mm/min hasta la fractura. Las curvas carga/deformación (W/d) obtenidas permitieron determinar las siguientes variables representativas de las propiedades estructurales del hueso entero: carga de fractura (Wf, N), carga elástica máxima límite (Wy, N) y rigidez ósea (Wy/dy, N/mm), donde dy representa la deformación del hueso en el sector de comportamiento elástico. Se efectuaron cortes a nivel de la media diáfisis femoral utilizando una microsierra de punta de diamante Isomet (Buehler, Lake Bluff, IL, EE.UU.), y se calcularon los diámetros horizontales y verticales externos e internos de la sección transversal para la evaluación de las propiedades geométricas óseas: área ósea total de sección transversa (CSA, mm2), estimada mediante la fórmula: π/4.V.H, momento de inercia axial (Ix, mm4), estimado mediante la fórmula: Ix=π (V3H – v3h)/64 y área medular (MA, mm2), estimada como MA=π/4.v.h, donde H y V corresponden a los diámetros externos horizontal y vertical respectivamente, y h y v corresponden a los diámetros internos horizontal y vertical respectivamente de la sección transversal del hueso a nivel de la media diáfisis. El área ósea cortical de la sección transversa (A, mm2) se calculó por la diferencia entre CSA y MA.
Mediante la homologación del fémur con un cilindro elíptico y la aplicación de fórmulas matemáticas se calcularon indirectamente las siguientes propiedades materiales del hueso cortical: módulo elástico de Young (E, N/mm2), estimado por la fórmula: E=Wy. L3/48 dy. Ix, donde Wy=carga elástica límite, L=longitud del hueso, dy=deformación en el punto de cesión, Ix=momento de inercia axial; y estrés elástico máximo (σy, N/mm2), estimado mediante la fórmula: σy=L. V. Wy/8. Ix, donde V es el diámetro externo vertical.
Análisis estadísticoLos resultados se expresaron como el promedio±ES. Los datos fueron analizados mediante el análisis de varianza (ANOVA). Con posterioridad se empleó el test de la t de Student-Newman-Keuls de comparaciones múltiples. Las diferencias entre medias fueron consideradas significativas con un p<0,0538. El análisis estadístico se realizó mediante el programa computarizado Graphpad Prism version 3.0 (Graphpad Software, San Diego, California).
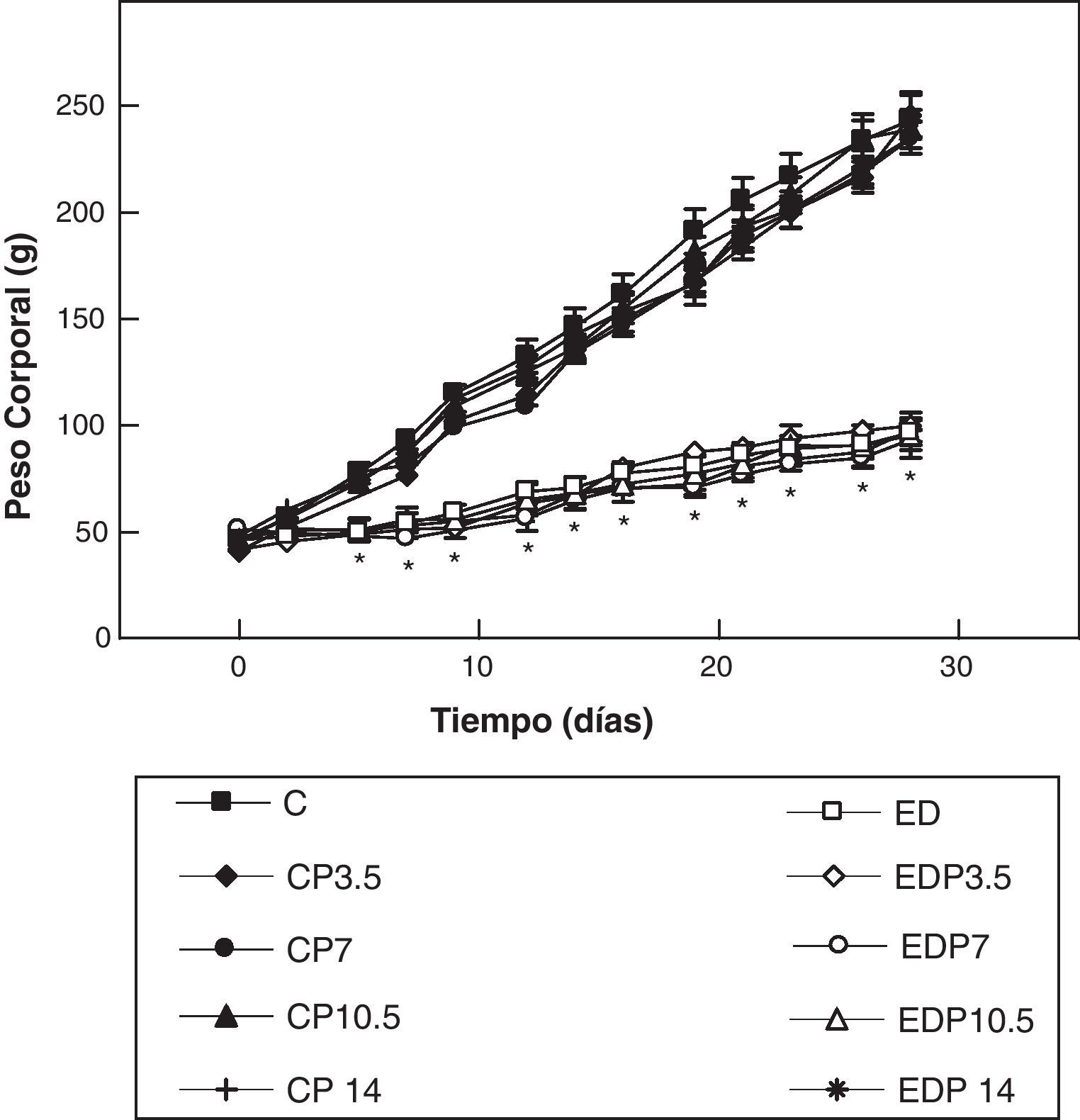
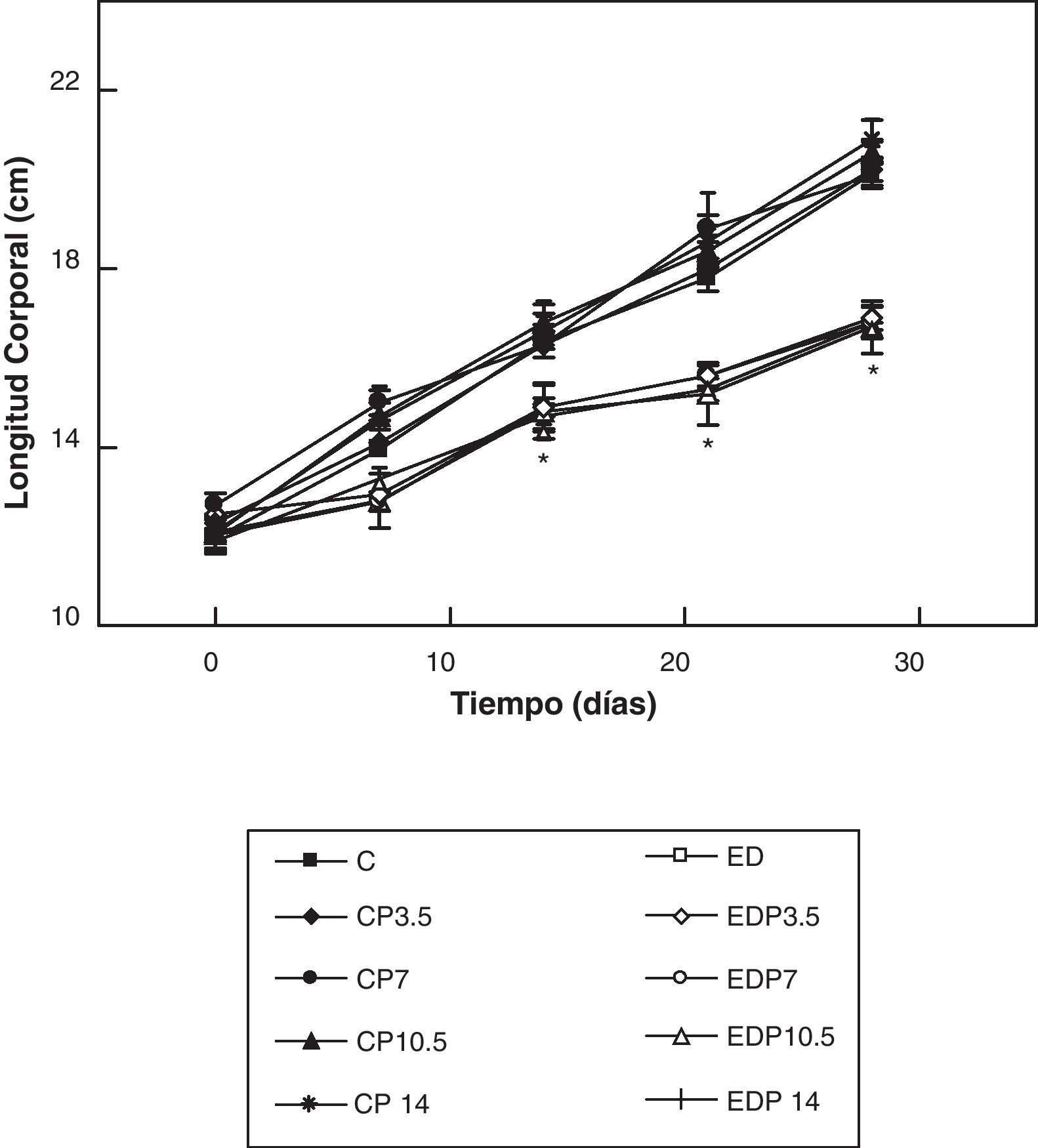
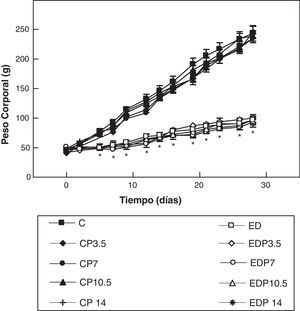
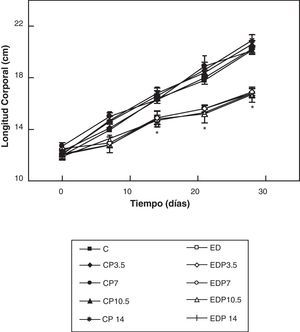
ResultadosEn las figuras 1 y 2 se muestran los perfiles de peso y de longitud corporales de ratas controles y experimentales con/sin P en función del tiempo, respectivamente. La restricción energética indujo una disminución altamente significativa (p<0,001) de la velocidad de crecimiento en los animales experimentales respecto de los controles, y ésta fue independiente de la administración de P para cualquiera de las dosis empleadas.
Evolución del peso corporal de los animales control (C), control + propranolol 3,5 mg/kg/día (CP3,5); control + propranolol 7 mg/kg/día (CP7); control + propranolol 10,5 mg/kg/día (CP10,5); control + propranolol 14 mg/kg/día; experimentales ED (ED), experimentales ED + propranolol 3,5 mg/kg/día (EDP3,5); experimentales ED + propranolol 7 mg/kg/día (EDP7); experimentales ED + propranolol 10,5 mg/kg/día (EDP10,5); experimentales ED + propranolol 14 mg/kg/día (EDP14) durante el período experimental. Valor promedio±error estándar de 8 animales por grupo.
*Diferencias significativas entre grupos ED respecto de C, con/sin propranolol (p < 0,05).
Evolución de la longitud corporal de los animales control (C), control + propranolol 3,5 mg/kg/día (CP3,5); control + propranolol 7 mg/kg/día (CP7); control + propranolol 10,5 mg/kg/día (CP10,5); control + propranolol 14 mg/kg/día; experimentales ED (ED), experimentales ED + propranolol 3,5 mg/kg/día (EDP3,5); experimentales ED + propranolol 7 mg/kg/día (EDP7); experimentales ED + propranolol 10,5 mg/kg/día (EDP10,5); experimentales ED + propranolol 14 mg/kg/día (EDP14) durante el período experimental. Valor promedio±error estándar de 8 animales por grupo.
*Diferencias significativas entre grupos ED respecto de C, con/sin propranolol (p < 0,05).
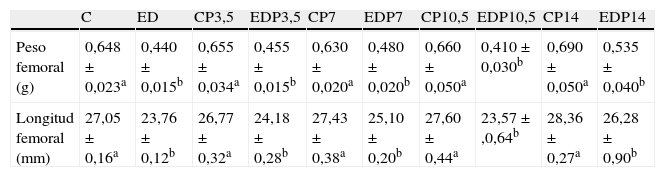
En la tabla 1 se presenta la morfometría del fémur de los animales controles y experimentales con/sin P a T4. El crecimiento del fémur fue afectado negativamente en las ratas subalimentadas comparado con sus respectivos controles (p<0,001). Sin embargo, el tratamiento con P no produjo cambios evidentes en los parámetros morfométricos evaluados en ninguna de las dosis empleadas e independientemente de la condición nutricional.
Peso y longitud femoral a tiempo final (T4)
| C | ED | CP3,5 | EDP3,5 | CP7 | EDP7 | CP10,5 | EDP10,5 | CP14 | EDP14 | |
| Peso femoral (g) | 0,648±0,023a | 0,440±0,015b | 0,655±0,034a | 0,455±0,015b | 0,630±0,020a | 0,480±0,020b | 0,660±0,050a | 0,410±0,030b | 0,690±0,050a | 0,535±0,040b |
| Longitud femoral (mm) | 27,05±0,16a | 23,76±0,12b | 26,77±0,32a | 24,18±0,28b | 27,43±0,38a | 25,10±0,20b | 27,60±0,44a | 23,57±,0,64b | 28,36±0,27a | 26,28±0,90b |
Animales control (C), control + propranolol 3,5 mg/kg/día (CP3,5); control + propranolol 7 mg/kg/día (CP7); control + propranolol 10,5 mg/kg/día (CP10,5); control + propranolol 14 mg/kg/día, experimentales ED (ED); experimentales ED + propranolol 3,5 mg/kg/día (EDP3,5); experimentales ED + propranolol 7 mg/kg/día (EDP7); experimentales ED + propranolol 10,5 mg/kg/día (EDP10,5); experimentales ED + propranolol 14 mg/kg/día (EDP14) a tiempo final (T4). Valor promedio±error estándar de 8 animales por grupo. Letras diferentes indican diferencias significativas entre grupos (p<0,05).
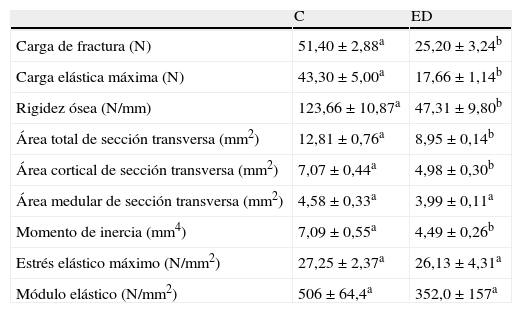
En la tabla 2 se presentan las propiedades biomecánicas de la diáfisis femoral de los animales ED vs C. En congruencia con estudios previos realizados en nuestro laboratorio2, los resultados biomecánicos del fémur muestran que las propiedades estructurales (carga máxima de fractura, carga en el límite elástico y rigidez ósea) de la media diáfisis se afectaron negativamente tras 4 semanas de restricción de alimento en las ratas ED respecto de los animales C (p<0,01). Sin embargo, la capacidad resistiva del esqueleto apendicular de los animales ED posterior al estrés nutricional fue la adecuada para el tamaño corporal alcanzado, la que fue evidenciada mediante la normalización de la carga de fractura del fémur por el peso corporal. En efecto, Wf/p (N/g) de ED vs C fue de 0,091±0,02 vs 0,097±0,01 respectivamente (p>0,05).
Propiedades estructurales (carga de fractura, carga elástica máxima, rigidez ósea), geométricas (área total de sección transversa, área cortical de sección transversa, área medular de la sección transversa y momento de inercia) y materiales (estrés elástico máximo y módulo elástico) del fémur de animales control (C) y experimentales ED a tiempo final (T4)
| C | ED | |
| Carga de fractura (N) | 51,40±2,88a | 25,20±3,24b |
| Carga elástica máxima (N) | 43,30±5,00a | 17,66±1,14b |
| Rigidez ósea (N/mm) | 123,66±10,87a | 47,31±9,80b |
| Área total de sección transversa (mm2) | 12,81±0,76a | 8,95±0,14b |
| Área cortical de sección transversa (mm2) | 7,07±0,44a | 4,98±0,30b |
| Área medular de sección transversa (mm2) | 4,58±0,33a | 3,99±0,11a |
| Momento de inercia (mm4) | 7,09±0,55a | 4,49±0,26b |
| Estrés elástico máximo (N/mm2) | 27,25±2,37a | 26,13±4,31a |
| Módulo elástico (N/mm2) | 506±64,4a | 352,0±157a |
Valor promedio±error estándar de 8 animales por grupo. Letras diferentes indican diferencias significativas entre grupos (p<0,05).
Al analizar el área total de la sección transversa y el momento de inercia axial, se observó que dichas variables geométricas fueron significativamente menores en el grupo ED respecto de las ratas C al final del período experimental (p<0,01) (tabla 2). El área cortical de la sección transversa de la media diáfisis femoral fue significativamente menor en los ED vs C (p<0,01). No se observaron diferencias significativas en el área de la sección transversa medular entre grupos (p>0,05).
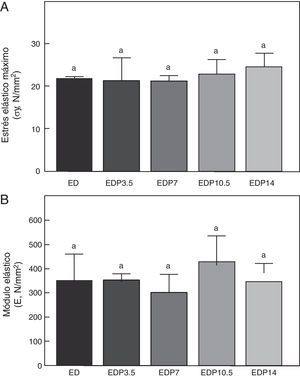
En lo que respecta a la calidad intrínseca del material óseo representada por las variables estrés elástico máximo y módulo de elasticidad, no hubo diferencias significativas entre grupos a tiempo final (p>0,05) (tabla 2).
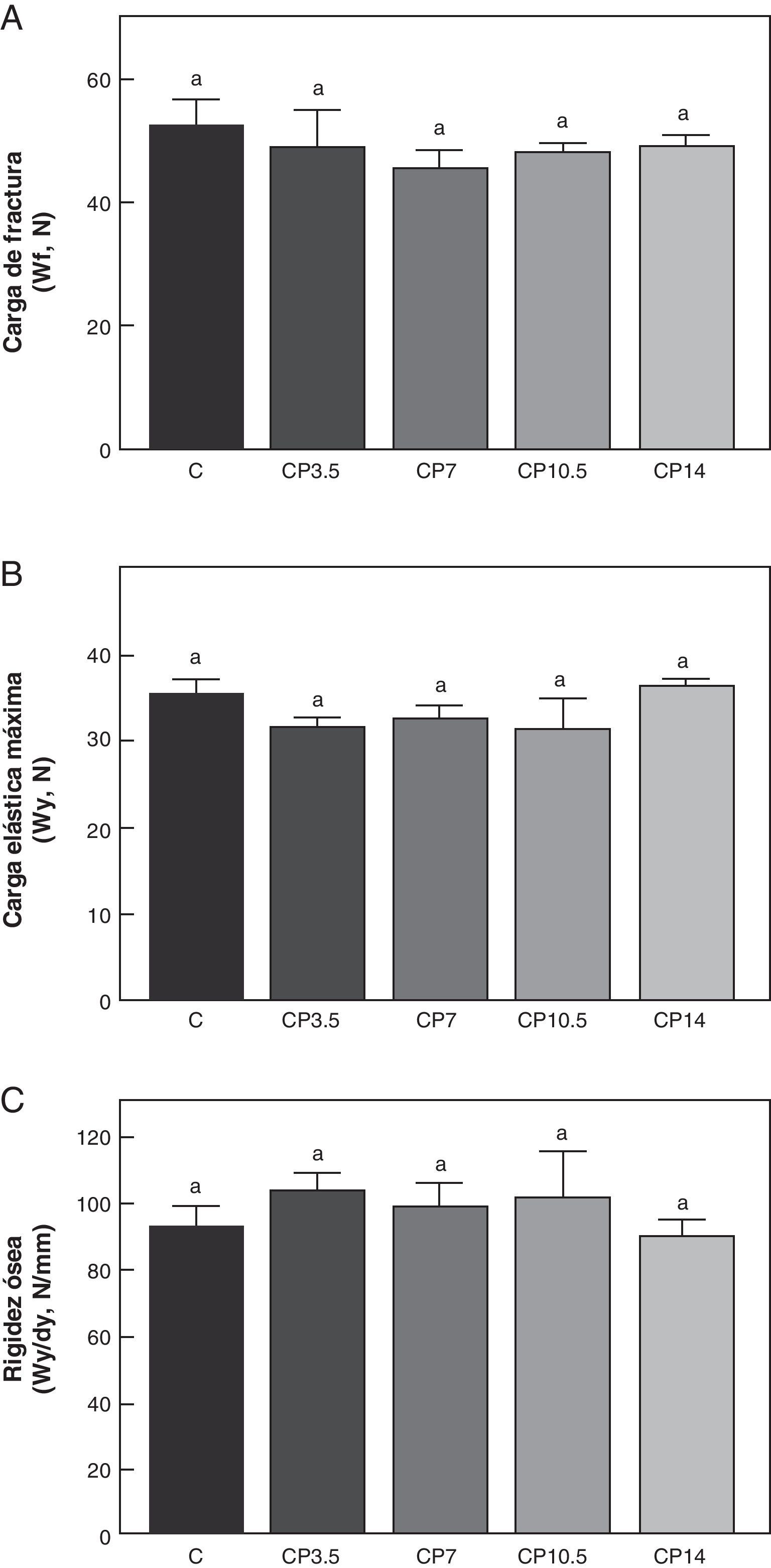
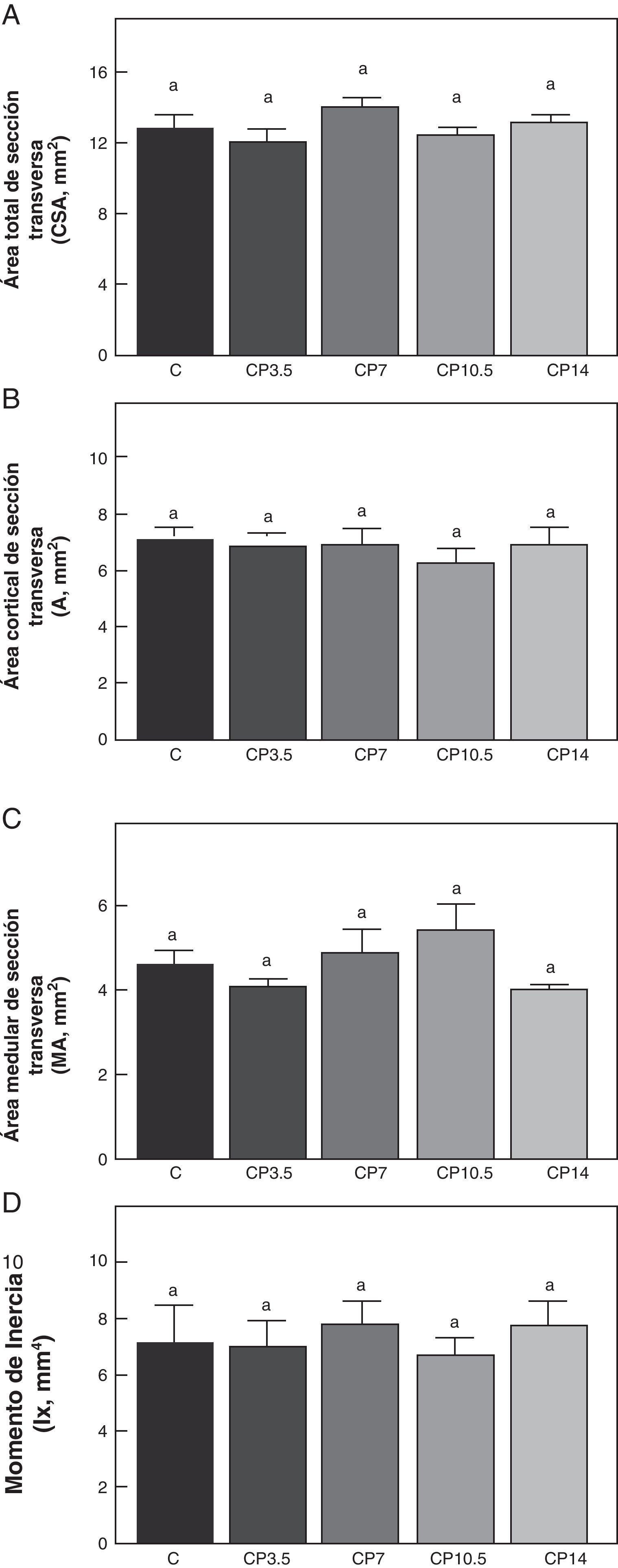
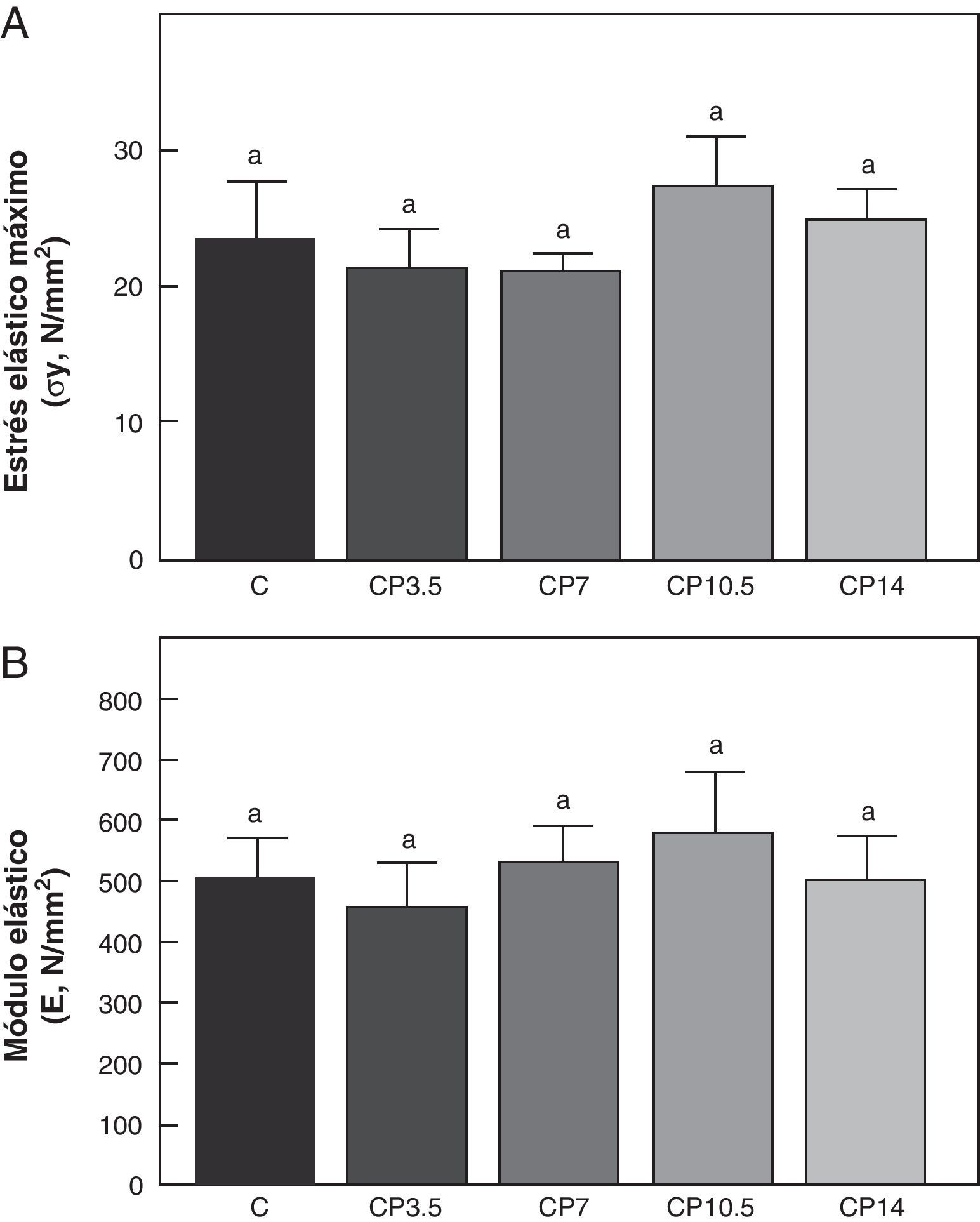
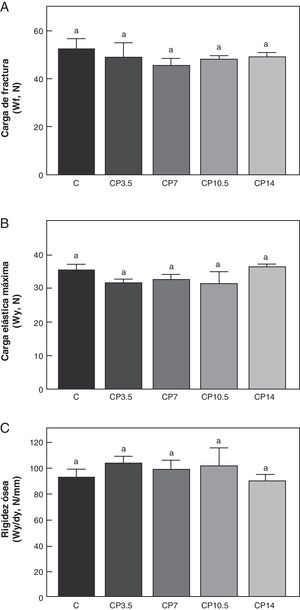
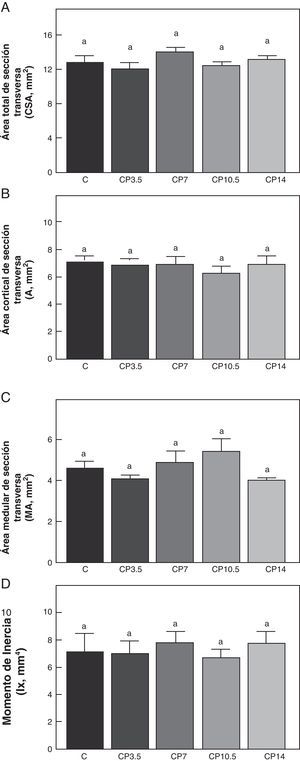
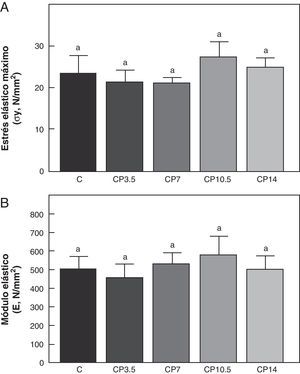
En las figuras 3-5 se muestran las propiedades estructurales, geométricas y materiales, respectivamente, del fémur de animales controles con/sin P. Los resultados del presente trabajo evidencian que el β-bloqueante, en el régimen utilizado, no produjo efectos sobre la competencia biomecánica ósea en los animales alimentados a libre demanda tratados con P, entre sí ni respecto de los animales controles no tratados (figs. 3-5).
Propiedades estructurales. A: carga de fractura (Wf), B: carga elástica máxima (Wy) y C: rigidez ósea (Wy/dy), del fémur de animales control (C), control+propranolol 3,5mg/kg/día (CP3,5); control+propranolol 7mg/kg/día (CP7); control+propranolol 10,5mg/kg/día (CP10,5); control+propranolol 14mg/kg/día a tiempo final (T4). Valor promedio±error estándar de 8 animales por grupo. Letras diferentes indican diferencias significativas entre grupos (p<0,05).
Propiedades geométricas. A: área total de sección transversa (CSA), B: área cortical de sección transversa (A), C: área medular de sección transversa (MA) y D: momento de inercia (Ix), del fémur de animales control (C), control + propranolol 3,5 mg/kg/día (CP3,5); control + propranolol 7 mg/kg/día (CP7); control + propranolol 10,5 mg/kg/día (CP10,5); control + propranolol 14 mg/kg/día a tiempo final (T4). Valor promedio±error estándar de 8 animales por grupo. Letras diferentes indican diferencias significativas entre grupos (p < 0,05).
Propiedades materiales. A: estrés elástico máximo (σy) y B: módulo elástico (E), del fémur de animales control (C), control + propranolol 3,5 mg/kg/día (CP3,5); control + propranolol 7 mg/kg/día (CP7); control + propranolol 10,5 mg/kg/día (CP10,5); control + propranolol 14 mg/kg/día (CP14) a tiempo final (T4). Valor promedio±error estándar de 8 animales por grupo. Letras diferentes indican diferencias significativas entre grupos (p < 0,05).
Al comparar la resistencia ósea a la fractura relativa al peso corporal se observó que no hubo diferencias significativas en Wf/p en ninguno de los grupos control tratados con P entre sí ni respecto de los animales controles no tratados. En efecto, Wf/p (N/g) de C; CP3,5; CP7; CP10,5 y CP14 fue de 0,097±0,01; 0,103±0,01; 0,096±0,03; 0,094±0,01 y de 0,097±0,01, respectivamente (p>0,05).
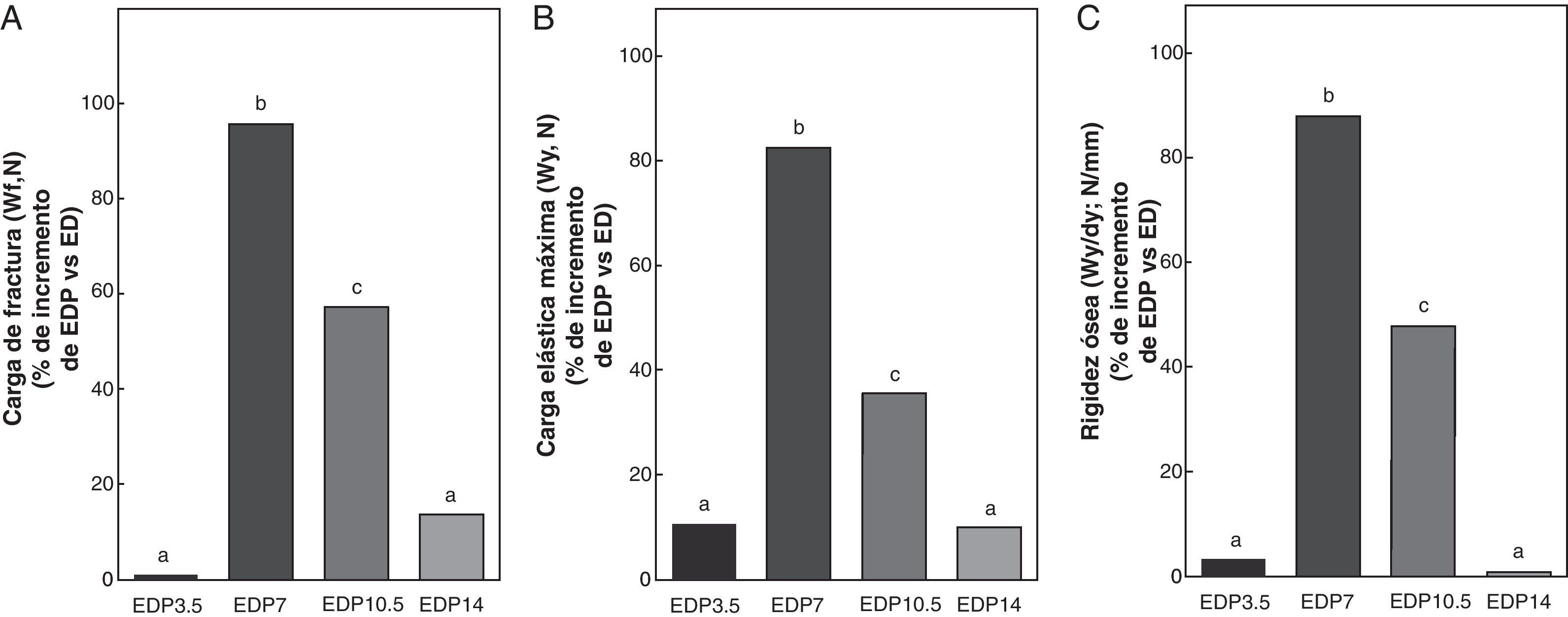
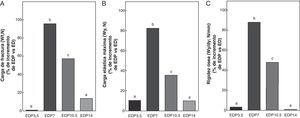
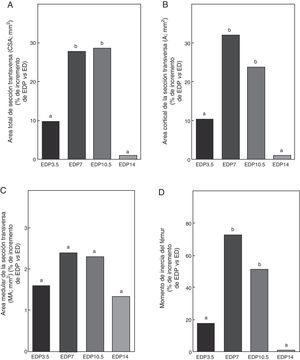
En las figuras 6-8 se muestran las propiedades estructurales, geométricas y materiales, respectivamente, del fémur de ratas ED tratadas con diferentes dosis de P expresadas como porcentaje de incremento de dichas variables respecto de las correspondientes a las ratas ED no tratadas. Los animales subalimentados tratados con P en dosis de 7 y 10,5mg/kg/día presentaron aumentos significativos (p<0,05) en las variables representativas de las propiedades estructurales del hueso entero como la carga de fractura, la carga elástica máxima límite y la rigidez ósea con respecto a las ratas ED no tratadas, con un máximo de incremento con 7mg/kg/día (fig. 6). El P administrado a ratas ED en dosis de 3,5 y 14mg/kg/día no produjo modificaciones significativas en ninguna de las variables biomecánicas evaluadas (fig. 6).
Propiedades estructurales. A: carga de fractura (Wf), B: carga elástica máxima (Wy) y C: rigidez ósea (Wy/dy), del fémur de animales experimentales ED+propranolol 3,5mg/kg/día (EDP3,5); experimentales ED+propranolol 7mg/kg/día (EDP7); experimentales ED+propranolol 10,5mg/kg/día (EDP10,5); experimentales ED+propranolol 14mg/kg/día (EDP14) expresadas como porcentaje de incremento de dichas variables respecto de las correspondientes a ED a tiempo final (T4). Letras diferentes indican diferencias significativas entre grupos, donde ED=a (p<0,05).
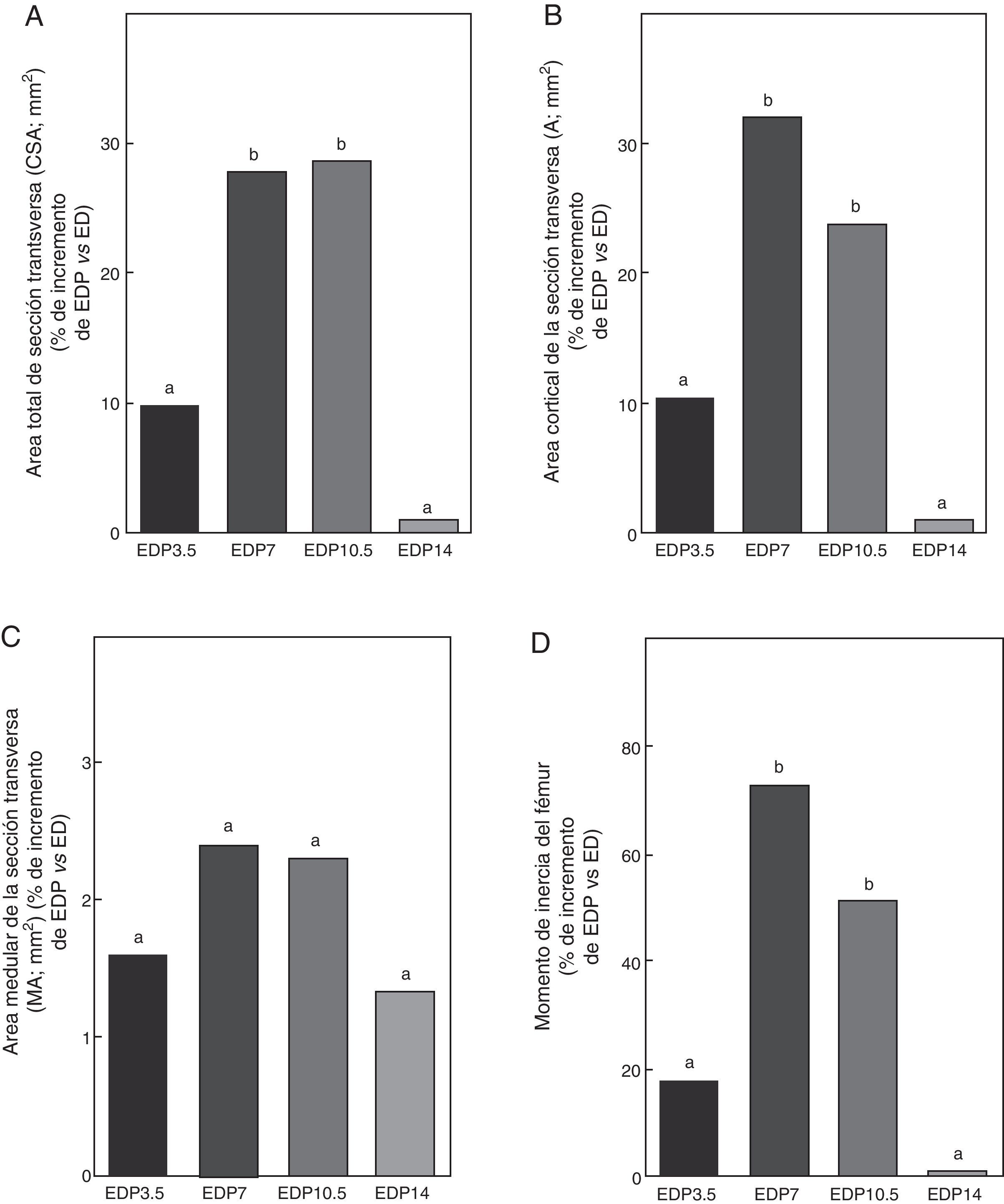
Propiedades geométricas. A: área total de sección transversa (CSA), B: área cortical de sección transversa (A), C: área medular de sección transversa (MA) y D: momento de inercia (Ix), del fémur de animales experimentales ED + propranolol 3,5 mg/kg/día (EDP3,5); experimentales ED + propranolol 7 mg/kg/día (EDP7); experimentales ED + propranolol 10,5 mg/kg/día (EDP10,5); experimentales ED + propranolol 14 mg/kg/día (EDP14) expresadas como porcentaje de incremento de dichas variables respecto de las correspondientes a ED a tiempo final (T4). Letras diferentes indican diferencias significativas entre grupos, donde ED = a (p < 0,05).
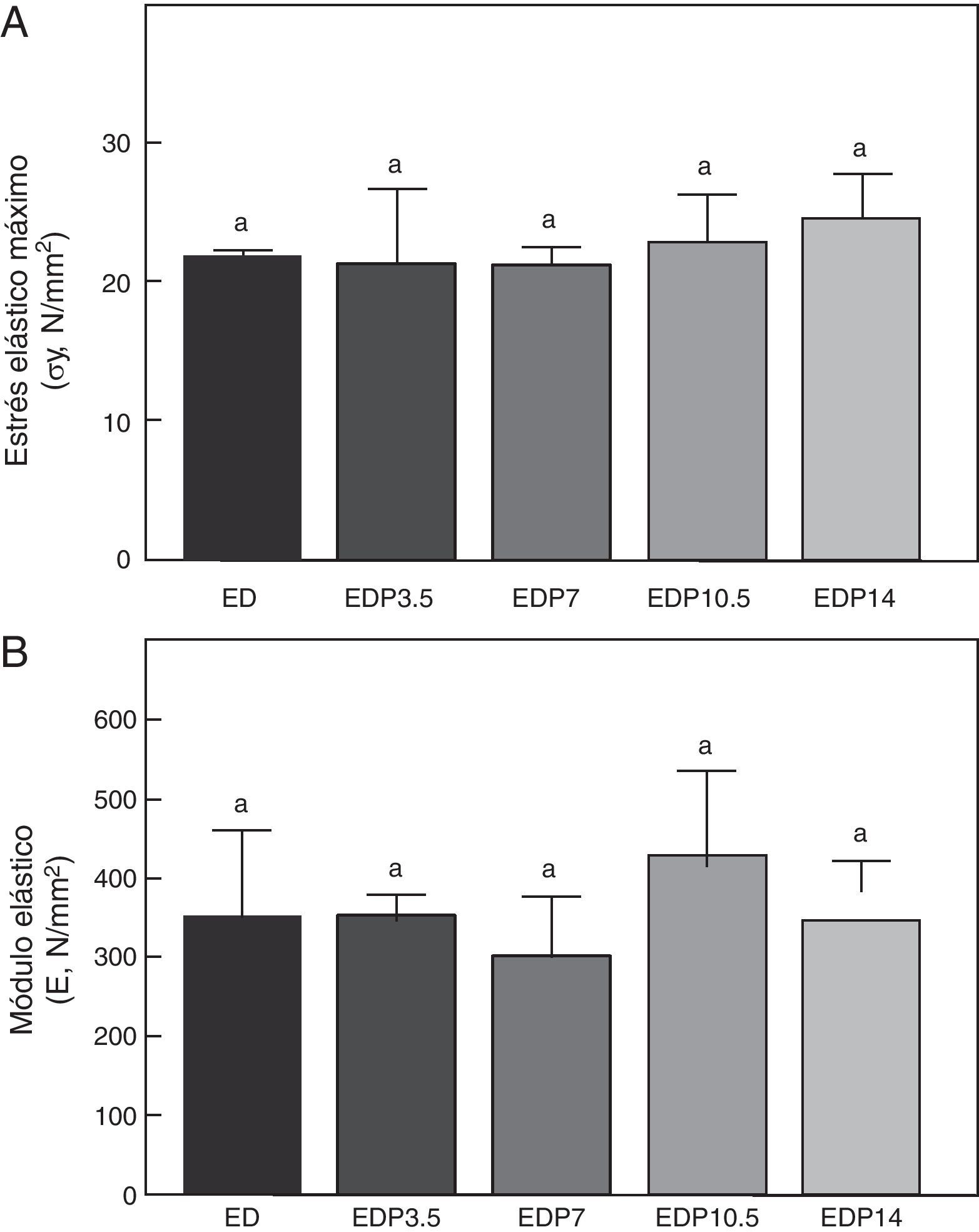
Propiedades materiales. A: estrés elástico máximo (σy) y B: módulo elástico (E), del fémur de animales experimentales ED+propranolol 3,5mg/kg/día (EDP3,5); experimentales ED+propranolol 7mg/kg/día (EDP7); experimentales ED+propranolol 10,5mg/kg/día (EDP10,5); experimentales ED+propranolol 14mg/kg/día (EDP14) expresadas como porcentaje de incremento de dichas variables respecto de las correspondientes a ED a tiempo final (T4). Letras diferentes indican diferencias significativas entre grupos, donde ED=a (p<0,05).
Al analizar la resistencia ósea a la fractura relativa al peso (Wf/p; N/g) de los animales subalimentados tratados con P, ésta fue de 0,087±0,02; 0,176±0,02; 0,146±0,01 y de 0,092±0,02 para EDP3,5; EDP7; EDP10,5 y EDP14, respectivamente. Wf/p de EDP7 y EDP10,5 fue significativamente superior respecto de ED (p<0,05). Si bien la capacidad resistiva a la fractura respecto del peso corporal de EDP7 fue superior a la de EDP10,5, no se evidenciaron diferencias significativas entre ambos grupos (p>0,05). No se observaron diferencias significativas en Wf/p de los grupos ED; EDP3,5; EDP14 (p>0,05).
En relación a las propiedades geométricas óseas, los resultados del presente estudio muestran que los animales subalimentados tratados con 7 y 10,5mg/kg/día de P, EDP7 y EDP10,5, respectivamente, presentan aumentos significativos en CSA, A e Ix respecto a ED (p<0,01) (fig. 7). No se observan diferencias significativas entre las variables CSA, A e Ix de la media diáfisis femoral de EDP7 respecto de EDP10,5. El área medular no se afectó durante el tratamiento para ninguna de las dosis de P utilizadas (p>0,05).
El P administrado a ratas ED en dosis de 3,5 y 14mg/kg/día no produjo modificaciones en CSA, A, MA e Ix evaluadas (p>0,05) (fig. 7).
En relación a la calidad intrínseca del material óseo, no hubo diferencias significativas en las variables estrés elástico máximo y módulo de elasticidad entre los animales subalimentados tratados con P entre sí ni respecto del grupo ED no tratado (p>0,05) (fig. 8).
DiscusiónDe acuerdo con los conceptos modernos de la biología ósea, los esqueletos constituyen estructuras vivas siempre cambiantes en respuesta a distintos estímulos, entre ellos, mecánicos, farmacológicos, ambientales y nutricionales, siendo este último de gran incidencia en la calidad biomecánica ósea2,4–6,17. En efecto, es el factor nutricional uno de los determinantes de la adquisición de hueso durante el crecimiento, el pico de masa ósea alcanzado en la edad adulta y la magnitud de la pérdida de hueso en la vejez.
Debido a la relación existente entre el desarrollo integral del individuo, el equilibrio salud-enfermedad, la condición nutricional y la aptitud biomecánica ósea, y a la evidencia de un control β-adrenérgico sobre el hueso, el objetivo del presente estudio fue determinar en un modelo animal de retraso del crecimiento, el efecto de diferentes dosis del β-bloqueante P sobre las variables antropo-morfométricas y biomecánicas óseas. Se evaluaron las posibles modificaciones de la calidad ósea relativas al uso mecánico a fin de poder inferir la dosis más adecuada que permita alcanzar la rigidez estructural apropiada como para soportar la estimulación mecánica habitual y/o máxima a la que podrían estar sometidos animales control de igual edad cronológica.
En el presente estudio la restricción impuesta fue lo suficientemente severa como para afectar negativamente el crecimiento corporal en todos los grupos de animales subalimentados tratados con P como en los ED no tratados. Se observó un comportamiento similar en el crecimiento del fémur de los animales desnutridos luego de 4 semanas de restricción. Independientemente de la condición nutricional y de la dosis de droga administrada, no se evidenciaron diferencias significativas en los parámetros mencionados entre los grupos tratados en relación a sus respectivos controles, C y ED, sugiriendo que el fármaco empleado no produciría efectos per se sobre el peso y la longitud corporal global y del hueso en particular. Estos resultados concuerdan con los obtenidos por otros autores que registraron cambios en la masa ósea sin modificaciones antropométricas frente a la administración del β-bloqueante19.
En relación a las propiedades estructurales de la mediadiáfisis obtenidas a través del análisis de las gráficas carga/deformación, los resultados del presente estudio muestran que éstas se afectaron negativamente luego de 4 semanas de restricción de alimento en los animales subalimentados en relación a su respectivo control. En este sentido puede decirse que en base a los conceptos propuestos por Frost relativos al mecanismo de autocontrol de la calidad mecánica del hueso39, un desajuste del mecanismo regulatorio del mecanostato óseo podría ser el resultado de una disminución de la estimulación mecánica del mismo por disminución del peso corporal de los animales ED respecto del grupo control de igual edad cronológica. Puede decirse, que a menor peso corporal, menor deformación ósea, la que sería interpretada por el osteocito como una señal de error biomecánico, con incremento de la actividad osteoclástica, aumento de la resorción ósea, lo que determinaría que el mecanostato ajuste la deformación ósea al nuevo peso corporal alcanzado por los animales ED. Sin embargo, cabe señalar que la carga de fractura femoral relativa al peso corporal no presentó diferencias significativas entre ED y su respectivo control, lo que sugiere que la resistencia efectiva del fémur a perder su integridad como cuerpo único se encuentra conservada en los animales desnutridos.
Asimismo, a igual edad cronológica, la relativamente menor rigidez ósea de los ED respecto de los animales C podría ser suficiente como para que la estructura ósea de los animales subalimentados soporte una pobre estimulación mecánica cotidiana, pero insuficiente como para soportar los esfuerzos fisiológicos habituales y/o máximos de un individuo sano y bien nutrido.
Es sabido que las propiedades estructurales del hueso entero están determinadas por la naturaleza fisicoquímica de su matriz calcificada (propiedades materiales focalizadas en la rigidez del tejido) y por la disposición arquitectónica de esa matriz en el espacio (propiedades geométricas focalizadas en la macroarquitectura)37. Cualquier cambio en las propiedades estructurales óseas puede y debe ser explicado por cambios en las propiedades materiales o en las geométricas o en ambas.
En congruencia con las propiedades mecánicas analizadas, el área total y cortical, así como el momento de inercia de la sección transversa fueron significativamente menores en los animales ED en comparación a sus respectivos controles, lo que puede ser el reflejo de una menor masa ósea con alteración de la distribución espacial de dicha masa en el modelo animal de ED.
Al analizar el área de la sección transversa de la mediadiáfisis femoral, se observó que el ancho de la pared cortical fue aproximadamente un 30% menor en los animales ED respecto de los controles. El mismo se incrementó significativamente frente a la administración de P en dosis de 7 y 10,5mg/kg/día sugiriendo una mayor masa ósea por aposición perióstica y/o disminución de la resorción en presencia del β-bloqueante en el presente modelo experimental. Similares resultados se observaron frente a la administración de bajas dosis del β-bloqueante, pero por un tiempo más prolongado en ratas adultas ovariectomizadas30,40.
La ausencia de diferencias significativas en el ancho medular de la sección transversa entre ED y C, sugiere que la menor masa ósea observada en los animales subalimentados, podría ser el resultado de una menor formación ósea y/o incremento de la resorción subperióstica sin variaciones en la superficie endóstica.
Si bien no se observan diferencias significativas en el área cortical de la sección transversa ni en el momento de inercia entre los grupos EDP7 y EDP10,5, dichas variables muestran una tendencia a ser superior en el primer grupo respecto del segundo, lo que sugiere un mejor diseño arquitectónico del material óseo mineralizado en las ratas subalimentadas tratadas con 7mg/kg/día de P.
En relación a los indicadores de las propiedades materiales del hueso cortical, el módulo elástico (indicador de la rigidez intrínseca del material óseo) y el estrés elástico máximo (indicador indirecto de la resistencia del tejido óseo), los mismos no fueron afectados ni por la restricción de alimento, al igual que lo observado en estudios previos realizados en nuestro laboratorio2, ni por la administración de la droga. La ausencia de diferencias en las propiedades materiales en los animales subalimentados tratados con P sugiere que el incremento de la capacidad resistiva de la diáfisis femoral estaría directamente relacionado con un incremento de la masa ósea cortical y una mayor eficiencia del diseño arquitectónico.
La concepción actual del esqueleto sostiene que el mismo está dinámicamente regulado por las deformaciones producidas por el uso muscular regional con el propósito de optimizar la eficiencia mecánica del diseño arquitectónico en función de la carga que soportan las regiones óseas, representando la contracción muscular la carga fisiológica más importante ejercida sobre el hueso41–44.
Si bien, como se mencionó previamente, la capacidad resistiva ósea de los animales ED relativa al tamaño corporal alcanzado podría ser suficiente para soportar fuerzas mecánicas diarias de baja intensidad, esta condición de la estructura ósea no sería la adecuada para soportar la estimulación mecánica máxima a la que podrían estar sometidos animales de igual edad cronológica. El aumento de la capacidad resistiva en los animales EDP7 y EDP10,5 respecto de los ED sugiere que la aptitud mecánica de los animales subalimentados tratados con P 7 y 10,5mg/kg/día ha sido optimizada o mejorada para los posibles esfuerzos fisiológicos máximos, con el consiguiente mantenimiento de una deformabilidad ósea alejada del nivel crítico que pueda llegar a resultar en una fractura. Sin embargo, al analizar el efecto de la dosis de P a la cual se alcanzó la mayor capacidad resistiva del fémur, 7mg/kg/día durante 4 semanas, sobre la masa muscular de los animales ED, se observó que dicha masa relativa al peso corporal no varió respecto de ED y de C. En efecto, el peso del cuádriceps/peso corporal (mg/g) de EDP7 vs ED vs C fue de 2,70±0,09 vs 2,63±0,06 vs 2,80±0,11, respectivamente (p>0,05). Dichos resultados sugieren que el P ejercería un efecto sobre el estado funcional del mecanostato óseo, el cual no se llevaría a cabo a través de una modificación del entorno mecánico. La incorporación modelatoria de hueso en los animales EDP7 podría ser el resultado de una modificación de la percepción de la magnitud de la deformación, del punto de referencia biomecánico por disminución del umbral mecánico remodelatorio y/o de la respuesta de los efectores osteoclastos-osteoblastos en el presente modelo de estrés nutricional.
Si bien Frost caracterizó el modelado y remodelado óseos como dos procesos efectores dinámicos con participación de los osteoclastos y osteoblastos en la resorción y formación de hueso39, en la actualidad aún existe controversia sobre el papel de dichos mecanismos en situaciones mecánicas como en el modo desuso observado en los animales ED. El estudio del comportamiento de los osteocitos como células mecanosensoras óseas permitiría la comprensión del mecanismo operacional del mecanostato en la adaptación funcional del hueso a la carga a soportar por el portante.
Existe evidencia que sugiere que la apoptosis del osteocito es necesaria para que el proceso de resorción sea iniciado en situaciones de deformaciones óseas inferiores al umbral mecánico remodelatorio45. Si bien se desconoce el mecanismo por el cual la célula mecanosensora muere en situación de desuso mecánico, un inadecuado aporte nutricional, así como de remoción de los productos metabólicos del osteocito, podrían ser la causa, al menos en parte, de la disminución de la sobrevida de dicha célula. En este sentido, podría decirse que el P administrado en dosis de 7mg/kg/día en los animales EDP7 tendría el efecto antiapoptótico más adecuado, responsable de la viabilidad del mecanosensor con el consiguiente incremento de la calidad ósea en las ratas ED.
Desde una concepción farmacodinámica, la menor rigidez estructural observada en los animales EDP10,5 respecto de EDP7 podría ser el resultado de una eficacia intrínseca diferencial del P dosis-dependiente relativa a la interacción ligando-receptor-cascada de señalización intracelular y/o a la regulación de receptores β-adrenérgicos. En efecto, el P podría comportarse como un agonista inverso parcial cuando es administrado en dosis de 10,5mg/kg/día en el presente régimen utilizado, fenómeno íntimamente relacionado con las drogas reconocidas por receptores acoplados a la proteína G. En efecto, los estudios recientes evidencian la participación de numerosos antagonistas β- adrenérgicos, incluído el P, los cuales mediante una actividad de agonistas parciales ejercerían una disminución de los niveles de AMPc con incremento de la señalización de la MAPKinasa a través del reclutamiento de β-arrestinas46.
Los resultados del presente estudio evidencian que el P en dosis de 3,5 mg/Kg/día no produce modificaciones en la calidad mecánica del fémur de ratas ED. Dicha respuesta podría ser la consecuencia de una dosis insuficiente como para producir un efecto benéfico del P sobre el esqueleto apendicular. Asimismo, la ausencia de respuesta observada en los animales EDP14 respecto de EDP7 podría deberse a que el β-bloqueante empleado administrado en dosis de 14mg/kg/día se comportaría como un agonista inverso total y/o a fenómenos de sensibilización de adrenoceptores.
Puede concluirse, que el P de 7mg/kg/día sería la dosis más efectiva en la incorporación modelatoria de hueso con incremento de la eficiencia estructural y mecánica del esqueleto apendicular en el presente modelo animal de retraso del crecimiento. Dicho efecto podría ser el resultado del mantenimiento de la viabilidad del mecanosensor, de modificaciones de su sensibilidad a la deformación, del punto de referencia biomecánico y/o de la respuesta de los efectores en las ratas ED.
FinanciaciónEste trabajo fue financiado con fondos de la Universidad de Buenos Aires (Proyecto UBACyT O004).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Graciela Champin por su asistencia técnica.