Proporcionar unas recomendaciones prácticas para la evaluación y tratamiento de la osteoporosis asociada a diferentes enfermedades endocrinas y alteraciones nutricionales.
ParticipantesMiembros del Grupo de Metabolismo Mineral de la Sociedad Española de Endocrinología y Nutrición, un metodólogo y un documentalista.
MétodosLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer tanto la fuerza de las recomendaciones como el grado de evidencia. Se realizó una búsqueda sistemática en Medline de la evidencia disponible para cada patología usando las siguientes palabras clave asociadas al nombre de cada patología: AND osteoporosis, fractures, bone mineral density, bone markers y treatment. Se revisaron artículos escritos en inglés con fecha de inclusión hasta 18 de octubre de 2011, y cada tema fue revisado por dos personas del Grupo. Un metodólogo resolvió las diferencias que surgieron durante el proceso de revisión de bibliografía y formulación de recomendaciones. Tras la formulación de las recomendaciones estas se discutieron en una reunión conjunta del Grupo de Trabajo.
ConclusionesEl documento establece unas recomendaciones prácticas basadas en la evidencia acerca de la evaluación y tratamiento de la osteoporosis en las enfermedades endocrinas y nutricionales que asocian baja masa ósea o aumento del riesgo de fractura. Para cada patología, se señala el riesgo de osteoporosis y fracturas asociado, se formulan recomendaciones en cuanto a la evaluación de masa ósea y se enumeran las opciones terapéuticas que han demostrado eficacia en aumentar la densidad mineral ósea y/o reducir el riesgo de fractura.
To provide practical recommendations for evaluation and treatment of osteoporosis associated to endocrine diseases and nutritional conditions.
ParticipantsMembers of the Bone Metabolism Working Group of the Spanish Society of Endocrinology, a methodologist, and a documentalist.
MethodsRecommendations were formulated according to the GRADE system (Grading of Recommendations, Assessment, Development, and Evaluation) to describe both the strength of recommendations and the quality of evidence. A systematic search was made in MEDLINE (Pubmed), using the following terms associated to the name of each condition: AND “osteoporosis”, “fractures”, “bone mineral density”, and “treatment”. Papers in English with publication date before 18 October 2011 were included. Current evidence for each disease was reviewed by two group members, and doubts related to the review process or development of recommendations were resolved by the methodologist. Finally, recommendations were discussed in a meeting of the Working Group.
ConclusionsThe document provides evidence-based practical recommendations for evaluation and management of endocrine and nutritional diseases associated to low bone mass or an increased risk of fracture. For each disease, the associated risk of low bone mass and fragility fractures is given, recommendations for bone mass assessment are provided, and treatment options that have shown to be effective for increasing bone mass and/or to decreasing fragility fractures are listed.
Numerosos patologías en el campo de la Endocrinología y de la Nutrición se asocian a osteoporosis y a un aumento del riesgo de fractura. Sin embargo, en muchas de estas entidades no existen recomendaciones específicas acerca de la evaluación de masa ósea y del tratamiento que debe realizarse.
En este contexto, el Grupo de Trabajo de Metabolismo mineral de la Sociedad Española de Endocrinología y Nutrición (SEEN) se propuso elaborar unas recomendaciones prácticas para la evaluación y tratamiento de la osteoporosis asociada a diferentes enfermedades endocrinas y alteraciones nutricionales. Los objetivos fueron establecer unas recomendaciones basadas en la evidencia acerca del riesgo de baja masa ósea y fracturas asociado a cada entidad, las pruebas diagnósticas necesarias para su evaluación y los tratamientos que han demostrado aumentar la masa ósea y/o reducir el riesgo de fractura. En los casos en los que la evidencia es escasa o nula, los miembros del Grupo de Trabajo realizaron recomendaciones basadas en su experiencia y conocimientos en estas patologías.
Desarrollo de recomendaciones basadas en la evidenciaLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer la fuerza de las recomendaciones y el grado de evidencia1. Este sistema establece una descripción gráfica de la calidad de la evidencia disponible y de la fuerza de la recomendación que se realiza en base a esta evidencia. Así, en términos de fuerza de recomendación se distinguen recomendaciones fuertes, expresadas como «Recomendamos» y el número 1, y recomendaciones débiles expresadas como «Sugerimos» y el número 2. La calidad de la evidencia se expresa con símbolos: ⊕OOO indica evidencia muy baja; ⊕⊕OO, evidencia baja; ⊕⊕⊕O, evidencia moderada; y ⊕⊕⊕⊕, evidencia alta. Junto a cada recomendación se describe la evidencia que sustenta dicha recomendación.
Se realizó una búsqueda sistemática en Medline de la evidencia disponible para cada patología usando las siguientes palabras clave asociadas al nombre de cada patología: AND osteoporosis, fractures, bone mineral density y treatment. Se revisaron artículos escritos en inglés con fecha de inclusión hasta 18 de octubre de 2011. Cada tema fue revisado por dos personas del Grupo. Un metodólogo resolvió las diferencias que surgieron durante el proceso de revisión de bibliografía y formulación de recomendaciones. Tras la formulación de las recomendaciones, estas se discutieron en una reunión conjunta del Grupo de Trabajo.
Para cada entidad, se revisan los siguientes aspectos de acuerdo a la evidencia disponible: necesidad de evaluación de masa ósea por densitometría dual de rayos x (DXA) y de la presencia de fracturas vertebrales asintomáticas a través de radiología de columna dorsolumbar, así como recomendaciones acerca de medidas preventivas y de tratamiento.
Además de las medidas especificadas en cada epígrafe, de forma general el Grupo de Trabajo de Metabolismo Mineral recomienda asegurar una adecuada ingesta de calcio y unos niveles adecuados de vitamina D en todas los procesos que cursan con descenso de la masa ósea y/o aumento del riesgo de fractura (1⊕OOO).
Diabetes Mellitus tipo 1EvaluaciónRecomendación- -
Recomendamos evaluar la masa ósea mediante DXA así como el riesgo de fractura no vertebral en los pacientes con Diabetes Mellitus Tipo 1 (DM1) (1⊕⊕OO).
- -
Sugerimos evaluar la presencia de fractura vertebral mediante radiografía convencional en pacientes con DM1 (2⊕⊕OO).
La mayoría de los estudios han puesto de manifiesto que la DM1 tiene un impacto negativo sobre la densidad mineral ósea (DMO), tanto a nivel lumbar como femoral. Este efecto parece independiente del índice de masa corporal (IMC), la duración de la enfermedad, el grado de control metabólico y se ha descrito tanto en mujeres como en varones2–5. La afectación está presente desde el diagnóstico6 y mejora con el tratamiento intensivo con insulina7. A su vez, las complicaciones microvasculares y el tabaquismo se asocian a una menor masa ósea en este grupo de pacientes8–10. Por el contrario, otros autores no han encontrado diferencias significativas en la DMO entre pacientes con diabetes mellitus tipo 1 y la población control11–13.
Dos metanálisis han mostrado que los pacientes con DM1 tienen un incremento de 6 a 8 veces del riesgo de fractura de cadera. Este incremento es superior al esperado por la disminución observada en la DMO, es independiente de la HbA1c2,14 y aumenta con la presencia de complicaciones micro y macrovasculares15. A su vez, se ha descrito un mayor número del conjunto de fracturas no vertebrales en sujetos con DM116,17.
En cuanto a la evaluación del riesgo de fractura, este puede realizarse a través de la herramienta FRAX, disponible en: http://www.shef.ac.uk/FRAX/tool.jsp?country=4, y que considera la DM 1 como osteoporosis secundaria.
En lo que respecta a las fracturas vertebrales (FV), los resultados no son uniformes. Así, mientras un estudio transversal no encuentran diferencias significativas18, Vestergaard et al., en un diseño de casos y controles, observan un incremento del riesgo tanto en varones como en mujeres con DM119. Por otro lado, varios estudios en población no diabética, han puesto de manifiesto que la presencia de FV, tanto clínica como morfométrica, son un factor de riesgo independiente de desarrollar un nuevo episodio de fractura por fragilidad.
TratamientoRecomendación- -
Sugerimos que los pacientes con DM1 que tengan osteoporosis y/o fractura por fragilidad deben seguir las mismas recomendaciones generales y farmacológicas que la población no diabética (2⊕⊕OO).
- -
El déficit de función osteoblástica en esta enfermedad hace atractivo el empleo de fármacos anabólicos en pacientes de alto riesgo o en prevención secundaria (2⊕OOO).
Aunque la hiperglucemia se ha asociado a un bajo nivel de remodelado óseo, hasta la fecha no hay ningún estudio que haya analizado de manera específica el efecto de las diferentes opciones terapéuticas sobre la DMO en pacientes con DM1 y osteoporosis. En lo que respecta a la prevención de fracturas solo disponemos de un estudio de reciente publicación donde la presencia de DM1 no disminuye la eficacia antifracturaria de los bifosfonatos ni del raloxifeno20.
Diabetes Mellitus tipo 2EvaluaciónRecomendación- -
Sugerimos medir la DMO y evaluar la presencia de FV mediante estudio de radiología simple en pacientes con Diabetes Mellitus tipo 2 (DM2) (2⊕⊕OO).
- -
Recomendamos evaluar el riesgo de fractura no vertebral en pacientes con DM2, en particular en aquellos con complicaciones vasculares, insulinoterapia o tratamiento con glitazonas (1⊕⊕OO).
Aunque los diferentes estudios han mostrado resultados variables, de forma global podemos decir que los pacientes con DM2 tienen un aumento de la DMO tanto a nivel lumbar como femoral con respecto a los sujetos no diabéticos en la diferentes poblaciones estudiadas2,21–26. Este incremento se correlaciona positivamente con el IMC, y de manera negativa con la duración de la enfermedad a nivel femoral y con el tratamiento con glitazonas. Parece ser independiente de la edad y la HbA1c2,27.
Sin embargo, a pesar de este aumento en la DMO, dos recientes metaanálisis han puesto de manifiesto que los pacientes con DM2 padecen un mayor número de fracturas no vertebrales (muñeca, pie, cadera) sin haberse objetivado un aumento significativo del riesgo de FV. En particular, para la cadera, los pacientes con DM2 tienen un riesgo relativo entre 1,4 y 1,7 con respecto a la población no diabética2,14. Por el contrario, Yamamoto et al., en un estudio transversal sí encuentran un incremento del riesgo de fracturas vertebrales en este grupo de pacientes28.
El riesgo de fracturas se ha asociado a la presencia de cataratas, microangiopatía (neuropatia, retinopatía), tratamiento con insulina e ictus, todo ello en relación con el aumento del riesgo de caídas característico de este grupo de pacientes29–34. A su vez, la DMO femoral y el índice FRAX predicen el riesgo de fractura de cadera y el conjunto de fracturas no vertebrales aunque parecen infraestimar el riesgo real que padecen estos pacientes35. Por otro lado, el efecto de los antidiabéticos orales sobre el riesgo de fractura ha mostrado resultados discordantes. Así, mientras el uso de metformina y sulfonilureas se ha asociado a un menor riesgo19,33, el tratamiento con glitazonas incrementa el riesgo particularmente en mujeres posmenopáusicas pero también en varones36–38.
Para la evaluación del riesgo de fractura en pacientes con DM2 puede utilizarse la escala QFracture (http://www.qfracture.org), que considera la presencia o no de DM2 como factor de riesgo aunque no ha sido validada para población española.
TratamientoRecomendación- -
Sugerimos que en los pacientes con DM2 la osteoporosis y la prevención de fracturas debe seguir las mismas recomendaciones que en población no diabética (2⊕⊕OO).
- -
El déficit de función osteoblástica en esta enfermedad hace atractivo el empleo de fármacos anabólicos en pacientes de alto riesgo o en prevención secundaria (2⊕OOO).
Pocos estudios han analizado de forma específica la prevención y el tratamiento de la osteoporosis en pacientes con DM2. En un análisis post hoc del estudio Fracture Intervention Trial, el tratamiento con alendronato resultó en similares ganancias de DMO en mujeres posmenopáusicas con o sin DM239. Por el contrario, Dagdelen et al., en un estudio retrospectivo de casos y controles, observaron que la presencia de DM2 condicionaba una menor respuesta al tratamiento con alendronato a nivel de hueso cortical (fémur, radio)40. En lo que respecta a la prevención de fracturas, al igual que en la DM1, la eficacia antifracturaria de los bifosfonatos y el raloxifeno no parece disminuir en pacientes con DM2.
Hiperparatiroidismo primarioEvaluaciónRecomendación- -
Recomendamos realizar una evaluación de la masa ósea y una radiografía lateral de columna dorsolumbar para evaluar la presencia de fracturas vertebrales en todos los pacientes afectos de HPTP (hiperparatiroidismo primario) (1⊕⊕⊕O).
Uno de cada 3 pacientes presenta pérdida de DMO a partir de los 10 años de evolución, con afectación predominante de hueso cortical preservándose el trabecular. Estos cambios revierten con la paratiroidectomia. El 21% de los pacientes desarrollan pérdida de masa ósea (T-score<2,5 DS) a los 10 años de seguimiento41, siendo factores determinantes la calcemia inicial, la menopausia y la edad más joven42. A partir de los 10 años la DMO cortical no permanece estable sino que se deteriora en la mayoría de los pacientes43.
Los estudios observacionales demuestran en grupos con HPTP asintomático que hay un aumento del riesgo de fracturas, sobre todo corticales del esqueleto axial. El aumento del riesgo de fractura global es de 1.8, 3.2 el de FV, 2.3 radio distal y 1.4 para fractura de cadera44,45.
TratamientoRecomendación- -
Recomendamos la paratiroidectomia en la mayoría de casos ya que aumenta la masa ósea y reduce el riesgo de fractura (1⊕⊕⊕O).
- -
En caso de contraindicación o rechazo de la cirugía sugerimos tratamiento combinado con cinacalcet (para control de cifras de PTH y calcio) y un anticatabólico (bisfosfonatos o denosumab) para evitar pérdida de masa ósea, aunque no existen datos sobre fracturas (2⊕OOO).
En pacientes con HPTP la paratiroidectomia mejora la secreción pulsátil de la PTH, aumenta el remodelado óseo, la mineralización y la formación ósea. Tras la paratiroidectomía se observa un aumento de la DMO entre el 4 y 12%, mayor en columna lumbar seguido del fémur y radio41,46–49. La masa ósea mejora en el 100% de los pacientes (del 8 al 12% en 3 años) y esta mejoría se mantiene a los 15 años sobre todo en el hueso trabecular. La mayoría aunque no todos los estudios muestran que tras la paratiroidectomía se reduce un 50% el riesgo de fractura43,50–52.
Los criterios para la paratiroidectomia en pacientes asintomáticos son los siguientes: T-score igual o inferior a -2,5 DE en columna lumbar, cuello femoral, cadera o tercio distal del radio en mujeres menopáusicas y en hombres con edad superior a 50 años (3th International Workshop)41. En premenopáusicas o varones con menos de 50 años, la International Society for Clinical Densitometry, considera el Z-score inferior a -2,5 DE en las mismas localizaciones53.
Los bifosfonatos, de los cuales el alendronato es el más estudiado, disminuyen la resorción ósea y aumentan la DMO lumbar y femoral. Están recomendados en pacientes con HPTP sin criterios de cirugía y DMO baja, aunque no modifican ni la calcemia ni la PTH. En mujeres posmenopáusicas los estrógenos-progestágenos disminuyen la resorción ósea y aumentan la DMO en grado comparable a sujetos normocalcémicos o al observado tras la paratiroidectomía en el HPTP. Cinacalcet disminuye la calcemia y la PTH, pero no disminuye el recambio óseo ni incrementa la DMO54–56.
Hipertiroidismo endógenoEvaluaciónRecomendación- -
Sugerimos realizar una evaluación de la masa ósea y de la presencia de fracturas en pacientes con antecedentes de hipertiroidismo. El antecedente de hipertiroidismo debe considerarse un factor de riesgo de fractura de cadera (2⊕⊕OO).
El hipertiroidismo produce una disminución de la masa ósea57–59 independiente de la etiología, tanto en varones como mujeres pre y posmenopáusicas60,61, siendo esta disminución mayor a más edad57. Existe un aumento del riesgo de fractura de cadera57,58,62. En general no se ha demostrado el aumento de riesgo de fractura de Colles ni vertebral63, aunque sí en mujeres mayores de 65 años64. La pérdida de masa ósea se debe a un aumento de la resorción ósea con aumento de los marcadores de remodelado que se normalizan tras la vuelta al eutiroidismo65, aunque hay una parte de la pérdida de masa ósea que es irreversible en base a estudios histomorfométricos66.
TratamientoRecomendación- -
El tratamiento del hipertiroidismo con rápida consecución del eutiroidismo produce una mejoría, al menos parcial, de la masa ósea y una disminución del riesgo de fractura (1⊕⊕OO).
- -
Recomendamos asegurar la adecuada ingesta de calcio y vitamina D (1⊕OOO).
- -
Sugerimos considerar el tratamiento con anticatabólicos (aminobisfosfonatos o denosumab) de forma individualizada en mujeres posmenopáusicas y en ancianos de ambos sexos con alto riesgo de fractura osteoporóticas. Las pacientes con osteoporosis posmenopáusica y con antecedente de hipertiroidismo pueden beneficiarse de tratamiento anabólico (PTH o teriparatida) antes de recibir antirreabsortivos (2⊕OOO).
La pérdida ósea causada por el hipertiroidismo es generalmente reversible, al menos parcialmente, a partir del primer año de tratamiento con antitiroideos y en un tiempo variable según los estudios57,63,67,68. El tratamiento con radioyodo produce también una mejoría de la DMO57,69. No hay estudios que hayan evaluado la DMO exclusivamente en pacientes tratados con cirugía, aunque sí se ha demostrado un descenso del riesgo de fracturas en estos pacientes58. Algunos estudios demuestran una mejoría de la DMO pero no una recuperación completa, manteniendo una masa ósea menor de la esperada70,71.
Hipertiroidismo endógeno subclínicoEvaluaciónRecomendación- -
Sugerimos realizar una evaluación de la masa ósea y de la presencia de fracturas en pacientes con hipertiroidismo subclínico, especialmente en el caso de mujeres posmenopáusicas y mayores de 65 años (2⊕⊕OO).
Aunque está bien establecido el efecto deletéreo sobre la DMO y el riesgo de fracturas en pacientes con hipertiroidismo endógeno, el riesgo en pacientes con hipertiroidismo subclínico no tratado es más controvertido. Se ha demostrado un aumento de los marcadores de remodelado óseo en pacientes con hipertiroidismo subclínico, tanto los de formación como de resorción72. En la valoración de masa ósea, se han realizado estudios principalmente en mujeres posmenopáusicas donde se demuestra un descenso de la DMO en aquellas con hipertiroidismo subclínico endógeno independientemente de la etiología de este73–76. En el caso de mujeres premenopáusicas hay resultados contradictorios y en cualquier caso con pérdidas de DMO menores que en el caso de las pacientes posmenopáusicas73,76. En cuanto al riesgo de fractura, ha sido evaluado en un reciente estudio de cohortes que ha mostrado una incidencia de fractura de cadera en varones mayores de 65 años con hipertiroidismo subclínico de 13,65 por 1.000 pacientes-año y un riesgo de fractura de cadera elevado: RR 4,91, IC 95% 1,13-21-27; no se encontraron resultados significativos en el caso de mujeres75. Por otro lado se ha demostrado un aumento del riesgo de fracturas en pacientes con hipertiroidismo subclínico con TSH indetectable77, y un estudio prospectivo de mujeres de más de 65 años mostró que una TSH indetectable fue factor de riesgo de fracturas vertebrales y de cadera tras cuatro años de seguimiento64. Por otro lado disponemos de estudios donde no se demuestra un efecto deletéreo del hipertiroidismo subclínico sobre el metabolismo óseo, pero estos han sido realizados con pacientes premenopáusicas o con una media de edad más joven78–80.
TratamientoRecomendación- -
El tratamiento del hipertiroidismo subclínico con rápida obtención del eutiroidismo produce una mejoría de la masa ósea (1⊕⊕OO).
- -
Sugerimos considerar el tratamiento con antirreabsortivos de forma individualizada en mujeres posmenopáusicas y en ancianos con osteoporosis para una rápida mejoría en el riesgo de fractura (2⊕OOO).
Dos estudios prospectivos en mujeres posmenopáusicas con hipertiroidismo subclínico mostraron una leve mejoría o estabilización de la DMO en pacientes tratadas con radioyodo o antitiroideos, mientras que las pacientes no tratadas presentaron un empeoramiento de esta81,82.
HipotiroidismoEvaluaciónRecomendación- -
No se recomiendan medidas específicas en este grupo de pacientes más allá de asegurar una adecuada ingesta de calcio y vitamina D (1⊕OOO).
El hipotiroidismo no tratado se asocia a mayor DMO por descenso del remodelado óseo66. Algunos estudios han demostrado un mayor riesgo de fractura tanto en hombres como en mujeres con hipotiroidismo primario, con un pico máximo en el momento del diagnóstico58,63,83. Se han dado diversas explicaciones a este aumento de riesgo de fractura, bien porque tras el inicio del tratamiento con levotiroxina existe un aumento del remodelado inicialmente, que luego se normaliza, bien por acúmulo de fracturas de estrés debido al bajo remodelado óseo o por aumento de caídas en pacientes con hipotiroidismo por efecto de este a nivel neuromuscular.
TratamientoRecomendación- -
Aunque el tratamiento del hipotiroidismo clínico produce una inicial pérdida de masa ósea, no parece que incremente el riesgo de fractura por lo que no se recomiendan medidas específicas si las cifras de TSH se mantienen en límites normales. (1⊕⊕OO).
- -
Recomendamos asegurar la ingesta adecuada de calcio y vitamina D (1⊕OOO).
En cuanto al efecto del tratamiento sustitutivo del hipotiroidismo sobre la DMO existen resultados dispares. Así, varios estudios no evidencian un efecto negativo del tratamiento sustitutivo con levotiroxina sobre la DMO63,84,85, mientras que en un metanálisis de estudios transversales sí se demostró una menor DMO en mujeres premenopáusicas, aunque no en posmenopáusicas ni varones86. En un reciente estudio en personas ancianas mayores de 70 años se encontró un aumento del riesgo de fracturas entre los que utilizaban levotiroxina frente a los que la habían usado en el pasado (OR 1,88 IC95% 1,71-2,05) con mayor riesgo en los que recibían dosis acumuladas y medias más altas, aunque no se analizaron las cifras de TSH ni la causa de la indicación87.
Hipotiroidismo subclínicoEvaluaciónRecomendación- -
No se recomiendan medidas específicas (1⊕OOO).
Existe escasa evidencia acerca de los efectos del hipotiroidismo subclínico sobre la masa ósea88,89. En cuanto al riesgo de fractura, un estudio reciente muestra un aumento de la incidencia de fractura de cadera en varones con disfunción tiroidea subclínica aunque no existe asociación en mujeres75.
TratamientoRecomendación- -
El tratamiento del hipotiroidismo subclínico con levotiroxina a dosis sustitutivas no parece incrementar el riesgo de fractura, por lo que no se recomiendan medidas específicas si las cifras de TSH se mantienen en rango normal (1⊕OOO).
- -
Recomendamos asegurar la ingesta adecuada de calcio y vitamina D (1⊕OOO).
No existen datos acerca de los efectos del tratamiento con levotiroxina sobre la masa ósea o el riesgo de fracturas en pacientes con hipotiroidismo subclínico, aunque sí se ha demostrado un aumento de marcadores tanto de resorción como de formación en mujeres tratadas con levotiroxina frente a placebo90.
Tratamiento supresor con levotiroxinaEvaluaciónRecomendación- -
Recomendamos la monitorización de la DMO cada 1-2 años en pacientes en tratamiento supresor con levotiroxina, especialmente en mujeres posmenopáusicas y mayores de 65 años (1⊕⊕OO).
- -
Recomendamos el uso de la menor dosis supresora posible y asegurar la adecuada ingesta de calcio y vitamina D (1⊕OOO).
- -
Sugerimos considerar el tratamiento con antirreabsortivos potentes (aminobisfosfonatos, denosumab) de forma individualizada en mujeres posmenopáusicas y en ancianos con riesgo de fractura medio calculado a partir de modelos que no tienen en cuanta el antecedente de hipertiroidismo subclínico (2⊕OOO).
Existen múltiples estudios realizados en pacientes con tratamiento supresor con levotiroxina, como parte del tratamiento del cáncer diferenciado de tiroides y como tratamiento del bocio multinodular no tóxico. Los resultados de estos estudios son contradictorios con descensos significativos de DMO tanto en varones como en mujeres en algunos de ellos91–97 y sin diferencias en cuanto a DMO en otros98–107,lo que puede reflejar diferencias en el uso de la dosis mínima supresora en la práctica clínica.
Se ha realizado un estudio poblacional de 17.684 pacientes en tratamiento con levotiroxina donde aquellos con TSH suprimida presentaban el doble de riesgo de fractura osteoporótica que los que tenían TSH normal, aunque no se tenían datos del nivel de FT4108.
Hipogonadismo femeninoEvaluaciónRecomendación- -
Recomendamos evaluar la masa ósea con DXA y la presencia de fracturas mediante radiografía lateral de columna dorsal y lumbar al diagnóstico de la situación de hipogonadismo y posteriormente cada 3-5 años (1⊕⊕⊕⊕).
El descenso de estrógenos en la mujer aumenta el riesgo de baja masa ósea y de fracturas por fragilidad109,110. Este riesgo es mayor cuanto el hipogonadismo se inicia a edades tempranas.
TratamientoRecomendación- -
Recomendamos realizar tratamiento etiológico de la causa de hipogonadismo. Cuando no sea posible se realizará tratamiento hormonal sustitutivo (1⊕⊕⊕⊕).
- -
Recomendamos mantener una óptima ingesta de calcio, vitamina D y realizar actividad física regular (1⊕⊕⊕⊕).
- -
No se recomienda el tratamiento con bifosfonatos en adolescentes y mujeres premenopáusicas (1⊕OOO).
- -
Si no se planea gestación a corto plazo y el riesgo de fractura es elevado, sugerimos iniciar tratamiento con denosumab (2⊕OOO).
- -
En pacientes con riesgo de fractura muy alto, o con fractura prevalente y baja DMO sugerimos realizar tratamiento anabólico (2⊕OOO).
El tratamiento etiológico está indicado cuando el hipogonadismo sea secundario a prolactinoma, anorexia nerviosa o amenorrea funcional hipotalámica111,112. En el resto de las situaciones, debe iniciarse tratamiento hormonal sustitutivo: píldora combinada de anticonceptivos orales (estrógenos asociados a progestágenos) en pacientes jóvenes y en caso de obesidad, hábito tabáquico o hipertensión formulaciones transdérmicas. En mujeres con osteopenia se recomienda usar etinil-estradiol oral o estrógenos conjugados en altas dosis111. El reemplazo con estrógenos debe realizarse hasta los 50 años de edad aproximadamente, evaluando riesgo /beneficio teniendo en cuenta edad, osteoporosis, hábito tabáquico y riesgo de trombosis111.
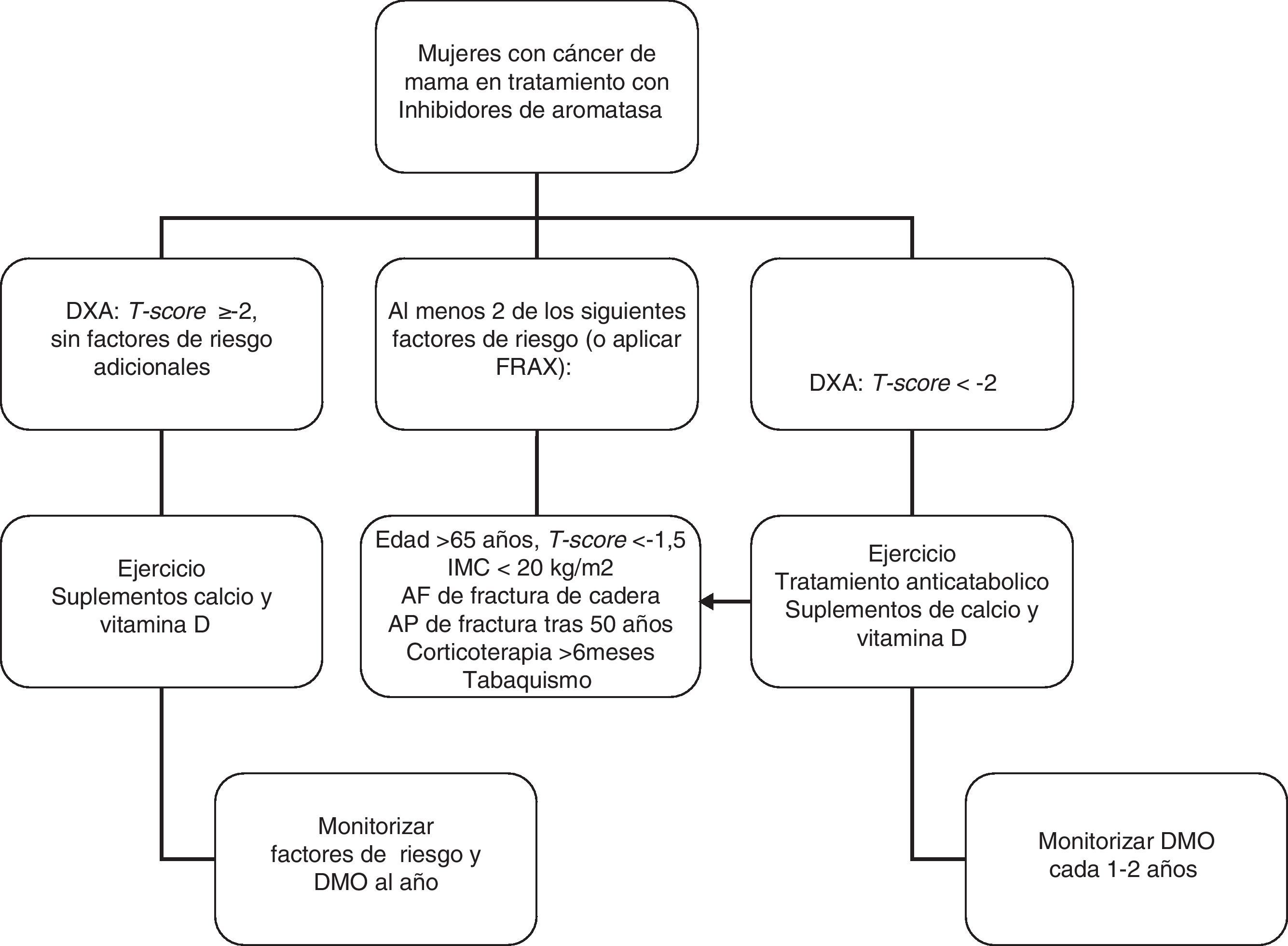
Cáncer de mama en tratamiento hormonalEvaluaciónRecomendación- -
En mujeres con cáncer de mama y que reciban tratamiento con agonistas GnRH y/o inhibidores de aromatasa, recomendamos realizar una evaluación de la masa ósea (1⊕⊕⊕O) así como descartar la presencia de fracturas vertebrales (1⊕⊕OO).
-El tratamiento con inhibidores de aromatasa en mujeres con carcinoma de mama se asocia a pérdida de masa ósea113 y fracturas114–115.
TratamientoRecomendación- -
Recomendamos administrar suplementos de calcio, vitamina D y consejos sobre actividad física a todas las pacientes (1⊕⊕OO).
- -
En las pacientes en las que esté indicado tratamiento anticatabólico (fig. 1) recomendamos emplear bifosfonatos: zoledronato (1⊕⊕⊕⊕), risedronato (1⊕⊕OO), ibandronato (1⊕⊕OO) o denosumab (1⊕⊕OO).
En mujeres en tratamiento con inhibidores de la aromatasa, zoledronato (4mg/6meses iv) ha demostrado aumentar la masa ósea entre 4,4 y 6,2% en columna lumbar y entre 1,2 y 2,6% en cadera116–117. Además, existen datos de amplios ensayos clínicos que sugieren beneficios antitumorales del zoledronato, derivados de un impacto positivo en el microambiente de la médula ósea.
El risedronato (35mg v.o./semana) en estudios a 2 años en mujeres con carcinoma de mama en tratamiento con anastrozol, ha demostrado inducir un aumento de la masa ósea lumbar (0,4-2,2%) y femoral (0,9- 1,8%) vs placebo118–119.
También ibandronato (150mg v.o/mes) han demostrado prevenir la pérdida de masa ósea en este grupo de pacientes120. Finalmente, el tratamiento con denosumab (60mg sc/6m) durante 24 meses induce un aumento de DMO de 7,6% en columna lumbar y de 4,7% respecto a placebo121.
Hipogonadismo masculinoEvaluaciónRecomendación- -
En varones jóvenes el descenso de los concentraciones de testosterona se asocia a baja masa ósea y aumento del riesgo de fractura (1⊕⊕⊕⊕).
- -
Recomendamos realizar DXA al diagnóstico del hipogonadismo y posteriormente cada 3-5 años (1⊕⊕OO).
En estudios realizados en pacientes con síndrome de Klinefelter adultos se observa una reducción de la DMO en un 25-48% al compararlo con varones adultos sanos y un 6-15% presenta osteoporosis122–124.
TratamientoRecomendación- -
Para aumentar la masa ósea y reducir el riesgo de fractura recomendamos: restaurar los niveles de testosterona (1⊕⊕OO), mantener un adecuado aporte de calcio y vitamina D y realizar actividad física regular (1⊕⊕⊕⊕).
- -
Recomendamos tratamiento con bifosfonatos en varones con osteoporosis y/o fracturas por fragilidad (1⊕⊕⊕⊕). Si existe osteoporosis grave, masa ósea muy baja (<3 DS) o falta de respuesta a bifosfonatos recomendamos usar teriparatida (1⊕⊕OO).
El tratamiento sustitutivo con testosterona puede realizarse por administración intramuscular o transdérmica (parches o gel), y siempre controlando los posibles efectos adversos del tratamiento125. En pacientes mayores con osteoporosis se recomienda asociar bifosfonatos126–128 y en caso de osteoporosis grave y/o falta de respuesta a bifosfonatos debe utilizarse teriparatida124.
Cáncer de próstata en tratamiento con terapia de deprivación androgénicaEvaluaciónRecomendación- -
Recomendamos realizar DXA y valorar la existencia de fracturas vertebrales mediante radiología al inicio del tratamiento con agonistas GnRH o tras la orquidectomia, y posteriormente cada 12 meses (1⊕⊕⊕⊕).
Los agonistas GnRH (gosereline, triptorelin, leuprolide) utilizados en el carcinoma de próstata avanzado inducen una pérdida de masa ósea y un aumento de la incidencia de fracturas. Ambos efectos están en relación con el tiempo de tratamiento y con las dosis de agonistas GnRH administrados129,130. El porcentaje de pérdida de masa ósea anual oscila entre un 0,6 y un 4,5%, y en los primeros 6-12 meses del inicio del tratamiento este porcentaje de pérdida de masa ósea es aún mayor (4-10%)131,132.
TratamientoRecomendación- -
Recomendamos que todos los pacientes en tratamiento con agonistas GnRH u orquidectomia reciban calcio (1.000-1.500mg) y vitamina D (800UI) acompañado de abstinencia del tabaco y actividad física regular (1⊕⊕⊕⊕).
- -
En pacientes con un T-score inferior a -2 y/o con antecedente de fractura osteoporótica recomendamos iniciar tratamiento con bifosfonatos (como primera opción con ácido zoledrónico) (1⊕⊕⊕⊕) o con denosumab (1⊕⊕⊕⊕).
- -
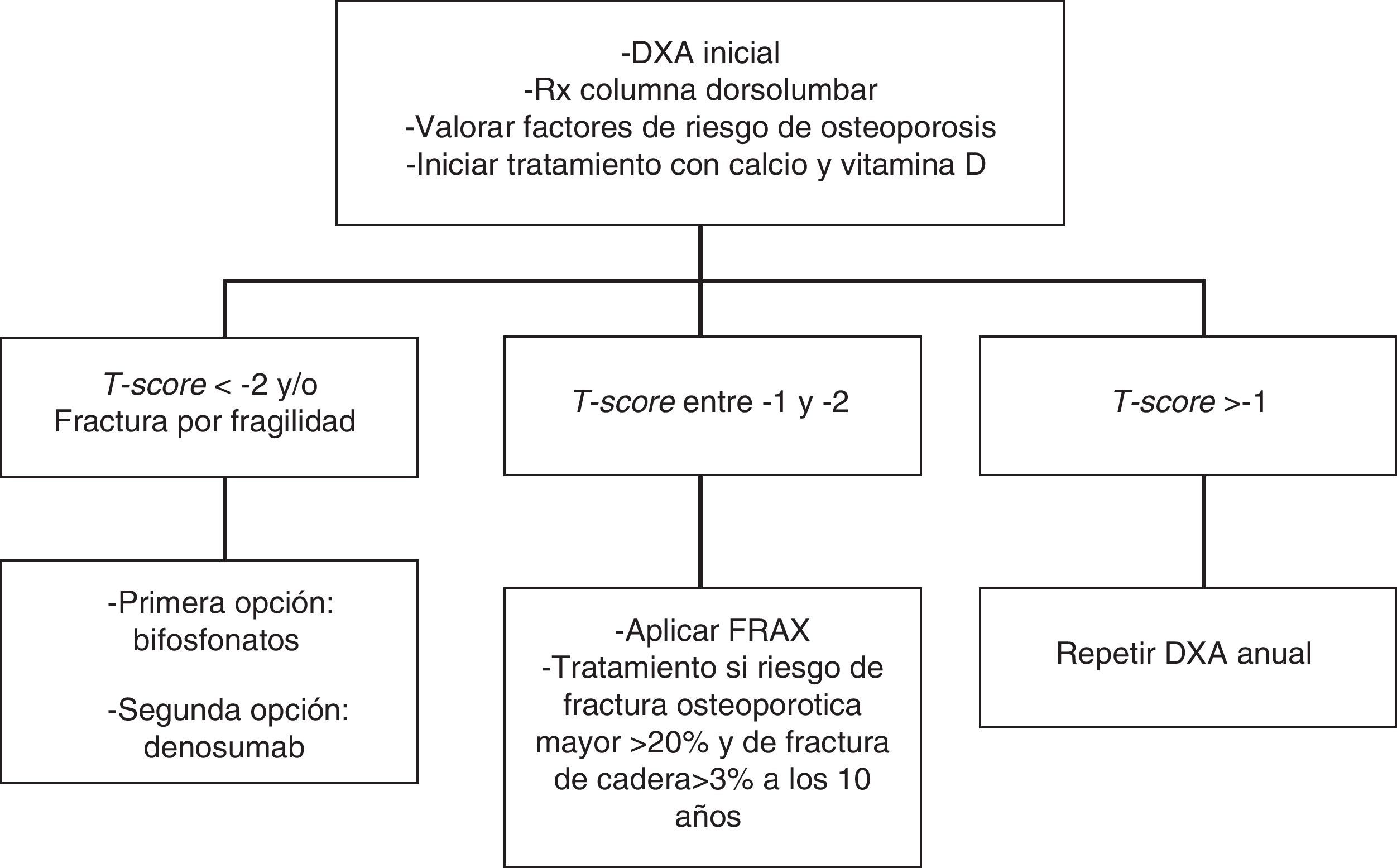
En pacientes con T-score entre -1 y -2 recomendamos valorar la presencia de otros factores de riesgo para osteoporosis (1⊕⊕⊕O).
En pacientes con cáncer de próstata tratados con terapia de deprivación androgénica, zoledronato ha demostrado aumentar la masa ósea respecto a placebo (6,7-7,8% en columna lumbar y 2,6-3,9% en cadera total) aunque no disponemos de datos en cuanto a reducción de nuevas fracturas131,133. Aunque no previene el desarrollo de metástasis óseas, reduce un 36% las complicaciones esqueléticas asociadas a estas134. El tratamiento con alendronato en pacientes con cáncer de próstata induce ganancia de masa ósea (3,7% en columna y 1,6% en cadera) aunque tampoco existen datos en cuanto a fracturas135.
Denosumab es el único fármaco que ha demostrado disminuir la incidencia de nuevas fracturas en pacientes con carcinoma de próstata. Tras 36 meses de tratamiento, la reducción del riesgo de nuevas fracturas vertebrales fue del 62% y del riesgo de cualquier nueva fractura del 28%136. Además, reduce las complicaciones esqueléticas asociadas con la metástasis óseas137. No se recomienda el tratamiento con teriparatida en pacientes con metástasis óseas, incluyendo micrometástasis o enfermedad oculta. Ranelato de estroncio tampoco esta recomendado en pacientes con cáncer de próstata.
En pacientes con riesgo intermedio (T-score entre -1 y -2) se recomienda iniciar tratamiento farmacológico cuando existan otros factores de riesgo para osteoporosis: tabaco, bajo peso (<70kg), alcoholismo o ciertos fármacos (anticoagulantes, omeoprazol, corticoides). En esta situación también puede calcularse el riesgo de fractura con la herramienta FRAX y evaluar el riesgo de fractura a los 10 años, iniciando tratamiento en aquellos pacientes con riesgo de fractura osteoporotica mayor >20% y de cadera >3% a los 10 años138 (fig. 2).
Déficit GH edad adultaEvaluaciónRecomendación- -
Sugerimos realizar una evaluación de la masa ósea y de la presencia de fracturas en los pacientes con déficit grave de GH (2⊕⊕OO).
El déficit grave de GH (DGH), aislado o con otros déficits hormonales hipofisarios, produce una disminución de la masa ósea139, cuya magnitud es dependiente de la edad y otros factores. Numerosos estudios transversales con bajo número de pacientes muestran que en adultos con déficit grave de GH existe un descenso de masa ósea de aproximadamente una desviación estándar. Sin embargo, estudios retrospectivos algo más amplios muestran que el efecto sobre la masa ósea del DGH es dependiente de la edad de inicio de este, siendo mayor en pacientes más jóvenes. Así, los pacientes menores de 30 años presentan la afectación más grave, aquellos con edades entre 30 y 45 años sufren una afectación intermedia140, y para edades más avanzadas la afectación es menor con ausencia de diferencias con respecto a controles para edades superiores a 55-60 años140–142.
Solo tres estudios han evaluado el riesgo de fractura en el DGH, mostrando un aumento de 2 a 5 veces143–145. No existe buena correlación entre la masa ósea y el riesgo de fracturas, ya que hasta un 50% de los pacientes con deformidades vertebrales presentan masa ósea normal146.
TratamientoRecomendación- -
El tratamiento con GH en adultos con DGH mejora la masa ósea (2⊕⊕OO).
- -
Tras los primeros años de tratamiento (4-5 años), la asociación de alendronato induce un aumento adicional de masa ósea (2⊕OOO).
- -
Recomendamos la continuidad del tratamiento sustitutivo en los DGH persistentes tras alcanzar la talla adulta para obtener una maduración ósea completa durante el período de transición entre la adolescencia y edad adulta (1⊕⊕OO).
- -
Sugerimos tratar con GH para reducir el riesgo de fractura vertebral en pacientes con DGH (2⊕OOO).
- -
En caso de respuesta terapéutica insuficiente sugerimos iniciar tratamiento anabólico seguido de tratamiento anticatabólico (2⊕OOO)
El tratamiento con GH ejerce un efecto anabólico. En el primer año de tratamiento puede observarse ausencia de efecto sobre la DMO e incluso un descenso de esta147–151, aunque tras 18-24 meses la mayoría de los estudios muestran aumento de DMO entre 4 y 10%, con mayor efecto a nivel lumbar. Aunque se han descrito incrementos de masa ósea hasta en los 10 años posteriores al inicio del tratamiento, generalmente a los 5 años se observa un efecto meseta152. Al llegar este momento, el añadir alendronato al tratamiento induce un mayor aumento de masa ósea que continuar únicamente con GH153–155.
Se ha demostrado que la continuidad o reintroducción del tratamiento sustitutivo en pacientes con DGH grave persistente al finalizar el crecimiento durante un período máximo de dos años se traduce en una DMO significativamente mayor que en los que no recibían tratamiento156–158.
No existen estudios prospectivos que hayan evaluado el efecto del tratamiento sustitutivo sobre el riesgo de fracturas. Se ha observado una prevalencia menor de deformidades vertebrales en los pacientes tratados con GH (54 frente a 78%), especialmente si el tratamiento se inicia precozmente tras el diagnóstico146.
Síndrome de CushingEvaluaciónRecomendación- -
El síndrome de Cushing produce una disminución de la masa ósea y un aumento del riesgo de fractura (2⊕⊕OO).
- -
Recomendamos realizar una evaluación de la masa ósea en estos pacientes y una evaluación de la presencia de fracturas, especialmente fracturas vertebrales asintomáticas (1⊕⊕OO).
El síndrome de Cushing produce una disminución de masa ósea, fundamentalmente en localización trabecular159–162. No se ha confirmado que la etiología del síndrome de Cushing influya en la prevalencia de osteoporosis y en el riesgo de fractura159–162, salvo en el caso del Cushing ectópico donde el riesgo de fractura puede ser mayor161.
TratamientoRecomendación- -
Se sugiere realizar tratamiento etiológico ya que este se traduce en un aumento de masa ósea (2⊕⊕OO).
- -
Sugerimos iniciar tratamiento con alendronato ya que puede favorecer que este aumento de masa ósea sea mayor, aunque no se ha evaluado el efecto sobre fracturas (2⊕⊕OO).
- -
Teniendo en cuenta el déficit de función osteoblástica característico de esta entidad, recomendamos valorar tratamiento anabólico en caso de muy baja masa ósea, fracturas prevalentes o falta de respuesta a tratamiento anticatabólico, especialmente en pacientes más jóvenes (1⊕OOO). En mujeres premenopáusicas recomendamos usar denosumab como anticatabólico (1⊕OOO).
Tras el tratamiento etiológico del síndrome de Cushing se ha descrito un aumento de la DMO163–164. En cuanto al tratamiento farmacológico, solo existe un estudio observacional con 39 pacientes donde el tratamiento con alendronato durante 12 meses indujo un aumento de DMO mayor que en los pacientes no tratados165.
Hipercortisolismo subclínico por incidentaloma adrenalEvaluaciónRecomendación- -
Sugerimos evaluar la masa ósea y la presencia de fracturas vertebrales en caso de incidentaloma adrenal con hipercortisolismo subclínico (2⊕⊕OO).
Existen evidencias contradictorias acerca de si en el hipercortisolismo subclínico por incidentaloma adrenal existe un descenso de masa ósea166–170. En cuanto al riesgo de fractura vertebral, la mayoría166,169–171, de los estudios transversales aunque no todos168 muestran una mayor incidencia de fractura vertebral. Sin embargo, dos estudios prospectivos recientes y con mayor número de pacientes confirman un aumento del riesgo de fractura vertebral en estos pacientes172,173.
TratamientoRecomendación- -
El tratamiento con anticatabólicos puede favorecer un aumento de masa ósea en mujeres premenopáusicas con hipercortisolismo subclínico, aunque no se ha evaluado el efecto sobre fracturas (2⊕⊕OO).
- -
Recomendamos valorar tratamiento anabólico en caso de muy baja masa ósea, fracturas prevalentes o falta de respuesta a tratamiento anticatabólico, especialmente en pacientes más jóvenes (1⊕OOO). En mujeres premenopáusicas recomendamos usar denosumab como anticatabólico (1⊕OOO).
Solo un estudio ha evaluado los efectos del tratamiento con bifosfonatos sobre la masa ósea en mujeres premenopáusicas con hipercortisolismo subclínico por incidentaloma adrenal, mostrando que el tratamiento con clodronato semanal durante 1 año aumentó la DMO respecto a calcio y vitamina D174.
Enfermedad de Addison.EvaluaciónRecomendación- -
El hipocortisolismo primario puede asociarse a una disminución de la masa ósea y una mayor prevalencia de osteoporosis en relación al tratamiento sustitutivo esteroideo y el déficit de andrógenos suprarrenales. Se desconoce si existe un aumento del riesgo de fractura (1⊕OOO).
- -
Sugerimos limitar el estudio de la DMO a aquellos pacientes con enfermedad de larga evolución o dosis de esteroides más altas, y a mujeres posmenopáusicas o en amenorrea (2⊕⊕OO).
Respecto a la masa ósea en la enfermedad de Addison, existen trabajos en los que de forma general no se encuentran diferencias respecto a controles175,176. La afectación ósea se ha evidenciado sobre todo en mujeres posmenopáusicas177,178 donde se describe una alta prevalencia de osteoporosis178,179 de predominio trabecular179–181. Un solo estudio ha examinado la presencia de fracturas vertebrales morfométricas mediante radiología simple no encontrando diferencias respecto al grupo control182.
TratamientoRecomendación- -
Sugerimos reducir las dosis de sustitución del tratamiento esteroideo para minimizar los efectos óseos (2⊕⊕OO).
- -
Sugerimos como tratamiento sustitutivo un corticoide de duración de acción corta (hidrocortisona) frente a los de acción intermedia o prolongada (2⊕⊕OO).
- -
El tratamiento con DHEA mejora la DMO en cadera frente a placebo (2⊕⊕OO).
No existen trabajos en los que se evalúen los efectos sobre la DMO de los fármacos antiosteoporóticos clásicos en estos pacientes. Dos estudios proponen reducir las dosis habituales de sustitución181,183 tras encontrar una mayor prevalencia de baja masa ósea en estos pacientes, aunque no evalúan su efecto de forma prospectiva. Además, en un estudio reciente los pacientes tratados con prednisona presentaron una masa ósea menor que los tratados con hidrocortisona a dosis equivalentes, por lo que los autores proponen utilizar preferentemente hidrocortisona para el tratamiento176. Solo se ha identificado un ensayo clínico a doble ciego donde se evaluó el efecto sobre la DMO de 50mg de DHEA durante 12 meses frente a placebo con cambios significativos y positivos en cadera 183.
Cirugía bariátricaEvaluaciónRecomendación- -
Recomendamos la evaluación de masa ósea precirugía (1⊕OOO).
- -
En los pacientes sometidos a técnicas malabsortivas (bypass gástrico en Y de Roux. Banda gástrica. Derivación Biliopancreática) recomendamos la realización de DXA anual/bianual hasta la estabilización de masa ósea (1⊕⊕OO).
La cirugía bariátrica produce un aumento en la reabsorción y disminución de la formación ósea184,185, que es mayor que el producido tras la pérdida de peso mediante tratamiento médico186,187 y puede variar según la técnica quirúrgica empleada185. Las pacientes posmenopaúsicas tienen mayor riesgo de pérdida ósea y requieren una vigilancia más estrecha188,189.
Se desconoce el riesgo real de fractura en estos pacientes, aunque en las predicciones de riesgo mediante el algoritmo FRAX parece no ser alto189,190.
TratamientoRecomendación- -
Antes de la cirugía, se recomienda mantener una ingesta de calcio similar a la población general y normalizar las cifras de vitamina D (2⊕⊕OO).
- -
Tras la cirugía, recomendamos dar suplementos de calcio y vitamina D de rutina cuando se hayan realizado técnicas malabsortivas (1⊕⊕⊕O).
- -
En caso de osteoporosis, sugerimos seguir las recomendaciones de las guías de práctica clínica habitual, corrigiendo previamente el déficit de calcio y vitamina D para evitar episodios de hipocalcemia severa (2⊕OOO).
- -
Para el tratamiento del déficit de vitamina D sugerimos emplear calcifediol (25 OH D) 50.000 UI (hidroferol 0,266 ugr medio vial) 1-3 veces en semana. En casos severos pueden ser preciso administrar esta misma dosis de forma diaria o administrar calcitriol (2⊕OOO).
Tras la cirugía se recomienda iniciar suplementos de calcio y vitamina D de rutina cuando se hayan realizado técnicas malabsortivas, ajustando la dosificación según las determinaciones bioquímicas191–193. El citrato cálcico es preferible al carbonato por su mayor biodisponibilidad y mejor eficacia en la normalización de marcadores óseos194. Además, es metabolizado a bicarbonato que tiene un efecto neutralizante en orina reduciendo el riesgo de nefrolitiasis195. El empleo de 50.000 UI semanales de vitamina D además de un suplemento diario de 800UI+1.500mg de citrato de calcio ha demostrado reducir la pérdida ósea tras bypass gástrico196. No existen datos suficientes para indicar la suplementación rutinaria de magnesio fuera de la incluida en el complejo multivitamínico empleado de forma habitual191.
En el tratamiento de la osteoporosis con bifosfonatos hay que tener en cuenta la posible intolerancia oral y el riesgo de úlcera de la boca anastomótica; en estos casos se sugiere el empleo de formulaciones intravenosas u otras alternativas terapéuticas como denosumab191,195.
Enfermedad celiacaEvaluaciónRecomendación- -
Recomendamos realizar una valoración de la masa ósea y de la presencia de fracturas en la presentación típica de la enfermedad celiaca (EC) en adultos (1⊕⊕⊕O).
- -
En la enfermedad con presentación atípica o silente recomendamos realizar una valoración de la masa ósea y del riesgo de fractura según los criterios de la población general con especial atención a aquellos con mala adherencia a la dieta sin gluten, con bajo peso (IMC<20 kg/m2), pérdida de peso >10% y mayores de 70 años (1⊕⊕OO).
- -
Recomendamos determinar los valores de vitamina D, PTH y calcio en cualquier forma de presentación (1⊕⊕OO).
- -
No recomendamos realizar un cribado para EC en pacientes con osteoporosis (2⊕⊕OO).
La EC ocasiona deterioro de la masa ósea197–201. La osteoporosis aparece fundamentalmente en la presentación típica o en los pacientes que presentan mala adherencia al tratamiento. Es controvertido si su prevalencia está aumentada en las presentaciones atípicas o silentes197–203. El incremento del riesgo relativo de fracturas se ha estimado que es del 43% para la enfermedad sintomática mientras que no varía significativamente para la presentación atípica o silente con respecto a la población general203–208.
A pesar de la elevada prevalencia de la EC, entre el 0,3-1% de la población, y que la mayoría de los casos permanecen sin diagnosticar197,198, no se recomienda el cribado de EC en pacientes con osteoporosis209–212.
No hay un acuerdo sobre el proceso patogénico, aunque se considera que intervienen dos vías199,200,213. La malabsorción de nutrientes predomina en la EC sintomática mientras que en la EC asintomática y silente predomina la producción de citoquinas proinflamatorias198,199. En ambas existe una malabsorción de calcio199,200,213–215. Además, existen datos que asocian la baja densidad ósea de la EC con predisposición genética216, con disminución de IGF-1 y con la existencia de autoanticuerpos contra la osteoprotegerina217.
TratamientoRecomendacion- -
En paciente con EC diagnosticada en la infancia, recomendamos una dieta libre en gluten ya que si esta se realiza con buena adherencia no precisa otro tratamiento o seguimiento específico para la prevención de la osteoporosis (1⊕⊕⊕O).
- -
En pacientes diagnosticados en la edad adulta se sugiere suplementar la alimentación libre en gluten con vitamina D y calcio según las recomendaciones generales, ajustándolas según el grado de malabsorción (2⊕⊕OO).
- -
En caso de ser necesario el tratamiento anticatabólico, se recomienda iniciar este tras completar 1 año con dieta libre en gluten (1⊕⊕OO).
- -
Se recomienda seguir las indicaciones generales para la prescripción de fármacos para la osteoporosis en la EC (1⊕⊕OO).
- -
Se recomienda vigilar el desarrollo de hipocalcemia si se realiza tratamiento con bisfosfonatos, sobre todo en sujetos con mala adherencia a la dieta (1⊕OOO).
Cuando la EC es diagnosticada en la infancia, la dieta libre de gluten es el único tratamiento necesario y con una buena adherencia se logra una masa ósea normal218–221. En los adultos, la dieta libre de gluten es la base del tratamiento y mejora la densidad mineral ósea (5% el primer año de forma general y hasta el 7% a los 2-3 años) incluso en pacientes sin recuperación total de la mucosa222,223, aunque existen estudios que muestran que la dieta sola no consigue la normalización de la masa ósea en la totalidad de sujetos y que se mantiene incrementado el riesgo de fractura224–227.
No existen estudios aleatorizados que permitan establecer la eficacia de los tratamientos habituales en osteoporosis en pacientes con enfermedad celiaca228 por lo que se asume que en cuanto a tratamiento deben seguirse las recomendaciones de la población general200,202,213.
Enfermedad inflamatoria intestinalEvaluaciónRecomendación- -
Aunque la enfermedad inflamatoria intestinal (EII) se asocia con baja masa ósea y un aumento del riesgo de fractura, no recomendamos la evaluación rutinaria de masa ósea (1⊕OOO).
- -
Recomendamos realizar una valoración del riesgo de fractura mediante el método FRAX en la fase de remisión de la EII (1⊕⊕OO).
- -
Recomendamos realizar una valoración con DXA a los pacientes en riesgo intermedio o alto según la herramienta FRAX, a los pacientes en tratamiento con corticoides o en caso de que existan 2 o más factores de riesgo: enfermedad activa continuada, IMC<20 kg/m2, pérdida de peso >10% y edad >70 años (1⊕⊕OO).
- -
Recomendamos determinar los concentraciones séricos de vitamina D, PTH y calcio (1⊕OOO).
- -
En función del riesgo de fractura, sugerimos repetir la valoración por DXA cada 2-3 años o cada año en caso de tratamiento con corticoides (2⊕OOO).
La EII se asocia a un incremento del riesgo de osteopenia y osteoporosis que varía en los estudios según el propio proceso inflamatorio (actividad, lugar de afectación y cirugía previa), la edad del diagnóstico y el tiempo de evolución. La patogenia de la osteoporosis en la EII es multifactorial. Además de las citoquinas inflamatorias, también influyen: la edad, el tratamiento con corticoides, la malnutrición, y la deficiencia de calcio y de vitamina D200,213.
Según los estudios, la prevalencia de osteopenia oscila entre el 22-55% para la enfermedad de Crohn y entre el 32-65% para la colitis ulcerosa. En cuanto a la prevalencia de osteoporosis, se estima en la enfermedad de Crohn entre el 3-57% y para la colitis ulcerosa entre el 4-50%229–232. El riesgo de fractura se incrementa entre un 40-60% con respecto a la población general233–237.
Varios estudios muestran que la densidad mineral ósea por sí sola no predice el riesgo de fracturas en los pacientes con EII234,238 y, de forma general, no se recomienda realizar un cribado con DXA en estos pacientes239–240.
La EII es una de las causas de osteoporosis secundaria introducida en la herramienta FRAX. Hasta la fecha, solo un estudio retrospectivo de cohortes muestra su utilidad en esta patología241. Hay que tener en cuenta que la herramienta FRAX no ha sido validada para la EII en poblaciones con edades inferiores a 40 años, que las bruscas variaciones del IMC limitan su precisión en fases activas de la enfermedad y que no considera la dosis acumulada de corticoides.
La herramienta FRAX permite clasificar en bajo, intermedio y alto el riesgo absoluto de fractura. Las guías actuales y los estudios realizados sustentan la idea de realizar una valoración por DXA en los sujetos con riesgo intermedio y alto y en los pacientes en tratamiento con corticoides138,241,242. También se recomienda que un paciente con EII debe realizar una evaluación por DXA si tiene dos o más factores de riesgo: IMC<20 kg/m2, pérdida de peso >10% o en tratamiento con corticoides200,238,239,243.
TratamientoRecomendación- -
Recomendamos controlar la inflamación con dieta o fármacos no esteroideos ya que la remisión o mejora del proceso inflamatorio supone una mejoría de la masa ósea (1⊕⊕OO).
- -
Para prevenir fracturas en pacientes con EII recomendamos mejorar el estado nutricional y suplementar con calcio y vitamina D, en especial en paciente jóvenes y en los tratados con glucocorticoides (1⊕OOO).
- -
Recomendamos realizar una actividad física regular como medida preventiva de la pérdida de masa ósea en la EII (1⊕OOO).
- -
La utilización de bisfosfonatos orales o iv mejora la masa ósea en la EII y su prescripción debe ajustarse a las recomendaciones generales. Se desconoce su efecto sobre el riesgo de fracturas. (1⊕⊕⊕O).
Los pacientes en remisión incrementan la masa ósea de forma proporcional al tiempo de remisión200,213,239,242 y el tratamiento de la EII con aziatioprina o anti-TNF-alfa mejora la masa ósea242,244–246. Además, existen datos que muestran que la dieta polimérica supone una alternativa a los corticoides para el control de la enfermedad en grados leves247.
El tratamiento con bifosfonatos (alendronato, risedronato e ibandronato iv) ha demostrado ser eficaz respecto a placebo en la prevención y tratamiento de la osteoporosis de los pacientes con EII con y sin glucocorticoides248–250. Este efecto no se ha demostrado con pamidronato iv251. Aunque no hay datos que sustenten una disminución del riesgo de fracturas en pacientes con EII y tratados con bisfosfonatos, se asume que son aplicables las indicaciones y recomendaciones terapéuticas generales para la osteoporosis239,252.
Anorexia nerviosaEvaluaciónRecomendación- -
La anorexia nerviosa produce una disminución de la masa ósea y un aumento del riesgo de fractura (2⊕⊕OO).
- -
Recomendamos realizar una evaluación de la masa ósea y de la presencia de fracturas en estos pacientes (1⊕⊕OO).
- -
El diagnóstico de la osteoporosis en niños y adolescentes no debe hacerse sobre la base de criterios densitométricos solamente (Z-score menor o igual a -2.0), sino que requiere además la presencia de una historia de fracturas clínicamente significativa: fractura de huesos largos de las extremidades inferiores, fracturas vertebrales por compresión o dos o más fracturas de huesos largos de las extremidades superiores (2⊕OOO).
En la anorexia nerviosa (AN) existe una pérdida de masa ósea, fundamentalmente a nivel trabecular253–257. La mayoría de los estudios se han realizado en mujeres adultas y muestran que entre el 38 y el 50% de las pacientes presentan ya osteoporosis en el momento del diagnóstico253–261.
Además, existe una alteración de la microarquitectura lo que junto a la baja masa ósea aumenta el riesgo de fractura. Así, la incidencia acumulada de cualquier fractura fue del 57% en las mujeres con AN mayores de 40 años en comparación un 42% en una población de igual edad y sexo259. Otros autores indican que más del 50% de las mujeres con historia previa de AN tendrán una fractura a los 40 años de edad y que el riesgo de fractura es el triple comparadas con mujeres sin historia previa de AN. La localización de las fracturas es similar a la osteoporosis posmenopáusica (columna, radio distal y fémur proximal)260.
La fisiopatología de la alteración ósea se atribuye a diversos factores: amenorrea, deficiente absorción de calcio, ejercicio físico extremo, déficit de 1,25 (OH) vit D, bajo aclaramiento de creatinina, exceso de cortisol sérico y urinario y concentraciones altos de GH257,259.
Los principales predictores de pérdida de masa ósea en este colectivo suelen ser el bajo peso, la duración de la enfermedad, el tiempo de amenorrea y el inadecuado consumo de calcio en la adolescencia257,259. Además, la aparición de anorexia nerviosa durante la adolescencia se asocia a un menor pico de masa ósea262–264.
TratamientoRecomendación- -
Recomendamos normalizar el peso y los ciclos menstruales para aumentar la masa ósea (1⊕⊕OO).
- -
Sugerimos aportar una ingesta cálcica diaria de 1.300 a 1.500mg/día y de 400 U/día de vitamina D o más en las pacientes con valores de vitamina D inferiores a 30 ng/dl (2⊕⊕OO).
- -
Sugerimos no tratar de forma generalizada con bifosfonatos (alendronato y risedronato) para aumentar la masa ósea en pacientes con AN (2⊕OOO).
- -
Sugerimos valorar de forma individualizada el tratamiento con bifosfonatos en pacientes adultos con muy baja masa ósea y con presencia de fracturas por fragilidad (2⊕OOO).
- -
Sugerimos no usar la terapia hormonal para prevenir la pérdida de masa ósea en las pacientes con amenorrea persistente y AN (2⊕OOO).
- -
Sugerimos iniciar tratamiento anabólico si existen fracturas por fragilidad (2⊕OOO).
- -
Como tratamiento anticatabólico sugerimos denosumab, que por su efecto reversible puede ofrecer ventajas en pacientes jóvenes (2⊕OOO).
El tratamiento que ha demostrado mayor aumento de la masa ósea en la AN es la recuperación espontánea de las menstruaciones, con un incremento del 19% en la DMO265. En este mismo estudio, el tratamiento con estrógenos no indujo cambios significativos en la masa ósea respecto a las pacientes no tratadas, aunque en las pacientes tratadas con estrógenos y que a su vez ganaban peso se produjo un incremento de un 4% en la DMO.
Se han propuesto varios factores para explicar la ausencia de efecto del tratamiento hormonal sobre la masa ósea en adolescentes con AN: que la dosis de estrógenos eficaz en el tratamiento de las mujeres menopáusicas sea inadecuada en la población joven; falta de cumplimiento terapéutico, y que el tratamiento con estrógenos no sea suficiente para corregir los múltiples factores implicados en la pérdida de masa ósea260,261,265,266.
En cuanto al tratamiento con bifosfonatos, existen escasos datos en AN. Además hay que tener en cuenta cuestiones acerca de su seguridad a largo plazo en la adolescencia y sus posibles efectos teratógenos, lo que hace que el tratamiento con estos fármacos deba considerarse individualmente. En este sentido, un estudio aleatorizado doble ciego comparó alendronato (10mg/día) con placebo en 32 adolescentes con AN y osteopenia durante un año, y concluyó que aunque la restauración del peso es el más importante determinante de la DMO, el tratamiento con alendronato aumenta discretamente la masa ósea en columna lumbar y cuello femoral267. En el segundo estudio, risedronato (5mg/día) indujo un discreto aumento de la DMO en columna. No existen datos sobre fracturas268.
Nutrición parenteral domiciliariaEvaluaciónRecomendación- -
Sugerimos evaluar la DMO al incluir a un paciente en un programa de nutrición parenteral domiciliaria (NPD) si el pronóstico vital del enfermo lo justifica (2⊕⊕OO).
- -
Sugerimos realizar un diagnóstico diferencial entre osteopenia/osteoporosis y osteomalacia en pacientes con baja DMO, especialmente a la hora de plantear una terapia (2⊕⊕OO).
- -
Sugerimos realizar una evaluación periódica (cada 1-2 años) de la DMO en los pacientes con NPD si el pronóstico del paciente lo justifica (2⊕OOO).
- -
Sugerimos evaluar los concentraciones de 25 OH vitamina D en pacientes que sean incluidos en un programa de NPD (2⊕⊕OO).
Diversos estudios transversales y de cohortes han encontrado una elevada prevalencia de afectación ósea (30-60%) en el momento de iniciar la NPD269–276. Esta afectación incluyó osteomalacia, osteopenia y osteoporosis. Las comparaciones con controles sanos son escasas, y solo el estudio de Tjllesen et al. sugiere que la DMO en pacientes que reciben NPD podría ser menor que en sujetos de la misma edad y sexo277. Estudios de cohortes muestran resultados heterogéneos en cuanto a la evolución de la DMO en pacientes que reciben NPD269,274,278. En pacientes con desnutrición o con fallo intestinal desarrollado antes de alcanzar el pico de masa ósea la administración de NPD podría incrementar la DMO, probablemente por la mejoría del estado nutricional275,279. Aunque existe una elevada prevalencia de fracturas (10-40%) en los pacientes que reciben NPD, no hay evidencias que sugieran que los pacientes con NPD tengan un riesgo incrementado de fracturas en comparación con sujetos de sexo y edad similar.
TratamientoRecomendación- -
Sugerimos plantear un tratamiento farmacológico en aquellos pacientes con NPD y afectación ósea si el pronóstico vital lo justifica (2⊕OOO).
- -
Sugerimos garantizar un adecuado aporte de vitamina D por vía oral o parenteral dada la elevada prevalencia de deficiencia de vitamina D y la habitual coexistencia de malabsorción en estos pacientes (2⊕OOO).
- -
En pacientes con NPD y osteoporosis sugerimos considerar los bifosfonatos intravenosos (2⊕⊕OO) o denosumab (2⊕OOO) como una opción terapéutica.
- -
En pacientes con larga expectativa de vida, sugerimos tratar con anabólicos en caso de fracturas por fragilidad o mala respuesta al tratamiento con anticatábolicos (2⊕OOO).
Los diferentes estudios276,280 muestran una elevada prevalencia de deficiencia de vitamina D (60-100%) teniendo en cuenta los criterios más comúnmente empleados en la actualidad (< 30ng/ml). En cuanto al tratamiento farmacológico, solo un estudio aleatorizado, controlado, y doble ciego281 ha evaluado la eficacia del tratamiento con bifosfonatos en pacientes con NPD. En este estudio, la administración de clodronato (1.500mg/3 meses iv durante 1 año) redujo los marcadores de resorción ósea en pacientes con NPD y T-score inferior a -1; en mujeres produjo un aumento de DMO en cadera, columna y radio, mientras que en varones solo en radio. No hubo diferencias en la incidencia de fracturas. En otro estudio no controlado se observó un incremento del T-score con pamidronato intravenoso entre aquellos pacientes que habían recibido previamente glucocorticoides282.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.