La hipoglucemia se define como un nivel de glucosa plasmática inferior a 50mg/dl1. No obstante, dependiendo de donde se mida la glucosa (sangre venosa o capilar) la definición de hipoglucemia puede variar. El punto de corte del nivel de glucosa que desencadena la respuesta fisiológica a la hipoglucemia y los síntomas derivados de esta también pueden tener variaciones. El diagnóstico de hipoglucemia se basa en la tríada de Whipple: baja concentración de glucosa en sangre, síntomas de hipoglucemia y mejoría de los síntomas una vez se normaliza la glucemia. Los síntomas de hipoglucemia se dividen en adrenérgicos: taquicardia, palpitaciones, temblores, sudoración, palidez y ansiedad, y no adrenérgicos o neuroglucopénicos: hambre, cefalea, debilidad, alteraciones visuales, confusión, letargia, convulsiones e incluso coma1. La causa más frecuente en nuestro medio es el tratamiento hipoglucemiante (hipoglucemiantes orales e insulina). Otras posibles causas son: la insuficiencia renal terminal, sepsis, déficits hormonales, grandes tumores mesenquimales, insulinoma, enfermedades metabólicas congénitas, etc. En ocasiones se detectan niveles plasmáticos de glucosa en rango de hipoglucemia sin que se acompañen de manifestaciones clínicas. Tales casos pueden deberse a una inadecuada percepción de los síntomas de hipoglucemia o a una «falsa hipoglucemia». A continuación, se presenta el caso de un paciente con una causa poco común de hipoglucemia.
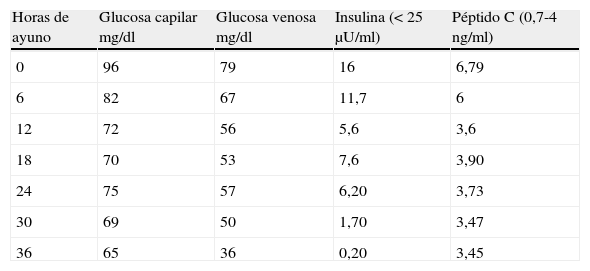
Varón de 83 años con antecedentes de hipertensión arterial en tratamiento con espironolactona 25mg diarios y furosemida 20mg al día, hipercolesterolemia tratada con atorvastatina 40mg al día, insuficiencia renal crónica secundaria a nefroangiosclerosis, fibrilación auricular paroxística, deterioro cognitivo, parkinsonismo vascular y síndrome depresivo. Además, se encontraba en estudio por diferentes especialistas por cuadros presincopales frecuentes y a raíz de una analítica en la que presentaba leucocitos 22.400/μl, hematíes 6,3×106/μl, hemoglobina 17,1g/dl, hematocrito 53% y plaquetas 441.000/μl, había sido diagnosticado de pancitosis moderada, con estudio negativo de síndrome mieloproliferativo. Fue derivado a Endocrinología para descartar hipoglucemia como causa de los cuadros sincopales, tras objetivar una glucemia venosa de 41mg/dL en situación de ayuno. En la anamnesis, no existían antecedentes de diabetes o toma de fármacos hipoglucemiantes. Los cuadros presincopales no guardaban relación con la ingesta ni con el ayuno. La exploración física era normal. En analíticas previas, presentaba glucemias entre 40-70mg/dl. En esta primera consulta se proporcionó un glucómetro para registrar la glucemia capilar en caso de síntomas presincopales y normas para la realización de una dieta fraccionada. En las revisiones siguientes, el paciente aportó determinaciones de glucemia capilar sin documentar ninguna hipoglucemia. En la analítica presentaba creatinina 1,6mg/dl, filtrado glomerular 44ml/min/1,73 m2, lactato deshidrogenasa 1.440 UI/l (313-618), cromogranina A 769ng/mL (19-98), péptido C 6,81ng/ml (0,7-4) e insulina 10,7μgUI/mL (< 25μU/ml), con glucemia de 41mg/dl, y en otra determinación péptido C 3,64ng/ml e insulina 16,5μgUI/mL, con glucemia 56mg/dl. Las concentraciones de péptido C se interpretaron teniendo en cuenta que su aclaramiento se encuentra disminuido en presencia de insuficiencia renal. La cromogranina A, empleada como marcador bioquímico de tumores neuroendocrinos, puede verse falsamente elevada en casos de insuficiencia renal e hipertensión arterial mal controlada. En la ecografía abdominal la cabeza y cuerpo pancreáticos no presentaban hallazgos reseñables, y el bazo era homogéneo de 12,5cm. En la tomografía computarizada (TC) abdómino-pélvica se identificó una lesión nodular milimétrica en cola pancreática de carácter inespecífico al no poder administrar contraste intravenoso por la insuficiencia renal, esplenomegalia homogénea y lesión lítica en vértebra D11. Debido a las concentraciones bajas de glucemia en varias determinaciones, con insulina y péptido C detectables, unido a la aparición de una lesión pancreática, se decidió ingreso para estudio de hipoglucemia. Se realizó test de ayuno que fue suspendido a las 36 horas por glucemia venosa de 36mg/dl, sin síntomas de hipoglucemia y con disminución de las concentraciones de insulina (tabla 1).
La principal característica fisiopatológica del hiperinsulinismo endógeno es la no supresión de la secreción de insulina durante la hipoglucemia. Este hecho se traduce en la aparición durante el test de ayuno de una concentración plasmática de insulina mayor de 6μU/ml y de péptido C mayor de 0,6ng/ml con una concentración plasmática de glucosa menor de 45mg/dl, con síntomas de hipoglucemia. Por tanto, los resultados de dicho test descartaban la existencia de hiperinsulinismo endógeno y demostraban una notable discrepancia entre los valores de glucemia capilar y venosa. Dicha variabilidad depende de factores como el glucómetro empleado y de una correcta realización de la técnica.
Dada la elevada cifra de leucocitos, la ausencia de síntomas de hipoglucemia y la discordancia de las cifras de glucemia del glucómetro y de sangre venosa, se decidió descartar el consumo de glucosa por células sanguíneas. Para ello se tomaron 2 muestras, una de las cuales fue centrifugada inmediatamente y la otra pasados 50 minutos, tiempo que se estima tarda en llegar habitualmente la muestra al laboratorio, siendo la primera determinación de 61mg/dl y la segunda de 46mg/dl. Estos resultados indicaban un descenso de la glucosa plasmática por consumo de la misma por células sanguíneas y descartaban la existencia de una hipoglucemia real. El paciente se negó a continuar estudio para filiar el nódulo pancreático y la lesión lítica hallada en la TC abdominal.
La hipoglucemia por consumo de células sanguíneas no suele reconocerse fácilmente, al contrario de lo que ocurre con la hipoglucorraquia en las meningitis bacterianas2. La glucosa circulante en sangre es consumida habitualmente por los eritrocitos y los leucocitos mediante la glucolisis, proceso que transforma la glucosa en piruvato3. Cuando existe un síndrome mieloproliferativo, estados leucémicos o leucocitosis por otras causas, el consumo de glucosa por las células sanguíneas aumenta y se puede detectar concentraciones bajas de glucosa1,4–6,8, El descenso de la glucosa in vitro está en relación directa con la duración y temperatura de incubación de la muestra, y con el número de leucocitos2. A temperatura ambiente, la glucosa desciende de 7 a 20mg/dl/hora, independientemente de la concentración de glucosa inicial7. Las temperaturas elevadas también aceleran el proceso de glucolisis3. Asimismo, la velocidad de la glucolisis es mayor en la sangre de pacientes con leucocitosis. Sin embargo, este fenómeno es independiente del tipo de leucocitos (linfocitos o polimorfonucleares) y la relación «glucemia/leucocitosis» es específica para cada individuo7. Por otro lado, se pensaba que el proceso de glucolisis era más rápido cuando la leucocitosis era a expensas de formas inmaduras. No obstante, al comparar muestras de sangre de individuos con leucemia con muestras de individuos sanos con similar cifra de leucocitos, se comprobó que el consumo de glucosa por las células leucémicas era menor que la quinta parte de las no leucémicas, excepto cuando la cifra de leucocitos superaba los 60.000/μl. Por tanto, la velocidad en el consumo de glucosa in vitro se relaciona más con el número de leucocitos que con la maduración o diferenciación celular9.
Existen varias posibilidades para evitar el consumo de glucosa in vitro10. En primer lugar, se deben evitar altas temperaturas, así como el retraso en el análisis de la muestra. Se recomienda mantener la muestra a temperatura aproximada de 4°C y minimizar el tiempo de transporte. Períodos superiores a 2 horas desde que se extrae la muestra hasta que es analizada se han asociado con una importante caída de glucemia11. En segundo lugar, se aconseja la centrifugación precoz de la muestra. Finalmente, para evitar este fenómeno, las muestras de sangre deberían recogerse en tubos que contengan inhibidores de la glucolisis, como fluoruro sódico u oxalato potásico. Sin embargo, estos compuestos pueden interferir con algunos métodos de laboratorio, por lo que están dejando de utilizarse.
La hipoglucemia por consumo de células sanguíneas debe sospecharse en caso de marcada leucocitosis por cualquier causa, hipoglucemia venosa sin síntomas de hipoglucemia y sin mejoría tras la administración de glucosa (ausencia de la triada de Whipple) o por un posible error en la recogida o procesamiento de la muestra.
Existen múltiples clasificaciones sobre las causas de hipoglucemia, sin embargo, pocas de ellas mencionan la causa descrita en este caso. Conocer y sospechar este fenómeno es conveniente para evitar falsos diagnósticos así como pruebas innecesarias.