La activación de diferentes procesos de muerte celular en los cardiomiocitos tras un infarto de miocardio (IM) contribuye al tamaño final del infarto, a la mortalidad subsecuente y al remodelado postinfarto en los supervivientes. Los diversos mecanismos deletéreos activados durante las fases de isquemia y reperfusión en el IM incluyen la privación de oxígeno, la disponibilidad reducida de nutrientes y factores de supervivencia, la acumulación de residuos, la generación de especies reactivas del oxígeno, la sobrecarga de calcio, la infiltración por neutrófilos en el área isquémica, la depleción energética, y la apertura del poro de transición de permeabilidad mitocondrial, todos ellos mecanismos de activación de apoptosis y necrosis en los cardiomiocitos. En los últimos años, las terapias basadas en el péptido similar al glucagón tipo 1 [GLP-1 (7-36) amida] han adquirido mayor relevancia como tratamiento metabólico de la diabetes mellitus tipo 2. Entre las acciones atribuidas a GLP-1 destaca la preservación de la viabilidad en diferentes tipos celulares, entre ellos los cardiomiocitos. Este artículo revisa los principales estudios experimentales que han contribuido a una mayor comprensión de la citoprotección inducida por GLP-1 en el miocardio y de sus efectos en la función cardiaca, ahondando en el estudio de su papel como diana terapéutica, no solo en el contexto de la diabetes mellitus sino también en otras patologías que cursan con remodelado cardiaco.
During myocardial infarction (MI), a variety of mechanisms contribute to activation of cell death processes in cardiomyocytes, which determines the final MI size, subsequent mortality, and post-MI remodeling. The deleterious mechanisms activated during the ischemia and reperfusion phases in MI include oxygen deprival, decreased availability of nutrients and survival factors, accumulation of waste products, generation of oxygen free radicals, calcium overload, neutrophil infiltration in the ischemic area, depletion of energy stores, and opening of the mitochondrial permeability transition pore, all of them contributing to activation of apoptosis and necrosis in cardiomyocytes. Glucagon-like peptide-1 [GLP-1 (7-36) amide] has gained relevance in recent years for metabolic treatment of patients with type 2 diabetes mellitus. Cytoprotection of different cell types, including cardiomyocytes, is among the pleiotropic actions reported for GLP-1. This paper reviews the most relevant experimental studies that have contributed to a better understanding of the molecular mechanisms and intracellular pathways involved in cardioprotection induced by GLP-1 and analyzes in depth its potential role as a therapeutic target both in the ischemic and reperfused myocardium and in other conditions that are associated with myocardial remodeling and heart failure.
Entre las alteraciones que se producen en el metabolismo cardiaco durante la fase isquémica del infarto de miocardio (IM) están la privación de oxígeno, de nutrientes y de factores de supervivencia, y la acumulación de residuos en los cardiomiocitos, provocando la activación de procesos de muerte celular y dando lugar al aturdimiento e hibernación del miocardio y, finalmente, a la afectación de la función contráctil1,2. Paradójicamente, el repentino restablecimiento del flujo de oxígeno en el área isquémica puede incrementar la lesión en el miocardio (denominada «lesión por isquemia-reperfusión»)3, generando especies reactivas del oxígeno, sobrecarga de calcio, infiltración por neutrófilos, depleción de la reserva energética y cambios en los mecanismos intracelulares que pueden conducir a la apertura del poro de transición de permeabilidad mitocondrial (PTPM)2. De esta manera, el aporte de oxígeno incrementa el daño en el cardiomiocito previamente isquémico y reduce los efectos beneficiosos de la reperfusión4. Como consecuencia de los procesos mencionados, los mecanismos de muerte celular por necrosis se activan durante la fase de isquemia y los cambios característicos de la apoptosis ocurren principalmente tras reperfusión5, contribuyendo ambos tipos de muerte celular al tamaño final del IM2.
La activación de un grupo de quinasas denominadas RISK, por sus siglas en inglés (Reperfusion Injury Survival Kinases), confiere protección frente a la injuria por isquemia-reperfusión a través de sus acciones antiapoptóticas y antinecróticas6. Específicamente, la cardioprotección inducida tras la activación de la vía RISK está mediada por la inhibición de la apertura del PTPM, el bloqueo de la sobrecarga de calcio y la activación de varios mecanismos antiapoptóticos7. En este sentido, es interesante señalar que las estrategias terapéuticas diseñadas para aumentar la actividad de la vía RISK provocan una disminución significativa del tamaño del IM6,8.
El péptido similar al glucagón tipo 1 [GLP-1 (7-36) amida] es una hormona derivada del gen proglucagón, liberada desde las células L del intestino en respuesta a la ingesta de nutrientes. Una vez en circulación, GLP-1 (7-36) ejerce acciones como incretina, estimulando la secreción de insulina de manera dependiente de glucosa al interaccionar con su receptor (GLP-1R) en las células beta de los islotes pancreáticos9–11. Sin embargo, la vida media de GLP-1 (7-36) en sangre es muy reducida (< 2 min), principalmente debido a su rápida degradación por la enzima dipeptidil peptidasa-4 (DPP-4) dando lugar al péptido GLP-1 (9-36), débil antagonista del GLP-1R y sin actividad incretina12,13. Por lo tanto, en el contexto de la diabetes mellitus tipo 2 (DMT2), las terapias basadas en GLP-1 (7-36) se han desarrollado basándose en estrategias consistentes en incrementar la presencia de GLP-1 (7-36) en sangre, bien mediante compuestos inhibidores de la actividad del enzima DPP-4 (p. ej. sitagliptina, vidagliptina, linagliptina, saxagliptina, alogliptina) o bien utilizando agonistas del GLP-1R resistentes a la acción de dicho enzima (p. ej. exenatida, liraglutida, albiglutida, lixisenatida, taspoglutida)14.
Mas allá de sus efectos sobre el metabolismo de la glucosa, durante los últimos años numerosos estudios han descrito acciones citoprotectoras de GLP-1 (7-36) en diversos tipos celulares. Por ejemplo, se ha demostrado que GLP-1 (7-36) inhibe procesos de muerte celular en colangiocitos15, neuronas16 y en células beta pancreáticas17,18, presentando en estas últimas una combinación de efectos antiapoptóticos y antinecróticos19. Dicha citoprotección parece ser debida a la preservación directa de la mitocondria ya que estudios en hepatocitos demuestran que GLP-1 (7-36) ejerce efectos similares a la insulina mediante la modulación de la fosforilación oxidativa y la inhibición del estrés oxidativo20.
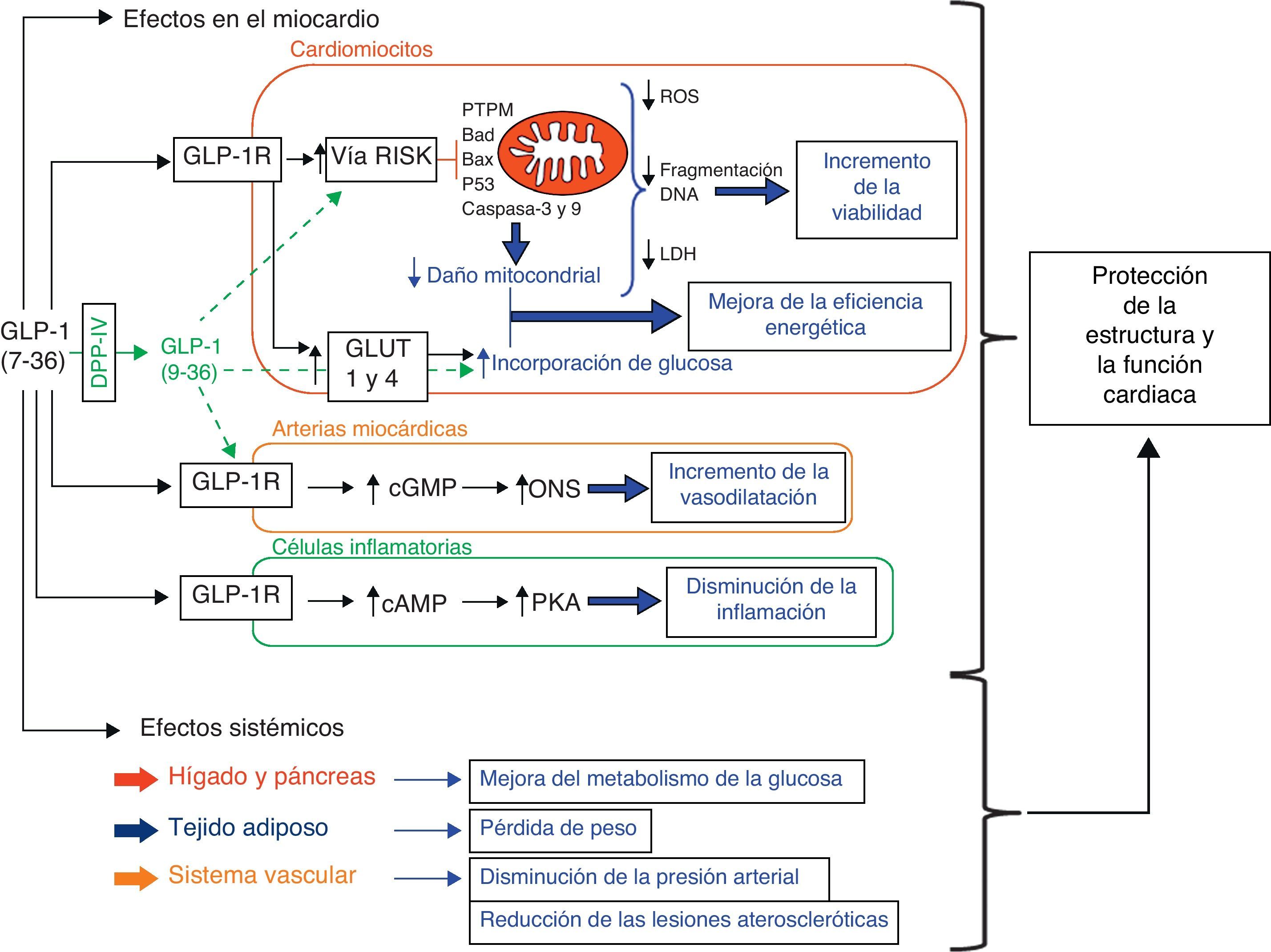
Hasta la fecha se han descrito una gran variedad de acciones de GLP-1 en el entorno cardiovascular, incluyendo modificaciones en el sistema hemodinámico21,22. Específicamente, las acciones citoprotectoras de GLP-1 (7-36) se han descrito en el corazón21–24. En este sentido, el hecho de que diferentes estudios demuestren la presencia de GLP-1R en el miocardio de diferentes modelos animales25,26 y en el tejido cardiaco humano27, sugiere que GLP-1 (7-36) puede ejercer efectos directos sobre este órgano. De hecho, varios estudios experimentales demuestran que la acción directa de GLP-1 (7-36) en el miocardio preserva la función cardiaca. Por ejemplo, la deleción genética del GLP-1R resulta en un empeoramiento de la respuesta contráctil del ventrículo izquierdo y de la función diastólica en ratones28. También se ha demostrado que la estimulación del GLP-1R en cardiomiocitos incrementa su viabilidad mediante la activación de la vía RISK (fig. 1)29–31. Además, la deficiencia genética de DPP-4 preserva la función cardiaca durante la endotoxemia32 y la isquemia-reperfusión33,34. Finalmente, es interesante mencionar que los niveles circulantes del GLP-1 se han asociado con la función cardiaca en estudios clínicos35,36.
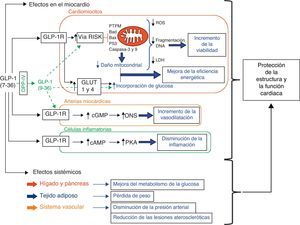
Representación esquemática de las vías intracelulares propuestas como mediadores de las acciones cardioprotectoras del péptido similar al glucagón tipo 1 (GLP-1). La combinación de los efectos de GLP-1 en el miocardio (p. ej. la inhibición de apoptosis y necrosis en los cardiomiocitos mediante la activación de la vía RISK, incremento del metabolismo de la glucosa, vasodilatación y acciones anti-inflamatorias) con los efectos sistémicos de GLP-1 a nivel metabólico y vascular, contribuye a la supervivencia cardiaca y a la mejora de la función.
(cAMP: adenosin monofosfato cíclico; cGMP: guanosin monofosfato cíclico; Cit c: citocromo c; DPP-4: dipeptidil peptidasa-4; ERK: quinasas reguladas por señales extracelulares; GLUT: transportador de glucosa; GSK: quinasa sintasa de glicógeno tipo 3; LDH: lactato deshidrogenasa; MEK ½: MAP quinasa quinasa; PTPM: poro de transición de permeabilidad mitocondrial; ONS: óxido nítrico sintasa; PI3K: fosfatidilinositol 3-quinasa; PKA: proteína quinasa A; PKB: proteína quinasa B; ROS: especies reactivas del oxígeno).
En esta revisión hemos incluido los estudios más relevantes que han contribuido a una mejor comprensión de las vías intracelulares y mecanismos moleculares desencadenados tras la estimulación del GLP-1R en cardiomiocitos, centrándonos en la modulación de la vía RISK y en la inhibición de mecanismos de muerte celular. Además, aportamos una comparación en paralelo de la influencia de GLP-1 sobre diferentes mecanismos intracelulares relacionados con la supervivencia miocárdica y las consecuencias funcionales que estas acciones pueden tener durante la isquemia-reperfusión experimental tanto en modelos diabéticos como no diabéticos. Finalmente, ya que la supervivencia del cardiomiocito también está comprometida en la insuficiencia cardiaca (IC)37–39, se ha incluido una discusión adicional sobre el papel cardioprotector de las estrategias basadas en GLP-1 y sus consecuencias en la estructura y función del miocardio en modelos experimentales de IC.
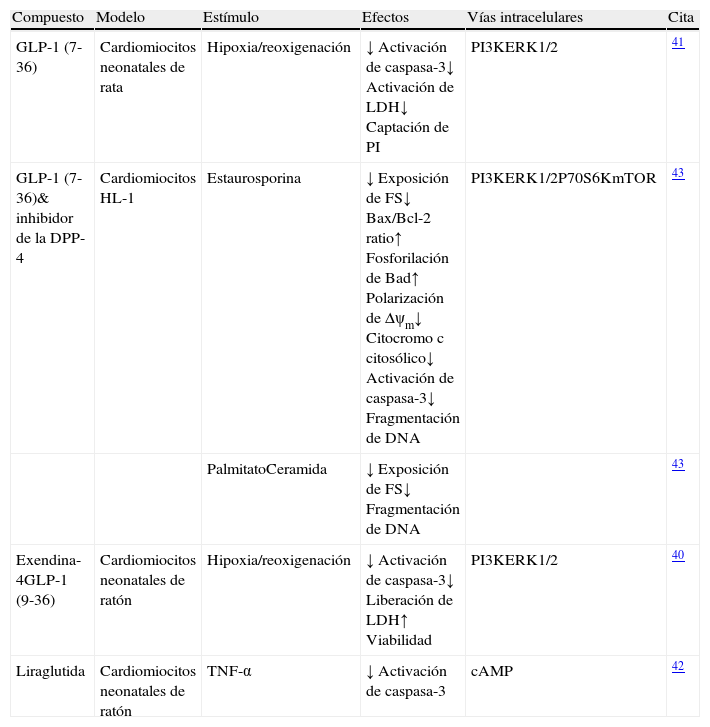
El péptido similar al glucagón tipo 1 y los cardiomiocitos en modelos experimentales in vitroDiversos estudios han demostrado que la incubación con GLP-1 (7-36), o con agonistas de su receptor, preserva la viabilidad de los cardiomiocitos cultivados en presencia de diferentes estímulos de muerte celular (tabla 1). Por ejemplo, la incubación con GLP-1 (7-36), o con un análogo, inhibe la activación de procesos de apoptosis y necrosis, y aumenta la viabilidad de cardiomiocitos neonatales, en condiciones de isquemia-reperfusión40,41 y en presencia de estímulos característicos de la IC como el factor de necrosis tumoral (TNF)-alfa42. Además, la incubación de cardiomiocitos murinos adultos (línea HL-1) en presencia de GLP-1 (7-36) previene la activación de mecanismos implicados en procesos de muerte celular desencadenados por estímulos apoptóticos clásicos como la estaurosporina y por estímulos propios del contexto diabético como el palmitato y la ceramida43. Además, en todos estos experimentos se demuestra que los efectos citoprotectores de GLP-1 (7-36) están principalmente mediados por mecanismos dependientes de la activación de la vía RISK, principalmente de la fosfoinositol 3-quinasa (PI3K) y de las quinasas reguladas por señales extracelulares (ERK1/2) (fig. 1). Por otro lado, es interesante señalar que determinados estudios asignan un papel citoprotector al péptido GLP-1 (9-36) considerado inactivo desde el punto de vista incretina, ya que inhibe procesos de muerte celular en cardiomiocitos sometidos a condiciones de isquemia-reperfusión, también mediante la activación de vías intracelulares dependientes de PI3K y ERK1/2 (fig. 1)40.
Estudio de los efectos citoprotectores de GLP-1 y de las terapias basadas en GLP-1 en cardiomiocitos in vitro
| Compuesto | Modelo | Estímulo | Efectos | Vías intracelulares | Cita |
| GLP-1 (7-36) | Cardiomiocitos neonatales de rata | Hipoxia/reoxigenación | ↓ Activación de caspasa-3↓ Activación de LDH↓ Captación de PI | PI3KERK1/2 | 41 |
| GLP-1 (7-36)& inhibidor de la DPP-4 | Cardiomiocitos HL-1 | Estaurosporina | ↓ Exposición de FS↓ Bax/Bcl-2 ratio↑ Fosforilación de Bad↑ Polarización de Δψm↓ Citocromo c citosólico↓ Activación de caspasa-3↓ Fragmentación de DNA | PI3KERK1/2P70S6KmTOR | 43 |
| PalmitatoCeramida | ↓ Exposición de FS↓ Fragmentación de DNA | 43 | |||
| Exendina-4GLP-1 (9-36) | Cardiomiocitos neonatales de ratón | Hipoxia/reoxigenación | ↓ Activación de caspasa-3↓ Liberación de LDH↑ Viabilidad | PI3KERK1/2 | 40 |
| Liraglutida | Cardiomiocitos neonatales de ratón | TNF-α | ↓ Activación de caspasa-3 | cAMP | 42 |
GLP-1 significa péptido similar al glucagón tipo 1; DPP-4: dipeptidíl peptidasa-4; TNF: factor de necrosis tumoral; LDH: lactato deshidrogenasa; PI: propidio de ioduro; FS: fosfatidilserina; Δψm: potencial de membrana mitocondrial; PI3K: fosfatidilinositol-3 quinasa; ERK: quinasas reguladas por señales extracelulares; cAMP: adenosina monofosfato cíclica.
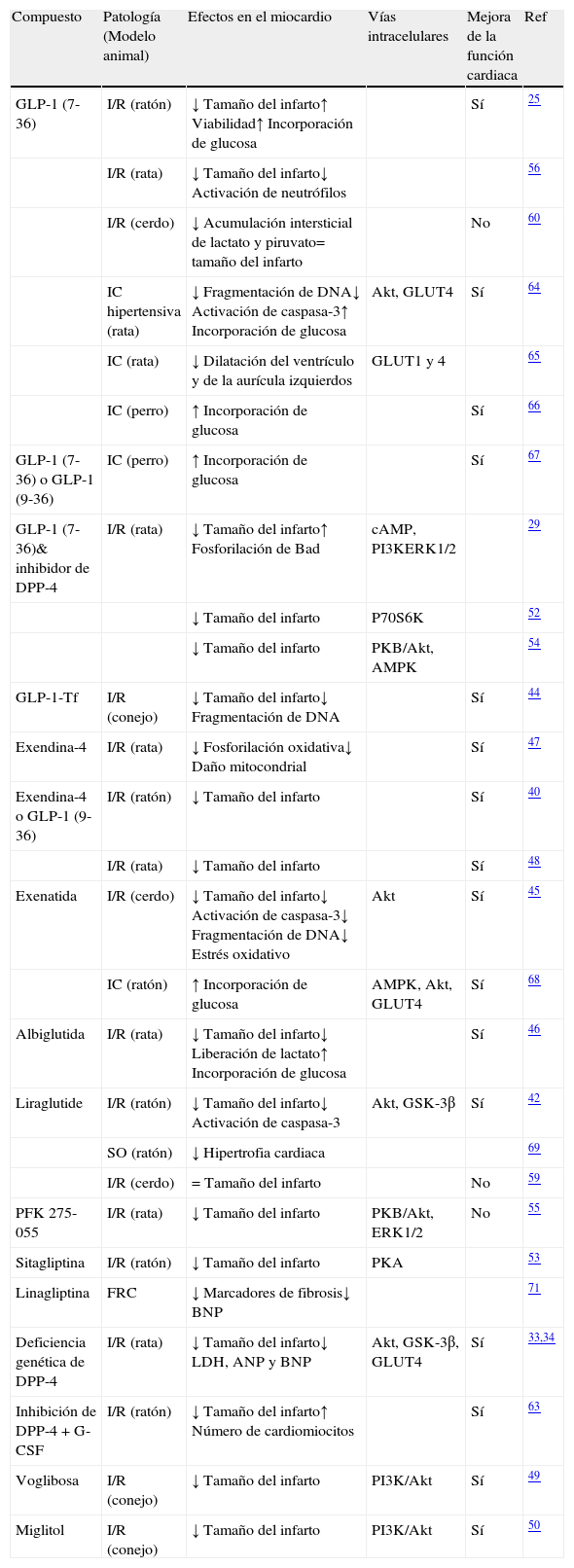
Numerosos trabajos han demostrado que la administración de GLP-1 (7-36), y de estrategias terapéuticas basadas en este péptido (agonistas del GLP-1R o inhibidores de la DPP-4), inhiben procesos de muerte celular activados en el miocardio en diferentes modelos experimentales de isquemia-reperfusión (tabla 2). Por ejemplo, el tratamiento con GLP-1 (7-36) en combinación con un inhibidor de la DPP-4 inhibe la actividad de la proteína proapoptótica Bad y disminuye el tamaño del área infartada en modelos animales de isquemia-reperfusión29. Además, el efecto antiapoptótico asociado a la reducción del área infartada se observa tanto si GLP-1 (7-36) se administra antes de la isquemia miocárdica, como al comienzo de la reperfusión44. También los agonistas del GLP-1R, como la exenatida, la albiglutida y la liraglutida, muestran actividad antiapoptótica y antinecrótica en modelos de isquemia-reperfusión. Concretamente, Timmers et al.45 demostraron en un modelo porcino de isquemia-reperfusión que la exenatida disminuye el tamaño del área infartada, inhibe la expresión de la proteasa caspasa-3 y la fragmentación de DNA, y reduce el estrés oxidativo. Además, la administración de albiglutida preserva la viabilidad del miocardio y disminuye la producción cardiaca de lactato tras injuria por isquemia-reperfusión en ratas46. Así mismo, la administración intraperitoneal de liraglutida antes del procedimiento de oclusión de la arteria coronaria en ratones disminuye el tamaño del área infartada, probablemente mediante la inhibición de la activación de la caspasa-3 en cardiomiocitos.42. Es interesante resaltar el hecho de que el aumento de la supervivencia de las células cardiacas en respuesta a terapias basadas en GLP-1 tiene un impacto significativo en la función cardiaca como se demuestra en la mayoría de los estudios mencionados, tanto en el contexto de la isquemia-reperfusión como en el de la IC (tabla 2)25,34,40,42,44–51.
Estudios de los efectos cardioprotectores de GLP-1 y de las terapias basadas en GLP-1 en modelos experimentales ex vivo e in vivo
| Compuesto | Patología (Modelo animal) | Efectos en el miocardio | Vías intracelulares | Mejora de la función cardiaca | Ref |
| GLP-1 (7-36) | I/R (ratón) | ↓ Tamaño del infarto↑ Viabilidad↑ Incorporación de glucosa | Sí | 25 | |
| I/R (rata) | ↓ Tamaño del infarto↓ Activación de neutrófilos | 56 | |||
| I/R (cerdo) | ↓ Acumulación intersticial de lactato y piruvato= tamaño del infarto | No | 60 | ||
| IC hipertensiva (rata) | ↓ Fragmentación de DNA↓ Activación de caspasa-3↑ Incorporación de glucosa | Akt, GLUT4 | Sí | 64 | |
| IC (rata) | ↓ Dilatación del ventrículo y de la aurícula izquierdos | GLUT1 y 4 | 65 | ||
| IC (perro) | ↑ Incorporación de glucosa | Sí | 66 | ||
| GLP-1 (7-36) o GLP-1 (9-36) | IC (perro) | ↑ Incorporación de glucosa | Sí | 67 | |
| GLP-1 (7-36)& inhibidor de DPP-4 | I/R (rata) | ↓ Tamaño del infarto↑ Fosforilación de Bad | cAMP, PI3KERK1/2 | 29 | |
| ↓ Tamaño del infarto | P70S6K | 52 | |||
| ↓ Tamaño del infarto | PKB/Akt, AMPK | 54 | |||
| GLP-1-Tf | I/R (conejo) | ↓ Tamaño del infarto↓ Fragmentación de DNA | Sí | 44 | |
| Exendina-4 | I/R (rata) | ↓ Fosforilación oxidativa↓ Daño mitocondrial | Sí | 47 | |
| Exendina-4 o GLP-1 (9-36) | I/R (ratón) | ↓ Tamaño del infarto | Sí | 40 | |
| I/R (rata) | ↓ Tamaño del infarto | Sí | 48 | ||
| Exenatida | I/R (cerdo) | ↓ Tamaño del infarto↓ Activación de caspasa-3↓ Fragmentación de DNA↓ Estrés oxidativo | Akt | Sí | 45 |
| IC (ratón) | ↑ Incorporación de glucosa | AMPK, Akt, GLUT4 | Sí | 68 | |
| Albiglutida | I/R (rata) | ↓ Tamaño del infarto↓ Liberación de lactato↑ Incorporación de glucosa | Sí | 46 | |
| Liraglutide | I/R (ratón) | ↓ Tamaño del infarto↓ Activación de caspasa-3 | Akt, GSK-3β | Sí | 42 |
| SO (ratón) | ↓ Hipertrofia cardiaca | 69 | |||
| I/R (cerdo) | = Tamaño del infarto | No | 59 | ||
| PFK 275-055 | I/R (rata) | ↓ Tamaño del infarto | PKB/Akt, ERK1/2 | No | 55 |
| Sitagliptina | I/R (ratón) | ↓ Tamaño del infarto | PKA | 53 | |
| Linagliptina | FRC | ↓ Marcadores de fibrosis↓ BNP | 71 | ||
| Deficiencia genética de DPP-4 | I/R (rata) | ↓ Tamaño del infarto↓ LDH, ANP y BNP | Akt, GSK-3β, GLUT4 | Sí | 33,34 |
| Inhibición de DPP-4+G-CSF | I/R (ratón) | ↓ Tamaño del infarto↑ Número de cardiomiocitos | Sí | 63 | |
| Voglibosa | I/R (conejo) | ↓ Tamaño del infarto | PI3K/Akt | Sí | 49 |
| Miglitol | I/R (conejo) | ↓ Tamaño del infarto | PI3K/Akt | Sí | 50 |
ANP: péptido natriurético atrial; BNP: péptido natriurético cerebral; cAMP: adenosina monofosfato cíclica; DPP-4: dipeptidíl peptidasa-4; ERK: quinasa regulada por señales extracelulares; FRC: fallo renal crónico; GLP-1 significa péptido similar al glucagón tipo 1; GLP-1-Tf, GLP-1 fusionado con transferrina humana; GLUT: transportador de glucosa; GSK: quinasa sintasa de glicógeno; IC: insuficiencia cardiaca; I/R: isquemia-reperfusión; PI3K: fosfatidilinositol 3-quinasa; PKA: proteína quinasa A; PKB: proteína quinasa B; PKF 275-055: inhibidor del enzima DPP-4; LDH: lactato deshidrogenasa; SO: síndrome de obesidad.
En coherencia con las observaciones realizadas en los modelos in vitro, diversos hallazgos apoyan la hipótesis de que los efectos cardioprotectores de GLP-1 (7-36) en modelos de isquemia-reperfusión están mediados por la activación de quinasas de la vía RISK, entre ellas PI3K, ERK1/2, cAMP, PKA, Akt y P70S6K (tabla 2)29,34,42,49,50,52–55. Por otro lado, se ha propuesto que la mejoría observada tras la administración de GLP-1 (7-36) en el IM, en cuanto al incremento de la supervivencia y a la mejora de la función cardiaca, también podría ser debida a una menor activación de células inflamatorias56, a la mejora de la microcirculación miocárdica57 y a un aumento en la incorporación de glucosa en el miocardio (fig. 1)46,58.
Sin embargo, los efectos beneficiosos de las terapias basadas en GLP-1 (7-36) en la estructura y función cardiacas no han sido confirmados en determinados estudios realizados en modelos porcinos de isquemia-reperfusión. Por ejemplo, ni la infusión de GLP-1 (7-36) ni el tratamiento con liraglutida, modifican el tamaño del infarto en dichos modelos experimentales59,60. Sin embargo, es bien sabido que los resultados pueden variar considerablemente dependiendo de la duración del tratamiento, las dosis administradas, así como el modelo animal utilizado. Por otro lado, es necesario mencionar que en el miocardio porcino la presencia de flujo de sangre colateral suele ser despreciable61, lo que puede contribuir a la disminución de la eficacia cardioprotectora de GLP-1 debido a la acumulación de productos tóxicos tras IM. Sin embargo, el hecho de que otros autores hayan demostrado que en el miocardio porcino el tratamiento con exenatida inhibe la apoptosis y el estrés oxidativo y activa quinasas de supervivencia tras un procedimiento de isquemia-reperfusión45, plantea la necesidad de diseñar nuevos estudios para clarificar el impacto beneficioso de las estrategias basadas en GLP-1 en este tipo de modelo experimental. También existen datos que demuestran que el bloqueo crónico de la actividad de DPP-4 con vidagliptina no previene el remodelado miocárdico estructural y funcional que sigue al IM en un modelo experimental de rata no diabética62. En este sentido, hallazgos obtenidos por el grupo de Sauvé et al.33 apoyan la hipótesis de que, en comparación con ratones no diabéticos, la inhibición de DPP-4 es una estrategia que presenta más eficacia cardioprotectora en cuanto a la activación de vías de supervivencia tras IM en ratones diabéticos. Por otra parte, observaciones recientes demuestran que la inhibición de DPP-4, en combinación con el factor estimulante de colonias de granulocitos (G-CSF) en condiciones de activación del ciclo celular en cardiomiocitos, incrementa la regeneración miocárdica y mejora la función en ratones tras IM63. Finalmente, y en concordancia con hallazgos in vitro, varios estudios indican que la administración del péptido GLP-1 (9-36) reduce el daño producido en el miocardio tras isquemia-reperfusión, apoyando así la hipótesis de que las terapias que inhiben la formación de este péptido pueden tener una menor eficacia cardioprotectora en estos modelos experimentales25,40,48.
El péptido similar al glucagón tipo 1 y los cardiomiocitos en modelos experimentales de insuficiencia cardiacaLos efectos de GLP-1 (7-36) sobre la viabilidad y función cardiacas también se han estudiado en modelos experimentales de IC (tabla 2). Por ejemplo, en ratas espontáneamente hipertensas con IC, la administración continuada de GLP-1 (7-36) durante 3 meses disminuye el índice apoptótico así como la activación de la caspasa-3, además de preservar la función del ventrículo izquierdo y de prolongar la supervivencia de los animales64. De la misma manera, el tratamiento con GLP-1 (7-36) o con exenatida en ratas con IC post-IM durante 11 semanas mejora significativamente el remodelado cardiaco, la función cardiaca y la supervivencia del modelo65. En coherencia con estos resultados, la infusión de GLP-1 (7-36) en perros con cardiomiopatía dilatada durante 48 h incrementa la incorporación de glucosa en el miocardio mejorando la función del ventrículo izquierdo y disminuyendo la resistencia vascular sistémica66. Estos hallazgos fueron confirmados un año después en el mismo modelo experimental, en el que además se demostró que GLP-1 (9-36) también ejerce acciones similares a GLP-1 (7-36) en cuanto a la estimulación de la incorporación de glucosa y a la mejora de la función del ventrículo izquierdo67, reforzando el papel cardioprotector de GLP-1 (9-36) en la IC experimental. Estudios posteriores en modelos experimentales de cardiomiopatía dilatada demostraron que el tratamiento con exenatida aumenta la contractilidad cardiaca y la incorporación de glucosa en el miocardio, disminuye la producción del péptido natriurético cerebral (BNP) y prolonga la supervivencia, asociándose todos estos efectos a un incremento en la activación de la vía RISK, especialmente de la quinasa AMP y de vías intracelulares dependientes de Akt68.
Evidencias recientes amplían las acciones cardioprotectoras de GLP-1 a condiciones patológicas diferentes del IM o de la IC. En concreto, la administración de liraglutida disminuye la hipertrofia cardiaca y la presión arterial en ratones obesos con resistencia a la insulina69. En este sentido, el efecto antihipertensivo de GLP-1 ya había sido previamente descrito en el modelo de ratas Dahl sensibles a la sal70. Además, se ha demostrado que el inhibidor de la DPP-4, linagliptina, disminuye la expresión de proteínas relacionadas con la presencia de fibrosis miocárdica y los niveles de marcadores de estrés cardiomiocitario en un modelo de rata con cardiomiopatía urémica71.
Conclusión y perspectivasLos hallazgos obtenidos hasta la fecha sugieren que las terapias basadas en GLP-1 (7-36) pueden ejercer acciones beneficiosas en el corazón más allá de sus efectos metabólicos, concretamente disminuyendo la susceptibilidad de los cardiomiocitos a la activación de procesos de muerte celular y aumentando la eficiencia energética de los mismos. Específicamente, los estudios in vitro demuestran un efecto directo de GLP-1 sobre la supervivencia de los cardiomiocitos mediante la activación de la vía RISK en presencia de estímulos característicos de la injuria por isquemia-reperfusión y del contexto de la IC (tabla 1). Coherentemente, los datos obtenidos en estudios realizados en modelos in vivo de isquemia-reperfusión y de IC demuestran que la activación de la vía RISK mediada por GLP-1 incrementa la supervivencia del miocardio (tabla 2). También es interesante señalar el hecho de que en la mayoría de los modelos experimentales in vivo la citoprotección inducida por GLP-1 se asocia con una mejora de la función cardiaca (tabla 2). En resumen, los efectos directos de GLP-1 (7-36) en el miocardio, en combinación con otras acciones del péptido sobre el sistema cardiovascular (revisado en 21-24), pueden explicar los efectos beneficiosos de las terapias basadas en incretinas en la estructura y función cardiacas, independientemente de la presencia o ausencia de DMT2 (fig. 1).
Sin embargo, es necesario analizar en mayor profundidad el impacto que las terapias basadas en GLP-1 (7-36) tienen en los diferentes procesos implicados en el remodelado miocárdico, incluyendo la evaluación de la vías implicadas en la hipertrofia y muerte de los cardiomiocitos, así como en los mecanismos que conducen a un excesivo depósito de colágeno y a la presencia de fibrosis miocárdica. Además, es necesario proponer nuevos estudios experimentales y clínicos que evalúen la eficacia cardioprotectora de las terapias basadas en incretinas, en comparación con otras estrategias farmacológicas, en pacientes con o sin DMT2, en ausencia o en presencia de IM o de IC. Además, es necesario diseñar nuevos estudios experimentales para analizar las dosis y prolongación de los tratamientos basados en GLP-1 en cada condición patológica, para alcanzar un equilibrio razonable entre los efectos secundarios y el impacto beneficioso observado en el remodelado miocárdico.
También existe la necesidad de diseñar experimentos adicionales en el contexto de la diabetes, dirigidos a comparar los efectos cardiovasculares de las terapias basadas en incretinas con otras terapias hipoglucemiantes, y analizando en profundidad el impacto que dichas terapias pueden tener sobre diferentes comorbilidades asociadas a esta enfermedad, como son la obesidad, hiperlipidemia, hipertensión, fallo renal, etc.72. En este mismo marco conceptual, deberían plantearse experimentos que comparen la eficacia cardioprotectora de diferentes terapias basadas en GLP-1, sobre todo teniendo en cuenta que los agonistas del GLP-1R y los inhibidores de la DPP-4 presentan diferentes acciones dependiendo de si se evalúan en el contexto metabólico o en el cardiovascular14,72,73. En este sentido, es importante mencionar las numerosas observaciones experimentales que asignan actividad cardioprotectora al péptido GLP-1 (9-36), cuyos niveles en sangre pueden estar influenciados por el tipo de terapia basada en incretinas que se administre, y que permiten plantear la hipótesis de que los agonistas del GLP-1R pueden mostrar una mayor eficacia cardioprotectora en términos de supervivencia de los cardiomiocitos. En este sentido, hallazgos realizados por Sauvé et al.33 muestran una clara tendencia hacia una mayor activación de las vías de supervivencia en el miocardio de animales diabéticos tratados con liraglutida en comparación con los tratados con sitagliptina.
En conclusión, se deben plantear nuevos estudios experimentales para investigar la aplicabilidad y efectividad de las terapias basadas en incretinas en el contexto cardiovascular. Dicha aproximación debería incluir un análisis combinado de la eficacia de las terapias basadas en GLP-1 para preservar la viabilidad y la función de los cardiomiocitos, así como de su influencia en otras lesiones celulares y tisulares características del remodelado cardiaco, en diferentes modelos experimentales tanto en ausencia como en presencia de diabetes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.