Existe una conocida controversia entre distintas sociedades científicas respecto a la recomendación o no de que se realice un cribado universal para la detección de disfunción tiroidea (DT) durante la gestación. Aunque varios estudios asocian el hipotiroidismo subclínico o la hipotiroxinemia con problemas obstétricos y/o con alteraciones neurocognitivas de la prole, no hay evidencia sobre los posibles efectos positivos de su tratamiento con tiroxina. Sin embargo, existe un acuerdo generalizado sobre la necesidad del tratamiento del hipotiroidismo clínico durante la gestación y los riesgos que podría ocasionar la abstención terapéutica. Por tratarse de una enfermedad frecuente, de fácil diagnóstico y para la que se dispone de un tratamiento efectivo y exento de riesgos, la Sociedad Española de Endocrinología y Nutrición (Grupo de Trabajo de Trastornos por Deficiencia de Yodo y Disfunción Tiroidea) y la Sociedad Española de Ginecología y Obstetricia recomiendan que se evalúe precozmente (antes de la semana 10) la función tiroidea a todas las mujeres embarazadas. Dada la compleja fisiología de la función tiroidea durante la gestación, la valoración de las hormonas debe realizarse utilizando valores de referencia para cada trimestre y para cada zona con las técnicas de laboratorio propias. Para el cribado, bastaría con la determinación de tirotropina y solo si esta está alterada, debería analizarse también la tiroxina libre o total. Debe recordarse también que una adecuada nutrición de yodo desde antes y durante el embarazo es fundamental para contribuir a la normalidad de la función tiroidea materno-fetal.
There is a controversy among different scientific societies in relation to the recommendations on whether universal screening for the detection of thyroid dysfunction during gestation should be performed or not. Although various studies have shown an association between subclinical hypothyroidism or hypothyroxinemia with obstetric problems and/or neurocognitive impairment in the offspring, no evidence on the possible positive effects of treatment of such conditions with thyroxin has been demonstrated so far. However, there is a general agreement about the need for treatment of clinical hypothyroidism during pregnancy and the risks of not doing so. Because it is a common, easily diagnosed and effectively treated disorder without special risk, the working Group of Iodine Deficiency Disorders and Thyroid Dysfunction of the Spanish Society of Endocrinology and Nutrition and Spanish Society of Gynaecology and Obstetrics recommends an early evaluation (before week 10) of thyroid function in all pregnant women. Given the complex physiology of thyroid function during pregnancy, hormone assessment should be performed according to reference values for each gestational trimester and generated locally in each reference laboratory. Thyrotropin determination would be sufficient for screening purposes and only if it is altered, free thyroxin or total thyroxin would be required. Adequate iodine nutrition is also highly recommended before and during pregnancy to contribute to a normal thyroid function in the pregnant women and fetus.
Dada la trascendencia que la patología tiroidea materna puede tener para la propia madre y el feto, desde el grupo de trabajo de la Sociedad Española de Endocrinología y Nutrición (SEEN), «Trastornos por Déficit de Yodo y Disfunción Tiroidea» y la Sociedad Española de Ginecología y Obstetricia (SEGO), además de puntualizar la importancia de una adecuada yodación durante la gestación, se estimó conveniente abordar el controvertido tema del cribado universal de la función y de la autoinmunidad tiroideas en la población gestante.
En los últimos 20 años se ha producido un importante aumento del conocimiento en relación con los trastornos tiroideos y el embarazo, con implicaciones clínicas relevantes, en cuanto a:
- -
Un mejor entendimiento de los importantes efectos adaptativos de la economía tiroidea materna ejercidos por el embarazo1.
- -
El impacto de la deficiencia de yodo, aun leve-moderada, sobre la madre, los resultados de la gestación y, sobre todo, en el feto en desarrollo2.
- -
Un mejor conocimiento sobre las pruebas que valoran la función/autoinmunidad tiroideas en el embarazo, para determinar valores de normalidad en la gestación.
- -
Los efectos adversos de distintos grados de hipofunción tiroidea materna y el momento de su detección durante la gestación, sobre los resultados del embarazo y el desarrollo neuropsicológico de los hijos3.
- -
El tratamiento óptimo de las mujeres embarazadas que están en tratamiento con levotiroxina (LT4) en el período preconcepcional y la necesidad de incrementar la dosis desde las primeras semanas del embarazo4,5.
- -
La influencia de la autoinmunidad tiroidea positiva, aún sin disfunción tiroidea (DT), sobre la fertilidad y la evolución del embarazo6.
Estos avances en el conocimiento de la glándula, la DT y la autoinmunidad tiroidea han constituido la base científica argumental de la que ha surgido la necesidad de plantearse la conveniencia o no de llevar a cabo un estudio generalizado de la función y del estado de la autoinmunidad tiroidea de todas las mujeres en edad fértil, bien cuando deseen concebir, o en una etapa precoz del embarazo.
En ausencia de una evidencia inequívoca, hay otras consideraciones que deberán tenerse en cuenta en la discusión para establecer una estrategia de cribado universal:
- -
La mayoría de los trastornos comunes, autoinmunidad/disfunción, que afectan al tiroides y embarazo, generalmente no ocasionan síntomas ni signos. Su diagnóstico es bioquímico.
- -
El hipotiroidismo subclínico (HSC), excluyendo la positividad asintomática de los anticuerpos antitiroideos, es el trastorno del tiroides más común en el embarazo y cualquier consideración acerca del cribado de la función tiroidea durante el mismo dependerá de la repercusión clínica de esta condición y de los potenciales beneficios de su tratamiento.
- -
La economía tiroidea materna sufre importantes cambios fisiológicos, adaptativos, con variación de las concentraciones periféricas de hormonas tiroideas y tirotropina (TSH) durante de la gestación, debiendo precisar sus límites de normalidad específicos según la edad gestacional, para una correcta interpretación, sobre todo de la enfermedad tiroidea subclínica.
La estrategia de cribado de la DT de la población gestante presenta la siguiente dicotomía: cribado universal frente a cribado selectivo. A continuación se exponen distintas posturas relevantes:
- 1.
Cribado universal antes de la concepción o en la primera visita antenatal y evaluación de los casos con anormalidad en las pruebas de función tiroidea:
en el caso del hipotiroidismo clínico (HC) existe unanimidad en la necesidad e importancia de su tratamiento5,7, aun cuando un reciente estudio de Lazarus et al. lo cuestiona8. Hasta la actualidad, diversos autores opinaban que aun pudiéndose aconsejar el cribado de la función tiroidea9, se carecía de datos concluyentes que demostraran que el tratamiento con LT4 de mujeres con HSC fuera beneficioso y que estuviera libre de riesgos9,10. Tanto el American College of Obstetricians and Gynecologists11 como la guía de la American Thyroid Association (ATA)12 se posicionan en este sentido y en el de no realizar un cribado universal de disfunción y/o autoinmunidad tiroidea en esta población. Sin embargo, en 2009, el grupo de trabajo de DT subclínica de la SEEN publicaba una guía en la que apoyaba manifiestamente el cribado de la función tiroidea en la pregestación o en el primer trimestre13. En esta misma línea se pronuncia un reciente editorial14.
- 2.
Cribado solo de los casos de alto riesgo para la DT:
diversas sociedades científicas como la ATA y la American Association of Clinical Endocrinologists (AACE) se posicionan aconsejando la identificación, cuidadosa monitorización y tratamiento, si procede, de las mujeres con riesgo de DT, clínica o subclínica, antes de la concepción o precozmente en el embarazo12,15. Poppe et al. afirman que el estudio sistemático podría ser más eficiente en mujeres de alto riesgo, particularmente en mujeres infértiles6. Sin embargo, estudiar solo a las mujeres embarazadas de alto riesgo podría dejar sin diagnóstico a alrededor de un tercio de las mujeres con hipotiroidismo16. La ATA reconoce como casos de riesgo12: a) mujeres con historia de DT previa, bocio, anticuerpos antitiroideos positivos, irradiación cervical o cirugía de tiroides; b) edad>30 años; c) historia familiar de enfermedad tiroidea; d) presencia de signos o síntomas clínicos de hipotiroidismo (aunque solo el 30% de los casos suelen manifestar clínica); e) mujeres afectadas de diabetes mellitus tipo 1 o cualquier otra enfermedad autoimunitaria; f) historia de abortos, prematuridad o infertilidad; g) obesidad mórbida; h) mujeres tratadas con litio, amiodarona o administración reciente de contraste yodado, e i) residencia en una zona con deficiencia moderada o grave de yodo.
Se denomina cribado (screening) a la identificación sistemática y activa de un problema de salud no reconocido por medio de la aplicación, de forma rápida, de pruebas (tests), exámenes u otros procedimientos. Hay que destacar que las pruebas de cribado se realizan en personas aparentemente sanas y que, en ningún caso, pretenden ser diagnósticas; por tanto, los resultados positivos requieren ser confirmados posteriormente. El concepto de cribado poblacional indica la aplicación del cribado a gran escala y en poblaciones o grupos poblacionales al completo. Es una investigación médica que no surge de la búsqueda de ayuda por parte de un paciente ante un problema de salud específico y que asume que la detección temprana de la enfermedad, o la identificación del riesgo, es beneficiosa para el individuo y para la comunidad. Se trata de una estrategia de prevención secundaria consistente en la detección precoz del problema de salud y su tratamiento oportuno con el objetivo de reducir la morbimorbilidad y las secuelas asociadas al mismo.
En 1968, la Organización Mundial de la Salud publicó un documento sobre los principios que debían regir un programa de cribado17 (tabla 1) y que, aún hoy, siguen siendo vigentes desde la perspectiva de las políticas de salud pública. Posteriormente, los 10 principios establecidos se agruparon en diferentes criterios18 que hacen referencia a 3 aspectos: la enfermedad o problema de salud (gravedad, alta prevalencia de la fase preclínica, buen conocimiento de la historia natural y período de tiempo entre la aparición de los primeros signos y la presentación de la enfermedad manifiesta), la prueba de cribado (válida; sencilla y económica; segura y aceptable; y fiable), y el diagnóstico y tratamiento del problema (disponibilidad de recursos adecuados y tratamiento accesible, efectivo, aceptable y seguro). La decisión sobre el establecimiento de un cribado debe basarse en la evaluación de cada uno de dichos criterios. La importancia de la enfermedad se valora en función de su frecuencia y gravedad19, de manera que patologías con prevalencias altas y consecuencias graves adquieren mayor fuerza para plantear el cribado. Por otra parte, la identificación precoz de la enfermedad requiere la existencia de una fase presintomática detectable y la disponibilidad de pruebas (marcadores biológicos, exploraciones radiológicas, etc.) que permitan dicha detección. Es, pues, imprescindible un buen conocimiento y comprensión de la historia natural del problema de salud y, especialmente, del alcance de los estadios preliminares (cambios patológicos frente a variaciones fisiológicas, progresión) para poder intervenir en el momento oportuno. En cuanto a la prueba de cribado, esta tiene que ser válida (sensible para identificar correctamente a las personas afectadas y específica para identificar a las que no lo están), precisa y fiable; debe, pues, mostrar una buena capacidad discriminatoria para poder diferenciar a las personas con el problema de salud de las que no lo presentan. Además de sus características técnicas, la prueba de cribado debe ser aceptada por la población; la aceptación depende de la naturaleza del riesgo que la enfermedad comporte y del nivel de educación sanitaria de dicha población; no obstante, la prueba ha de permitir una realización fácil, ser poco problemática y no causar prácticamente molestias o incomodidades.
Principios del cribado
| 1. La enfermedad tiene que ser un problema de salud importante |
| 2. Debe haber un tratamiento aceptado para aquellos pacientes en los que se identifique la enfermedad |
| 3. Hay que disponer de recursos para el diagnóstico y el tratamiento |
| 4. La enfermedad debe presentar una fase de latencia o sintomatología precoz detectable |
| 5. Hay que disponer de una prueba de cribado válida |
| 6. La prueba de cribado debe ser aceptada por la población |
| 7. La historia natural del problema de salud, desde la fase de latencia hasta la enfermedad manifiesta, tiene que ser conocida y comprendida |
| 8. Debe existir acuerdo en cuanto al tratamiento de los pacientes |
| 9. El coste del cribado (incluyendo el diagnóstico y el tratamiento de los pacientes identificados) tiene que estar equilibrado con el coste de la atención sanitaria general dedicada al problema |
| 10. El cribado debe concebirse como un proceso continuado y no como un proyecto único que se lleva a cabo una sola vez |
Fuente: Wilson y Jugner17.
La habilidad para tratar adecuadamente el problema de salud, una vez este ha sido identificado, es quizás el criterio más importante de un cribado. Tanto es así que, si no se dispone de tratamiento para las fases iniciales de la enfermedad que pueda cambiar el curso y el pronóstico de la misma, no hay que considerar el establecimiento del cribado. El tratamiento oportuno y adecuado incluye el acuerdo previo sobre la pauta terapéutica que van a recibir los pacientes claramente diagnosticados, así como la estrategia de seguimiento para aquellos con diagnósticos en el límite de la normalidad. Finalmente, la disponibilidad de recursos hace referencia tanto a los medios materiales y humanos que se necesitan para llevar a cabo el cribado, como a los servicios sanitarios apropiados para verificar los hallazgos y tratar a las personas cuya sospecha diagnóstica se confirme. No en vano, la detección precoz de la enfermedad debe representar una mejora sustancial en la salud de la población y un balance económico favorable en las relaciones coste-beneficio y coste-efectividad.
Cribado universal de la función tiroidea en la gestaciónNo es fácil establecer un consenso cuando no se trata de una enfermedad única, sino de diversas enfermedades asociadas al tiroides durante la gestación. Además, cuando su potencial repercusión sobre esta puede ser muy heterogénea según la causa y/o la gravedad de la disfunción. Con una visión simplista se podría afirmar que «las anomalías tiroideas son frecuentes en mujeres en edad fértil, se detectan con facilidad con una simple medición de TSH y cuando se identifican se tratan adecuadamente con un suplemento de tiroxina seguro y barato»20. Sin embargo, cuando la evaluación de la DT se traslada a la mujer gestante el tema adquiere una mayor complejidad. Siguiendo los criterios de Beaglehole et al.18 se pueden establecer los siguientes interrogantes:
¿La DT durante la gestación implica un problema de salud?, ¿se dispone de pruebas diagnósticas simples y fiables?, ¿el cribado universal es rentable, desde el punto de vista coste-beneficio?, ¿a quién, cuándo y cómo debería realizarse el cribado de DT?, ¿existe un tratamiento simple, sin riesgos y del que haya una evidencia sólida?
Argumentos a favor del cribado universalLa disfunción tiroidea durante la gestación como problema de saludPrevalencia de disfunción tiroidea en la gestaciónLos datos sobre prevalencia de hipotiroidismo en mujeres embarazadas sanas de nuestro país son limitados21–23, mostrando una frecuencia de HSC del 4,6-6,4% y de HC del 1,6%24. Otro estudio observa una prevalencia de HSC del 6,5 al 9,9%25. En la literatura médica internacional, la frecuencia de DT clínica y subclínica (hipotiroidismo e hipertiroidismo) es similar16,26,27, de tal manera que entre el 5,7 y el 11,8% de las mujeres presentarán algún tipo de alteración de la función tiroidea durante la gestación. Según Stagnaro-Green et al., la prevalencia de HC puede llegar al 0,5% en mujeres en edad fértil28, pero recientemente se ha descrito una prevalencia de HC del 2,5% en una extensa población de mujeres embarazadas de EE.UU.29. La hipotiroxinemia materna (disminución de las concentraciones séricas de tiroxina libre [T4L] en plasma con TSH normal) es unas 150 veces más frecuente que el hipotiroidismo congénito3 y representa un estado de hipofunción tiroidea cuya causa más frecuente es la deficiencia nutricional de yodo30. Por otro lado, entre el 5 y el 14% de las gestantes sanas presentan anticuerpos antiperoxidasa (TPO) y/o antitiroglobulina positivos6,31; ello se asociará a concentraciones de TSH más elevadas y de T4L más bajas32. Respecto al hipertiroidismo, la prevalencia de enfermedad de Graves puede oscilar entre el 0,1 y el 1%33 y entre el 1 y el 3% la del síndrome de hipertiroidismo gestacional34.
Complicaciones obstétricas asociadas a la disfunción tiroidea- -
Infertilidad: existe una conocida asociación entre hipotiroidismo y descenso de la fertilidad; sin embargo, estudios recientes muestran cómo el hipotiroidismo no impide la posibilidad de concebir6,35. También, un alto porcentaje de mujeres con HC o HSC quedan embarazadas sin haber sido tratadas con tiroxina36.
- -
Aborto/muerte fetal intraútero: se ha descrito una elevada asociación entre el aumento en la tasa de abortos, endometriosis y fallo ovárico y la autoinmunidad tiroidea6. El éxito de la reproducción asistida se reduce ante autoinmunidad tiroidea con elevación de la TSH37. En cuanto a las gestaciones avanzadas, hay un riesgo aumentado de muerte fetal intraútero en las embarazadas con TSH>6mUI/l (odds ratio 4,4)38 y, en general, el riesgo de aborto se incrementa claramente en caso de HC o de HSC39–41.
- -
Crecimiento intrauterino restringido: existe una correlación positiva entre el grado de hipotiroidismo materno (subclínico o manifiesto) y la restricción del crecimiento fetal intraútero42–44.
- -
Estados hipertensivos del embarazo: se ha observado una correlación entre las concentraciones de TSH y las de endotelina en la mujer gestante, acordes a la gravedad de la preeclampsia/eclampsia45–47.
- -
Desprendimiento de placenta normalmente inserta: riesgo relativo de 3 en HSC26.
- -
Prematuridad: se asocia fuertemente al hipotiroidismo materno, clínico y/o subclínico48,49.
En 1999, Haddow et al.7 observaron que los hijos de aquellas mujeres con hipotiroidismo no diagnosticado (TSH por encima del percentil 98) durante la gestación presentaban, a los 9 años de edad, puntuaciones significativamente más bajas en test relacionados con la inteligencia, la atención, el lenguaje, la habilidad de lectura, los resultados escolares y el rendimiento visomotor. Otros estudios han relacionado el HSC, la hipotiroxinemia o autoinmunidad tiroidea de las madres con peores resultados en los test de inteligencia y psicomotricidad de los hijos50. El efecto de la hipotiroxinemia materna ha generado, recientemente, un amplio debate sobre su implicación en el desarrollo neuropsicológico de los hijos. Mientras que diversos autores51–53 muestran que la «hipotiroxinemia materna» (T4L<percentil 10) en el primer trimestre, sin HSC, se asocia a una disminución del desarrollo neuropsicológico de los hijos, el reciente trabajo de Craig et al.54 no observa ninguna diferencia. Sin embargo, ya en el año 2000, Morreale de Escobar et al. presentan evidencias epidemiológicas y experimentales que sugieren fuertemente que la hipotiroxinemia en el primer trimestre (con o sin TSH aumentada) aumenta el riesgo de un pobre desarrollo neuropsicológico de la prole3. El retraso se produce por disminución en la disponibilidad de tiroxina materna en el cerebro fetal en desarrollo25,55. El riguroso método de selección que Berbel et al. imponen en su población de estudio para la evaluación de los parámetros neuropsicológicos apoyarían claramente el efecto de la hipotiroxinemia sobre estos25.
Estadio precoz detectableLos requerimientos de tiroxina en mujeres con hipotiroidismo conocido aumentan en la gestación56, lo que obliga a incrementar sus dosis entre el 30 y el 50% desde el momento en que se confirma el embarazo. Un retraso de 6-10 semanas en la suplementación precisa (yodo y/o tiroxina) al inicio de la gestación incrementa el riesgo de retraso del neurodesarrollo de la descendencia25. Así pues, es también importante garantizar un aporte adecuado de yodo durante la gestación (250μg/día)12,57. Además, un buen estado nutricional de yodo, relacionado con el consumo de sal yodada en períodos prolongados previos al embarazo, puede reducir el riesgo de DT durante la gestación58. En nuestro entorno la sal yodada y también el consumo de leche59 pueden contribuir a una buena nutrición de yodo. En poblaciones con deficiencia de yodo durante la gestación y la lactancia, la suplementación con 150-200μg de yodo garantiza alcanzar la ingesta recomendada.
Consideraciones sobre el cribado de la disfunción tiroidea en gestantes sanasLa sociedad, y más concretamente la mujer embarazada, demanda un análisis exhaustivo de todo lo concerniente al desarrollo fetal60. La posibilidad de detectar a aquellas gestantes con riesgo para desarrollar una DT durante el embarazo y prevenir así posibles secuelas neurológicas en la descendencia ha dejado de ser un debate exclusivo de las sociedades científicas y empieza a generar un interés social en la población norteamericana61. El estudio de la función tiroidea en el primer trimestre de gestación requiere una única determinación en sangre, que se podría hacer de manera conjunta con el resto de la analítica del primer trimestre, y no precisa de otras exploraciones adicionales o de adiestramiento específico por parte del obstetra.
Respecto a las pruebas que pueden utilizarse para realizar el cribado, la concentración de TSH sigue siendo un marcador muy sensible de la función tiroidea, incluso durante la gestación14,62, aun considerando el efecto de la beta-human chorionic gonadotropin (β-HCG, «beta-gonadotropina coriónica humana» especialmente en el primer trimestre, que inducirá una disminución de la TSH, por lo que los valores de referencia (VR) también serán más bajos63. La T4L materna presenta algunas dificultades para su determinación precisa durante la gestación con las técnicas de inmunoensayo comúnmente utilizadas. Ello se debe a la interferencia que supone la modificación de las proteínas plasmáticas que se produce durante la gestación. No obstante, recientemente se ha comprobado que determinados inmunoensayos para T4L64 pueden tener una buena aproximación al patrón que ofrece la técnica de Tandem Mass Spectrometry, que a su vez ha demostrado tener una muy buena correlación con la de diálisis en equilibrio, considerada el gold standard, en los diferentes trimestres de la gestación65. También se ha apostado por la determinación de la T4 total (TT4), que se realiza mediante una metodología más robusta que la utilizada para la determinación de T4L. Su modificación durante la gestación es más previsible y parece que los VR establecidos en diferentes poblaciones podrían ser más comparables y probablemente más fiables que los de T4L, proponiéndose un cálculo rápido para obtener el VR de TT4 de la mujer gestante: bastaría con multiplicar por 1,5 el VR de la población no gestante63. El índice de T4L, prácticamente en desuso, es un buen método para situaciones en las que la concentración de globulina fijadora de tiroxina está alterada, como ocurre en la gestación66.
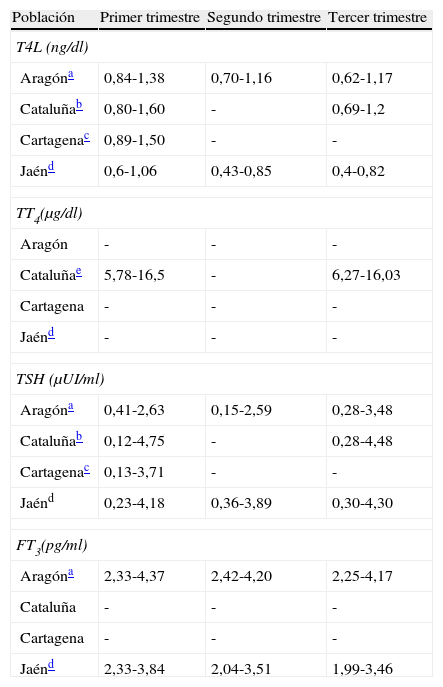
Dados los significativos cambios de las concentraciones de las hormonas tiroideas que se producen durante la gestación67, la determinación de los VR debería realizarse no solo para cada trimestre de la gestación, sino además para cada zona/población68 y con las técnicas propias, especialmente en el caso de la T4L. En España solo existen 4 trabajos publicados que indican los VR de sus respectivas poblaciones (tabla 2): en Aragón31, Cartagena69, Cataluña70 y Jaén71. La reciente guía de la ATA asume que ante la ausencia de VR locales, en el caso de la TSH, se considere el punto de corte en 2,5μUI/ml en el primer trimestre y de 3μUI/ml en el segundo y tercer trimestres12. El punto de 2,5μUI/ml no solo se elige por aproximarse al percentil 97,5, sino por haberse evidenciado una mayor morbilidad por encima de este5,72.
Valores de referencia de hormonas tiroideas de diferentes poblaciones de España
| Población | Primer trimestre | Segundo trimestre | Tercer trimestre |
| T4L (ng/dl) | |||
| Aragóna | 0,84-1,38 | 0,70-1,16 | 0,62-1,17 |
| Cataluñab | 0,80-1,60 | - | 0,69-1,2 |
| Cartagenac | 0,89-1,50 | - | - |
| Jaénd | 0,6-1,06 | 0,43-0,85 | 0,4-0,82 |
| TT4(μg/dl) | |||
| Aragón | - | - | - |
| Cataluñae | 5,78-16,5 | - | 6,27-16,03 |
| Cartagena | - | - | - |
| Jaénd | - | - | - |
| TSH (μUI/ml) | |||
| Aragóna | 0,41-2,63 | 0,15-2,59 | 0,28-3,48 |
| Cataluñab | 0,12-4,75 | - | 0,28-4,48 |
| Cartagenac | 0,13-3,71 | - | - |
| Jaénd | 0,23-4,18 | 0,36-3,89 | 0,30-4,30 |
| FT3(pg/ml) | |||
| Aragóna | 2,33-4,37 | 2,42-4,20 | 2,25-4,17 |
| Cataluña | - | - | - |
| Cartagena | - | - | - |
| Jaénd | 2,33-3,84 | 2,04-3,51 | 1,99-3,46 |
Los valores reflejan los percentiles 2,5 y 97,5, respectivamente.
FT3: triyodotironina fetal; TSH: tirotropina; T4L: tiroxina libre; TT4: tiroxina total.
Análisis por inmunoensayo-quimioluminiscencia (Architect i2000, Abbott Diagnostics). Cálculo realizado en la población con anticuerpos antitiroideos negativos. No consta la nutrición de yodo de la población. Fuente: Bocos-Terraz et al.31
Análisis por inmunoensayo-quimioluminiscencia (ADVIA Centaur®, Bayer). Cálculo realizado en población con anticuerpos anti-TPO negativos. La mediana de yoduria de la población en el primer trimestre era de 163μg/l. En este estudio se incluye el valor del percentil 10 para la T4L (0,86μg/dl en el primer trimestre y 0,80μg/dl en el tercer trimestre). Fuente: Vila et al.70
Análisis por inmunoensayo-quimioluminiscencia (Roche Diagnostics). Cálculo realizado en la población con anticuerpos antitiroideos negativos. No consta la nutrición de yodo de la población. Fuente: García de Guadiana Romualdo et al.69
Inmunoensayo-quimioluminiscencia (Beckman Access, Immuno Assay System). Se excluyen las mujeres con anticuerpos antitiroideos positivos. La mediana de yoduria en el primer trimestre era de 109,85μg/l, y tras suplementación, de 179 en el segundo y de 181,78 en el tercero. Fuente: Santiago et al.71
El cribado supondría: a) identificación de patología tiroidea que, de otro modo, permanecería desconocida73; b) normalización precoz de la función tiroidea materna5, y c) reducción de complicaciones perinatales asociadas a la hipofunción tiroidea materna (prematuridad, retraso de crecimiento intrauterino o muerte fetal)74.
La finalidad del diagnóstico prenatal es poder intervenir terapéuticamente en etapas cruciales del desarrollo. En este sentido, el objetivo más ambicioso del cribado de la función tiroidea en el primer trimestre de gestación es poder anticiparnos a situaciones irreversibles, aportando las cantidades adecuadas de yodo y/o tiroxina que permitan que el sistema nervioso central del feto se desarrolle en las mejores condiciones75. Berbel et al., al tratar precozmente con yoduro potásico a gestantes hipotiroxinémicas, logran la recuperación de la concentración de tiroxina y mejores resultados en los test de psicomotricidad de los hijos25. Según los resultados del estudio de Negro et al., sería necesario cribar y tratar a unas 40 mujeres para prevenir un único resultado adverso del embarazo76, situación realmente favorable si se compara con otros ensayos de intervención para otros problemas de salud como la hipercolesterolemia o la hipertensión20. Los resultados publicados en febrero de 2012 del estudio CATS8 indicarían que el tratamiento con LT4 de mujeres gestantes con HC, HSC o hipotiroxinemia aislada (HA) no supondría ningún beneficio a los hijos de estas en comparación con los de madres en la misma situación, pero no tratadas. Indudablemente, esta publicación es de un gran interés pero, al valorarla, deben considerarse 3 aspectos. El primero es que las mujeres inician el tratamiento con LT4 en el segundo trimestre, con lo que el período más crítico del neurodesarrollo del feto ya ha pasado, hecho que hace mucho menos probable que se observen efectos positivos. El segundo es que el estudio no compara las poblaciones de hijos de madres hipotiroideas (tratadas y no tratadas) con un grupo de hijos de madres eutiroideas. Haddow et al. sí lo hacen y observan cambios significativos7. La ausencia de esta comparación deja el interrogante de si el retraso en el diagnóstico y tratamiento puede haber dejado hijos de estas madres hipotiroideas con alguna disminución de su potencial neuropsicológico. No obstante, entre el 12,1 y 14,1% de los niños estudiados presentan un coeficiente de inteligencia (CI) inferior a 85. Un tercer aspecto a considerar es que el trabajo no aporta datos con respecto a los problemas obstétricos de estas mujeres y si el tratamiento con LT4 pudiera haber reducido su incidencia, como documentan otros estudios76,77. Así pues, el estudio de Lazarus et al. no permite descartar que el diagnóstico y tratamiento precoz (<10 semanas) de mujeres hipotiroideas pueda reducir el riesgo de hijos con menor CI así como la incidencia de complicaciones obstétricas.
Hay pocos estudios que evalúen si el cribado universal es coste-efectivo. Aun así, los pocos publicados van a favor de esta relación coste-efectividad. Thung et al. establecen un modelo en el que el cribado es coste-efectivo bajo el supuesto de que el tratamiento con tiroxina de las mujeres con HSC pudiera reducir la incidencia de hijos con CI<8574. Dosiou et al. concluyen que el cribado universal de los anticuerpos anti-TPO es coste-efectivo, incluso si se compara con el cribado de mujeres de alto riesgo73,78.
Argumentos en contra del cribado universalLa disfunción tiroidea durante la gestación como problema de saludEl cribado de la DT durante el embarazo puede detectar distintas situaciones, algunas de las cuales no tenemos la absoluta certeza de que deban calificarse de patológicas y, por tanto, cuyo tratamiento es, cuando menos, discutible.
Respecto al HC, diversos trabajos lo han relacionado de forma indiscutible con peores resultados intelectuales o neurocognitivos en la descendencia7, incremento de muerte fetal38,79 y otras complicaciones como hipertensión arterial o crecimiento intrauterino retardado79. Un cribado universal dirigido a detectar HC puede, por tanto, estar justificado. Son menos claras tanto la definición como la repercusión del HSC. En el estudio prospectivo de Casey et al.26, el HSC se asoció con parto prematuro (PP), abruptio placentae, más ingresos en Neonatología y más distrés respiratorio. Sin embargo, en una revisión sistemática sobre enfermedad tiroidea materna y PP80, solo el trabajo de Casey et al. había mostrado asociación con PP, y otros 2 estudios la relacionaron con bajo peso al nacer. Así pues, no se puede dar aún por establecida la asociación absoluta entre HSC y peores resultados obstétricos. Casey et al. afirman que hasta que no se demuestre que el tratamiento con tiroxina puede evitar un peor resultado obstétrico no está justificado el cribado universal81. Por último, el estudio prospectivo de Negro et al.76, en el que aleatorizan más de 4.000 mujeres a cribado universal o selectivo e inician tratamiento en los casos con TSH>2,5μUI/ml en el primer trimestre y anticuerpos anti-TPO positivos, no mostró diferencias entre el grupo de cribado universal y el de cribado dirigido respecto a evolución obstétrica y neonatal complicada o desfavorable. Esta conclusión por sí misma ya inclinaría la balanza hacia el cribado selectivo.
Otro potencial hallazgo del cribado es la HA, que en la práctica clínica está lejos de ser aceptada como una enfermedad tiroidea independiente27,82. En primer lugar cabría preguntarse por debajo de qué límites se considera HA, ¿los VR se basan en los determinados en población gestante y específicos para cada trimestre? Los trabajos de Pop et al.51,83 asocian la HA (<percentil 10) en el primer trimestre con peor rendimiento neuropsicológico de los hijos. Sin embargo, en los niños en que la T4L materna se normalizó espontáneamente en el segundo o tercer trimestres, o bien en aquellos en que teniéndola normal en el primer trimestre descendió posteriormente, no se confirmaron los hallazgos83. Tampoco Craig et al. asocian deficiencias neurocognitivas en hijos de madres con HA en el segundo trimestre de la gestación54. La discordancia con los resultados de Pop et al. podría relacionarse con los estrictos criterios de apareamiento que Craig establece. ¿Por qué la TSH no se incrementa en la HA, si es más elevada en gestantes con la sola presencia de positividad de anticuerpos anti-TPO aun con T4L normal84,85? Es conocido que en áreas yododeficientes pueden encontrarse valores bajos de T4L sin incremento de TSH86, lo que fundamentalmente se podría interpretar por el efecto del aumento del cociente T3/T41. ¿Qué ocurre en áreas no claramente yododeficientes? El estudio de Mitchell et al.87 observa que con una yoduria media de 134μg/l en gestantes, el CI se asoció solo con la TSH en los modelos multivariantes (y con la T4L, solo en modelos univariantes). Moleti et al.88 observan que un cuarto de sus gestantes habían tenido HA en algún momento del embarazo, sin que su causa, en áreas no yododeficientes, se comprenda en su totalidad. Se debe recordar que la T4L desciende progresivamente desde el inicio del segundo trimestre84,89, debiendo contemplarse otras interpretaciones más sistémicas sobre este descenso que la mera suficiencia yodada. En resumen, cuando se detectan mujeres con HA es difícil interpretar, por ahora y con certeza, que se trata de un cuadro patológico, y se plantean dudas sobre cuál debe ser la actitud a seguir, dado que por el momento no se ha demostrado que el tratamiento con tiroxina mejore el discreto peor rendimiento psicomotor de los hijos, que es, hasta la actualidad, la única comorbilidad descrita asociada a la HA en países no claramente yododeficientes. Por tanto, no parece justificado un cribado dirigido a la HA por el momento.
La autoinmunidad tiroidea positiva puede existir en alrededor de un 10% de gestantes90,91. Dos metaanálisis la han asociado a PP o a abortos90,92, aunque no se ha confirmado esta asociación en otros80. En un trabajo japonés93 en el que se determinan 7 tipos de autoanticuerpos, excluyendo los anticardiolipina, se observa que los PP fueron similares en el grupo control que en mujeres con algún anticuerpo positivo o con antimicrosomales positivos. Una revisión reciente94 indica que, además de los anticuerpos antifosfolípido, otros anticuerpos se han relacionado con pérdidas recurrentes de embarazo: antiprotrombina, antinucleares, antilaminina, antigliadina, antitransglutaminasa, anti-TPO, y combinaciones de ellos. No se conoce con certeza el mecanismo por el cual la autoinmunidad tiroidea podría inducir problemas obstétricos, aunque se ha sugerido la posibilidad de que puedieran coexistir anticuerpos antirreceptor de TSH que bloquearían la acción de la β-HCG95. No obstante, no se puede descartar que se trate simplemente de una asociación entre problemas obstétricos y otros autoanticuerpos, que en muchos trabajos no se hayan tenido en cuenta, o con la mayor edad de las mujeres con autoinmunidad tiroidea positiva92.
El hipertiroidismo franco se asocia con abortos, desprendimiento placentario, preeclampsia, PP, malformaciones, retraso de crecimiento intrauterino, bocio e hipertiroidismo fetal y neonatal96. Sin embargo, el hipertiroidismo gestacional (TSH baja con T4L normal o discretamente elevada y anticuerpos negativos) no se asocia a ninguna morbilidad fetal81. En un contexto de cribado universal, entre un 1,781 y un 3%84 de gestantes en el primer trimestre podrían ser diagnosticadas como tales, y aunque puede asociarse a hiperémesis gravídica, su tratamiento con antitiroideos podría producir complicaciones en el feto por el riesgo de inducir un descenso yatrógeno de la tiroxina. Así pues, el hipertiroidismo clínico puede tratarse con antitiroideos33, pero siempre con la precaución de mantener una T4L en el margen alto de la normalidad y evitar inducir una situación de déficit. El hipertiroidismo subclínico no se debe tratar5.
Consideraciones sobre el cribado de la disfunción tiroidea en gestantes sanasAnte la ausencia de VR de TSH específicos para la población gestante, y especialmente de T4L, se debe ser cauto a la hora de convertir en patológicas a las gestantes sanas de países no claramente yododeficientes, y más aún si se consideran los VR que suelen suministrar los kits comerciales que habitualmente se utilizan en la clínica. Una revisión francesa97 aplica diferentes criterios propuestos en la literatura médica para definir la hipotiroxinemia: para T4L<12pmol/l, el 41% de sus gestantes serían patológicas, y para T4L<10,3pmol/l, el 10%, y si consideramos el HSC, con una TSH>2,5μUI/ml el 26,3% de su población gestante estaría en situación de hipotiroidismo; como en otras series de mujeres gestantes, no se encontró ninguna asociación de los test de función tiroidea con la yoduria. Los autores concluyen que el amplio rango de hipotiroxinemia y prevalencia de HSC debería disparar la reflexión crítica sobre las concentraciones diagnósticas. Lo cierto es que los VR para la TSH en el primer trimestre de gestación no están claramente establecidos y que presentan cambios relevantes según la semana en que se determinen62,85,98 y el tipo de población, aun utilizando el mismo método de análisis68. Según distintos trabajos, el percentil 2,5 en el primer trimestre puede oscilar de 0,02 a 0,05μUI/ml98,99 y los percentiles 97,5 y 98 entre 2,15-2,3 y 3,61-4μUI/ml85,98–100.
Respecto a la T4L materna, debe añadirse que las técnicas de inmunoensayo habitualmente empleadas pueden verse interferidas en situaciones en las que se modifican las proteínas transportadoras y sus propiedades de ligando, tal como ocurre durante la gestación, como ya se ha comentado. La concentración de T4L es especialmente baja en el tercer trimestre de la gestación respecto a la población de mujeres no embarazadas, pudiéndose establecer una sobreestimación de hipotiroxinemia con las técnicas de inmunoensayo66. Algunos autores afirman que no hay ningún valor absoluto de T4L que pueda definir la hipotiroxinemia con estas técnicas101. Se ha comprobado que el método más preciso para analizar la T4L en estas situaciones es el de diálisis en equilibrio, que realiza una determinación directa de la hormona102. Sin embargo, es un método muy laborioso y caro que hace difícil su utilización en la clínica diaria. En los últimos años se ha desarrollado la técnica de Tandem Mass Spectrometry, que ha demostrado tener una muy buena correlación con la de diálisis en equilibrio durante la gestación65, a diferencia de las técnicas de inmunoensayo que, además, presentan una gran variabilidad entre los diferentes métodos existentes102.
Potenciales beneficios del cribado de la función tiroidea y tratamiento de la disfunción tiroidea en la mujer gestanteLos beneficios del tratamiento con tiroxina en el HC ya se han comentado7. Sin embargo, en el caso del HSC, no hay trabajos concluyentes. Una reciente revisión Cochrane103 concluye que ante la limitada evidencia referente al tratamiento de estos casos, es difícil justificar la implementación de un programa de cribado universal para detectar la DT en la población gestante.
En la autoinmunidad tiroidea sin hipotiroidismo, hasta ahora solo un trabajo77 ha descrito que la utilización de tiroxina pueda reducir el riesgo de PP. Sin embargo, otro trabajo reciente no observa cambios en las mujeres con anticuerpos anti-TPO positivos tratadas con tiroxina, aunque este estudio adolece de falta de grupo control104. Además, en otro estudio realizado en mujeres con anticuerpos anti-TPO positivos, bajo técnicas de reproducción asistida, estas no obtuvieron beneficios al ser tratadas con LT4105.
Respecto a la HA, ¿se podría normalizar con suplementación yodada? En población adulta no gestante, según los datos del NHANES III, la T4L no muestra ninguna asociación con la yoduria aislada o ajustada por creatinina106. Además, en mujeres en edad fértil y gestantes, la yoduria había descendido respecto a encuestas anteriores (de 320 a 145μg/l). La TSH y T4L no mostraron tampoco asociación con los cambios de yoduria107. En 4 trabajos prospectivos, la suplementación yodada frente a placebo no mostró diferencias en las concentraciones de T4L108. Solo en 2 trabajos25,109 se observa que el grupo control no suplementado tiene, en el tercer trimestre, T4L más baja que los grupos de tratamiento; en otro trabajo de intervención, por el contrario, se encuentran valores de T4L más bajos en el tercer trimestre y valores más elevados de TSH neonatal en mujeres suplementadas con 300μg de yodo que en controles55. Aunque otros parámetros de resultado como los obtenidos en el índice de desarrollo psicomotor puedan ofrecer argumentos favorables a la suplementación25,55, debe ponerse en tela de juicio que la T4L pueda ser un buen marcador de la respuesta a la suplementación yodada, en mujeres gestantes, por lo menos con las técnicas de medición actualmente disponibles en la práctica clínica. En sentido contrario, un reciente estudio de carácter observacional asocia una T4L más baja y peores resultados en test neurocognitivo en niñas, hijas de madres que recibieron suplementación con yoduro potásico durante la gestación110. Por último, según los argumentos comentados en este apartado, no parece que el beneficio del cribado supere a los posibles problemas que este puediera acarrear. Se podrían detectar situaciones de dudoso valor patológico, que crearían incertidumbre diagnóstica, terapéutica y pronóstica a la madre, al obstetra y al endocrinólogo. Ante ello, cabe adoptar una actitud prudente para evitar tratamientos con eficacia aún no probada sobre las morbilidades de la gestación y del feto, como el tratamiento con LT4 de la HA o la indicación de antitiroideos ante una interpretación incorrecta de las concentraciones inhibidas de TSH, durante el primer trimestre, que podría provocar hipotiroxinemias yatrogénicas con peor resultado patológico que aquellas que se pretenden evitar con el cribado. En resumen, y expuestas las reservas previas, incluso aunque se decidiera realizar un cribado universal en base a los beneficios esperados para el tratamiento del HC, sería obligado disponer primero de VR y desarrollar un programa formativo específico y dirigido a médicos de atención primaria, obstetras, internistas y también endocrinólogos no familiarizados con la DT en la gestación, con el objetivo fundamental de conseguir la abstención terapéutica en situaciones de valor patológico no probado.
Otro aspecto a considerar es que no existen estudios clinicoepidemiológicos de coste-beneficio del cribado universal. Los hasta ahora publicados son modelos teóricos73,74,78 que han sido cuestionados ante la ausencia de estudios prospectivos controlados que evalúen la efectividad del tratamiento con tiroxina111,112.
Consideraciones finalesA modo de resumen sobre los argumentos expuestos, y siguiendo los criterios de Beaglehole et al.18, se pueden expresar las siguientes consideraciones:
La disfunción tiroidea durante la gestación como problema de salud- 1.
Existen evidencias y acuerdo generalizado de que el HC no diagnosticado o mal controlado puede influir de forma negativa, entre otros aspectos, sobre la fertilidad, la evolución de la gestación y los resultados neurocognitivos en los hijos.
- 2.
Respecto al HSC existe más controversia en cuanto al aumento de la prematuridad y de abruptio placentae. Hay evidencias de que el HSC también podría afectar el intelecto de los hijos.
- 3.
Hasta la actualidad, se han descrito efectos perniciosos de la hipotiroxinemia sobre los hijos de las madres portadoras de esta condición durante la gestación. Sin embargo, un reciente estudio no observa ningún efecto relacionado con la hipotiroxinemia en el segundo trimestre.
- 4.
Los datos de la bibliografía apoyan que la autoinmunidad tiroidea podría también afectar la fertilidad, la prematuridad y ocasionar mayor riesgo de abortos. No obstante, la causalidad no está demostrada, ya que no podría descartarse totalmente la existencia de un efecto solapado con otros anticuerpos o que este estuviera relacionado con la mayor edad de las mujeres que también presentan más prevalencia de anticuerpos anti-TPO positivos.
- 5.
El hipertiroidismo clínico no controlado puede incrementar la morbilidad durante la gestación y causar un aumento de la prematuridad.
- 1.
La concentración de TSH sigue siendo un marcador muy sensible de la función tiroidea, incluso durante la gestación. Cabe considerar que los VR pueden ser más bajos por el efecto de la β-HCG, especialmente en el primer trimestre.
- 2.
La T4L materna presenta algunas dificultades para su determinación precisa con las técnicas de inmunoensayo comúnmente utilizadas. Ello se debe a las modificaciones de las proteínas transportadoras que se producen durante la gestación. La técnica de Tandem Mass Spectrometry es una buena alternativa en estos casos. No obstante, se ha comprobado que determinados inmunoensayos para T4L pueden ofrecer una buena aproximación al patrón que esta técnica ofrece.
- 3.
La TT4 puede determinarse mediante una metodología más robusta que la utilizada para la determinación de T4L. Su modificación durante la gestación es más previsible y parece que los VR establecidos en diferentes poblaciones podrían ser más comparables.
- 4.
Respecto a si el cribado es coste-efectivo, hay pocos estudios y, además, se basan en modelos teóricos. Hacen falta estudios prospectivos controlados que evalúen si el diagnóstico y posterior tratamiento de la DT, como consecuencia del cribado, es coste-efectivo.
- 1.
La determinación de los VR debería realizarse para cada trimestre de la gestación, en cada zona/población y con las técnicas propias, especialmente en el caso de la T4L. En España solo existen 3 trabajos publicados que indican los VR de sus respectivas poblaciones (tabla 2). La reciente guía de la ATA asume que ante la ausencia de VR locales, en el caso de la TSH se considere el punto de corte en 2,5μUI/ml en el primer trimestre y 3μUI/ml en el segundo y tercer trimestres.
- 2.
El diagnóstico del HC y del hipertiroidismo clínico debe comprenderse igual que en la población no gestante, con la salvedad de que es imprescindible disponer de VR específicos para la población gestante. De igual modo el HSC. Ante la falta de disponibilidad de VR propios, la ATA define esta situación frente a una TSH de 2,5 a 10μUI/ml con T4L dentro de los VR. Se debe ser muy cauto ante la valoración del descenso de TSH del primer trimestre y el diagnóstico de hipertiroidismo. También debe extremarse la prudencia ante el diagnóstico de HA, por la frecuente infraestimación de la T4L que se obtiene con algunas de las técnicas habitualmente empleadas.
- 3.
El aumento del riesgo de hipotiroidismo con la positividad de los anticuerpos anti-TPO obliga, en estos casos, a monitorizar la función tiroidea durante la gestación.
- 1.
Para garantizar una función tiroidea normal durante la gestación y la lactancia, la mejor prevención es una adecuada ingesta de yodo (250μg/día). De igual modo, es muy importante que exista una adecuda nutrición de yodo desde mucho antes del embarazo. Ello puede reducir el riesgo de DT durante la gestación. La sal yodada y también la leche contribuyen a alcanzar una buena nutrición de yodo.
- 2.
Hay evidencias de que el tratamiento precoz del HC (en las primeras semanas de gestación) consigue beneficios indiscutibles sobre la maduración del feto.
- 3.
Aun con la evidencia de los problemas que se asocian al HSC, hasta la actualidad, con la excepción del trabajo de Negro et al., no hay estudios prospectivos sobre los posibles efectos beneficiosos del tratamiento con LT4. El reciente estudio CATS inicia el tratamiento en el segundo trimestre. Todo ello dificulta dar una recomendación general, aunque la valoración clínica debe guiar la posible intervención. El tratamiento se puede indicar si al HSC se asocia la positividad de anticuerpos anti-TPO.
- 4.
Ya se ha discutido la dificultad de la valoración de la HA, pero de confirmarse, en un entorno de yododeficiencia, las pacientes pueden beneficiarse de un adecuado aporte de yodo.
- 5.
El hipertiroidismo clínico puede tratarse con antitiroideos, pero con cautela y procurando mantener una T4L en el margen alto de la normalidad y evitar inducir una situación de déficit. El HSC no se debe tratar.
- 6.
Es discutible tratar con LT4 a mujeres gestantes eutiroideas con anticuerpos anti-TPO positivos. No obstante, si se asocia a un HSC, el tratamiento con LT4 puede reducir el riesgo de complicaciones obstétricas.
En el año 2010 hubo en España 486.575 nacimientos113. La prevalencia de HC no conocido en población gestante se estima entre el 0,3-0,5%12, pudiendo ser muy superior24,29. Asumiendo que esta prevalencia sea aplicable también a población española, durante el año 2010, el número de mujeres embarazadas en España afectadas de esta patología y no diagnosticadas podría haber oscilado entre 1.453 y 2.420. Del total de nacimientos, 155.943 pertenecían a mujeres de menos de 30 años, y de estas, el 20% podrían padecer algún criterio que justificara el cribado76. De las 124.754 restantes, a las que no habría que hacer cribado según la ATA12, entre 374 y 624 podrían padecer un HC que no sería diagnosticado, cifra que podría llegar a casi 2.000 si se considera la prevalencia detectada por Menéndez et al.24. Hay total unanimidad y acuerdo en la necesidad de tratar con LT4 a estas mujeres, recomendación que sostiene la ATA12 con un nivel de evidencia máximo. En 2010, no haber realizado el cribado en dicha población pudo haber dejado entre 500 y 2.000 mujeres sin diagnóstico ni tratamiento del HC. Aunque faltan más estudios que analicen el coste-beneficio o coste-efectividad del cribado del HSC, en el caso del HC, por ser una enfermedad relativamente frecuente, con riesgos bien conocidos tanto obstétricos como para los hijos, que es de diagnóstico sencillo y barato y que tiene un tratamiento seguro y también barato, es fácil pensar que un estudio coste-beneficio obtendría resultados positivos y, ante la falta de los mismos, la no realización de cribado parece una decisión poco ética y difícil de asumir por un clínico. En este sentido, un cribado poblacional del HC en las gestantes, seguido del tratamiento oportuno, evitaría los riesgos mencionados y mejoraría la salud de un número no insignificante de mujeres y de sus hijos. Por todo ello, la SEEN (Grupo de Trabajo de Trastornos por Deficiencia de Yodo y Disfunción Tiroidea) y la SEGO consideran que el cribado de la función tiroidea durante la gestación está justificado para la detección y el tratamiento precoz del HC.
Recomendaciones de la Sociedad Española de Endocrinología y Nutrición (Grupo de Trabajo de Trastornos por Deficiencia de Yodo y Disfunción Tiroidea) y de la Sociedad Española de Ginecología y ObstetriciaGrados de recomendación basados en el Scottish Intercolegiate Guidelines Network (SIGN)114.
- 1.
El cribado de la DT en la población gestante estaría justificado para detectar HC e iniciar un tratamiento precoz (<10 semanas). Este debería realizarse preferiblemente en la preconcepción, si es posible, o al inicio de la gestación (SIGN: B).
- 2.
No estaría justificado un cribado para la detección del HSC o HA, situaciones en las que aún no hay suficiente evidencia científica que demuestre el beneficio de un ulterior tratamiento con LT4 (SIGN: C).
- 3.
Debe garantizarse una adecuada ingesta de yodo a toda la población, especialmente a las mujeres en edad fértil, a todas las embarazadas y las lactantes. En estos últimos grupos la ingesta recomendada de yodo es de 250μg/día. En poblaciones yododeficientes la suplementación con 150-200μg de yodo permite alcanzar la ingesta recomendada. Idealmente un aporte suficiente de yodo tendría que garantizarse ya en situación preconcepcional (SIGN: B).
- 4.
Para el cribado al inicio de la gestación basta con la determinación de la concentración de TSH. Analizar la T4L o la TT4 solo estaría justificado si la TSH estuviese alterada (SIGN: B).
- 5.
Es imprescindible disponer de los VR de estas hormonas para cada trimestre y población, determinadas mediante las técnicas de laboratorio propias (ν).
- 6.
Ante la dificultad que, a menudo, entraña la interpretación de los resultados de los análisis de las hormonas tiroideas durante la gestación, es de interés desarrollar programas formativos a médicos de atención primaria, obstetras, internistas y también endocrinólogos no familiarizados con la DT en la gestación, dirigido fundamentalmente a la abstención terapéutica en situaciones de valor patológico no probado. El trabajo multidisciplinar entre estos grupos de profesionales es imprescindible para mejorar el abordaje de la patología tiroidea en la población gestante (ν).
Los autores declaran no tener ningún conflicto de intereses.
Arena, Jose; Ares, Susana; Arrizabalaga, Juan José; Arrobas, Teresa; Bandrés Nivela, María Orosia; Berbel, Pere; Bezanilla López, Carolina; Caballero, Águeda; de la Vieja Escolar, Antonio; Donnay Candil, Sergio (coordinador del Grupo de Trabajo de Trastornos por Deficiencia de Yodo y Disfunción Tiroidea); Espada, Mercedes; García Fuentes, Eduardo; Gonzalez Mateo, Carmen; Gentil, Alfonso; Iglesias Reymunde, Teresa; Lucas, Anna; Muñoz Marquez, Jose; Menendez, Edelmiro; Millon Ramirez, Maria del Carmen; Moll Mascaró, Gracia; Morales, Francisco; Moreno, Jose Carlos; Pineda Arrivas, Jose Javier; Puig-Domingo, Manel; Riestra, María; Santiago, Piedad; Santiesteban, Pilar; Soriguer, Federico; Torres Costa, María Teresa; Tortosa, Frederic; Velasco, Inés; Vich Sastre, Francisca; Vila, Lluís; Wengrowicz, Silvia.
Los nombres de los componentes del grupo están relacionados en el anexo 1.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente de forma íntegra en Medicina Clínica (Med Clin [Barc], con el doi correspondiente).
Avalado por la Sociedad Española de Endocrinología y Nutrición (SEEN) y la Sociedad Española de Ginecología y Obstetricia (SEGO).