La endomicroscopia láser confocal con sonda permite obtener imágenes de alta resolución de la mucosa del tracto gastrointestinal ya que deja integrar la visión macroscópica y microscópica en tiempo real. Este artículo presenta la primera experiencia en México en una serie de casos con esófago de Barrett documentado con diagnóstico histopatológico y comparados con las imágenes obtenidas por medio de la sonda confocal.
Probe-based confocal laser endomicroscopy produces high resolution images of the gastrointestinal tract and can integrate macroscopic and microscopic views in real time. This article presents a number of documented cases of Barrett's oesophagus with a histopathological diagnosis, and compares them with the images obtained by probe-based confocal laser endomicroscopy.
El esófago de Barrett (EB) se define como el cambio del epitelio escamoso normal por un epitelio columnar con presencia de células caliciformes; este cambio también es conocido como metaplasia intestinal1. Las guías de vigilancia para el manejo de pacientes con EB mencionan la toma de biopsias dirigidas de lesiones visibles, seguida por biopsias al azar de los 4 cuadrantes cada 2cm (protocolo de Seattle)2. No obstante, este método tiene varias desventajas, entre ellas el consumo de tiempo y costos debido al número de biopsias por analizar.
En un intento por reducir tiempo y costos se han desarrollado nuevas herramientas para auxiliar a los endoscopistas. La endomicroscopia láser confocal (EC) es una nueva modalidad endoscópica, que permite obtener imágenes de alta resolución en tiempo real de la mucosa del tracto gastrointestinal que hace posible integrar la visión macroscópica y microscópica3.
ObjetivoDescribir la correlación entre los hallazgos endoscópicos, histopatológicos y de endomicroscopia confocal en 4 pacientes con EB.
Material y métodosEste estudio se realizó en el Departamento de Endoscopia Gastrointestinal en el Instituto Nacional de Ciencias Médicas y Nutrición «Salvador Zubirán» durante los meses de mayo y junio del 2014. Todas las endoscopias fueron hechas con endomicroscopia confocal con sonda, previo consentimiento informado por el paciente y bajo sedación por el servicio de anestesiología. Las endoscopias fueron realizadas por un único endoscopista (RBZ) con experiencia en el diagnóstico y manejo endoscópico del EB. Inicialmente, se llevó a cabo una endoscopia con luz convencional y cromoendoscopia digital con NBI con un endoscopio de alta definición (Olympus GIF-160Z, Tokio, Japón); posteriormente se introdujo a través del canal de trabajo la sonda GastroFlex UHD para EC (Cellvizio, Mauna Kea Technologies, París, Francia) previa aplicación intravenosa de 1ml de fluoresceína al 10%; y con la sonda colocada de manera fija y paralela a la mucosa esofágica, los focos sospechosos identificados en la endoscopia inicial fueron caracterizados y clasificados en epitelio normal, metaplasia de Barrett o displasia de acuerdo a la clasificación de Miami (tabla 1). Los criterios de EC utilizados para catalogar a los pacientes se muestran en la tabla 2.
Clasificación de Miami para esófago de Barrett
| Epitelio escamoso normal | Células planas sin criptas o vellosidades |
| Vasos brillantes sin papilas | |
| EB sin displasia | Arquitectura vellosa uniforme |
| Células columnares | |
| Células caliciformes oscuras | |
| Displasia de alto grado | Estructuras vellosas |
| Borde epitelial engrosado oscuro, irregular | |
| Vasos dilatados irregulares | |
| Adenocarcinoma | Estructura desorganizada/pérdida de vellosidades |
| Células columnares oscuras | |
| Vasos dilatados irregulares |
Fuente: Wallace et al.22.
Características basales de pacientes
| Caso | Edad, años | Sexo | Clasificación de Praga | Resultado histológico previo | Tratamiento previo |
|---|---|---|---|---|---|
| 1 | 45 | M | C3 M5 | DAG y DBG | REM |
| 2 | 39 | F | C1 M2 | SD | Vigilanciaa |
| 3 | 81 | M | C5 M6 | DBG | Vigilanciaa |
| 4 | 63 | F | C5 M6 | DBG | Vigilanciaa |
C: circunferencia; DAG: displasia de alto grado; DBG: displasia de bajo grado; F: femenino; M: longitud máxima; M: masculino; REM: resección endoscópica de mucosa; SD: sin displasia.
Fuente: Wang y Sampliner2.
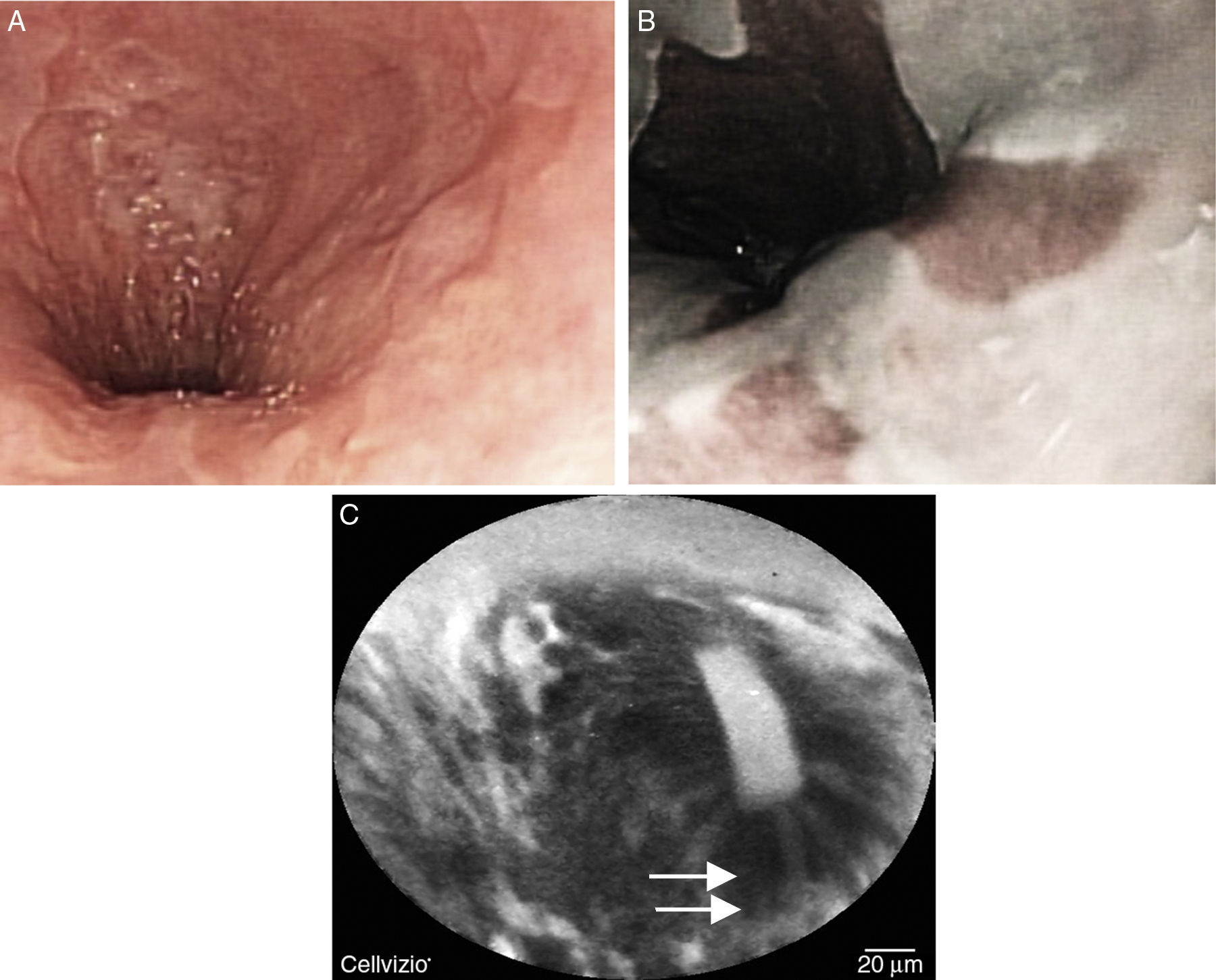
Un hombre de 45 años de edad con EB con clasificación de Praga C3 M5 con diagnóstico histopatológico de displasia de bajo grado (DBG) hace un año, se realizó panendoscopia de alta definición con cromoendoscopia digital con NBI de control a los 6 meses. En esta endoscopia se visualizó un área plana bien delimitada a los 35cm de la arcada dentaria superior (ADS), y otra área nodular a los 37cm de la ADS bien delimitada de aproximadamente 1cm de diámetro (fig. 1A), esto se corroboró con EC en donde se observaron glándulas irregulares y desorganización celular, imágenes compatibles con displasia dentro de la metaplasia intestinal (fig. 1B). Esto se confirmó por el servicio de patología como DBG a los 35cm de la ADS, además un foco a los 37cm de la ADS de displasia de alto grado (DAG). En un segundo tiempo, estas áreas de DBG y DAG fueron tratadas con resección endoscópica de la mucosa con el paquete REM de Olympus (Olympus EMR Kit; Olympus America Inc., Center Valley, PA, EE. UU.). El reporte histopatológico confirmó resección completa de las zonas de DBG y DAG con márgenes libres.
A) Imagen endoscópica de esófago de Barrett con lesión focal nodular; en la cromoendoscopia con NBI con magnificación se observa patrón glandular tubular con irregularidad del patrón vascular. B) Endomicroscopia confocal con sonda que muestra mucosa con arquitectura vellosa, el epitelio es irregular y se encuentra engrosado (asterisco). Se visualizan algunas células caliciformes (flecha gruesa) y vasos tortuosos (flecha delgada).
El tiempo de duración total del estudio fue de 32min de los cuales la EC consumió 9min. Actualmente el paciente lleva 16 meses de seguimiento y 4 endoscopias de seguimiento, de las cuales 2 han sido para tratamiento con ablación por radiofrecuencia. Sus últimas biopsias reportaron EB sin displasia (tabla 3).
Comparación de hallazgos endoscópicos con endomicroscopia láser confocal y diagnóstico histopatológico
| Caso | Hallazgos endoscópicos | Histopatológico | Tx | ||
|---|---|---|---|---|---|
| Luz convencional | Cromoendoscopia digital | EC con sonda | |||
| 1 | Dos zonas elevadas a 37 y 35cm ADS | Patrón glandular tubulovelloso, hipervascularidad | Displasia presente | EB DAG | REM+ARF |
| 2 | Metaplasia intestinal | Patrón glandular oval, vascularidad conservada | Sin displasia | EB SD | Vigilanciaa |
| 3 | Zona nodular a 30 y 31cm ADS | Patrón glandular tubular, vascularidad conservada | Sin displasia | EB SD | Vigilanciaa |
| 4 | Zona nodular a 24 y 26cm ADS | Patrón glandular tubular, hipervascularidad | Displasia presente | EB DBG | ARF |
ADS: arcada dentaria superior; ARF: ablación por radiofrecuencia; DAG: displasia de alto grado; DBG: displasia de bajo grado; REM: resección endoscópica de mucosa; SD: sin displasia.
Fuente: Wang y Sampliner2.
Paciente femenino de 39 años de edad con diagnóstico confirmado de EB sin displasia desde hace 7 años. Ella cuenta con antecedente de enfermedad por reflujo gastroesofágico con adecuada respuesta a inhibidores de bomba de protones, por lo que se realizó funduplicatura de Nissen hace un año. Al momento del estudio se encontraba asintomática. Acudió a su panendoscopia de seguimiento, la cual se realiza con un endoscopio de alta definición (Olympus GIF-160Z, Olympus América de México, S.A. de C.V. Miami, FL, EE. UU.) con cromoendoscopia digital con NBI en donde se documentó EB con clasificación de Praga C1 M2, con patrón glandular oval y patrón vascular regular; posteriormente se realizó EC con sonda, revelando células cilíndricas con borde en cepillo, bien organizadas, el patrón vascular se observó regular sin dilataciones, todo ello compatible con EB sin displasia de acuerdo a los criterios de Miami (fig. 2A-C). Las biopsias confirmaron el diagnóstico de EB sin displasia.
El tiempo de duración total del estudio fue de 28min de los cuales la EC consumió 7min Actualmente la paciente lleva 12 meses de seguimiento y tendrá su próxima endoscopia en 3 años.
Caso 3Paciente masculino de 81 años con antecedente de cáncer de ampolla de Vater tratado con procedimiento de Whipple hace 12 años. Cuenta con diagnóstico de EB con DBG a los 30 y 31cm de la ADS con clasificación de Praga C5 M6 desde hace 6 meses; al momento de su estudio el paciente refirió 3 episodios de regurgitación ácida y un episodio de pirosis por semana. Se realizó endoscopia de seguimiento con endoscopio de alta definición (Olympus GIF-160Z, Olympus América de México, S.A. de C.V. Miami, FL, EE. .UU.). Se visualizó mucosa asalmonada sin observar una lesión focal, posteriormente se realizó cromoendoscopia digital con NBI, observando patrón glandular tubular y se introdujo sonda confocal con la que se vieron células cilíndricas con borde en cepillo y células caliciformes; el patrón vascular es regular, no se observa una zona clara de displasia (fig. 3A-C). Se toman biopsias de las zonas previamente documentadas con DBG (30 y 31cm de ADS) con reporte histopatológico de EB sin displasia.
A-B) Imagen endoscópica de esófago de Barrett con cromoendoscopia con NBI. C) Endomicroscopia confocal con sonda muestra mucosa con arquitectura vellosa uniforme; el epitelio regular. Se visualizan algunas células caliciformes (flecha gruesa) y vasos regulares sin tortuosidad (flecha delgada).
El tiempo de duración total del estudio fue de 25min de los cuales la EC consumió 8min Actualmente el paciente lleva 12 meses de seguimiento y una endoscopia de seguimiento con biopsias que reportaron EB sin displasia.
Caso 4Paciente femenino de 63 años de edad con EB con clasificación de Praga C5 M6 con DBG a los 24 y 26cm de ADS diagnosticada hace 6 meses, además presentó una estenosis esofágica simple a los 28cm de la ADS probablemente péptica, la cual se dilató en 3 ocasiones con dilatador hidroneumático CRE hasta 18mm Actualmente niega disfagia u otra sintomatología gastrointestinal. Se realizó panendoscopia de rutina con endoscopio de alta definición más cromoendoscopia digital con NBI (Olympus GIF-160Z, Olympus América de México, S.A. de C.V. Miami, FL, EE. UU.) donde se observó área de metaplasia intestinal con patrón glandular oval alternando con zonas de patrón tubular e hipervascularidad a los 24 y 26cm de la ADS; además se visualizó zona de estenosis a los 28cm de la ADS con una longitud menor de 2cm y que no obstruye la luz esofágica (fig. 4A-C); sin embargo no es posible franquearla; por lo que se realiza dilatación esofágica con dilatadores de Savary-Gilliard hasta 15mm de diámetro observando posdilatación con visión endoscópica desgarro mucoso. Posteriormente se introdujo sonda confocal, observando arquitectura celular desorganizada a los 24 y 26cm de la ADS, así como vasos dilatados en estas zonas, compatibles con DBG (fig. 4D). Se tomaron biopsias con diagnóstico histopatológico de DBG. En este caso en particular, se consideró que la paciente era candidata a resección endoscópica de la mucosa mas no a tratamiento de erradicación con ablación por radiofrecuencia; ya que la paciente cuenta con un factor de riesgo ya documentado que es la estenosis esofágica.
A-C) Imagen endoscópica de esófago de Barrett con estenosis simple y presencia de úlcera; en la cromoendoscopia con NBI con magnificación se observa patrón glandular tubular con irregularidad del patrón vascular. D) Endomicroscopia confocal con sonda que muestra mucosa con arquitectura vellosa irregular, epitelio engrosado y oscuro (asterisco). Se visualizan algunas células caliciformes (flecha gruesa) y vasos tortuosos (flecha delgada).
El tiempo de duración total del estudio fue de 36min de los cuales la EC consumió 11min Actualmente la paciente lleva 14 meses de seguimiento y 2 endoscopias de seguimiento. Las biopsias de estos procedimientos confirmaron EB sin displasia. Su próximo control endoscópico será en 3 años.
DiscusiónEn las últimas 4 décadas el EB ha incrementado su incidencia de manera alarmante hasta un 300%4-8. Se sabe que el EB está asociado a un incremento en el desarrollo de adenocarcinoma esofágico. El adenocarcinoma esofágico tiene una supervivencia pobre (menos del 5% a 5 años) y se cree que es secundario a un diagnóstico tardío, infiltración linfovascular temprana y baja vascularización del tejido, lo cual conlleva a una repuesta pobre a quimioterapia.
La endoscopia con luz blanca identifica el EB y otras anormalidades obvias de la mucosa (por ejemplo, nódulos, áreas elevadas o deprimidas) pero no distingue metaplasia intestinal de displasia u otro tipo de metaplasia (cardíaca u oxíntica)9. Como se mencionó anteriormente, las guías de vigilancia para el manejo de pacientes con EB recomiendan apegarse al protocolo de Seattle2. Este método para detectar displasia tiene varias fallas como son el consumo de tiempo, es costoso y no siempre es preciso, además solo se biopsia una pequeña fracción del EB (menos del 3.5% del total de la superficie de un segmento de 2cm de longitud)10. Esto se corroboró en un análisis detallado sobre especímenes de esofagectomía de pacientes con EB; el estudio reveló que en estas piezas de esofagectomía existían áreas focalizadas de DBG, áreas de DAG y adenocarcinoma11. Además, hasta un 40% de DAG se asoció a focos sincrónicos ocultos de adenocarcinoma después de una esofagectomía. Esto ha creado la necesidad de desarrollar nuevas tecnologías para la correcta evaluación del EB como son la endoscopia de alta definición12, cromoendoscopia digital13 y EC, ya sea con tecnología integrada en el endoscopio o a través del canal de trabajo con sonda14.
Desde del 200415, cuando apareció el primer estudio in vivo, la EC ha mostrado ser útil en distintas enfermedades del tubo digestivo, entre ellas, el EB. Para obtener estas imágenes de alta definición, la EC requiere la administración intravenosa de un contraste previo a la realización del estudio con un agente como la fluoresceína, el cual ha demostrado ser seguro en varios estudios16–18. En un estudio prospectivo19 se evaluaron 156 lesiones esofágicas sospechosas, la EC determinó con gran exactitud la presencia de EB (sensibilidad del 98.1% y especificidad del 94.1%) y neoplasia asociada (sensibilidad del 92.9% y especificidad del 98.4%). Otro estudio prospectivo20, el cual incluyó a 36 pacientes, comparó el rendimiento de las biopsias aleatorias contra las biopsias dirigidas por EC. El rendimiento diagnóstico se incrementó un 18% en el caso de las biopsias aleatorias comparado con un 34% en el caso de las biopsias dirigidas con EC. Más recientemente, la sonda confocal obtuvo resultados prometedores con un valor predictivo negativo, valor predictivo positivo, sensibilidad y especificidad no despreciables (98.8, 44, 80 y 94%, respectivamente), además presentó un aceptable acuerdo interobservador (kappa=0.6)21. Sin embargo, un elemento esencial para cualquier nueva tecnología de imagen es la estandarización de indicaciones, terminología, categorización de imágenes y prioridades de investigación, es por eso que se creó el sistema de clasificación de Miami, llevándose a cabo en Miami, Florida en 2009; esta clasificación está basada en un consenso para los usuarios de sonda confocal22.
En este trabajo, presentamos una serie casos que describen el uso de la EC con sonda comparado con endoscopia con luz convencional. De acuerdo a nuestros resultados fue posible precisar con mayor exactitud las zonas más afectadas por EB y, de esta manera, realizar biopsias dirigidas de dichas lesiones, reduciendo tiempo y costos de los procedimientos.
Una limitación de nuestro trabajo es el reducido número de pacientes; sin embargo, este trabajo representa el primer reporte del uso de esta tecnología en nuestro país. Anteriormente, de acuerdo a 2 estudios mexicanos23,24, la prevalencia de EB en México iba del 1.3-1.6%. Sin embargo, Bernal et al.25 recientemente presentaron en la Semana Americana de Gastroenterología un trabajo realizado en el INCMNSZ el cual incluyó 43,639 endoscopias realizadas en el periodo de 2002 a 2012, donde se incluyeron 420 pacientes con diagnóstico histopatológico de EB; es decir, una prevalencia de 9.6 endoscopías con EB por cada 1,000 endoscopias realizadas. De estas, el 19.3% de los pacientes presentaron algún tipo de displasia o cáncer. Por ello podríamos considerar la EC una aplicación viable en el diagnóstico de EB en nuestro medio.
ConclusionesLa endomicroscopia con láser confocal es una herramienta útil en el seguimiento y manejo en los pacientes con EB. Aún faltan estudios para determinar la aplicabilidad y eficacia de la EC en EB.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoNo se recibió ningún patrocinio para la publicación de este artículo
Conflicto de interesesLos autores declaran que no existen conflicto de intereses