La hidradenitis supurativa, también conocida como hidrosadenitis supurativa o acné inversa, es una dermatosis inflamatoria crónica, que se caracterizada por la presencia recurrente de nódulos, abscesos y trayectos fistulosos, afectando principalmente a pliegues anatómicos. Este cuadro puede cursar por brotes y progresar a un estado inflamatorio crónico con formación de tractos fibrosos y cicatrices hipertróficas.
En los últimos años se han publicado varios casos que sugieren la posible asociación entre esta enfermedad y la enfermedad inflamatoria intestinal. Este hecho resulta de importancia, dado que en algunos casos la hidradenitis supurativa se manifiesta en la región glútea y perianal, pudiendo ser confundida con la variante perianal de la enfermedad inflamatoria intestinal.
En el presente artículo se pretende analizar las características que definen a la hidradenitis supurativa, así como su asociación con la enfermedad inflamatoria intestinal.
Hidradenitis suppurativa, also called acne inversa, is a chronic inflammatory dermatosis characterized by recurrent presence of nodes, abscesses and fistula tracts that mostly affects sweat gland bearing areas. This condition may develop outbreaks and progress to a chronic inflammatory state with the formation of fibroid tracts and hypertrophic scars.
Over the last years several cases have been published that suggest an association between this illness and inflammatory bowel disease. This is a relevant fact because in some cases hidradenitis suppurativa involves the anal and perianal area, which could lead to confusion with the perianal form of inflammatory bowel disease.
This article aims to analyze the characteristics that define hidradenitis suppurativa as well as its association with inflammatory bowel disease.
La hidradenitis supurativa (HS), también conocida como hidrosadenitis supurativa o acné inversa, es una dermatosis inflamatoria crónica, que se caracteriza por la presencia recurrente de nódulos, abscesos y trayectos fistulosos, afectando predominantemente las axilas, las ingles y la región anogenital, y en menor medida las nalgas, las mamas, el abdomen, la nuca y la región retroauricular. La HS puede cursar por brotes o progresar a un estado inflamatorio crónico, con formación de tractos fibrosos y cicatrices hipertróficas1,2.
En los últimos años se han publicado series de pacientes en diferentes países que confirman la asociación entre esta afección y la enfermedad inflamatoria intestinal (EII). Este hecho resulta de importancia, dado que en algunos casos la HS se manifiesta en la región glútea y perianal, pudiendo ser confundida con la variante perianal de la EII. A su vez, el digestólogo puede tener un importante papel en la detección precoz de la HS, lo que permitiría un tratamiento temprano por parte del dermatólogo.
En el presente artículo se pretenden analizar las características que definen a la HS, así como su asociación a la EII.
EpidemiologíaSe trata de un proceso inflamatorio crónico, con una prevalencia que afecta aproximadamente al 1% de la población3,4, cuyo comienzo se produce habitualmente tras la pubertad, generalmente al inicio de la tercera década, y suele permanecer activa durante la tercera y cuarta décadas de la vida. Además se ha observado que en las mujeres existe con frecuencia una mejoría tras la instauración de la menopausia, y por tanto suelen ser varones los pacientes que mantienen actividad de la enfermedad a partir de los 50 años5,6.
En relación con la distribución por sexos se ha observado que la HS es más frecuente en mujeres que en varones7. A partir de los datos de los estudios publicados se cuantifica que la ratio mujer:varón es de aproximadamente 3:1, oscilando los valores comunicados en algunos de los estudios más relevantes desde 2,6:18 a 3,3:19.
La HS se ha asociado desde el punto de vista epidemiológico a múltiples comorbilidades, recogidas en la Tabla 1, entre las que destaca la EII5,10–14.
Comorbilidades de la HS
| Enfermedad inflamatoria intestinal |
| Enfermedad de Crohn |
| Colitis ulcerosa |
| Enfermedades endocrino-metabólicas |
| Síndrome metabólico |
| Enfermedad de Cushing |
| Acromegalia |
| Enfermedades tiroideas |
| Síndromes de oclusión folicular |
| Acné conglobata |
| Celulitis disecante del cuero cabelludo |
| Sinus pilonidal |
| Trastornos genéticos asociados a oclusión folicular |
| Paquioniquia congénita |
| Enfermedad de Dowlin-Degos |
| Esteatocistoma múltiple |
| Enfermedades articulares |
| Espondiloartropatía |
| Enfermedades psiquiátricas |
| Depresión |
| Ansiedad |
| Dependencia de alcohol o drogas |
| Neoplasias |
| Epiteliomas cutáneos (carcinoma epidermoide) |
| Linfomas |
| Enfermedades dermatológicas |
| Pioderma gangrenoso (síndrome PASH) |
| Pitiriasis rubra pilaris |
| Acantosis nigricans |
| Paniculitis (eritema nodoso) |
| Enfermedad de Fox-Fordyce |
| Enfermedades renales |
| Síndrome nefrótico |
| Nefritis intersticial aguda |
| Otras |
| Anemia |
| Amiloidosis |
| Síndrome de ovario poliquístico |
| Enfermedad de Behçet |
| Síndrome de Sjögren |
| Síndrome PAPA |
| Síndrome SAPHO |
| Síndrome de Down |
| Síndrome queratitis-ictiosis-sordera |
De todas ellas destaca la asociación entre la HS y la EII. La existencia de una base patogénica común, la mayor o menor asociación, y las forma de presentación clínica, que en muchos casos puede ser confundida con manifestaciones extraintestinales de la enfermedad de Crohn (EC), hace que el conocimiento de esta enfermedad por parte del digestólogo resulte importante para optimizar el manejo del paciente.
Etiopatogenia de la hidradenitis supurativaLa HS es considerada en la actualidad una enfermedad inflamatoria del folículo pilosebáceo en la que subyace un desequilibrio del sistema inmunológico, en una persona predispuesta genéticamente. Se considera que sobre este paciente predispuesto actúan determinados factores exógenos desencadenantes o agravantes que modifican el curso de la enfermedad1.
Factores predisponentes de hidradenitis supurativaAspectos genéticosAproximadamente el 40% de los pacientes tiene familiares afectos. El patrón de herencia más frecuentemente observado es autosómico dominante. Los genes implicados se encuentran situados en los locus 1p21.1-1q25.31.
Se han descrito mutaciones inactivantes en los genes presenilina i (PSENI), potenciador de presinilina ii (PSENEN) y nicastina NCSTN en familias que presentaban formas clínicas graves y atípicas. Estos genes codifican 3 de las 4 subunidades de la γ-secretasa implicada en la vía de los receptores Notch. Estas mutaciones se han asociado con alteraciones epidérmicas y foliculares, con ausencia o alteración en la formación de las glándulas sebáceas en estudios en ratones15–17.
Interleuquina 1βSe demostró en muestra de tejido de las lesiones, y también en piel sana perilesional, una elevación significativa (31 veces superior), respecto a piel sana y significativamente más elevada en piel afecta de HS en comparación con la piel psoriásica. Existe además una correlación entre los niveles de interleuquina 1β (IL-1β) y la severidad de los síntomas18. Es significativa la mayor reducción en los valores de IL-1β con fármacos anti factor de necrosis tumoral-α (FNT-α) en comparación con el resto de IL proinflamatorias18. La IL-1β está implicada en la mayoría de procesos autoinflamatorios como en los síndromes SAPHO, PAPA, PAPASH y PASH, siendo esta citoquina la diana terapéutica de los antagonistas selectivos del receptor de la IL-1 (anakinra).
Factor de necrosis tumoral αAunque existe disparidad en los resultados en diferentes estudios, se ha demostrado una elevación de FNT-α y de su mARN en biopsias de piel lesional y sana perilesional, siendo estos valores hasta 5 veces más altos que en la psoriasis18,19 Se han relacionado los niveles de FNT-α en piel lesional con la severidad de la enfermedad20.
Microbioma y biofilmEl microbioma humano o flora microbiana normal está compuesto por el conjunto de microorganismos que viven en el ser humano de forma simbiótica. Las alteraciones en el microbioma se han relacionado con el desarrollo de enfermedades autoinmunes como la EII1,21. Se desconoce en la actualidad qué papel desempeña en el desarrollo de la HS la composición del microbioma.
Un biofilm está formado por un ecosistema microbiano organizado, conformado por uno o varios microorganismos adheridos a un sustrato, con características funcionales y estructuras complejas, formando una comunidad. Se caracteriza por la excreción de una matriz extracelular adhesiva protectora denominada biopelícula. Aunque desconocemos qué papel desempeña el biofilm en el desarrollo de la enfermedad, parece lógico entender que ante una colonización bacteriana, facilitada por el desequilibrio en los péptidos antimicrobianos (PAMs), encontremos un estímulo para la cascada inflamatoria y la producción de citoquinas a partir del reconocimiento de patógenos por los receptores Toll-like de los macrófagos1,21.
Factores desencadenantes- •
Tabaco. Aproximadamente del 70% al 88,9% de pacientes afectos de HS son fumadores22. La nicotina del tabaco estimula la sobreproducción de IL 10, como hemos indicado anteriormente, y se relaciona con la disfunción de la vía de señalización de la γ-secretasa y Notch16.
- •
La obesidad está considerada un factor exacerbante, más que desencadenante. El síndrome metabólico, al igual que en otros trastornos autoinmunes, parece estar relacionado de forma estadísticamente significativa con la HS. Además, influye en la irritación mecánica, la oclusión y la maceración23,24.
- •
Ropa ajustada. Las fuerzas de cizallamiento y fricción estimulan la aparición de lesiones por la rotura de los folículos.
- •
Desodorantes o depilación. Los irritantes actúan como exacerbantes de la enfermedad, no como desencadenantes25.
- •
Fármacos. Terapias como el litio, los anticonceptivos o la isotretinoína son tratamientos que pueden provocar exacerbaciones en los pacientes con HS1.
Las manifestaciones clínicas de la enfermedad son muy heterogéneas, pero se suele manifestar con lesiones inflamatorias, dolorosas y profundas que incluyen nódulos, fístulas y abscesos. Los dobles comedones son característicos y se han descrito en los pliegues de niños como posibles precursores de lesiones de hidradenitis supurativa1,2.
Los empeoramientos se asocian con aumento del dolor y de la supuración, y en mujeres, frecuentemente (40%), ocurren justo antes de la menstruación. 1,2.
La HS suele iniciarse en la 2.ª-3.ª décadas de la vida, aunque se han descrito casos de comienzo temprano en niños. Recientemente, el comienzo precoz de la enfermedad se ha asociado a una mayor susceptibilidad genética, con una historia familiar del 55% frente al 34% en los casos de comienzo pospuberal y una mayor extensión de las lesiones1,2.
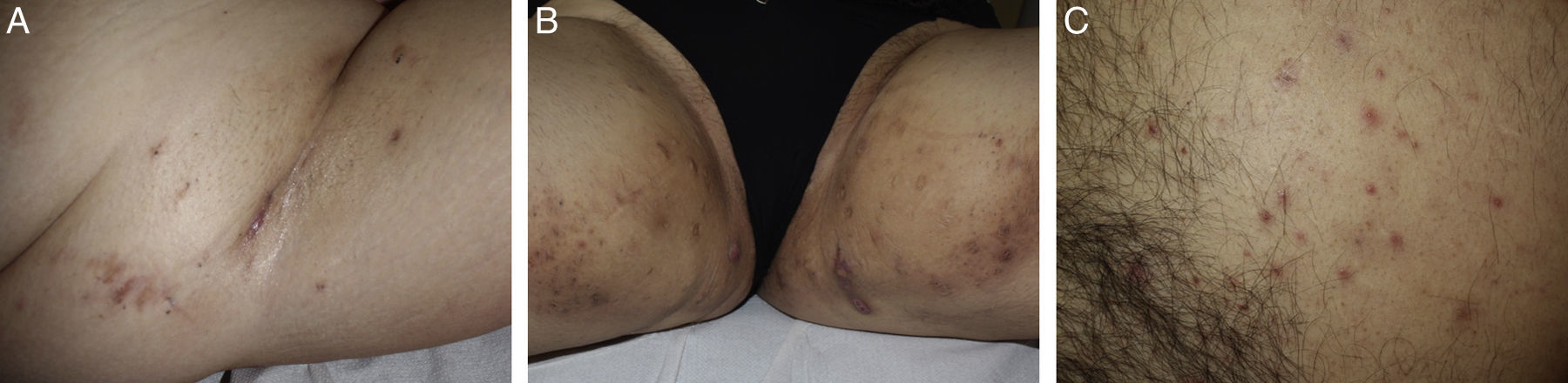
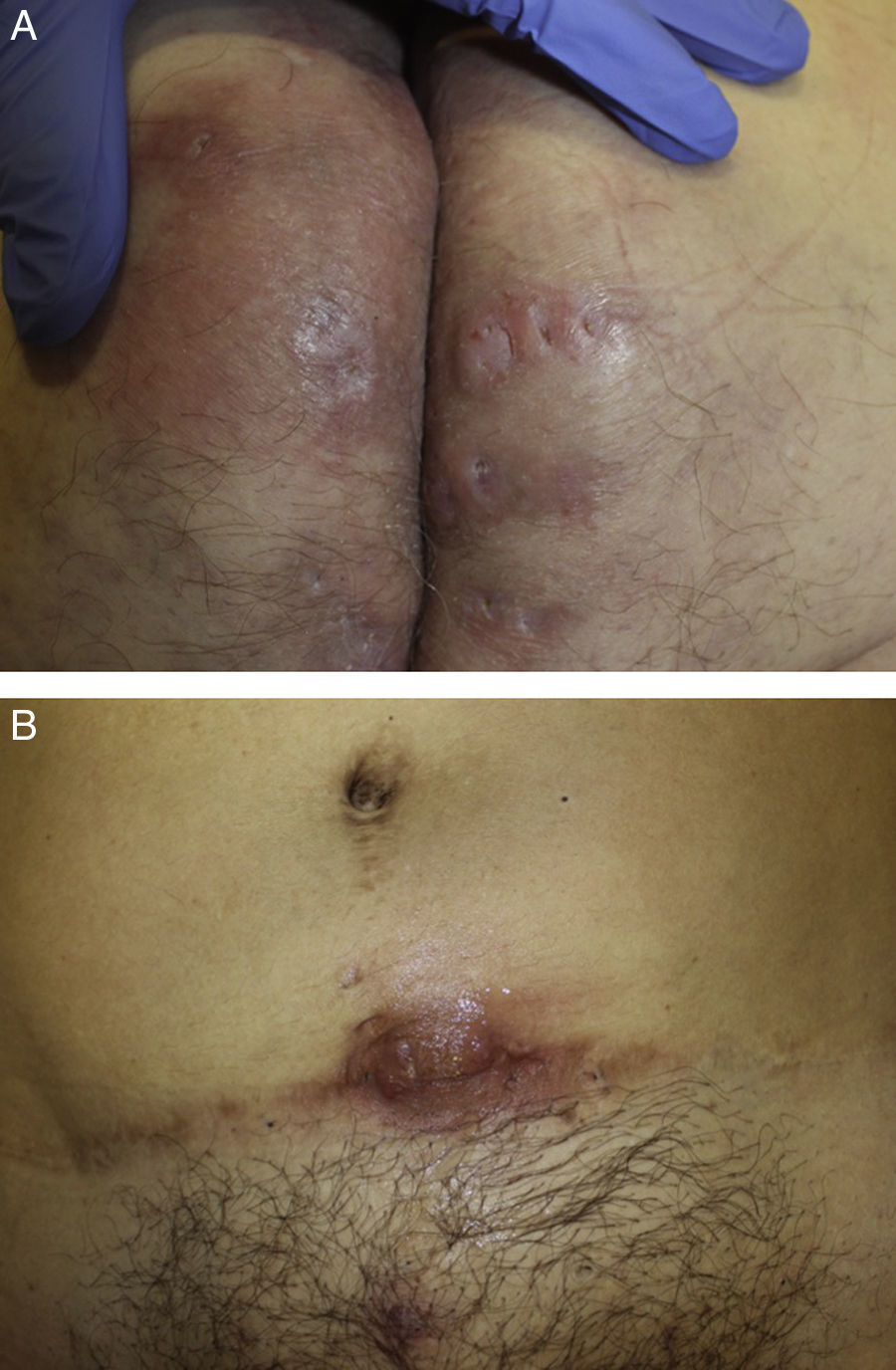
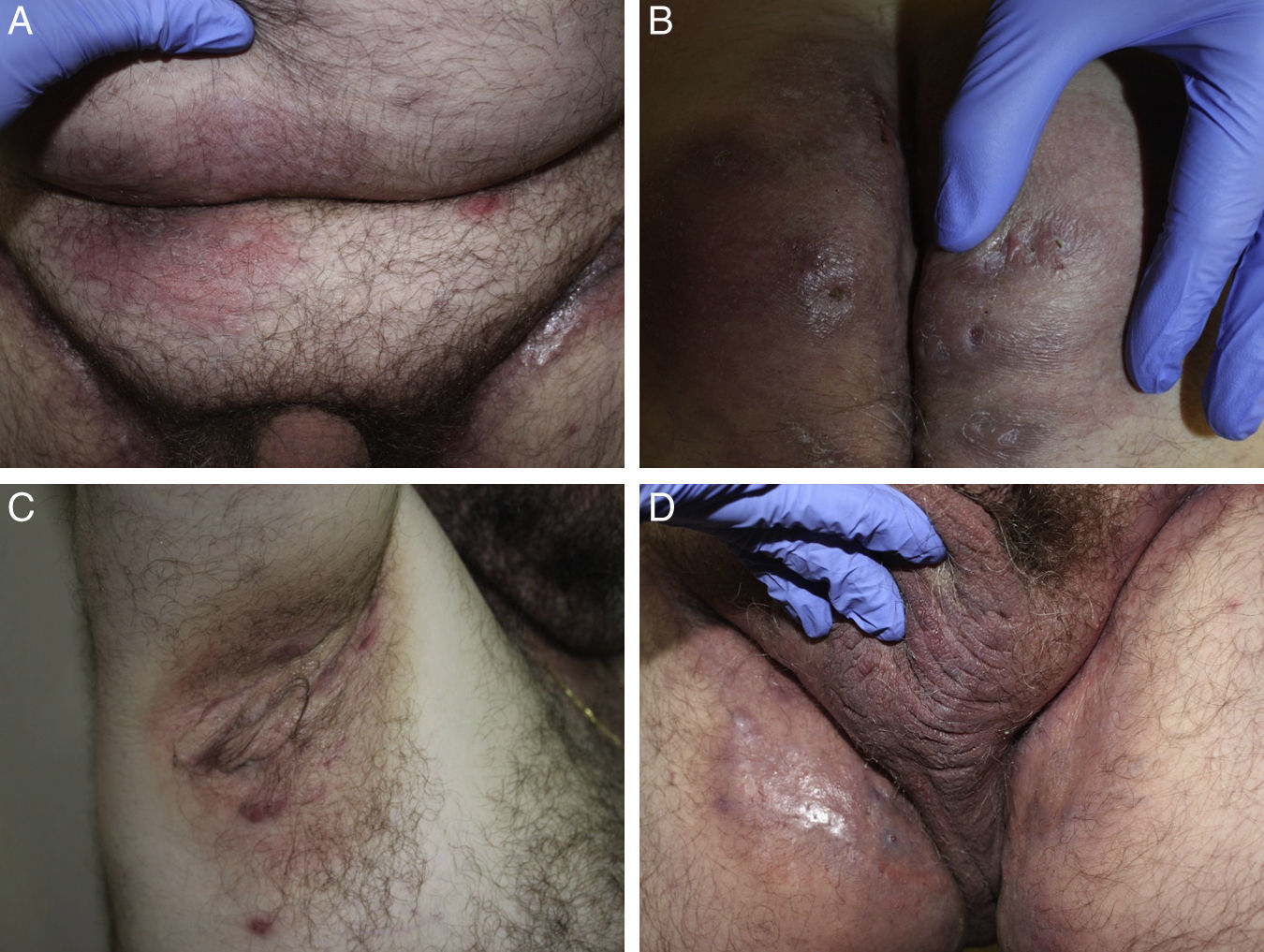
Las localizaciones más frecuentes son las axilas, las ingles, los glúteos y las áreas perianal, perineal, mamaria e inframamaria. Esta distribución de localizaciones varía por sexo, siendo en las mujeres más frecuentes la inframamaria, la axilar y la inguinal, mientras que en los hombres las zonas más habitualmente afectadas son la glútea, la perianal y las localizaciones atípicas (como la nuca y la retroauricular)1,2 (figs. 1–3).
La gravedad de la HS se evalúa de forma rutinaria siguiendo el sistema de clasificación de Hurley, que la divide en tres estadios. La definición de los mismos, así como la prevalencia de cada uno de ellos se incluyen en la tabla 2.1,26
En 2013 Canoui-Poitrine et al. definieron 3 fenotipos de pacientes con HS, los pacientes LC1 (axilo-mamaria) se caracterizaban por tener lesiones en las axilas y las mamas y más riesgo de cicatrices hipertróficas. En los pacientes LC2 (folicular), además, la enfermedad se localizaba en las orejas, el tórax, la espalda y las piernas y asociaban lesiones foliculares (sinus pilonidal y comedones), acné grave e historia familiar, siendo varones más frecuentemente, fumadores y su enfermedad era más grave. Por último, los pacientes LC3 (glútea), presentan lesiones eminentemente localizadas en región glútea, a modo de pápulas y lesiones foliculares, y característicamente los pacientes son delgados y la enfermedad tiene un comportamiento menos agresivo27.
Recientemente, se ha sugerido un nuevo fenotipo, la HS fulminante, más habitual en varones de origen afro-caribeño y que asociaría con frecuencia síntomas reumatológicos (artritis y/o espondilitis) y anemia5.
Desde el punto de vista histológico, la HS se define actualmente como una enfermedad folicular28,29. Von Laffert ha descrito los hallazgos microscópicos de 94 extirpaciones quirúrgicas de pacientes con HS30. La hiperqueratosis folicular se encontró en el 82%, la hiperplasia del epitelio folicular era evidente en el 77% y la perifoliculitis en el 68% de los casos. Otros hallazgos relevantes en este trabajo son la presencia de un infiltrado subepidérmico de células inflamatorias en las áreas de epidermis interfolicular (78%) y de una hiperplasia epidérmica psoriasiforme, con crestas epidérmicas de longitud similar (58%). La combinación de estas 2 últimas características histopatológicas estaba presente en el 36% de los especímenes estudiados. El análisis inmunohistoquímico del infiltrado inflamatorio perifolicular y subepidérmico reveló resultados muy similares, con presencia linfocitos, neutrófilos, células plasmáticas e histiocitos30.
Hidradenitis supurativa en el paciente con enfermedad inflamatoria intestinalAsociación entre hidradenitis supurativa y enfermedad de CrohnExisten múltiples estudios que confirman la existencia de una asociación entre la HS y la EII. De la misma forma, resulta evidente que ambos procesos inflamatorios guardan una serie de similitudes, recogidas en la tabla 3.
Análisis comparativo de características que definen a la HS y a la EII
| Crohn | Colitis ulcerosa | Hidradenitis supurativa | |
|---|---|---|---|
| Localización | Tracto gastrointestinal | Intestino grueso | Pliegues |
| Plano de inflamación | Transmural | Superficie epitelio | Dérmico profundo |
| Confluencia lesiones | Formación granulomas | Inflamación continua con abscesos | Lesiones continuas |
| Cicatrización | Sí | No | Sí |
| Fístulas | Sí | No | Sí |
| Influencia del tabaco | Sí | Sí | Sí |
| Cronicidad | Sí | Sí | Sí |
| Predisposición genética | Sí | Sí | Sí |
| Respuesta a anti-TNF | Sí | Sí | Sí |
Así, en un estudio de 679 casos con EII seguidos durante a una media de 19,8 años, se identificaron 8 casos con HS (edad media, 44,4±8,3 años; 7 mujeres; 6 casos pacientes obesos)31. Comparado con la población general, la tasa de incidencia de HS en EII fue de 8,9 (intervalo de confianza del 95%, 3,6-17,5). La incidencia acumulada a los 10 y a los 30 años de HS fue de 0,85% y de 1,55% respectivamente. Cinco pacientes presentaron enfermedad de Crohn (EC), 4 de los cuales asociaron enfermedad perianal. De los 3 casos con colitis ulcerosa 2 habían sido sometidos a anastomosis íleo anal.
Otro reciente estudio realizó un análisis retrospectivo usando información procedente de la base de datos del Hospital Mount Sinai entre los años 2003 y 2013. Un total de 18 casos (15 pacientes con EC, 3 con colitis ulcerosa) asociados a HS fueron localizados32. Los 15 pacientes con EC asociada a HS fueron 11 mujeres y 4 hombres (9 pacientes de raza negra, 5 de raza caucásica y uno asiática). Siete pacientes tenían afectación cólica y 8 ileocólica. A su vez, 10 de estos pacientes asociaban lesiones perianales.
Janse et al. realizaron un estudio de prevalencia de HS en EII a partir de un cuestionario validado para HS enviado a 1.969 pacientes. De ellos, un total de 1.260 pacientes participaron, revelando una prevalencia significativamente superior con respecto a la población general (6,8-10,6% frente a 1-2%)33. Los pacientes con EII y HS mostraron los primeros síntomas de inflamación intestinal de forma significativamente precoz, y requirieron con mayor frecuencia de terapias anti-TNF-α y de resección quirúrgica, en comparación con casos de EII sin HS asociada.
El género femenino, el tabaco, un índice de masa corporal elevado y las edades jóvenes fueron parámetros que se asociaron de forma independiente con el desarrollo de HS.
A su vez, el análisis de asociación alélica en 59 casos de EII y HS y el 293 controles (EII sin HS) mostró la existencia de 2 asociaciones prometedoras en regiones genómicas portadoras de ELOVL7 (rs number 10057395, p=7,15×10, odds ratio=0,4), y en la región intergénica entre SULT1B1 y SULT1E1 (rs number 2014777, p=7,48×10, odds ratio=2,3)33.
Patrón clínico de la hidradenitis supurativa en el paciente con enfermedad inflamatoria intestinalLa variante definida por Canoui-Poitriene et al. como forma «glútea», que se ha relacionado con una mayor frecuencia de asociar EII, representa el 26% del total con respecto a los otros 2 subtipos de HS; se caracteriza por un patrón clínico de afectación predominantemente en los glúteos9.
Estudios posteriores han confirmado la mayor tendencia del paciente con EII a asociar HS con afectación perianal (73%), así como en las áreas axilar (53%) e inguinal (47%)32 (fig. 3).
Por lo tanto, la exploración de estas áreas en los pacientes con EII permitirá una detección precoz de una posible HS asociada, y con ello un diagnóstico precoz de la enfermedad.
Diagnóstico de hidradenitis supurativa en el paciente con enfermedad inflamatoria intestinalEl diagnóstico de la HS en el paciente con EII es eminentemente clínico (fig. 4). Sin embargo, el reto diagnóstico aparece cuando un paciente con EII presenta lesiones perianales. El análisis histológico resulta insuficiente para discernir entre ambas enfermedades, dado que en las biopsias del paciente con HS no es infrecuente encontrar procesos granulomatosos neutrofílicos similares a los que se observan en las biopsias intestinales de la EC.
En estos casos, la realización de una exploración clínica completa del paciente, incluyendo el análisis visual de las axilas e ingles, así como la realización de pruebas de imagen, principalmente la resonancia magnética y en menor medida la ecografía, permiten establecer el diagnóstico diferencial entre ambos cuadros.
Dicha separación entre ambas patologias va más encaminada a la actitud terapéutica frente a las lesiones perianales que frente a establecer un diagnóstico que intente separar 2 entidades que, dado sus características clínicas, patogénicas y su respuesta terapéutica, deberían considerarse como 2 procesos dentro de un mismo espectro de enfermedad autoinflamatoria (tabla 3).
Tratamiento de la hidradenitis asociada a la enfermedad inflamatoria intestinalTanto la EII, en especial la EC, como la HS son 2 enfermedades en las que el TNF desempeña un importante papel en el proceso inflamatorio.
En el caso de la HS el arsenal terapéutico, descrito en la tabla 4, incluye diferentes combinaciones de tratamientos médicos (terapias antibióticas, antiinflamatorias, antiandrogénicas, inmunosupresoras e inmunomoduladoras) y ocasionalmente quirúrgicas, con la finalidad de alcanzar un control óptimo de la inflamación cutánea.
Tratamiento médico en la HS
| Terapia | Nivel de evidencia | Fuerza de recomendación |
|---|---|---|
| 1.alínea | ||
| Clindamicina tópica | IIb | Posible B |
| Clindamicina/rifampicina (oral) | III | C |
| Adalimumab (subcutáneo)a | Ib | A |
| Tetraciclina (oral) | IIb | B |
| 2.alínea | ||
| Gluconato de cinc | III | C |
| Resorcinol | III | C |
| Corticoide intralesional | IV | D |
| Corticoide sistémico | IV | D |
| Infliximab | Ib/IIa | B |
| Acitretino/etretinato | III | C |
| 3.ª línea | ||
| Colchicina | IV | D |
| Toxina botulínica | IV | D |
| Isotretionína | IV | D |
| Dapsona | IV | D |
| Ciclosporina | IV | D |
| Terapia hormonal | IV | D |
Sin embargo, aquellos casos en los que la HS se asocia a EII requiere un abordaje multidisciplinar basado en el establecimiento de un consenso terapéutico. Así, dependiendo de la actividad inflamatoria existente a nivel cutáneo e intestinal, la elección de las terapias irá dirigida a alcanzar un adecuado control del paciente.
ConclusionesEl paciente con HS moderada y severa, al igual que ocurre con pacientes con EII, supone un reto terapéutico ya no solo en el control de un brote ocasional, sino en el mantenimiento del paciente libre de enfermedad.
La asociación de la HS a la EII es más frecuente de lo que en principio podría imaginarse. Sin embargo, esa situación no parece relacionarse con un hecho causal. Así, el carácter multifactorial, la existencia de interacción de factores anatómicos, genéticos, ambientales como el tabaco, la obesidad, el carácter crónico de la enfermedad, con un comportamiento recidivante, con el desarrollo de fístulas, así como la refractariedad a tratamientos sistémicos y las tasas de respuesta a tratamientos anti-TNF-α permiten establecer la hipótesis de que la EII, principalmente la EC, y la HS son enfermedades que formarían parte de un espectro clínico-patogénico común.
Una exploración de los pliegues axilar e inguinal, así como de la región glútea, permitirá detectar precozmente aquellos casos que asocien HS a su enfermedad inflamatoria intestinal.
El manejo multidisciplinar del paciente que combina HS y EII permitirá establecer una terapia personalizada de este tipo de casos, consiguiendo optimizar los resultados obtenidos frente a un tratamiento individualizado por cada especialidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.