Esta revisión explica las razones en que se fundamentan los consejos dietéticos para los pacientes con EII, con especial énfasis en desmitificar algunos conceptos tradicionales con escasa base científica. El «reposo intestinal» es un concepto obsoleto, de modo que, mantener a un paciente con EII activa en ayuno total y sueroterapia debe considerarse como mala práctica. De hecho, los pacientes con EII en brote deberían evitar solo aquellos alimentos, incluidos los lácteos, que de forma reiterada y sistemática aumenten sus síntomas. Durante los brotes es aconsejable una dieta pobre en residuos, particularmente en aquellos pacientes con EC estenosante, o en brotes graves de CU. El cóctel probiótico VSL#3 es eficaz para prevenir tanto el primer episodio como la recidiva de la reservoritis. Asimismo, el probiótico E. coli Nissle 1917 es útil en la CU, particularmente como tratamiento de mantenimiento. En cambio, los probióticos no son útiles en la EC. Los datos clínicos disponibles tampoco apoyan el uso de ácidos grasos omega 3 en la EII, ni activa ni inactiva.
This review explains the reasons for dietary advice for patients with IBD are based, with special emphasis on demystifying some traditional concepts with little scientific basis. «bowel rest» is an outdated concept so that keeping a patient with active IBD in total fasting and fluid therapy alone should be considered bad practice. In fact, patients with an IBD outbreak should avoid only those foods, including dairy ones, who repeatedly and systematically increase their symptoms. During outbreaks a low fibre diet is recommended, particularly in patients with stenosing CD, or severe UC attacks. The probiotic cocktail VSL#3 is effective in preventing both the first episode and subsequent bouts of pouchitis. Also, the probiotic E. coli Nissle 1917 is useful in UC, particularly as maintenance therapy. However, probiotics are not useful in CD. The available clinical data do not support the use of omega-3 fatty acids in IBD, both active and inactive.
Aunque, por desgracia, la etiología de la enfermedad inflamatoria intestinal (EII) es aún desconocida, existen evidencias cada vez más firmes de que tanto la colitis ulcerosa (CU) como la enfermedad de Crohn (EC) se desencadenan por la acción de determinado(s) factor(es) ambiental(es) en individuos genéticamente predispuestos.
En la actualidad, el tratamiento médico de la EII se basa fundamentalmente en el control farmacológico de la inflamación mediante aminosalicilatos, corticosteroides, inmunosupresores convencionales o agentes biológicos con acción inmunomoduladora. El variado arsenal terapéutico de que se dispone no debe restar importancia a las medidas dietético-nutricionales y a los cambios en el estilo de vida que pueden mejorar la calidad de vida de estos pacientes, e incluso, evitar complicaciones de la enfermedad.
Sin embargo, hay que reconocer que durante años hemos aconsejado a nuestros pacientes modificaciones en la dieta (en general, de carácter restrictivo) esencialmente basadas en el empirismo y en la hipótesis de que los antígenos alimentarios eran uno de los factores ambientales determinantes en el desencadenamiento de la enfermedad y sus manifestaciones. Hoy en día sabemos que los antígenos alimentarios juegan, en el mejor de los casos, un papel marginal en la patogenia de la CU y la EC1, mientras que la flora comensal intestinal está ganando creciente protagonismo patogénico en estas enfermedades2. Bien al contrario, los trastornos nutricionales son parte importante de las manifestaciones clínicas de la EII3.
La presente revisión pretende explicar las razones en que se fundamentan los consejos dietéticos que son pertinentes para estos pacientes, con especial énfasis en desmitificar algunos conceptos tradicionales con escasa base científica.
Dieta en la enfermedad inflamatoria intestinal: ¿restringir o permitir?Durante décadas, los médicos –y, en particular, los gastroenterólogos– basaron sus consejos dietéticos para los pacientes con EII (y, de hecho, en la mayor parte de los pacientes con enfermedades del tracto gastrointestinal) en un criterio universal de restricción. Este criterio se fundamentaba en el concepto de que el «reposo intestinal» era poco menos que una condición sine qua non para resolver el brote de EC o CU, y se veía reforzado por las frecuentes y variadas intolerancias alimentarias que estos pacientes manifiestan. En el platillo opuesto de la balanza se sitúan los déficits nutricionales frecuentes en los pacientes con EII, de cuyas consecuencias no se comenzó a tomar consciencia hasta la década de 1980. Este argumento ha ido ganando terreno en los últimos años, de modo que la tendencia actual consiste, como veremos, en recomendar una dieta lo más libre y variada posible.
Intolerancia a alimentos en la enfermedad inflamatoria intestinalComo se ha mencionado, la intolerancia alimentaria es una queja frecuente de muchos pacientes con EII. En un estudio prospectivo, el 65% de los 130 pacientes que completaron un cuestionario manifestaron intolerancia a algún tipo de alimento, circunstancia que se produjo en tan solo el 14% de un grupo de 70 controles sanos (p<0,0001)4. Los alimentos más comúnmente no tolerados fueron las verduras y frutas, los lácteos, la carne y el pan. Además, alrededor de una tercera parte de los pacientes no toleraban más de 2 alimentos y cerca del 20%, más de 64. Un estudio más reciente5 en 183 pacientes con CU corroboró estos hallazgos: casi el 50% de los pacientes evitaban tomar algún tipo de alimento. No obstante, no es menos cierto que otro 22% tomaban cantidades suplementarias de estos mismos alimentos porque tenían la percepción de que les sentaban particularmente bien, o mejoraban su colitis5.
A pesar de su elevada frecuencia aparente, la intolerancia alimentaria es un fenómeno relativamente inconstante en los pacientes con EII. Pearson et al.6 reintrodujeron alimentos convencionales de manera escalonada en 28 pacientes con EC que habían entrado en remisión gracias a una dieta elemental. Durante este proceso, 20 pacientes manifestaron intolerancia a alguno de los alimentos, pero 7 de ellos toleraron ese mismo alimento en una segunda exposición. Es más, algunos de los pacientes que también manifestaron intolerancia tras la segunda exposición fueron, no obstante, capaces de tolerarlo en una tercera exposición a ciegas, e incluso algún enfermo respondió de forma opuesta en 2 reexposiciones a ciegas al mismo alimento. Estos datos ponen de manifiesto la dificultad de demostrar de forma consistente las intolerancias alimentarias en la EII.
Desde esta perspectiva, la supresión por parte del paciente de cualquier alimento que crea que «no le sienta bien» no parece ser una estrategia eficaz ni recomendable. De hecho, en una serie amplia de pacientes con CU mencionada anteriormente, los cambios que los pacientes introducían en su dieta, basados en sus propias percepciones, no modificaron en absoluto la tasa de recidiva de la colitis5.
La utilidad de eliminar de forma «reglada» aquellos alimentos que desencadenan síntomas –lo que se conoce como «dieta de exclusión»– en la EC ha sido defendida por diversos autores, sobre todo en el Reino Unido, tanto por su potencial capacidad de prevenir la recidiva de la enfermedad como por su efecto ahorrador de corticosteroides y de determinadas complicaciones ligadas a la terapia esteroidea7,8. Hasta la fecha solo se ha publicado un estudio prospectivo, controlado y aleatorizado que investigue el papel de la dieta de exclusión en la prevención de la recidiva en la EC9, el diseño del cual cabe calificar, como mínimo, de peculiar. Se incluyó a 78 pacientes que habían entrado en remisión con una dieta elemental, los cuales fueron aleatorizados para recibir una dieta de exclusión (v. gr. introducción paulatina de alimentos con supresión de aquellos que producían síntomas) o prednisolona (40mg/día), cuya dosis se redujo progresivamente hasta su total supresión en 12 semanas (grupo control). El manejo del grupo control es difícilmente justificable cuando es bien conocido que los corticosteroides no son eficaces en el mantenimiento de la remisión de estos pacientes. Sea como fuere, la tasa acumulada de recidiva a los 2 años fue significativamente inferior en el grupo tratado con dieta de exclusión que en el grupo control (62 vs. 79%; p=0,048)9. Sin embargo, un 62% de recidiva es una tasa relativamente elevada, lo cual indica que las dietas de exclusión deben ser útiles tan solo en un pequeño subgrupo de pacientes con EC, cuyas características están aún por determinar.
«Reposo intestinal» y enfermedad inflamatoria intestinal activaEl «reposo intestinal» fue, durante años, parte esencial del tratamiento médico de los brotes de EII activa, de tal forma que los pacientes se mantenían durante días (y a veces semanas) en ayuno asociado a sueroterapia i.v. o, en el mejor de los casos, con nutrición parenteral total. Sin embargo, a partir de la segunda mitad de la década de los 80 diversos estudios demostraron que la tasa de remisión tras el tratamiento esteroideo era similar con nutrición parenteral total, nutrición enteral total o dieta oral convencional, tanto en pacientes con EC10 como CU11,12 activas. Por tanto, el «reposo intestinal» es un concepto obsoleto de modo que, hoy en día, mantener a un paciente con EII activa en ayuno total y sueroterapia i.v. debe considerarse como mala práctica.
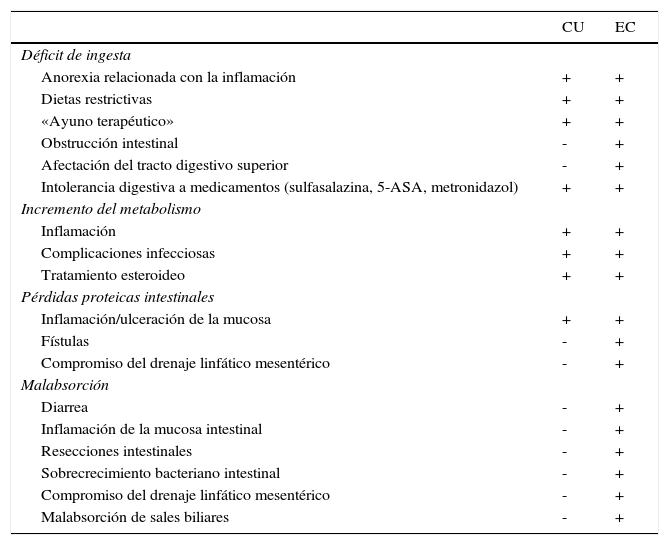
Déficits nutricionales en la enfermedad inflamatoria intestinal y sus consecuenciasLa frecuencia de malnutrición energético-proteica (MEP) en series clásicas de pacientes con EII oscila entre el 20 y el 85%13–15. Esta variabilidad es debida a que la mayoría de las series incluyen conjuntamente pacientes con CU y EC, tanto hospitalizados como ambulatorios, lo que produce una mezcla heterogénea de diferentes grados de actividad inflamatoria, extensión y localización de la enfermedad, etc. En un estudio prospectivo clásico, realizado en pacientes adultos con EII moderada-grave, la frecuencia global de MEP fue del 85%13. En los pacientes ambulatorios en remisión, esta cifra es muy inferior, pero pueden persistir déficits nutricionales y funcionales múltiples, principalmente en la EC de larga evolución. La etiología de la MEP en la EII es multifactorial. Los principales mecanismos implicados son a) el déficit de ingesta, b) el incremento de metabolismo, sobre todo asociado al propio proceso inflamatorio c) las pérdidas proteicas intestinales y d) la malabsorción, aunque no todos ellos son igualmente operativos en la CU y en la EC (tabla 1)3. De hecho, la prevalencia de MEP asociada a EII se ha visto drásticamente reducida, probablemente a consecuencia de un mejor control de la actividad inflamatoria con los más modernos agentes biológicos16 y se está asistiendo a un incremento de los casos de sobrepeso y obesidad en estos pacientes16–18.
Factores etiológicos que contribuyen al desarrollo de MEP en la EII
| CU | EC | |
|---|---|---|
| Déficit de ingesta | ||
| Anorexia relacionada con la inflamación | + | + |
| Dietas restrictivas | + | + |
| «Ayuno terapéutico» | + | + |
| Obstrucción intestinal | - | + |
| Afectación del tracto digestivo superior | - | + |
| Intolerancia digestiva a medicamentos (sulfasalazina, 5-ASA, metronidazol) | + | + |
| Incremento del metabolismo | ||
| Inflamación | + | + |
| Complicaciones infecciosas | + | + |
| Tratamiento esteroideo | + | + |
| Pérdidas proteicas intestinales | ||
| Inflamación/ulceración de la mucosa | + | + |
| Fístulas | - | + |
| Compromiso del drenaje linfático mesentérico | - | + |
| Malabsorción | ||
| Diarrea | - | + |
| Inflamación de la mucosa intestinal | - | + |
| Resecciones intestinales | - | + |
| Sobrecrecimiento bacteriano intestinal | - | + |
| Compromiso del drenaje linfático mesentérico | - | + |
| Malabsorción de sales biliares | - | + |
Los déficits de vitaminas y oligoelementos, y su posible papel en la patogenia de la EII, han sido poco documentados en la literatura. Es importante destacar que –con excepción de los déficits de hierro y ácido fólico– los déficits de micronutrientes en la EII en raras ocasiones son clínicamente aparentes. Los pacientes tratados con sulfasalazina pueden desarrollar déficit de ácido fólico. Asimismo, los pacientes con EC ileal, resección quirúrgica de este segmento o sobrecrecimiento bacteriano intestinal ven comprometida la absorción de vitamina B12 y, si no reciben suplementos por vía parenteral, pueden desarrollar anemia megaloblástica u otros síntomas de déficit. El déficit de vitamina D no es infrecuente en la EII y se correlaciona con el grado de osteopenia que presentan estos pacientes (ver más adelante).
Aunque existen numerosos artículos que describen casos de déficits vitamínicos aislados en la EII, pocos autores han estudiado el estado global de vitaminas en estos pacientes. En un estudio realizado en pacientes con CU y EC activas, los niveles sanguíneos de biotina, ácido fólico, β-caroteno y vitaminas A, C y tiamina fueron significativamente más bajos en pacientes con colitis extensa, ileitis e íleo-colitis que en los controles sanos19. Además, los pacientes con afectación ileal mostraron niveles bajos de vitamina B12 y en los pacientes con colitis se detectaron niveles subóptimos de riboflavina19. Aunque ningún paciente mostró signos clínicos de deficiencia vitamínica, más del 40% se encontraba en riesgo de desarrollar hipovitaminosis (definida como niveles de vitamina por debajo del percentil 15 de su distribución en los controles sanos) para la vitamina A, β-caroteno, ácido fólico, biotina, vitamina C y tiamina19. Otros estudios han mostrado resultados similares incluso en pacientes con EII en remisión clínica14,15,20.
El déficit de hierro debido a pérdidas hemáticas por el intestino es probablemente el déficit mineral más común en la EII. También se ha descrito déficit de cinc, selenio y magnesio. El estatus de otros elementos traza como el cobre, manganeso, cromo y molibdeno ha sido muchos menos estudiado en estos enfermos21–23.
Aun en ausencia de datos objetivos que lo demuestren, en general, se considera que la MEP y los déficit de micronutrientes tienen una amplia gama de consecuencias de carácter general que pueden de modificar el curso clínico y la respuesta al tratamiento de la EII (tabla 2).
Consecuencias de los déficits nutricionales en la EII
| • Inmunosupresión |
| • Dificultades en los procesos de reparación tisular |
| • Hipoplasia vellositaria intestinal (autoperpetuación de la malnutrición) |
| • Disrupción de la barrera mucosa intestinal (incremento de la traslocación bacteriana intestinal) |
| • Retraso de crecimiento y de maduración sexual (niños y adolescentes) |
| • Enfermedad metabólica ósea |
| • Déficit del transporte plasmático de fármacos |
| • Incremento del riesgo quirúrgico |
| • Disminución de la defensa antioxidante |
| • Hiperhomocisteinemia y aumento del riesgo trombótico (complejo vitamínico B) |
| • Hipogonadismo, alopecia, rash cutáneo (déficit de cinc) |
| • Anemia |
| • Incremento de la morbimortalidad |
En niños y adolescentes con EII, la MEP se considera un factor primordial en la patogenia del retraso de crecimiento y desarrollo sexual que se puede observar en el 20-30% de los pacientes, sobre todo en los afectos de EC24–26. De hecho, el retraso de crecimiento se considera la complicación extraintestinal más frecuente de la EC en la edad pediátrica. Estudios realizados antes de la aparición de los fármacos biológicos demuestran el impacto negativo de la EII diagnosticada en la infancia sobre la estatura que se alcanza en la edad adulta24,26. Por tanto, la recuperación de la velocidad de crecimiento debe ser un objetivo fundamental del tratamiento de la EII en la infancia y adolescencia. El hecho de que el crecimiento se acelera cuando estos niños se incluyen en un plan de rehabilitación nutricional27–29 apoya el concepto de que la MEP es un factor etiológico de primer orden de esta complicación.
La prevalencia global de osteopenia/osteoporosis en la EII alcanza el 45%30–32, y es más frecuente en la EC que en la CU33. La disminución de la densidad mineral ósea es particularmente importante en niños y adolescentes, en la medida en que el riesgo de fracturas en la edad adulta se relaciona estrechamente con el pico de masa ósea que se alcance al final de la pubertad. La actividad inflamatoria de la propia EII, el uso de esteroides y el sexo femenino son factores de riesgo conocidos de osteopenia en estos enfermos. Sin embargo, el bajo peso corporal, la hipoalbuminemia, el déficit de vitamina D y la necesidad de recibir nutrición artificial (como variable subsidiaria de la presencia de MEP) se han identificado también como predictores de enfermedad metabólica ósea, lo que pone de manifiesto que esta es también una complicación nutricional de la EII34,35.
Consejo dietético en los pacientes con enfermedad inflamatoria intestinalEs obvio que el objetivo principal de la dieta en la CU y la EC es prevenir y corregir la MEP asociada a estas enfermedades, mediante la prescripción de una dieta lo más libre y variada posible, sin empeorar (y, si es posible, mejorando) los síntomas de la enfermedad (dolor abdominal, diarrea, etc.). Los hábitos dietéticos han sido tradicionalmente propuestos como un posible factor ambiental desencadenante de EII en individuos genéticamente susceptibles. Diversos estudios de casos y controles han investigado este punto, aunque la metodología de algunos de ellos ha sido criticada36. Estudios recientes de cohortes37 y casos y controles38 relacionan el desarrollo de CU y EC con un patrón dietético a base de carnes, grasas y azúcares refinados38, mientras que el consumo de fibra dietética tendría un efecto protector37,38.
A pesar de todo, una vez la enfermedad se ha desarrollado, no disponemos de evidencias suficientemente convincentes que relacionen a ningún alimento en el desencadenamiento, perpetuación o empeoramiento de los brotes de actividad inflamatoria en la EII. En consecuencia, y teniendo en cuenta la necesidad de prevenir los déficits nutricionales, los pacientes con CU o EC en brote deberían evitar solo aquellos alimentos que de forma reiterada y sistemática aumenten sus síntomas. De hecho, y como se ha comentado antes, la aparición o empeoramiento de un síntoma tras la ingestión de un alimento concreto es, en la mayor parte de ocasiones, absolutamente fortuita. Por consiguiente, si se atribuye todo síntoma al alimento ingerido de forma previa, se corre el riesgo de incurrir en una dieta excesivamente monótona y, por tanto, restrictiva. En este contexto, existen 2 tipos de alimentos cuyo consumo suscita con frecuencia dudas tanto entre los médicos como entre los pacientes: los lácteos y la fibra. En los últimos años, además, se ha popularizado el uso tanto de probióticos como de suplementos de ácidos grasos omega 3 en diversas situaciones entre la que la EII no ha sido una excepción.
¿Hay que restringir el consumo de lácteos en la enfermedad inflamatoria intestinal activa?No existe ningún fundamento científico para prohibir el consumo de productos lácteos a los pacientes con CU y EC por el mero hecho de padecer estas enfermedades. Que se sepa, ningún componente de la leche es capaz de favorecer la inflamación intestinal, desencadenar un brote y, mucho menos, causar la enfermedad. En cambio, es bien sabido que la leche y sus derivados son la más importante fuente de calcio, necesario para prevenir la osteopenia de estos pacientes.
Sin embargo, también es cierto que un determinado porcentaje de individuos de la población general (sobre todo en países de la cuenca mediterránea) presentan déficit de lactasa. Cuando la lactosa no absorbida en el intestino delgado llega al colon puede provocar diarrea o flatulencia de manera dosis-dependiente. Este fenómeno, que es independiente del hecho de padecer EII, puede ocurrir en pacientes con estas enfermedades y, en estos casos, la ingesta de leche puede aumentar sus síntomas (sobre todo la diarrea).
No obstante, estudios realizados por nuestro grupo señalan que la prevalencia de malabsorción de lactosa (evaluada mediante la excreción de hidrógeno en el aliento) no es superior en los pacientes con EII que en controles sanos39. Por tanto, los pacientes con EII solo deben limitar el consumo de lácteos durante los brotes si este clara y reiteradamente aumenta su diarrea. Además, la mayoría de los pacientes que intoleran la leche pueden tolerar otros derivados lácteos como el yogur y los quesos curados, cuyo contenido en lactosa es mucho menor.
¿Hay que restringir el consumo de fibra en la enfermedad inflamatoria intestinal activa?A pesar del posible papel protector de la fibra en el desarrollo de EII37,38, durante los brotes de la enfermedad es aconsejable hacer una dieta pobre en residuos, particularmente en aquellos pacientes con formas estenosantes de EC, o en brotes de CU grave o extensa. Esto implica eliminar de la dieta la denominada fibra insoluble (lignina, celulosa). Este tipo de fibra produce un residuo fecal abundante que puede facilitar la obstrucción intestinal cuando hay estenosis, o dañar la mucosa frágil y ulcerada del colon en un brote grave de colitis. Los alimentos ricos en fibra insoluble son los alimentos integrales, los preparados que contienen salvado de cereales y algunos vegetales especialmente «leñosos» (espárragos, alcachofas, etc.).
A diferencia de la fibra insoluble, la fibra soluble (pectinas, mucílagos, goma de guar, etc.), contenida sobre todo en frutas y legumbres, produce menos residuo y, además, es fermentada por la flora del colon. La fermentación de la fibra soluble produce diversas sustancias, algunas de las cuales, como los ácidos grasos de cadena corta (AGCC) –particularmente el butirato– pueden ser beneficiosos para la EII. Se ha demostrado que el butirato es el sustrato energético preferido del colonocito, y se ha señalado que una disminución de la β-oxidación del butirato luminal, que ocasionaría un déficit energético epitelial, puede estar implicada en la patogénesis de la CU40. En los pacientes con CU se ha observado disminución de los niveles fecales de AGCC en relación con la gravedad de la enfermedad40. La disminución de la β-oxidación del butirato se ha podido demostrar en la CU humana, incluso inactiva41,42.
Como contrapartida, la fermentación de la fibra soluble produce gases (hidrógeno, metano, anhídrido carbónico), que pueden aumentar el dolor abdominal y la sensación de flatulencia durante los brotes. Por tanto, el consumo de alimentos ricos en fibra soluble solo deberá limitarse si produce estas molestias y dependiendo de su intensidad. Es más, teóricamente, la ingesta de un tipo de fibra dietética fermentable, que fermente lentamente a lo largo de todo el colon, para asegurar suficiente producción de butirato en el colon distal, podría ser beneficiosa en el tratamiento de la CU. Sin embargo, en las fases de actividad de la CU existe sangre en la luz del colon y, por tanto, oxígeno, que favorece el crecimiento de bacterias como Lactobacilli y Streptococci, que son productoras de ácido láctico. Asimismo, el pH ácido en la luz del colon, que se observa en las fases de agudización de la enfermedad, comporta un freno de la fermentación bacteriana y que se produzca más lactato que butirato. De hecho, se ha observado que los niveles de lactato en las heces se hallan aumentados en los pacientes con CU activa43. Dado que se ha mostrado que en el animal de experimentación el lactato puede lesionar la mucosa intestinal por un mecanismo directo, se ha indicado que el aumento en la producción de este compuesto podría ser perjudicial en la CU humana43.
En cambio, la fibra fermentable podría ser útil en la CU inactiva. Un ensayo clínico multicéntrico español evaluó el efecto de un fibra dietética fermentable (semillas de Plantago ovata) en el mantenimiento de la remisión en la CU inactiva44. No se apreciaron diferencias significativas entre este tipo de fibra y el tratamiento habitual con mesalazina (porcentaje de recidiva a los 12 meses: 40 vs. 35%, respectivamente). Además, es de destacar que se observó un aumento en la concentración fecal de butirato en los pacientes tratados con fibra, lo que indica una fermentación lenta a lo largo de todo el colon. Cabe resaltar, no obstante, que no está claro si otros tipos de fibras fermentables pueden inducir cambios cuantitativos y cualitativos en la producción de AGCC similares a las semillas de Plantago ovata.
¿Son útiles los probióticos y prebióticos en la enfermedad inflamatoria intestinal?Esta aspecto ha sido recientemente objeto de una revisión sistemática45. Varios ensayos clínicos aleatorios han demostrado claramente que el cóctel probiótico VSL#3 –que incluye 8 especies de Lactobacilli, Bifidobacteria y Streptococci– es eficaz para prevenir tanto el primer episodio como la recidiva de la reservoritis tras tratamiento con antibióticos. Sin embargo, no hay datos que demuestren la utilidad de los probióticos para el tratamiento de la reservoritis activa. Como en el caso de reservoritis, también existen datos sólidos a favor del uso del probiótico E. coli Nissle 1917 en la CU, particularmente como tratamiento de mantenimiento. En cambio, los ensayos clínicos aleatorios sobre el uso de probióticos en la EC han sido, por desgracia, negativos hasta la fecha. Estos incluyen diversos estudios que evaluaron su posible utilidad tanto en la prevención de la recurrencia posquirúrgica como de la recidiva tras remisión inducida por tratamiento médico en esta enfermedad.
De todas formas, es importante resaltar que no todos los probióticos (o cócteles probióticos) tienen el mismo comportamiento o propiedades biológicas. Por tanto, como norma, los resultados obtenidos con un determinado probiótico no se pueden extrapolar a otros preparados, por lo que bien podría ser que el probiótico «ideal» para la EC todavía no se hubiese evaluado.
¿Son útiles los ácidos grasos omega 3 en la enfermedad inflamatoria intestinal?Los ácidos grasos poliinsaturados omega 3 de cadena larga, derivados del aceite de pescado –eicosapentaenoico y docosahexaenoico– ejercen diversas acciones antiinflamatorias46. Su ingestión aumenta la incorporación del ácido eicosapentaenoico a la membrana celular, con la consiguiente disminución de ácido araquidónico lo que, a su vez, reduce la producción de eicosanoides proinflamatorios46. También se ha descrito un aumento de la producción de otras sustancias antiinflamatorias como las resolvinas47, así como una disminución de la síntesis de citocinas proinflamatorias (a través de la inhibición de NFκB y la estimulación de la síntesis de PPARγ), una disminución de la quimiotaxis de los leucocitos y de la reactividad de las células T46. Sin embargo, los datos clínicos disponibles recientemente revisados48 no apoyan el uso de ácidos grasos omega 3 en el tratamiento de la EII, ni activa ni inactiva. Los resultados negativos son particularmente consistentes en lo que se refiere al mantenimiento de la remisión (sobre todo en CU y, en menor medida, en la EC). Los estudios sobre su uso en la EII activa no permiten sacar conclusiones firmes, ya sea por la heterogeneidad de su diseño (CU) ya sea por su escaso número (EC).
Responsabilidades éticasProtección de personas y animalesEl autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosEl autor declara que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoEl autor declara que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses. Asimismo, no ha recibido financiación alguna para la elaboración del presente artículo.