La colitis microscópica (CM) comprende 2 entidades fundamentales (colitis linfocítica y colitis colágena) definidas por diarrea crónica acuosa, crónica o recurrente, colonoscopia normal e histopatología característica. En su fisiopatología aún poco conocida se ha implicado la exposición de la mucosa del colon a diferentes antígenos luminales, incluyendo distintos fármacos. Así, la relación entre el desarrollo de CM tras la exposición ha sido motivo de investigación durante más de 2 décadas, y se ha fundamentado en estudios observacionales, incluyendo casos clínicos y series de casos, estudios de casos y controles, y datos de prescripción de fármacos. Así, los inhibidores de la bomba de protones, antiinflamatorios no esteroides, inhibidores selectivos de la recaptación de serotonina, betabloqueantes y estatinas, entre otros, se han relacionado con la aparición de esta enfermedad, si bien también se reconocen como causa frecuente de diarrea.
En el momento actual carecemos de criterios universalmente aceptados para establecer relaciones causa-efecto en las reacciones adversas a medicamentos, aunque se dispone de distintos métodos que proporcionan diferentes niveles de probabilidad para las mismas. Así, la existencia de una relación de alta probabilidad en la aparición de CM como efecto adverso a un medicamento solo se ha demostrado para casos individuales mediante criterios cronológicos (exposición, efecto de la retirada y recidiva con la reintroducción) y semiológicos. Aunque estudios de casos y controles han mostrado repetidamente asociaciones significativas entre la exposición a fármacos y CM, la variabilidad en su diseño, incluyendo las poblaciones de referencia empleadas y los criterios de exposición al fármaco considerados, requiere un análisis específico. Este artículo analiza críticamente la compleja relación entre fármacos, diarrea y CM, para concluir que una relación causa-efecto verosímil solo se ha descrito para pocos fármacos y en casos individuales de CM.
Microscopic colitis (MC) comprises 2 fundamental entities (lymphocytic colitis and collagenous colitis) defined by chronic or recurrent watery diarrhea, normal colonoscopy and characteristic histopathological features. The exposure of the colonic mucosa at different luminal antigens, including different drugs, has been involved in the still poor understood pathophysiology of MC. Thus, the relationship between the development of MC after drug exposure has been the subject of research for more than 2 decades, mainly based on observational studies, including case reports and case series, case-control studies, and data on drug prescriptions. Among others, proton-pump inhibitors, nonsteroidal antiinflammatory drugs, selective inhibitors of serotonin reuptake, beta-blockers and statins, have been linked to the onset of MC, but all these drugs are also recognized as a frequent cause of drug-associated diarrhea.
At present we have no universally accepted criteria for establishing cause-effect relationships in adverse drug reactions, although several methods have provide us with different levels of likelihood. Thus, the existence of a high probability of MC occurrence as an adverse effect to a specific drug has been shown only in individual cases by using chronological (exposure, effect of withdrawal and relapse with re-exposure) and semiological criteria. Although case-control studies have repeatedly shown significant associations between drug exposure and MC, variability in their designs, including reference populations used and the criteria considered in defining drug exposure, requires a detailed analysis. This article critically examines the complex relationship between drugs, diarrhea and MC, to conclude that a likely cause-effect relationship has only been described for few drugs and in individual cases of MC.
El término colitis microscópica (CM) agrupa a una familia de enfermedades inflamatorias intestinales crónicas, que incluyen como entidades principales la colitis linfocítica (CL) y la colitis colágena (CC). Ambas se caracterizan por diarrea acuosa, crónica o intermitente, colonoscopia de aspecto normal o casi normal, y anomalías específicas en las biopsias obtenidas de la mucosa del colon que permiten distinguir una entidad de la otra1–3.
Desde la caracterización de la enfermedad en 19804, la incidencia y la prevalencia de la CM han aumentado hasta dejar de constituir un trastorno raro y convertirse en causa común de diarrea crónica acuosa en nuestro medio. Un reciente metaanálisis de estudios epidemiológicos ha mostrado una tasa global de incidencia para la CC de 4,14 (Intervalo de confianza del 95% [IC95%]: 2,89-5,40) por 100.000 habitantes y año, y para la CL de 4,85 (IC95%: 3,45-6,25)5. Hasta el 10% de los pacientes investigados por diarrea acuosa no sanguinolenta crónica o intermitente se diagnostican de CM, alcanzando el 20% en los sujetos de más de 70 años, siendo especialmente frecuente en mujeres mayores y fumadores6.
A pesar de su relativa frecuencia, la etiología de la CM sigue siendo desconocida. Las teorías más comunes proponen que la CM constituye el resultado de la activación del sistema inmune de la mucosa del colon en respuesta a su exposición a diferentes factores antigénicos luminales, como toxinas, infecciones o fármacos. De hecho, la resolución de las alteraciones histopatológicas mucosas tras la derivación del tránsito intestinal indica que los antígenos luminales están directamente implicados en la patogenia de la CM7–9.
A pesar de que hasta la fecha no se ha podido identificar un agente patógeno específico, la potencial etiología infecciosa de la CM se sustenta en diversas observaciones clínicas, como el desarrollo de CM tras una infección gastrointestinal por Clostridium difficile10,11 o la mayor frecuencia de anticuerpos frente a Yersinia enterocolitica y otros agentes infecciosos en el suero de los pacientes con CC en comparación con sujetos controles12. Si bien no se dispone de pruebas científicas concluyentes, el efecto potencial de los ácidos biliares en el desarrollo de CM se sustenta en modelos experimentales animales de la enfermedad13,14, el frecuente desarrollo de diarrea como efecto de una resección ileal con malabsorción de ácidos biliares15, y la demostración de dicha malabsorción en una proporción significativa de pacientes con CL y CC16,17. Por otro lado, el tratamiento con quelantes de ácidos biliares no consigue la remisión de las lesiones histológicas de la CM18. El consumo de fármacos ha sido también considerado de forma repetida como un factor de riesgo ambiental causante o precipitante de una CM. Diferentes trabajos, desde casos clínicos individuales hasta estudios epidemiológicos observacionales, han implicado a diversos medicamentos de uso frecuente como causa potencial de CL y CC, a partir de observar asociaciones significativas, pero con un grado variable de plausibilidad causal.
Sin embargo, debemos recordar que la diarrea es un efecto adverso frecuente de muchos medicamentos, que acontece hasta en el 7% del total de efectos adversos a fármacos, debido a mecanismos fisiopatológicos diversos y en muchas ocasiones multifactoriales19–21. Una larga lista que incluye más de 700 fármacos ha sido reconocida como causa potencial de diarrea, afectando más frecuentemente a los pacientes ancianos22, debido a la mayor susceptibilidad al efecto tóxico de los fármacos y sus metabolitos inherente al propio proceso de envejecimiento, y a la polifarmacia a la que está sometida esta población, que por otro lado es la más susceptible de padecer CM.
En esta revisión abordaremos en profundidad los aspectos relacionados con el consumo de fármacos como potencial causa de CM, a partir de una revisión crítica de la literatura al respecto y del análisis de las limitaciones de los estudios disponibles sobre esta asociación. Para ello, se realizó una búsqueda en PubMed, para artículos publicados sin restricción de idiomas ni tiempo, sobre la asociación de CM y consumo de fármacos, combinando los términos «exposición a fármacos», «consumo de fármacos» y «factores de riesgo», con «colitis microscópica», «colitis linfocítica» y «colitis colágena». Se revisaron también las referencias de los documentos recuperados para buscar información adicional.
Relaciones de causalidad entre exposición a fármacos y efectos adversosEn el momento actual carecemos de criterios universalmente aceptados para establecer una relación causa-efecto en las reacciones adversas a medicamentos, si bien distintos autores han empleado métodos diversos para estimar estas relaciones de causalidad. Una revisión sistemática sobre el tema clasificó estos métodos en 3 diferentes categorías23: a) juicios expertos basados en introspecciones globales; b) algoritmos y c) métodos probabilísticos o bayesianos.
El programa de la OMS para la monitorización internacional de fármacos ha propuesto un método basado en juicios expertos24, en el que se establecen diferentes categorías de causalidad en base a (i) la secuencia temporal y cronología entre la causa y el efecto, (ii) la información previa sobre el fármaco, (iii) la relación dosis-respuesta, (iv) el patrón de respuesta al fármaco, (v) la reprovocación (buscando la recidiva del evento al administrar de nuevo el fármaco, (vi) la exclusión de otros candidatos etiológicos alternativos, y (vii) la exposición a fármacos concomitantes. Los eventos adversos son de este modo clasificados como «probables», «posibles», «improbables» y «no valorables» (tabla 1).
Criterios de causalidad en las reacciones adversas a fármacos (adaptados de la OMS)
| Probabilidad | Criterios |
|---|---|
| Cierta | Momento del evento en relación con la exposición al fármaco compatible, y mejora de los síntomas después de interrumpir la medicación, seguida de recurrencia de los síntomas (y en su caso, las alteraciones morfológicas) tras la exposición repetida, u otra prueba definitiva |
| Probable | Momento del evento en relación con la exposición al fármaco compatible, y mejoría de los síntomas al interrumpir la medicación. Además, el evento no es atribuible a la situación clínica del paciente |
| Posible | Momento del evento en relación con la exposición al fármaco compatible, pero el evento también podría ser atribuible a la situación clínica del paciente |
| Improbable | Las reacciones no cumplen ninguno de los criterios anteriormente mencionados |
| Inclasificable | Datos insuficientes |
Los algoritmos emplean métodos estructurados y estandarizados para evaluar mediante una aproximación sistemática los posibles efectos adversos de los fármacos. Aunque proporcionan un mayor nivel de consistencia y de reproductibilidad que los métodos anteriores, en algunos puntos siguen requiriendo de juicios clínicos para alcanzar una conclusión. Entre los algoritmos, el denominado «método francés» (por haber sido empleado por las agencias reguladoras de este país)26 se ha empleado de manera específica para evaluar la imputabilidad de los fármacos en el origen de la CM27 (tabla 2). El método emplea 3 criterios cronológicos (exposición, retirada y reprovocación) y 4 semiológicos (signos clínicos sugestivos, factor favorecedor, explicación alternativa no farmacológica y pruebas de laboratorio específicas). La puntuación total de estos 7 criterios permite clasificar s reacciones como «probables», «posibles» e «improbables».
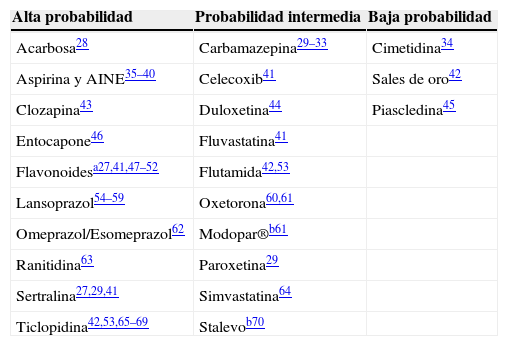
Evaluación de los niveles de probabilidad con los que distintos fármacos pueden desencadenar colitis microscópica: revisión de la literatura
| Alta probabilidad | Probabilidad intermedia | Baja probabilidad |
|---|---|---|
| Acarbosa28 | Carbamazepina29–33 | Cimetidina34 |
| Aspirina y AINE35–40 | Celecoxib41 | Sales de oro42 |
| Clozapina43 | Duloxetina44 | Piascledina45 |
| Entocapone46 | Fluvastatina41 | |
| Flavonoidesa27,41,47–52 | Flutamida42,53 | |
| Lansoprazol54–59 | Oxetorona60,61 | |
| Omeprazol/Esomeprazol62 | Modopar®b61 | |
| Ranitidina63 | Paroxetina29 | |
| Sertralina27,29,41 | Simvastatina64 | |
| Ticlopidina42,53,65–69 | Stalevob70 |
AINE: antiinflamatorios no esteroideos.
Modopar® es un fármaco antiparkinsoniano que conteniene levodopa y benseracida; Stalevo® es un fármaco antiparkinsoniano que contiene carbidopa, levodopa y entocapone.
Modificada de Beaugerie y Pardi27.
La concordancia entre los 2 métodos anteriores de evaluación de la imputabilidad de fármacos en efectos adversos, en todo caso, ha demostrado ser muy baja en un estudio comparativo, con grados de acuerdo de entre el 61 y el 17% para las distintas categorías71.
Finalmente, los métodos probabilísticos para evaluar la causalidad de las reacciones adversas a fármacos emplean los hallazgos de un caso específico para transformar las probabilidades a priori en probabilidades a posteriori mediante el cálculo de las razones de verosimilitud de cada uno de los elementos relevantes del caso72. La principal ventaja de estos métodos es la posibilidad de evaluar de manera simultánea múltiples causas potenciales, junto con la automatización de los procesos.
Estudios sobre la asociación entre exposición a fármacos y colitis microscópicaLos datos actualmente disponibles sobre la capacidad de los fármacos como posible factor de riesgo para desencadenar CM proceden de varias fuentes:.
- a)
Estudios de casos clínicos: Estas descripciones incluyen un número limitado de pacientes, en los se han implicando varios medicamentos asociados con el riesgo de desarrollar CM, repetidamente descritos desde la década de 199040,73. A pesar de que la lista de medicamentos potenciales es larga, una relación de verosimilitud causal cierta (en base a la relación temporal entre la exposición y los síntomas, la resolución de los hallazgos clínicos y patológicos tras la retirada del fármaco, y su recidiva tras la provocación) solo se ha demostrado para unos pocos fármacos, que incluyen acarbosa28, AINE40, ranitidina63, omeprazol62, lansoprazol56, ticlopinina66 y el venotónico cyclo 3 forte74, si bien en algunos casos la evaluación tras la provocación fue exclusivamente clínica sin la obtención de nuevas biopsias40,66.
- b)
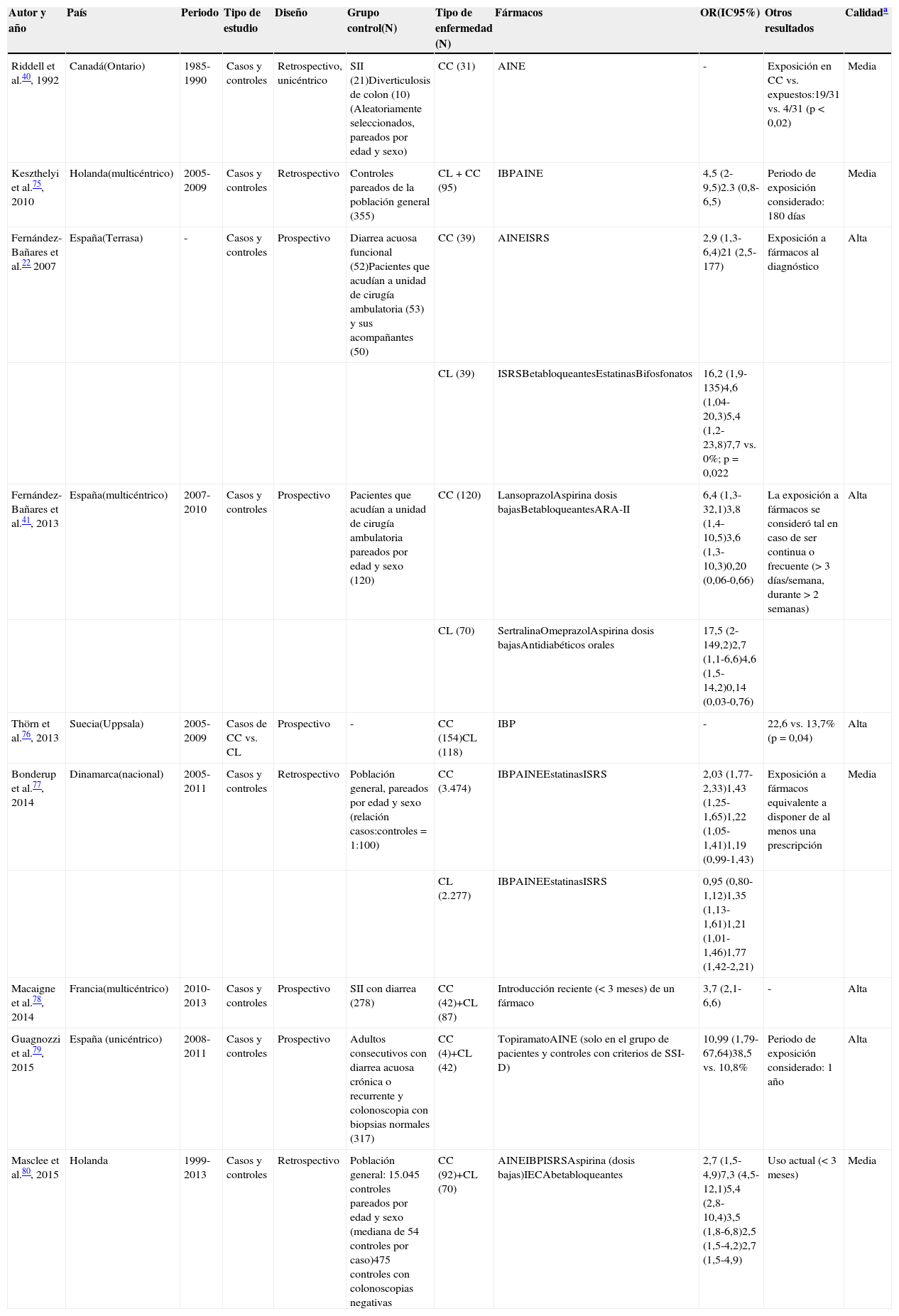
Estudios de casos-controles: Estos estudios, tanto prospectivos como retrospectivos, demuestran la asociación entre una mayor frecuencia de CM (o alguna de sus variantes) y la exposición a un determinado medicamento, pero no permiten establecer relaciones de causalidad (tabla 3). Sin embargo, como principal beneficio, estos estudios permiten proponer posibles factores de riesgo farmacológicos para posteriormente ser investigados mediante pruebas de causalidad.
Tabla 3.Estudios observacionales de casos y controles sobre la asociación de colitis microscópica y exposición a fármacos
Autor y año País Periodo Tipo de estudio Diseño Grupo control(N) Tipo de enfermedad (N) Fármacos OR(IC95%) Otros resultados Calidada Riddell et al.40, 1992 Canadá(Ontario) 1985-1990 Casos y controles Retrospectivo, unicéntrico SII (21)Diverticulosis de colon (10)(Aleatoriamente seleccionados, pareados por edad y sexo) CC (31) AINE - Exposición en CC vs. expuestos:19/31 vs. 4/31 (p<0,02) Media Keszthelyi et al.75, 2010 Holanda(multicéntrico) 2005-2009 Casos y controles Retrospectivo Controles pareados de la población general (355) CL+CC (95) IBPAINE 4,5 (2-9,5)2.3 (0,8-6,5) Periodo de exposición considerado: 180 días Media Fernández-Bañares et al.22 2007 España(Terrasa) - Casos y controles Prospectivo Diarrea acuosa funcional (52)Pacientes que acudían a unidad de cirugía ambulatoria (53) y sus acompañantes (50) CC (39) AINEISRS 2,9 (1,3-6,4)21 (2,5-177) Exposición a fármacos al diagnóstico Alta CL (39) ISRSBetabloqueantesEstatinasBifosfonatos 16,2 (1,9-135)4,6 (1,04-20,3)5,4 (1,2-23,8)7,7 vs. 0%; p=0,022 Fernández-Bañares et al.41, 2013 España(multicéntrico) 2007-2010 Casos y controles Prospectivo Pacientes que acudían a unidad de cirugía ambulatoria pareados por edad y sexo (120) CC (120) LansoprazolAspirina dosis bajasBetabloqueantesARA-II 6,4 (1,3-32,1)3,8 (1,4-10,5)3,6 (1,3-10,3)0,20 (0,06-0,66) La exposición a fármacos se consideró tal en caso de ser continua o frecuente (>3 días/semana, durante>2 semanas) Alta CL (70) SertralinaOmeprazolAspirina dosis bajasAntidiabéticos orales 17,5 (2-149,2)2,7 (1,1-6,6)4,6 (1,5-14,2)0,14 (0,03-0,76) Thörn et al.76, 2013 Suecia(Uppsala) 2005-2009 Casos de CC vs. CL Prospectivo - CC (154)CL (118) IBP - 22,6 vs. 13,7% (p=0,04) Alta Bonderup et al.77, 2014 Dinamarca(nacional) 2005-2011 Casos y controles Retrospectivo Población general, pareados por edad y sexo (relación casos:controles=1:100) CC (3.474) IBPAINEEstatinasISRS 2,03 (1,77-2,33)1,43 (1,25-1,65)1,22 (1,05-1,41)1,19 (0,99-1,43) Exposición a fármacos equivalente a disponer de al menos una prescripción Media CL (2.277) IBPAINEEstatinasISRS 0,95 (0,80-1,12)1,35 (1,13-1,61)1,21 (1,01-1,46)1,77 (1,42-2,21) Macaigne et al.78, 2014 Francia(multicéntrico) 2010-2013 Casos y controles Prospectivo SII con diarrea (278) CC (42)+CL (87) Introducción reciente (<3 meses) de un fármaco 3,7 (2,1-6,6) - Alta Guagnozzi et al.79, 2015 España (unicéntrico) 2008-2011 Casos y controles Prospectivo Adultos consecutivos con diarrea acuosa crónica o recurrente y colonoscopia con biopsias normales (317) CC (4)+CL (42) TopiramatoAINE (solo en el grupo de pacientes y controles con criterios de SSI-D) 10,99 (1,79-67,64)38,5 vs. 10,8% Periodo de exposición considerado: 1 año Alta Masclee et al.80, 2015 Holanda 1999-2013 Casos y controles Retrospectivo Población general: 15.045 controles pareados por edad y sexo (mediana de 54 controles por caso)475 controles con colonoscopias negativas CC (92)+CL (70) AINEIBPISRSAspirina (dosis bajas)IECAbetabloqueantes 2,7 (1,5-4,9)7,3 (4,5-12,1)5,4 (2,8-10,4)3,5 (1,8-6,8)2,5 (1,5-4,2)2,7 (1,5-4,9) Uso actual (<3 meses) Media AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas del receptor de angiotensina-II; CC: colitis colágena; CL: colitis linfocítica; IBP: inhibidor de la bomba de protones; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima convertidora de angiotensina; ISRS: inhibidores selectivos de la recaptación de serotonina; N: número de pacientes/controles; OR: odds ratio; SII-D: síndrome de intestino irritable con predominio de diarrea (según Roma III).
El consumo de AINE, incluyendo la aspirina a dosis bajas (<300mg), se ha relacionado de forma global con el riesgo de CM en 6 estudios22,41,76,77,80,81 en cada una de sus 2 variantes de CL y CC. Sin embargo, esta asociación no ha sido universalmente reproducida en otros estudios con similar diseño79. La exposición a inhibidores de bomba de protones (IBP) (especialmente omeprazol y lansoprazol) también ha sido relacionada con un riesgo global aumentado para el desarrollo de CM75,80, en concordancia con los estudios de imputación de fármacos antes descritos; en general, esta asociación ha sido más intensa y frecuentemente comunicada para la CC que para la CL41,76,77 así como para formas más sintomáticas de CM82. La exposición a antidepresivos inhibidores selectivos de la recaptación de serotonina, especialmente sertralina, y el mayor riesgo de CM ha sido documentada en varios estudios22,41,77, tanto en pacientes con CC como con CL. Otros estudios han relacionado, aunque no de forma universal, la CM con la exposición a estatinas22,41,77,80, betabloqueantes22,41,76,80 y bifosfonatos22. Otro estudio, sin embargo no encontró diferencias en el consumo de la mayoría de estos fármacos entre pacientes con CM y aquellos con diarrea crónica22, lo que sugiere que podrían comportarse más como inductores de diarrea que como causa de verdadera CM.
Con menor frecuencia, se han documentado asociaciones significativas entre la CM y el consumo de inhibidores de la enzima convertidora de angiotensina80, antagonistas de los receptores de la angiotensina-II41 y, muy recientemente, de topiramato79.
La reciente introducción de un nuevo fármaco (en menos de 3 meses), especialmente en el caso de IBP o antiparkinsonianos, ha sido identificada como un factor de riesgo significativo asociado a CM78. En este sentido, la inducción de diarrea o su agravamiento tras la exposición a fármacos podría motivar la realización de una colonoscopia que facilitase así el diagnóstico de una CM subyacente, que no sería directamente causada por el fármaco. En contraste, el tiempo de exposición a fármacos específicamente asociados con CM fue generalmente largo (de 15 a 60 meses) en otro estudio41.
- c)
Datos de registros de prescripción de fármacos: Los 2 estudios de casos y controles disponibles basados en esta metodología han mostrado resultados opuestos: Mientras que un amplio estudio nacional danés incluyendo 5.751 casos con CC o CL mostró una asociación significativa con IBP, estatinas, AINE e inhibidores selectivos de la recaptación de serotonina77, el otro estudio desarrollado en Pennsylvania (EE. UU.) no mostró asociación alguna entre la CM y el consumo de fármacos habitualmente relacionados83, si bien el grado de concordancia entre el consumo declarado de fármacos por los pacientes y los datos registrados en la base fue generalmente bajo.
Muchos de los fármacos cuyo empleo ha sido asociado con la inducción de CM también se reconocen como causa de diarrea inducida por medicamentos. Entre ellos se encuentran las sales de oro, acarbosa, ticlopidina, sertralina, y, con menor frecuencia, IBP y AINE19,84, cuyos mecanismos de acción, en general, están en el origen de la propia diarrea (tabla 4).
Frecuencia con la que distintos fármacos causan diarrea
| Fármacos que causan diarrea en un 20% de pacientes | Fármacos que causan diarrea en un 10% de pacientes | Fármacos que ocasionalmente causan diarrea |
|---|---|---|
| Inhibidores de la alfa-glucosidasaBiguanidasSales de oroColchicinaDiacereinaTerapia antirretroviral altamente activaProstaglandinasInhibidores de la tirosincinasa | AntibióticosAgentes quimioterápicosAgonistas colonérgicosCisapridaDigoxinaAgentes inmunosupresoresMetoclopramidaOrlistat (inhibidor de lipasa)Laxantes osmóticosHidratos de carbono no absorbiblesInhibidores selectivos de la recaptación de serotonina | 5-aminosalicilatos (especialmente olsalacina)Inhibidores de la acetilcolinesterasaAnticolinérgicosCafeínaCalcitoninaCarbamazepinaÁcido quenodeoxicólicoColestiraminaInhibidores de la colinesterasaCimetidinaSulfato ferroso (raramente)Venotónicos flavonoidesEstatinasIrinotecánIsotretinoínaLevodopa-benserazidaAntiácidos de magnesioMetildopaAgonistas de la motilinaAntiinflamatorios no esteroideosOctreotidoPenicillaminaPrebioticosInhibidores de la bomba de protonesTacrinaTegaserodTeofilinaHormonas tiroideasTiclopidina |
Tomada de Abraham y Sellin19 (reproducida con permiso de Elsevier).
Por otro lado, es importante señalar que la mayoría de los pacientes con CM carecen de una historia farmacológica previa sugestiva, lo que descarta que los fármacos y sus metabolitos constituyan los principales agentes etiológicos para este enfermedad. Además, solo una pequeña parte de las asociaciones descritas entre fármacos y CM se sustentan en bases probabilísticas ciertas, atendiendo a los criterios propuestos por la OMS o por el método francés.
Junto a las limitaciones para establecer relaciones de causalidad, los diferentes criterios empleados para definir «exposición a fármacos» han variado ampliamente entre los diferentes estudios, abarcando desde haber recibido el paciente al menos una prescripción en el año previo (sin constancia de su cumplimiento)79,85, en los 6 meses previos22, el consumo actual (así considerado si la exposición del fármaco se produjo dentro de los 3 meses del inicio de los síntomas)80, hasta el consumo continuo o frecuente –al menos 3 días a la semana durante 2 semanas o más22,41. El tiempo medio de exposición a un determinado fármaco imputado en el desarrollo de CM antes del inicio de la clínica tampoco ha sido sistemáticamente considerado de manera uniforme por los diferentes estudios. Así, el estudio de imputabilidad de Beaugerie y Pardi27 mostró un rango muy amplio de tiempo entre la exposición al fármaco y el desarrollo de la clínica de diarrea acuosa, que varió de un día a 3 meses, si bien la tendencia fue a un comienzo rápido de los síntomas, en una mediana de 4 días.
Finalmente, los estudios de casos y controles que han mostrado asociaciones estadísticamente significativas entre ciertos fármacos y la CM lo han hecho considerando distintos tipos de poblaciones de referencia, desde población general75,77,80, hasta pacientes con síndrome de intestino irritable40,78, diarrea acuosa funcional22 o pacientes sometidos a intervenciones quirúrgicas41.
¿Qué hacer ante un paciente con colitis microscópica que está tomando fármacos que se asocian al inicio de colitis microscópica?Desde el punto de vista de la práctica clínica rutinaria este es un problema frecuente al tratar a pacientes con CM. Las recomendaciones están basadas en la opinión de expertos ya que no existen estudios controlados en este aspecto. Se aconseja:
- 1.
Suspender el fármaco sospechoso (si es innecesario o de eficacia dudosa) o si es posible cambiarlo por otro de eficacia similar. Valorar la respuesta clínica en 10-14 días, si persiste diarrea existe indicación de iniciar tratamiento específico.
- 2.
En caso de que la suspensión o el cambio del fármaco no sea justificable por razones médicas, se aconseja iniciar el tratamiento específico como si se tratara de un paciente que no recibiera tratamiento con estos fármacos.
La diarrea es un efecto adverso frecuente de múltiples fármacos, pudiendo aparecer por diversos mecanismos. Varios estudios de casos y controles han asociado la CM al consumo de algunos medicamentos, pero este hecho no puede implicar de modo inequívoco una relación causal en todos los casos, sino más bien aportar nuevas vías de investigación para las asociaciones descritas. Una relación causa-efecto verosímil entre la exposición a fármacos y CM solo se ha descrito para unos pocos fármacos y en casos individuales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.