La granulocitoaféresis es un procedimiento que permite depurar de la sangre diferentes poblaciones leucocitarias activas y modificar mediadores que intervienen en el proceso inflamatorio. De esta manera, y en base a su teórico efecto inmunomodulador, constituye un atractiva opción en el tratamiento de la enfermedad inflamatoria intestinal. Los estudios al respecto han tenido importantes limitaciones, pero cada vez tenemos más datos que nos ayudan a posicionar los escenarios posibles donde emplear la granulocitoaféresis. Estos son principalmente la enfermedad dependiente o refractaria a los corticoides, especialmente cuando los tratamientos inmunomoduladores y/o biológicos fracasan y cuando es necesario reducir o evitar los corticoides sistémicos. Su excelente perfil de seguridad le confiere un papel en situaciones de comorbilidad o riesgo para la utilización de los fármacos con efecto inmunosupresor o en pediatría. En esta revisión realizamos una puesta al día sobre el papel de la granulocitoaféresis en la enfermedad inflamatoria intestinal.
Granulocyte apheresis is a procedure that allows the removal of different activated leukocyte populations and it also modifies some circulating inflammatory mediators. These effects, along with its immunomodulatory potential, make it an attractive therapeutic option in inflammatory bowel disease. Previous studies with this technique have had significant limitations, but recent data is emerging about the ideal clinical setting in which granulocyte apheresis should be indicated. Most of the evidence supports its use in conditions that are dependent or refractory to corticosteroids, especially when treatments with immunomodulators or biologics has failed and when it is necessary to reduce or avoid the use of systemic corticosteroids. Its excellent safety profile gives it a role in cases of comorbidity or risk in the use of immunosuppressive drugs or in paediatric patients. In this review, we provide an update on the role of granulocyte apheresis in inflammatory bowel disease.
La enfermedad inflamatoria intestinal (EII) incluye básicamente la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), que característicamente tienen un curso recidivante con brotes de actividad1. Los corticoides continúan siendo el tratamiento de elección en la fase aguda, pero no modifican la historia natural de la enfermedad y presentan importantes efectos secundarios. Además, cada año alrededor del 50% de los pacientes desarrollan resistencia o dependencia a los corticoides2. En estos casos los inmunomoduladores (IMM) tiopurínicos, y más recientemente los fármacos biológicos anti-TNF, han supuesto una importante aportación, aunque en una proporción de pacientes estas medicaciones son ineficaces o presentan efectos adversos3. Por lo tanto, se necesitan otras opciones terapéuticas para controlar la progresión de la enfermedad y evitar intervenciones quirúrgicas.
La actividad inflamatoria en la EII se asocia a un incremento en sangre periférica de granulocitos y monocitos-macrófagos activados y a una infiltración intestinal por estas células inflamatorias que son responsables, en gran medida, del daño tisular mediante la liberación de proteasas, radicales libres de oxígeno y otros mediadores. El grado de infiltración mucosa por neutrófilos se ha asociado cuantitativamente con la gravedad del cuadro y se ha definido incluso como un factor predictivo de recidiva4. Por tanto, la reducción de células inflamatorias mediante técnicas de citoaféresis se ha propuesto como un mecanismo terapéutico en la EII y en otras enfermedades autoinmunes. Esto ofrece una aproximación diferente al enfoque de tratamiento habitual, en tanto que se centra en extraer elementos implicados en el desarrollo de la enfermedad en lugar de introducir un agente externo farmacológico.
En los últimos años vamos disponiendo de estudios prospectivos y de práctica clínica, tanto japoneses como también europeos, que aportan datos sobre el papel de la granulocito-monocito aféresis (GMA) en escenarios específicos de la EII. Estos datos se plasman en diversos metaanálisis; el más reciente de 20165. Los datos que se presentan en ellos contribuyen a posicionar a la GMA como alternativa eficaz y segura en el tratamiento de la CU. La American Society for Apheresis (ASFA) considera a la aféresis leucocitaria como una terapia de segunda línea, ya sea sola o en asociación con otras medidas, en el tratamiento de la CU (calidad de la evidencia moderada)6.
En la presente revisión pretendemos realizar una puesta al día de los aspectos más relevantes publicados en los últimos años sobre el papel actual de la aféresis en la EII, estando vigente en su mayoría los datos recogidos en revisiones previas realizadas en nuestro medio7,8.
Mecanismo de acciónLa técnica de la aféresis se basa en la recirculación de la sangre del paciente por un circuito con una columna de diferentes materiales que favorecen la eliminación selectiva de células. Para esto es necesario canular dos vías venosas periféricas antecubitales, siendo excepcional la necesidad de un acceso central. Disponemos principalmente de tres sistemas en el mercado. En el primero, y el más extendido en España, la columna se rellena de aproximadamente 35.000 cuentas de acetato de celulosa de 2mm de diámetro (Adacolum®, Japan Immnunoresearch Laboratories, JIMRO, Takasaki, Japón). En este caso se eliminan un 65% de granulocitos, un 55% de monocitos y un 2% de linfocitos9,10. En el segundo sistema, llamado Cellsorba® (AsahiKasei Medical Co. Ltd., Tokio, Japón), se usa una membrana no tejida de fibra de poliéster. En este caso se adhieren un 99% de granulocitos y monocitos, un 70% de linfocitos y un 35% de plaquetas11. Existe comercializada otra columna con cuentas de poliarilato, aunque solo disponemos de datos preliminares con ella (Immunopure®, Nikkiso, Tokyo, Japón)12.
La acción de la aféresis requiere la capacidad de actuar selectivamente sobre determinadas subpoblaciones celulares y ciertos factores humorales. En el caso de la GMA inicialmente, la IgG y los inmunocomplejos circulantes se adhieren a las cuentas de celulosa9,13. Esto permite que los leucocitos se adhieran a su vez a la fracción Fc mediante los receptores de inmunoglobulina (FcγR)9,13. Asimismo se produce una activación del complemento que incluye a C3a y C5a, generando fragmentos C3b/C3bi que actúan como opsoninas9. Esto se favorece mediante la acción de receptores de complemento como CR1/CD35, CR2/CD21 y CR3 (Mac-1, CD11b/CD18). La selectividad del efecto sobre los granulocitos, monocitos y plaquetas se debe a la distribución de estos receptores de membrana en las diferentes líneas celulares. Por este motivo, los linfocitos se ven afectados mínimamente por este tipo de aféresis al expresar receptores del complemento solo en pequeñas subpoblaciones de linfocitosB, T y natural killer (NK). De forma similar, el FcγR solo está presente en algunas poblaciones de linfocitosB CD19+ y NK CD56+. De hecho, puede observarse un incremento del recuento absoluto de linfocitos tras las sesiones14.
Estos sucesos en la columna de GMA se siguen de otros cambios inmunológicos. Hay que resaltar la disminución de neutrófilos CD10+ (activados), que lleva a una compensación desde la médula ósea de una población de neutrófilos CD10− (inmaduros)15. A pesar de que no existe un efecto directo de eliminación de linfocitos, sí parece haber una modulación de algunas poblaciones como los CD4+CD25+ (Treg)16. Otros efectos que se han observado son una disminución de L-selectina circulante (CD62L) y un aumento de Mac-1 (CD11b)17. Más recientemente, estudios in vitro han mostrado una reducción en la producción de IL-23, aunque la correlación entre el grado de adsorción y los niveles de la interleucina era muy débil18. Esto podría estar en relación con el descenso en los niveles de TGF-β observado también in vitro, aunque no ha sido reproducido en todos los estudios19,20.
Además de los efectos de la aféresis sobre estos elementos del sistema inmune, han sido de gran interés los estudios sobre los cambios en la mucosa colónica. Al estudiar la expresión de diferentes marcadores se ha comprobado que los pacientes con respuesta a la técnica presentaban además una disminución de IL-1 beta, IL-1ra, IL-6, IL-8, IFN-γ y TNF-α en el colon21,22.
Escenarios de empleo de la aféresisColitis ulcerosa. Corticodependencia y corticorrefractariedadLa GMA permite reducir o retirar la administración de corticoides evitando los efectos secundarios de estos23. La corticodependencia es el escenario más común de utilización de la aféresis en Europa, aunque su empleo está limitado por la falta de estudios controlados. El Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) ha promovido recientemente un estudio controlado, aleatorizado y abierto para comparar la asociación de GMA y prednisona frente al tratamiento convencional con un curso de prednisona en pacientes con CU activa corticodependiente. La adición de GMA al tratamiento corticoideo no incrementó la tasa de remisión libre de corticoides a la semana 24 como variable principal de eficacia, pero sí retrasó significativamente el tiempo hasta la recidiva. Aunque los resultados de este estudio probablemente estén condicionados por el exigente objetivo primario planteado y por no haber alcanzado el reclutamiento previsto, en el subgrupo de pacientes naïve a tratamiento con IMM tiopurínicos la tasa de remisión libre de corticoides a 24semanas fue superior con la adición de GMA. Por otro lado se confirmó una tasa de efectos adversos relacionados con los corticoides inferior en el grupo que recibió GMA24.
La GMA se puede considerar una alternativa terapéutica en la CU corticodependiente o corticorrefractaria con respuesta insuficiente o intolerancia a inmunosupresores y/o biológicos. Un reciente estudio prospectivo abierto, multicéntrico, no controlado (estudio ART) evaluó la eficacia de 5 a 10 sesiones de aféresis con Adacolumn® en una cohorte de 86 pacientes con un perfil de difícil tratamiento. La inducción de la remisión a la semana12, como objetivo primario del estudio, fue del 39%, y la de remisión libre de esteroides, del 22,6%. Un 30% de los pacientes en que tanto los inmunosupresores como los agentes anti-TNF habían fracasado alcanzaron la remisión25. Los resultados finales del estudio, comunicados en forma de abstract26, indican que la remisión a largo plazo, manteniendo estables los IMM previos, permanece en el 33% de los pacientes a las 48 semanas, con una tasa de colectomía del 14%, comparable a la descrita en estudios controlados de infliximab en CU27. Estos datos de eficacia y seguridad, tanto a corto como a largo plazo, confirman los datos del registro SiMAC en una cohorte de 142 pacientes corticodependientes de similares características de refractariedad a tratamiento inmunosupresor o biológico28. La aféresis puede contribuir a recuperar la eficacia de los IMM tiopurínicos cuando estos fracasan y rescatar algunos pacientes corticodependientes de la cirugía29,30. La GMA también ha mostrado eficacia a corto plazo así como mantenida en el tiempo, con tasas de remisión más elevadas (71% tras inducción y 48% al año) en pacientes con enfermedad corticodependiente o corticorrefractaria menos evolucionada al no haber llevado tratamiento previo con IMM ni biológicos31.
El pioderma gangrenoso y la hidrosadenitis supurativa son dos manifestaciones que pueden asociarse a la EII. Recientemente se ha descrito la utilidad de la GMA en estos procesos de difícil control, aunque por el momento se trata solo de casos aislados32,33.
Enfermedad de CrohnLos resultados en el ensayo clínico aleatorizado más relevante no mostraron diferencias en la eficacia frente a una columna ficticia en una población no seleccionada de pacientes con EC moderada-grave34. En este estudio se incluyeron un total de 235 pacientes, en los que se realizaron 10 sesiones en las que se filtraron 1.800ml por sesión. No se encontraron diferencias significativas a las 12 semanas en la tasa de remisión (17,8 vs 19,2%, p=0.858). De todas formas, en los análisis exploratorios realizados se observó que los pacientes con una mayor actividad clínica basal (CDAI>300) eran los que más se beneficiaban de este tratamiento. Hay que destacar también que, a pesar de que todos los pacientes tenían síntomas al inicio, solo el 15% tenían actividad endoscópica confirmada.
Se ha estudiado también una estrategia de tratamiento diferente combinando la GMA con tiopurinas en EC activa precoz (menos de 2 años de evolución) y no expuesta previamente a corticoides ni biológicos35. Se obtuvieron buenos resultados en cuanto a remisión clínica rápida (77% a las 6semanas) y a largo plazo (82% a las 52semanas). De todas formas, resulta difícil evaluar los datos dado el pequeño tamaño de la serie, la dosis media baja de tiopurinas y la ausencia de un grupo control.
Además del ensayo citado, el resto de la evidencia reciente disponible en EC proviene de series más pequeñas. Dentro de la experiencia italiana publicada en 2014 se ha descrito la respuesta en 35 pacientes con EC moderadamente activa (CDAI 247±37)31. La mayoría de estos pacientes eran corticodependientes (63%) y ninguno de ellos había recibido previamente IMM ni biológicos. Se alcanzó la remisión en un 63%, sin diferencias según la respuesta previa a los corticoides. Esta respuesta se mantuvo en el 54 y en el 43% a los 6 y 12meses, respectivamente. En una serie más reciente procedente de Suecia se trataron 14 pacientes con EC, en su mayoría con 8 sesiones con una cadencia semanal, alcanzando la remisión al final del ciclo un 14% y un 36% una respuesta parcial36. No disponemos de datos sobre los tratamientos previos y la respuesta a los corticoides en estos pacientes. Ninguno de los tres pacientes que recibieron un segundo ciclo 2-3meses tras una respuesta parcial obtuvo beneficio con este segundo tratamiento.
En estudios previos se ha sugerido que los pacientes con EC que más se podrían beneficiar son aquellos con afectación colónica37. Al evaluar con FDG-PET los cambios durante el tratamiento con aféresis se ha observado que hay una disminución en la captación en todas las lesiones mediante FDG-PET, independientemente de la localización38. A pesar de los datos disponibles en los últimos años, es evidente que necesitamos más información para evaluar el posible efecto, las pautas y el posicionamiento de este tratamiento en la EC.
Prevención de recidivaLa cicatrización mucosa constituye un objetivo clave en el tratamiento de la CU que se asocia a la reducción del riesgo de recidiva y a la necesidad de cirugía39. Por otro lado, la determinación de calprotectina fecal tiene una buena correlación con el grado de actividad lesional determinada por endoscopia40. La aféresis puede constituir una alternativa en pacientes con enfermedad con alto riesgo de recidiva por presentar niveles elevados de calprotectina fecal, como muestra el estudio abierto controlado de Maiden et al.41, especialmente en casos de difícil control por presentar recidivas frecuentes o con mala respuesta o intolerancia a los tratamientos farmacológicos.
Tratamiento combinado con biológicosAl igual que con el resto de tratamientos, también se ha planteado la posibilidad de usar la aféresis asociada a biológicos. De todas formas, no disponemos de mucha información sobre las diferentes opciones y su eficacia. El primer caso se describió en nuestro país en 2006 en un paciente con EC colónica que presentaba pérdida de respuesta a infliximab42. Se realizaron sesiones de mantenimiento cada 8semanas, alternándose con las infusiones de infliximab. Con esta combinación se alcanzó la remisión tanto clínica como endoscópica. Más tarde se ha descrito su uso en otro paciente con EC ileocolónica con pérdida de respuesta a infliximab al que se le realizaron sesiones de aféresis mensuales, manteniendo posteriormente la remisión con monoterapia con aféresis43. Otro caso con pérdida de respuesta a adalimumab también alcanzó remisión clínica, aunque no endoscópica, con una pauta intensiva de aféresis44. El estudio con mayor número de pacientes incluyó 10 sujetos con CU activa moderada-grave45. Se inició adalimumab junto con la aféresis en pauta intensiva (dos sesiones semanales) durante la inducción, manteniendo posteriormente adalimumab en monoterapia. Alcanzaron la remisión clínica un 56% a las 10semanas (objetivo primario) y un 33% a las 52semanas. El escaso número de pacientes tratados, la ausencia de un grupo control, así como la diferente estrategia de manejo de estos pacientes en nuestro medio, no permite conocer si el tratamiento combinado desde el inicio incrementa la efectividad de cada una de las opciones por separado. En nuestra experiencia, aunque en un número limitado de pacientes, la asociación de aféresis al tratamiento biológico ha sido útil, especialmente en pacientes con CU y respuesta parcial al mismo46. En EC refractaria se han comunicado experiencias iniciales con GMA en pauta intensiva asociada a adalimumab47.
En resumen, parece que puede obtenerse un efecto beneficioso con la asociación de la aféresis a tratamientos biológicos, especialmente tras una respuesta parcial o pérdida de respuesta a estos. Al contrario que con otras combinaciones de tratamientos, la aféresis ofrece un muy buen perfil de seguridad. De todas formas, aún desconocemos los mecanismos por los que la aféresis podría influir en la farmacocinética de los biológicos, y la evidencia sobre su beneficio clínico aún es muy débil para generalizar su uso.
PediatríaLa población infantil con EII está formada por un grupo de pacientes con características propias, de entre las que destaca la necesidad de tratamientos seguros y sin efectos adversos, especialmente sobre el crecimiento. Por este motivo se ha evaluado la aféresis como una opción en esta población de pacientes. En un escenario con una enfermedad de reciente diagnóstico (media 6,4±3,4meses) se obtuvieron resultados favorables usando la aféresis en pacientes no expuestos previamente a inmunosupresores48. En este caso, el tratamiento en monoterapia con 11 sesiones de aféresis alcanzó la remisión clínica en el 70% y la remisión profunda (clínica y endoscópica) en el 53%. En el 30% que no respondieron inicialmente a la aféresis sí lo hicieron al añadir 0,5-1mg/kg/día de prednisona oral, siendo posible retirar los corticoides 3meses después. Todos los efectos adversos observados fueron leves (dolor en la zona de punción, cefalea, náuseas, vómitos y fotofobia). En un estudio publicado más recientemente se incluyeron de forma prospectiva 25 pacientes con CU moderadamente activa (edad media 13,5±2,6 años; PUCAI [índice de actividad de colitis ulcerosa pediátrica] 42,6±40)49. En este caso, el 60% de los pacientes eran refractarios a IMM. Se realizaron 5 sesiones semanales filtrando 1.800ml por sesión. En el 70% observaron una disminución significativa o moderada en el PUCAI, aunque el estudio carecía de potencia estadística suficiente. El 32% de los casos presentaron algún efecto adverso relacionado con la técnica, ninguno de ellos grave. A pesar de que los datos en la CU pediátrica son limitados, en general apoyan el posible beneficio clínico de la aféresis en algunos de estos pacientes refractarios, incluso a inmunosupresores, pudiendo limitar el empleo de corticoides.
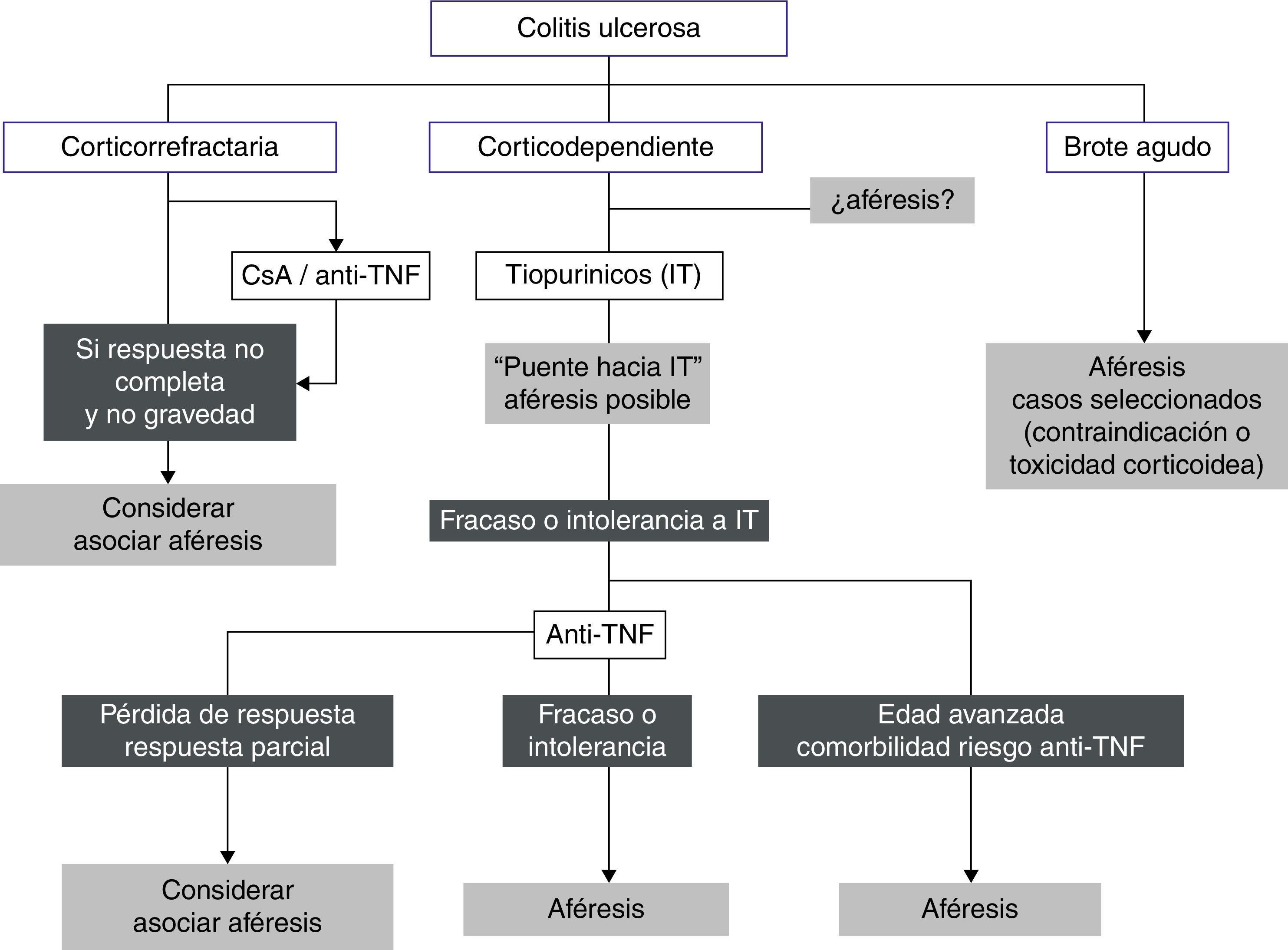
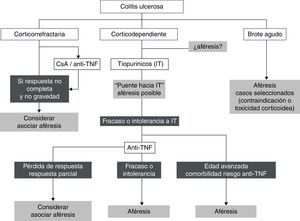
La figura 1 recoge un posible algoritmo de su utilización en CU.
Pautas de tratamientoFrecuencia de las sesionesLa pauta habitual de una sesión de aféresis semanal durante 5semanas consecutivas tiene una base empírica. Diversos estudios han valorado el empleo de regímenes «intensivos» con dos e incluso tres sesiones semanales, al menos en las primeras semanas. En general todos ellos apuntan a un menor tiempo hasta alcanzar la remisión tanto en EC como CU sin que la eficacia global de la técnica se vea afectada50,51. Incluso se ha descrito el empleo diario de la aféresis en 5días consecutivos sin mostrar problemas de seguridad y con una tasa de remisión del 23% al sexto día52. A pesar de estos resultados, parece ser que la eficacia de la aféresis es tiempo-dependiente y algunos de sus mecanismos de acción, así como la reducción del infiltrado por neutrófilos en la mucosa, precisan de varias semanas53,54.
Número de sesionesEste punto continúa siendo controvertido. El empleo de 5sesiones en 5semanas versus 10sesiones en 8semanas muestra una eficacia similar55,56; no obstante, el empleo de un mayor número de sesiones parece incrementar la eficacia en los casos más refractarios, y en el diseño de los últimos estudios controlados en corticodependencia se han empleado más de 5 sesiones24-26.
RetratamientoUn aspecto importante en la práctica clínica es la posibilidad de re-tratar a los pacientes con ciclos repetidos de aféresis. Veintiséis (65%) de los 40 pacientes con EII refractaria a tratamiento convencional tratados con GMA en una cohorte sueca alcanzaron la remisión clínica y endoscópica. De esos 26 casos, los que presentaron una recidiva durante el seguimiento fueron retratados con nuevos ciclos de GMA, alcanzándose la remisión de nuevo en prácticamente todos los pacientes, en un caso incluso hasta en 5ocasiones57.
Volemia procesadaCon la pauta estándar de tratamiento de 60min de duración por sesión a un flujo de 30ml/h se procesan aproximadamente 1.800ml/sesión, lo cual supone una fracción del volumen sanguíneo circulante (VSC) que puede ser muy dispar en función del sexo, peso y talla de cada paciente, siendo un importante factor que puede condicionar los resultados58. Para un varón de 70kg de peso y 170cm de altura esto supondría un 38% de su VSC. Por otro lado, con esta pauta las columnas pueden no ser empleadas hasta su máxima capacidad. Aunque no existen datos consistentes, adaptar el flujo de la bomba, y sobre todo el tiempo de duración de las sesiones de cada paciente, en función de sus características antropométricas podría permitir tratar la misma fracción predefinida o incluso la totalidad del VSC calculado en todos los pacientes y aumentar así el rendimiento de la técnica. Este es un importante aspecto a replantear, y a ello contribuyen estudios como el de Yoshimura et al.59, en el que, aunque con pocos pacientes, el filtrado en función del peso (60ml/kg) tiende a mostrar mejores resultados que la pauta estándar de 1.800ml/sesión, y el de Kanke et al.60, con mejores resultados al prolongar las sesiones a 90min (filtrado de 2.700ml/sesión) con este mismo objetivo.
SeguridadLos recientes estudios observacionales y registros de seguimiento reafirman la seguridad como una de las principales características de este procedimiento28,61. La tasa de efectos adversos comunicada se estima en un 2-3% de las sesiones, afectando a alrededor del 20% de los pacientes tratados23. En general estos efectos adversos son leves (cefalea, escalofríos, fatiga, rubor, febrícula) y no obligan a interrumpir el tratamiento. Las principales limitaciones del procedimiento son las relacionadas con la dificultad de obtener adecuados accesos venosos periféricos o los problemas de relacionados con el circuito en su mayoría solventables con un personal de enfermería entrenado en los procedimientos de aféresis. Recientemente se ha comunicado que es posible aplicar la técnica con régimen intensivo de 2sesiones/semana utilizando un único acceso venoso de punción con resultados comparables en efectividad, seguridad y problemas del circuito al empleo convencional de dos accesos venosos antecubitales, pudiendo constituir una alternativa a la necesidad de recurrir a una vía central en ciertos casos62.
Por otra parte, cada vez se describen más casos de pacientes con EII con infecciones concomitantes en quienes el efecto inmunosupresor del tratamiento farmacológico disponible puede ser de alto riego (hepatitisB, citomegalovirus) habiendo sido tratados exitosamente con aféresis63,64.
En la tabla 1 se recoge el perfil de paciente candidato a GMA desde el punto de vista de seguridad de la técnica.
Perfil del paciente candidato a granulocito-monocito aféresis (GMA) en base a su seguridad
| Contraindicación o toxicidad de corticoides | Diabetes, enfermedad ósea, HTA, glaucoma, retraso del crecimiento en niños |
| Comorbilidad importante | Edad avanzada |
| Insuficiencia cardiaca | |
| Antecedente de neoplasia | |
| Riesgo del tratamiento inmunomodulador o biológico | Estados de inmunosupresión |
| Infecciones asociadas | |
| Protección no confirmada frente a hepatitis B o tuberculosis |
Los datos al respecto son limitados. Un estudio en nuestro medio concluye que la GMA es una opción coste-efectiva en CU corticodependiente65. Un estudio escandinavo encuentra que el mayor coste económico de las columnas permite una ganancia en años de vida ajustados por calidad (QALY) dentro de los estándares favorables de coste-utilidad23,66.
ConclusionesLa GMA constituye una opción terapéutica que permite «tratar sin fármacos» algunas formas leves-moderadas de EII, fundamentalmente en caso de corticodependencia o refractariedad a otros tratamientos y principalmente ante situaciones de riesgo para tratamientos de uso frecuente, como los IMM o biológicos. Aspectos del procedimiento relacionados con la volemia procesada y la frecuencia de las sesiones pueden mejorar su rendimiento, pero estos aspectos, así como su efectividad en otros escenarios, precisan ser confirmados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesJosé Luis Cabriada ha participado en asesoramiento científico y ha recibido soporte para investigación por parte de Otsuka Pharmaceuticals, Abbvie, MSD y Takeda. Iago Rodríguez-Lago declara no tener conflictos de intereses relacionados con esta publicación.