La enfermedad de Crohn afecta a una parte de la población joven y tiene un fuerte impacto en la calidad de vida. Su etiología es desconocida y los fármacos existentes no son curativos. Además, una proporción significativa de pacientes presentan intolerancia, refractariedad o pérdida de respuesta a los tratamientos médicos disponibles y por la extensión o la localización de las lesiones no son buenos candidatos a cirugía. En los últimos años se está llevando a cabo una exhaustiva investigación sobre nuevas formas de afrontar la enfermedad de Crohn refractaria, incluyendo nuevas dianas terapéuticas pero también la terapia celular, como el trasplante de células madre, con resultados esperanzadores.
Crohn's disease affects a part of the young population and has a strong impact on quality of life. Its etiology is unknown and existing drugs are not curative. In addition, a significant proportion of patients present intolerance, refractoriness, or loss of response to available medical therapies, and surgery is not a good option due to the extent or location of the disease. In recent years, a thorough investigation into new ways of dealing with refractory Crohn's disease is being developed, with new medical therapeutic targets but also cell therapy, including stem cell transplant, with encouraging results.
Los objetivos del tratamiento de la enfermedad de Crohn (EC) incluyen la inducción y el mantenimiento de la remisión clínica e, idealmente, la cicatrización completa de las lesiones intestinales con el fin último de reconstituir la función intestinal normal. El tratamiento médico de la EC incluye el uso de corticoides, fármacos inmunomoduladores (tiopurinas, metotrexato), anticuerpos monoclonales contra el factor de necrosis tumoral (anti-TNF) y bloqueadores de las integrinas (vedolizumab). Los corticoides son capaces de inducir la remisión clínica pero no son adecuados para el mantenimiento de la remisión ni para alcanzar la curación mucosa1,2. Los fármacos inmunomoduladores han demostrado su eficacia para el mantenimiento de la remisión en la EC luminal y perianal, pero hasta un 25% de pacientes presentan intolerancia o efectos adversos relacionados con las tiopurinas3,4. Los fármacos anti-TNF (infliximab, adalimumab) son eficaces tanto para la inducción como para el mantenimiento de la remisión, pero un tercio de los pacientes presentan falta de respuesta de primaria y hasta el 50% presentan pérdida de respuesta secundaria a lo largo del tratamiento5-12. Más recientemente, vedolizumab, un anticuerpo anti-α4β7 anti-integrina, ha demostrado también su eficacia para la inducción y el mantenimiento de la remisión en pacientes con EC activa moderada-grave con respuesta inadecuada, pérdida de respuesta o intolerancia al tratamiento convencional o a anti-TNF13.
Por lo tanto, una proporción no despreciable de pacientes presentan intolerancia, refractariedad o pérdida de respuesta a los fármacos disponibles y por la extensión o la localización de las lesiones no son buenos candidatos a una aproximación quirúrgica. Por todo ello, en los últimos años se está llevando a cabo una amplia investigación sobre nuevas formas de afrontar la EC refractaria.
Por un lado, se están evaluando nuevas moléculas con distintos mecanismos de acción. Los nuevos fármacos biológicos en proceso de investigación incluyen, entre otros, anticuerpos anti p40 que bloquean IL-12 e IL-23 (ustekinumab), anticuerpos anti p10 que bloquean IL-23 (risankizumab, MEDI2070), los inhibidores de Janus Kinasa (JAK) (tofacitinib), así como oligonucleótidos anti-sentido SMAD7 (Mongersen)14-16.
Por otro lado, las propiedades biológicas únicas de las células madre, su capacidad de autorrenovación y de regenerar tejidos y sistemas de órganos y su potencia inmunomoduladora han desembocado en un campo de investigación apasionante y novedoso. Así, se ha evaluado la eficacia de la administración sistémica de células mesenquimales autógenas para el tratamiento de la EC luminal17, la inyección local de células mesenquimales alogénicas en la EC perianal18, la administración intraperitoneal de células dendríticas tolerogénicas19 o la administración intravenosa de célulasT reguladoras para la EC luminal20. Asimismo, la evidencia acumulada en los últimos años sobre la eficacia del trasplante de progenitores hematopoyéticos (TPH) hacen de este último una opción terapéutica para pacientes con enfermedades mediadas por la inmunidad refractarias a tratamiento convencional, incluyendo la EC.
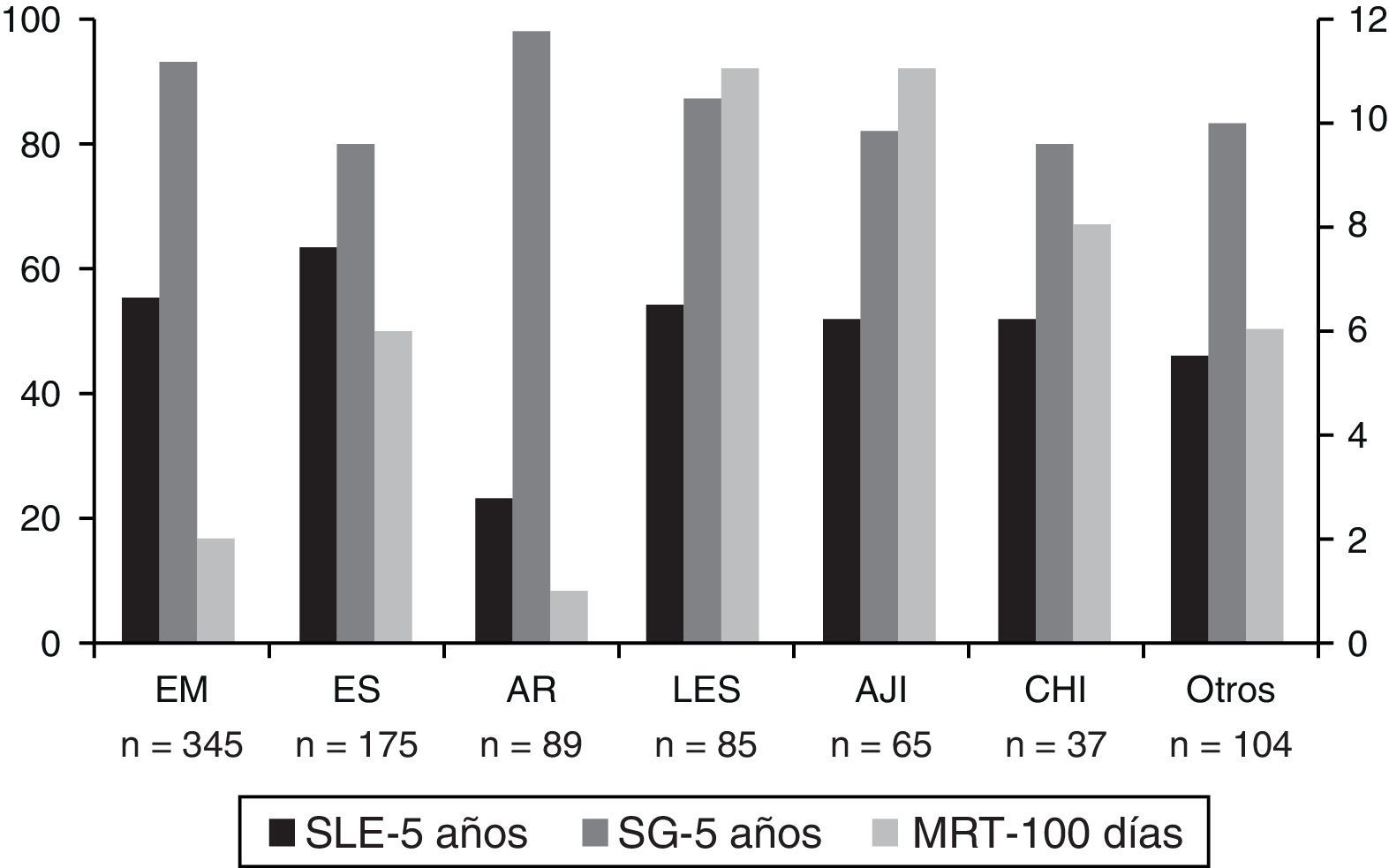
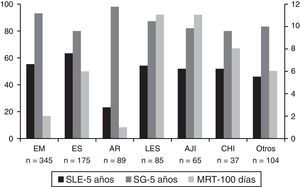
Trasplante de progenitores hematopoyéticos para el tratamiento de enfermedades mediadas por la inmunidadEl uso clínico del TPH como tratamiento específico de enfermedades mediadas por la inmunidad comenzó a finales de 1990 y se basa en los resultados de décadas de experimentación en modelos animales y en la observación de remisiones sostenidas de dichas enfermedades en pacientes trasplantados por un proceso maligno intercurrente21,22. En 1997, un comité internacional formado por miembros de la European Blood and Marrow Transplantation Group (EBMT) estableció las directrices sobre las indicaciones y protocolos de trasplante para el tratamiento de enfermedades inmunomediadas que fueron posteriormente actualizadas en 201223. Además, se creó una base de datos para monitorizar la indicación, la viabilidad, la eficacia y la toxicidad de los distintos protocolos de trasplante aplicado al tratamiento de enfermedades no neoplásicas. En la última revisión de la misma se habían incluido un total de 1.300 pacientes con enfermedades inmunomediadas que habían recibido un trasplante autógeno (más del 95%) o alogénico, siendo las enfermedades neurológicas (esclerosis múltiple) y las enfermedades del tejido conectivo (esclerosis sistémica) las indicaciones más frecuentes24. El análisis de estos pacientes puso de manifiesto una supervivencia global a los 5años del trasplante del 87%, una progresión libre de enfermedad a los 5años del 43% y una mortalidad relacionada con el trasplante durante los primeros 100días de entre el 1 y el 11% (fig. 1). Así, las guías clínicas de la EBMT-Autoimmune Diseases Group establecen que: a)el trasplante autógeno es de elección, en contraste con el alogénico, y debe ser considerado como una opción terapéutica en pacientes con enfermedades inmunomediadas refractarias a tratamientos convencionales; b)los pacientes candidatos deben ser referidos a centros con equipos multidisciplinares, con experiencia específica en el tratamiento de enfermedades inmunomediadas y que dispongan de una acreditación Joint Accreditation Committee of the International Society for Cellular Therapy (JACIE) o similar; c)siempre que sea posible, el TPH debe ser realizado en el contexto de un estudio clínico faseii o iii, y d)en ausencia de estudios clínicos disponibles, el TPH pude ser considerado como una «opción clínica» tras discusión multidisciplinar de cada caso.
Resultados globales del trasplante autógeno de progenitores hematopoyéticos en enfermedades mediadas por la inmunidad.
AJI: artritis juvenil idiopática; AR: artritis reumatoide; CHI: citopenias hematológicas inmunes; EM: esclerosis múltiple; ES: esclerosis sistémica; LES: lupus eritematoso sistémico; MRT: mortalidad relacionada con el trasplante (primeros 100días); SG: supervivencia global a los 5años del trasplante; SLE: supervivencia libre de enfermedad a los 5años del trasplante.
Aunque el mecanismo de acción no está del todo establecido, la hipótesis más aceptada es que la quimioterapia empleada durante el TPH autógeno y la posterior reinfusión de progenitores hematopoyéticos permite regenerar un nuevo repertorio policlonal de célulasT, induce la formación de célulasT reguladoras derivadas del timo, restaura la tolerancia periférica a autoantígenos (en el caso de la EC probablemente la tolerancia a antígenos bacterianos) y elimina células productoras de autoanticuerpos. Se consiguen, pues, no solo cambios inespecíficos derivados del uso de citotóxicos, sino también la «reeducación» del sistema inmunológico hacia un perfil de inmunotolerancia25-27. Por otra parte, el trasplante alogénico añade a los mecanismos de acción previamente descritos la corrección de la predisposición genética a padecer la enfermedad mediante la infusión de células procedentes de un donante sano.
Trasplante autógeno de progenitores hematopoyéticos: movilización y acondicionamientoEl TPH autógeno puede realizarse tanto con células madre movilizadas de sangre periférica como con médula ósea, aunque las primeras se consideran de elección por ser más fácilmente recolectadas y poseer mejores características como injerto. En la mayoría de enfermedades mediadas por la inmunidad, la movilización con factor de crecimiento de colonias de granulocitos (G-CSF) es segura pero se han descrito exacerbaciones de la enfermedad de base, por lo que habitualmente se combina con un quimioterápico que ayuda a prevenir brotes y a mejorar la calidad de las células movilizadas con un descenso significativo de célulasT28. No existen estudios que evalúen diferentes regímenes de movilización, pero la mayoría de pacientes son tratados con ciclofosfamida 2-4g/m224.
El acondicionamiento puede realizarse con regímenes de mayor o menor intensidad mieloablativa. Así, existen regímenes no mieloablativos que emplean ciclofosfamida con o sin globulina antitimocítica (ATG), regímenes de intensidad mieloablativa baja que emplean fármacos no mieloablativos asociados a melfalán o BEAM (carmustina, etopósido, citarabina y melfalán) o regímenes de alta intensidad mieloablativa, que asocian a fármacos no mieloablativos la irradiación corporal total o dosis completas de busulfán. El argumento a favor de emplear regímenes no mieloablativos o de baja intensidad para el tratamiento de enfermedades no malignas, como las enfermedades mediadas por la inmunidad, reside en una mayor seguridad y una menor mortalidad asociada29.
Existe controversia sobre si la selección ex vivo de células CD34+ aporta beneficios en el TPH autógeno en enfermedades inmunomediadas. Un estudio reciente realizado en pacientes con esclerosis sistémica mostró que la selección de CD34+ no añade beneficios ni en la supervivencia global, ni en la progresión libre de enfermedad, ni en la incidencia de recidiva o de progresión de la enfermedad30.
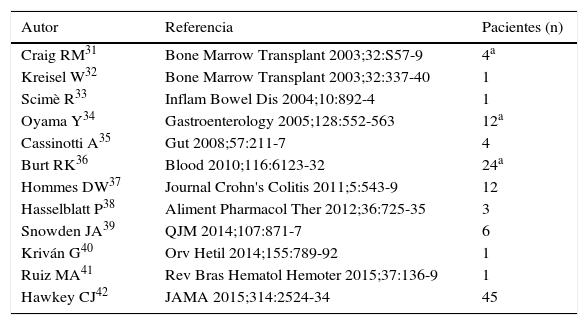
Trasplante autógeno de progenitores hematopoyéticos en la enfermedad de CrohnLa tabla 1 muestra los artículos publicados en la literatura sobre la eficacia del TPH autógeno para el tratamiento de pacientes con EC refractaria que incluyen entre uno y 45 pacientes31-42. La serie no controlada más amplia publicada hasta la fecha procede de la Northwestern University Medical Center de Chicago, con un total de 24 pacientes34. Los pacientes incluidos tenían una edad media de 27años (15-52años), una EC activa con un Índice de actividad de la enfermedad de Crohn (CDAI) medio de 291 (250-358), más del 50% ya había precisado alguna resección quirúrgica previa y todos ellos eran refractarios a inmunomoduladores y a anti-TNF. El régimen de acondicionamiento consistió en ciclofosfamida y ATG. La supervivencia libre de enfermedad, definida como el porcentaje de pacientes que no precisaron reiniciar tratamiento específico para la EC, fue del 91% al año, del 63% a los2 años, del 57% a los 3años, del 39% a los 4años y del 19% a los 5años de seguimiento tras el trasplante. El 53% de los pacientes que recidivaron (15/24) alcanzaron de nuevo la remisión clínica sin fármacos tras la inducción de la misma mediante fármacos. El porcentaje de pacientes en remisión, con o sin tratamiento, fue de entre el 70 y el 80% en cada evaluación anual durante los 5años de seguimiento. Asimismo, la supervivencia libre de fármacos fue superior al 60% en cada evaluación y la supervivencia libre de esteroides, superior al 80%. En este grupo de pacientes no hubo mortalidad asociada al procedimiento, siendo la fiebre neutropénica y las bacteriemias las complicaciones asociadas más frecuentes.
Artículos publicados en la literatura sobre la eficacia del TPH autógeno para el tratamiento de pacientes con EC refractaria
| Autor | Referencia | Pacientes (n) |
|---|---|---|
| Craig RM31 | Bone Marrow Transplant 2003;32:S57-9 | 4a |
| Kreisel W32 | Bone Marrow Transplant 2003;32:337-40 | 1 |
| Scimè R33 | Inflam Bowel Dis 2004;10:892-4 | 1 |
| Oyama Y34 | Gastroenterology 2005;128:552-563 | 12a |
| Cassinotti A35 | Gut 2008;57:211-7 | 4 |
| Burt RK36 | Blood 2010;116:6123-32 | 24a |
| Hommes DW37 | Journal Crohn's Colitis 2011;5:543-9 | 12 |
| Hasselblatt P38 | Aliment Pharmacol Ther 2012;36:725-35 | 3 |
| Snowden JA39 | QJM 2014;107:871-7 | 6 |
| Kriván G40 | Orv Hetil 2014;155:789-92 | 1 |
| Ruiz MA41 | Rev Bras Hematol Hemoter 2015;37:136-9 | 1 |
| Hawkey CJ42 | JAMA 2015;314:2524-34 | 45 |
a Reportados también en Burt et al., 201036.
Otra serie amplia procedente de Barcelona incluyó un total de 29 pacientes con edad media de 29años (16-49años)43. Todos ellos eran refractarios a terapias convencionales y el 45% habían precisado cirugía resectiva previa. La proporción de pacientes con CDAI<150, que no habían precisado reiniciar tratamiento para la EC ni habían requerido cirugía a los 6meses del trasplante fue del 82%, del 52% a los 2años, del 39% a los 4años y del 15% a los 5años, resultados superponibles a los obtenidos en la serie de Chicago. El 80% de los pacientes que presentaron recidiva durante el seguimiento alcanzaron de nuevo la remisión clínica tras la reintroducción de tratamiento médico convencional, consistente en la mayoría de los casos en un anti-TNF con/sin un inmunomodulador asociado. Los efectos secundarios graves más frecuentes se relacionaron con infecciones bacterianas, la mayoría de origen abdominal, y se observaron en los primeros 5 pacientes trasplantados. Tras la introducción de cambios en la política antibiótica y nutricional no se observaron más infecciones bacterianas44. A largo plazo, los efectos secundarios más frecuentes fueron las infecciones víricas (citomegalovirus, Epstein-Barr). En esta serie se produjo un fallecimiento secundario a una infección diseminada por citomegalovirus.
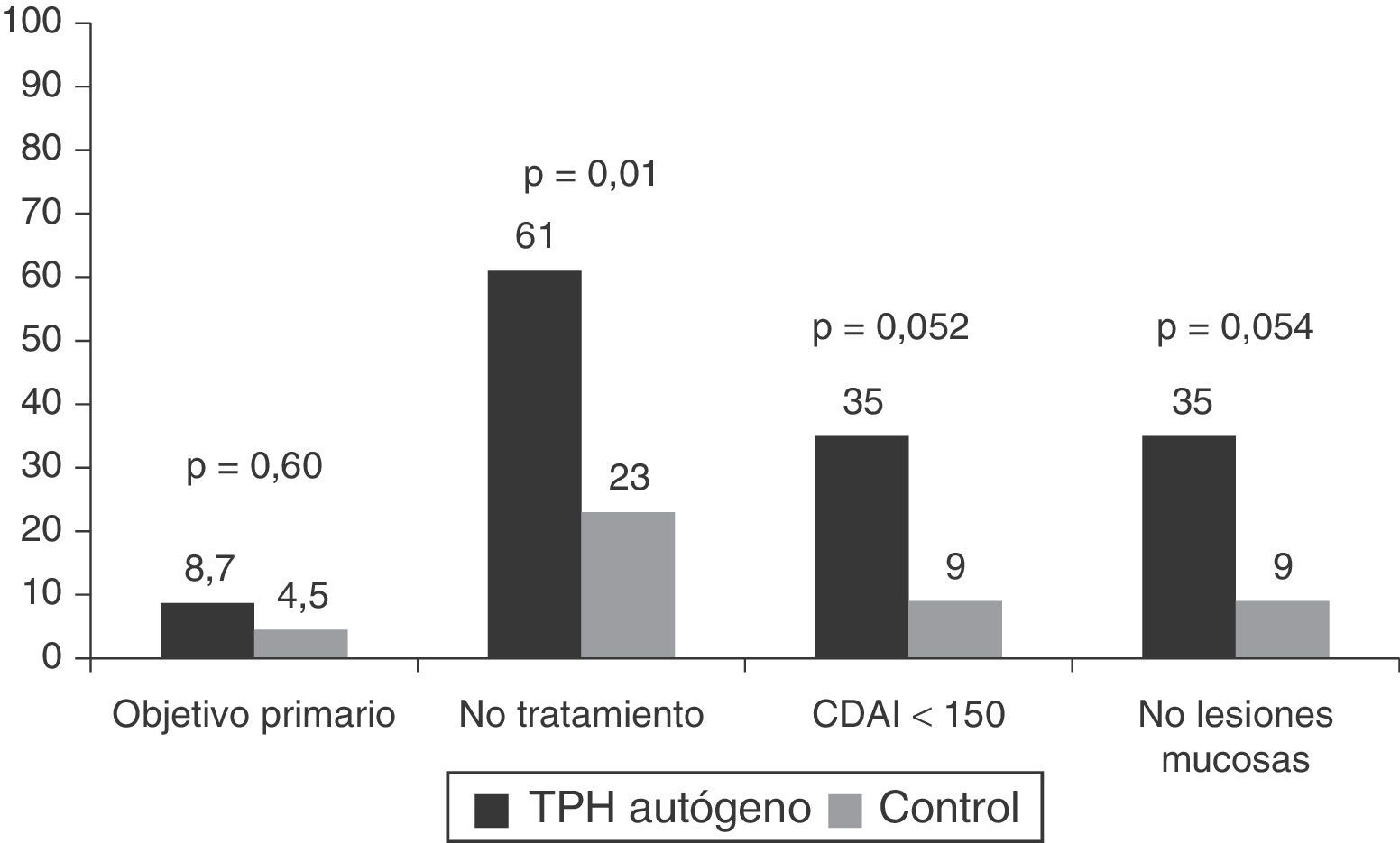
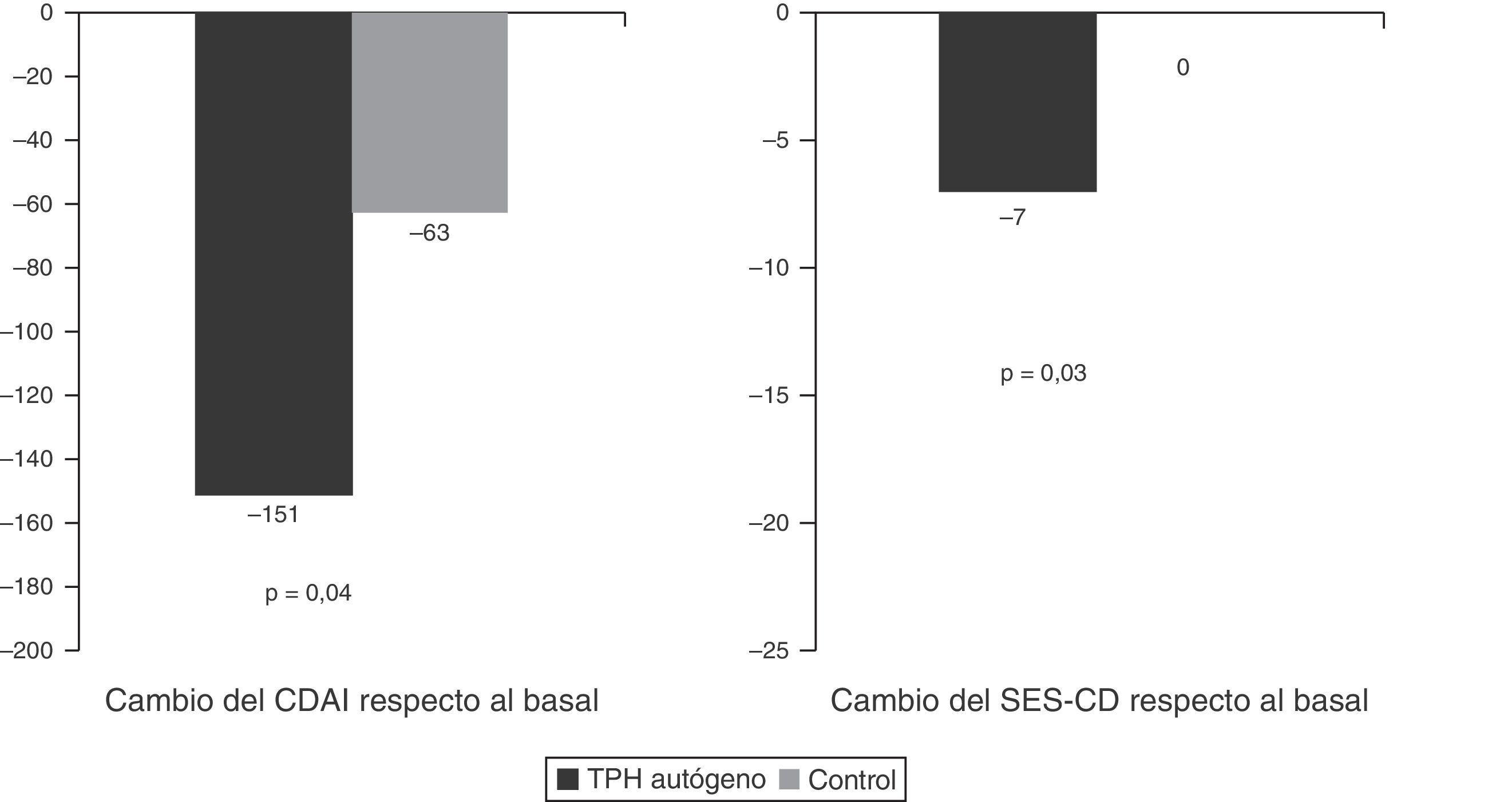
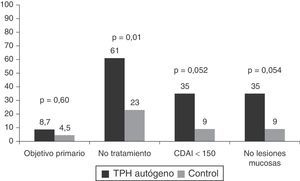
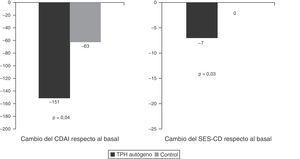
El único estudio aleatorizado llevado a cabo hasta el momento en esta patología y publicado recientemente es el estudio Autologous Stem Cell Transplantation International Crohn's Disease trial (ASTIC), que ha evaluado el efecto del TPH autógeno en pacientes con EC activa refractaria a tratamiento médico (3 o más inmunosupresores, fármacos anti-TNF y corticoides) y no tributarios de cirugía42. En este estudio se incluyeron un total de 45 pacientes que fueron movilizados con ciclofosfamida y G-CSF y posteriormente aleatorizados a trasplante precoz (4semanas tras la movilización) o a recibir tratamiento estándar para la EC con la opción de ser trasplantados un año después de la movilización a criterio del investigador. El objetivo primario se definió como remisión sostenida al año e incluía remisión clínica (CDAI<150), sin tratamiento activo para la EC durante los 3meses previos y sin lesiones endoscópicas o radiológicas sugestivas de actividad de la EC. Dos de los 23 (8,7%) pacientes en el grupo de trasplante y uno de 22 (4,5%) en el grupo control alcanzaron el objetivo primario, diferencia que no fue significativa (p=0,60). Cabe pensar que el objetivo propuesto por los investigadores era muy estricto, poco realista, sin precedentes en estudios previos en EC y que quizá, teniendo en cuenta la gravedad de la EC en los pacientes incluidos en el estudio, la remisión clínica sin corticoides al año y en los años subsiguientes, sin el requerimiento de curación mucosa completa, hubiera constituido un objetivo más idóneo. La figura 2 muestra los resultados del estudio ASTIC, tanto el objetivo primario global como el subanálisis de los distintos componentes del mismo. Se observaron diferencias significativas en la proporción de pacientes sin tratamiento activo para la EC en los pacientes trasplantados respecto al grupo control (61% vs 23%, respectivamente; p=0,01) y una tendencia a una mayor proporción de pacientes en remisión clínica (35% vs 9%; p=0,052) y en remisión endoscópica (35% vs 9%; p=0,054) en los pacientes trasplantados respecto al grupo control. Asimismo, al evaluar los objetivos secundarios del estudio se observaron diferencias significativas entre los pacientes trasplantados y el grupo control en los cambios del CDAI respecto al basal (−151 vs −63, respectivamente; p=0,04) y en los cambios del índice endoscópico (SES-CD) (−7 vs 0, respectivamente, p=0,03), indicando todo ello un efecto beneficioso del trasplante (fig. 3).
Resultados del estudio ASTIC.
Objetivo primario: remisión sostenida al año del trasplante definida como remisión clínica, sin ningún tratamiento activo durante los últimos 3 meses de la evaluación y sin evidencia de lesiones endoscópicas y/o radiológicas.
TPH autógeno: trasplante de progenitores hematopoyéticos autógeno
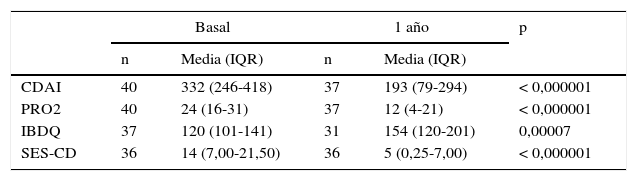
El análisis al año de la evolución clínica, endoscópica y en la calidad de vida de todos los pacientes incluidos y trasplantados en el estudio ASTIC (incluyendo los pacientes trasplantados al año de la movilización y seguidos durante un año) se muestran en la tabla 245. Se observaron diferencias muy significativas en los índices clínicos, la percepción del paciente, la calidad de vida y los índices endoscópicos entre la situación basal y un año tras el trasplante, sugiriendo de nuevo el efecto terapéutico del TPH autógeno para el tratamiento de la EC.
Evolución de todos los pacientes del estudio ASTIC (trasplante precoz+trasplante tardío) un año después del trasplante (n=40)
| Basal | 1 año | p | |||
|---|---|---|---|---|---|
| n | Media (IQR) | n | Media (IQR) | ||
| CDAI | 40 | 332 (246-418) | 37 | 193 (79-294) | < 0,000001 |
| PRO2 | 40 | 24 (16-31) | 37 | 12 (4-21) | < 0,000001 |
| IBDQ | 37 | 120 (101-141) | 31 | 154 (120-201) | 0,00007 |
| SES-CD | 36 | 14 (7,00-21,50) | 36 | 5 (0,25-7,00) | < 0,000001 |
CDAI: Crohn's Disease Activity Index; IBDQ: Inflammatory Bowel Disease Questionnaire; PRO2: Patient Reported Outcomes; SES-CD: Simplified Endoscopic Activity score for Crohn's Disease.
Un paciente incluido en el estudio ASTIC falleció a los 20días del acondicionamiento a causa de un síndrome sinusoidal obstructivo atribuido a un efecto secundario de la ciclofosfamida.
Trasplante alogénico de progenitores hematopoyéticos en la enfermedad de CrohnEn el año 2009, y posteriormente en 2012, aparecieron los primeros datos en la literatura correspondientes a los resultados del TPH alogénico en un grupo de pacientes pediátricos con diagnóstico establecido de una enfermedad monogénica caracterizada por una pérdida homocigótica de la IL-10 o de su receptor (IL-10R)46,47. Esta mutación origina la aparición muy precoz (en los primeros meses de vida) de una enfermedad similar a la EC, con colitis refractaria y enfermedad perianal grave con elevados requerimientos quirúrgicos. En una cohorte de 66 pacientes con EC precoz (definida como inicio antes de los 5años de edad) se detectaron 16 pacientes con déficit de IL-10 o de IL-10R. De estos, 5 pacientes recibieron un TPH alogénico, consiguiendo una remisión rápida y duradera en todos ellos con un seguimiento medio de 2años. Asimismo, experimentos in vitro demostraron la reconstitución de la señal IL-10R tras el trasplante.
Excepto en situaciones específicas, como la previamente descrita, el TPH alogénico no está indicado para tratar la EC debido a la elevada morbimortalidad asociada al procedimiento, con tasas de mortalidad que pueden alcanzar hasta el 20%48.
ConclusionesLa EC afecta significativamente la calidad de vida de los pacientes, en su mayoría adultos jóvenes. Los tratamientos disponibles en la actualidad no son curativos y un alto porcentaje de pacientes precisa una o varias resecciones quirúrgicas a lo largo de su vida para tratar complicaciones asociadas a la enfermedad. Además, una proporción significativa de pacientes no responde o pierde la respuesta a los fármacos disponibles. En los últimos años se han producido grandes avances en el conocimiento de las células madre y sus aplicaciones terapéuticas. En este sentido, el TPH autógeno se ha empleado como tratamiento de rescate en pacientes con EC refractaria con resultados esperanzadores. Sin embargo, la elevada frecuencia de recidiva de la EC tras un periodo más o menos largo tras el trasplante obliga a determinar factores predictivos de recidiva o incluso la posibilidad de introducir estrategias terapéuticas preventivas para un mejor control de los pacientes. Debido a los riesgos asociados al procedimiento, incluyendo el riesgo de mortalidad, el TPH autógeno está indicado solo en pacientes muy seleccionados con EC extensa, refractaria a todas las líneas de tratamiento disponibles, no tributarios de cirugía por la localización o extensión de la enfermedad y debe realizarse en centros experimentados con instalaciones adecuadas y equipos multidisciplinares. Por otro lado, el TPH alogénico corrige el defecto genético del sistema inmunológico pero, salvo casos muy concretos con defectos monogénicos bien establecidos, no está indicado para el tratamiento de la EC refractaria por la elevada morbimortalidad asociada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.