El objetivo de este estudio ha sido evaluar la actividad in vitro de la daptomicina frente a una colección de aislamientos de Staphylococcus aureus resistente a meticilina (SARM) de diversas procedencias y frente a estafilococos coagulasa negativa (ECN) procedentes de hemocultivos clínicamente significativos.
MétodosSe incluyeron en el estudio un total de 1.186 cepas de estafilococos (755 SARM y 431 ECN) procedentes de 40 hospitales españoles integrados en el programa VIRA (Vigilancia de Resistencias a los Antimicrobianos) correspondientes al período 2001 al 2006. Los estudios de sensibilidad se llevaron a cabo mediante el método de microdilución en caldo.
ResultadosLa mayor parte de los aislamientos de SARM fueron resistentes al ciprofloxacino (96%) y a la eritromicina (79,7%). Los valores de concentración inhibitoria mínima frente al 50 y al 90% de las cepas de daptomicina fueron de 0,5μg/ml y de 1μg/ml, respectivamente. Para linezolid, vancomicina y teicoplanina estos valores fueron de 1μg/ml y de 2μg/ml, respectivamente. Solamente se detectó un aislado con una concentración inhibitoria mínima de daptomicina de 2μg/ml. La daptomicina inhibió el total de las cepas de los ECN a unas concentraciones comprendidas entre los valores iguales o inferiores a 0,125 y a 1μg/ml y mostraba la misma actividad frente a las cepas sensibles a oxacilina que frente a las cepas resistentes a este antibiótico.
ConclusiónLa daptomicina se ha mostrado muy activa frente a las cepas de estafilococos estudiadas. Además, se ha comprobado que su actividad no se ve afectada por la resistencia a otros antimicrobianos como oxacilina, linezolid, ciprofloxacino, gentamicina y teicoplanina. Los resultados de este estudio indican que daptomicina se puede considerar como un tratamiento útil en las infecciones graves por SARM y por ECN.
The objective of this study was to determine the in vitro activity of daptomycin and other agents against methicillin-resistant Staphylococcus aureus (MRSA) isolates from several sources and coagulase-negative staphylococci (CoNS) from clinically significant blood cultures.
MethodsWe tested a total of 1186 staphylococci isolates (755 MRSA and 431 CoNS) collected as part of a multicenter surveillance program for antimicrobial resistance (VIRA study) from 40 medical centers throughout Spain between 2001 and 2006. Broth microdilution tests were performed according to the Clinical and Laboratory Standards Institute guidelines.
ResultsMost MRSA isolates were resistant to ciprofloxacin (96%) and erythromycin (79.7%). Daptomycin yielded a MIC50/MIC90 of 0.5/1μg/mL in MRSA, compared with 1/2μg/mL for linezolid, vancomycin, and teicoplanin. Daptomycin MICs were in the range of ⩽0.125–2μg/mL. Only 1 MRSA strain had a reproducible daptomycin MIC of 2μg/mL. Among CoNS isolates, the MIC range for daptomycin was ⩽0.125–1μg/mL. Daptomycin was equally active against oxacillin-susceptible and oxacillin-resistant strains.
ConclusionDaptomycin was highly active against the staphylococci isolates studied. The activity of this agent was not affected by resistance to other antibiotics such as oxacillin, teicoplanin, linezolid, ciprofloxacin, or gentamicin. These data suggest that daptomycin may be useful for the treatment of severe infection caused by MRSA or CoNS.
El Staphylococcus aureus es actualmente una causa importante de infección grave, tanto nosocomial como comunitaria. A través de los años, este microorganismo ha ido desarrollando resistencias a diversos antimicrobianos utilizados habitualmente para el tratamiento de las infecciones que ocasiona. En las 2 últimas décadas, las tasas de resistencia a los antibióticos en S. aureus se han incrementado notablemente, esto ha dado lugar a que cada vez sean más limitadas las opciones terapéuticas disponibles para el tratamiento de las infecciones causadas por esta bacteria. Actualmente, en España la tasa de resistencia a oxacilina en S. aureus se sitúa en torno al 30%1,2. Los aislamientos de S. aureus resistentes a meticilina (SARM) presentan, a su vez, resistencias a otros agentes, como quinolonas, macrólidos y aminoglucósidos. Aunque la resistencia de alto grado a la vancomicina en los aislamientos de SARM es muy rara, sólo se han publicado 7 casos en EE. UU.3, el aislamiento de cepas con sensibilidad intermedia a vancomicina (concentración inhibitoria mínima [CIM] de 8 a 16μg/ml) descrito por primera vez en Japón4 se ha notificado también en otros países y con una incidencia cada vez mayor5,6. Por otra parte, en la bibliografía reciente aparecen estudios en los que se refleja una disminución progresiva de la sensibilidad de SARM a vancomicina7–9, junto con diversas comunicaciones sobre los fracasos terapéuticos con este antibiótico en el tratamiento de infecciones causadas por aislamientos de SARM que presentaban unos valores de CIM para vancomicina algo elevados, de uno a 2μg/ml, aunque dentro del rango de sensibilidad10. Todo esto hace cada vez más necesaria la búsqueda de nuevos compuestos con actividad frente a estos microorganismos multirresistentes que sean capaces de evadir los diferentes mecanismos de resistencia.
Los estafilococos coagulasa negativa (ECN), que se consideran actualmente como importantes patógenos bacterianos, son la primera causa de bacteriemia nosocomial11. Estos microorganismos presentan elevadas tasas de resistencia a oxacilina (superiores a las que se comunicaron para S. aureus) y a otros antimicrobianos, como eritromicina, gentamicina, ciprofloxacino y clindamicina. También se ha descrito la aparición de resistencias de los ECN a los glucopéptidos, aunque en España, por el momento, no es frecuente1,2.
La daptomicina es un lipopéptido cíclico producido por Streptomyces roseosporus. Presenta una potente y rápida actividad bactericida frente a la mayoría de las bacterias grampositivas. Posee un mecanismo de acción único, que consiste en producir una despolarización de la membrana celular bacteriana con la colaboración del calcio iónico extracelular. La semivida prolongada de este antibiótico permite la administración de una dosis única diaria. La daptomicina está indicada para el tratamiento de infecciones complicadas de piel y partes blandas (IPPBc), endocarditis infecciosa del lado derecho (EID) debida a S. aureus y bacteriemia por S. aureus cuando está asociada a EID o a IPPBc.
El objetivo de este estudio es evaluar la actividad de la daptomicina frente a una colección de aislamientos de SARM y de ECN procedentes del estudio multicéntrico de seguimiento de resistencias VIRA (Vigilancia de Resistencias a los Antimicrobianos)2,12,13. A su vez, la actividad in vitro de la daptomicina se ha comparado con la de otros antimicrobianos utilizados para el tratamiento de las infecciones ocasionadas por estas bacterias multirresistentes.
MétodosSe incluyeron en el estudio un total de 1.186 cepas de estafilococos (755 cepas de SARM y 431 cepas de ECN) procedentes de 40 hospitales españoles integrados en el programa VIRA correspondientes al período 2001 a 20062,12,13. Los aislados se enviaron al centro coordinador del estudio (Hospital Clínico San Carlos), donde se confirmó la identificación de éstos mediante la utilización de los sistemas comercializados Slidex-Staph y Vitek 2-ID-GPC (bioMérieux, Marcy l’Etoile, Francia) y se realizaron los estudios de sensibilidad. Todos los aislamientos de ECN procedían de hemocultivos clínicamente significativos e incluían las siguientes especies de Staphylococcus: S. epidermidis (288), S. hominis (50), S. haemolyticus (41), S. warneri (16), S. saprophyticus (9), S. auricularis (7), S. chromogenes (6), S. capitis 85), S. simulans (3), S. xylosus (1), S. schleiferi (1), y S. cohnii (1). La procedencia de las cepas de SARM fue la siguiente: piel y partes blandas (57,8%), tracto respiratorio (19,8%), sangre (8,9%), orina (4,6%), catéter (3,5%), intraabdominal (2,1%) y otras (3,1%).
Los estudios de sensibilidad se llevaron a cabo mediante el método de microdilución en caldo según las normas descritas por el CLSI (Clinical Laboratory Standards Institute)14, con la utilización del sistema comercializado Sensititre (Trek Diagnostic Sistems, East Grinstead, Reino Unido). Se incluyeron como cepas control S. aureus ATCC 29213, S. aureus ATCC 43300 y Enterococcus faecalis ATCC 29212. Los antimicrobianos estudiados fueron los siguientes: daptomicina, vancomicina, teicoplanina, oxacilina, quinupristina-dalfopristina, linezolid, ciprofloxacino, trimetoprima-sulfametoxazol, gentamicina, tetraciclina, eritromicina y clindamicina. Se ensayaron diluciones de daptomicina comprendidas entre 0,125 y 8μg/ml, suplementadas con 50μg/ml de calcio en cada pocillo. La lectura se efectuó a las 20h de incubación a 35°C, excepto para vancomicina y oxacilina que se realizó a las 24h. Se utilizó como criterio de interpretación para cada uno de los antimicrobianos ensayados el que publicó recientemente el CLSI15.
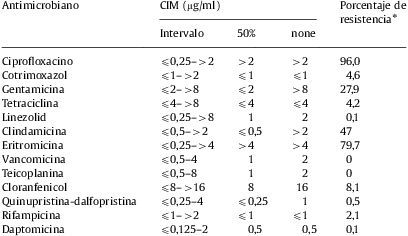
ResultadosLos resultados de los estudios de sensibilidad para las 755 cepas de SARM se resumen en la tabla 1. Los valores de las CIM de daptomicina estuvieron comprendidos entre los valores iguales o inferiores a 0,125 y 2μg/ml. Solamente se detectó un aislado con una CIM de daptomicina de 2μg/ml. La mayor parte de los aislamientos de SARM fueron resistentes al ciprofloxacino (96%) y a la eritromicina (79,7%). La quinupristina-dalfopristina mostró buena actividad frente a estas bacterias, con un 99,5% de cepas sensibles a este antibiótico. La tasa de resistencia a la gentamicina fue del 27,9%. El 46% de los aislamientos de SARM presentó resistencia cruzada a eritromicina, clindamicina y ciprofloxacino. El 20,8% fue simultáneamente resistente a eritromicina, clindamicina, ciprofloxacino y gentamicina. Se ha encontrado una cepa de SARM que presentó una CIM para linezolid superior a 8μg/ml y otra con sensibilidad intermedia a vancomicina (CIM de 4μg/ml). Ambas fueron sensibles a daptomicina (CIM de 0,5μg/ml y de 1μg/ml, respectivamente). Los valores de la CIM de daptomicina necesarias para inhibir al 50% y al 90% de las cepas fueron ambos de 0,5μg/ml. Para linezolid, vancomicina y teicoplanina estos valores fueron de 1μg/ml y de 2μg/ml, respectivamente.
Actividad de la daptomicina y otros antimicrobianos frente a 755 cepas de Staphylococcus aureus resistente a meticilina
| Antimicrobiano | CIM (μg/ml) | Porcentaje de resistencia* | ||
| Intervalo | 50% | 90% | ||
| Ciprofloxacino | ⩽0,25–>2 | >2 | >2 | 96,0 |
| Cotrimoxazol | ⩽1–>2 | ⩽1 | ⩽1 | 4,6 |
| Gentamicina | ⩽2–>8 | ⩽2 | >8 | 27,9 |
| Tetraciclina | ⩽4–>8 | ⩽4 | ⩽4 | 4,2 |
| Linezolid | ⩽0,25–>8 | 1 | 2 | 0,1 |
| Clindamicina | ⩽0,5–>2 | ⩽0,5 | >2 | 47 |
| Eritromicina | ⩽0,25–>4 | >4 | >4 | 79,7 |
| Vancomicina | ⩽0,5–4 | 1 | 2 | 0 |
| Teicoplanina | ⩽0,5–8 | 1 | 2 | 0 |
| Cloranfenicol | ⩽8–>16 | 8 | 16 | 8,1 |
| Quinupristina-dalfopristina | ⩽0,25–4 | ⩽0,25 | 1 | 0,5 |
| Rifampicina | ⩽1–>2 | ⩽1 | ⩽1 | 2,1 |
| Daptomicina | ⩽0,125–2 | 0,5 | 0,5 | 0,1 |
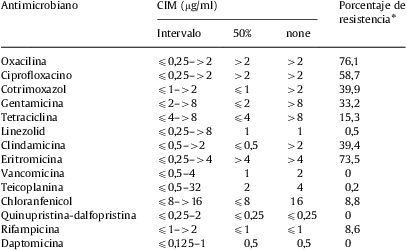
Según se puede observar en la tabla 2, en la que se resumen los resultados de los estudios de sensibilidad para los 431 aislados de ECN, la resistencia a oxacilina fue superior al 76%. La daptomicina inhibió el total de las cepas de ECN a unas concentraciones comprendidas entre los valores iguales o inferiores a 0,125 y 1μg/ml y mostró la misma actividad frente a las cepas sensibles a oxacilina que frente a las cepas resistentes a este antibiótico. Las tasas de resistencia a gentamicina, trimetoprima y sulfametoxazol fueron del 33,2% y del 39,9%, respectivamente. Más del 30% de las cepas de ECN presentaron resistencia simultánea a eritromicina, clindamicina y ciprofloxacino. El 13,5% de las cepas mostraron el siguiente patrón de resistencia: ciprofloxacino, eritromicina, clindamicina, cotrimoxazol y gentamicina. Todos los aislados fueron sensibles a vancomicina. Tanto la cepa (S. haemolyticus) que presentaba un valor de CIM para teicoplanina de 32μg/ml como las 2 cepas (S. epidermidis y S. hominis, respectivamente) no sensibles a linezolid (CIM superior a 8μg/ml) fueron inhibidas por concentraciones de daptomicina iguales o inferiores a 0,5μg/ml.
Actividad de daptomicina y otros antimicrobianos frente a 431 cepas de estafilococos coagulasa negativa
| Antimicrobiano | CIM (μg/ml) | Porcentaje de resistencia* | ||
| Intervalo | 50% | 90% | ||
| Oxacilina | ⩽0,25–>2 | >2 | >2 | 76,1 |
| Ciprofloxacino | ⩽0,25–>2 | >2 | >2 | 58,7 |
| Cotrimoxazol | ⩽1–>2 | ⩽1 | >2 | 39,9 |
| Gentamicina | ⩽2–>8 | ⩽2 | >8 | 33,2 |
| Tetraciclina | ⩽4–>8 | ⩽4 | >8 | 15,3 |
| Linezolid | ⩽0,25–>8 | 1 | 1 | 0,5 |
| Clindamicina | ⩽0,5–>2 | ⩽0,5 | >2 | 39,4 |
| Eritromicina | ⩽0,25–>4 | >4 | >4 | 73,5 |
| Vancomicina | ⩽0,5–4 | 1 | 2 | 0 |
| Teicoplanina | ⩽0,5–32 | 2 | 4 | 0,2 |
| Chloranfenicol | ⩽8–>16 | ⩽8 | 16 | 8,8 |
| Quinupristina-dalfopristina | ⩽0,25–2 | ⩽0,25 | ⩽0,25 | 0 |
| Rifampicina | ⩽1–>2 | ⩽1 | ⩽1 | 8,6 |
| Daptomicina | ⩽0,125–1 | 0,5 | 0,5 | 0 |
En este estudio se comprueba que la multirresistencia es común, tanto entre los aislamientos de SARM como de ECN. La vancomicina se ha considerado como el tratamiento de elección en las infecciones graves por SARM. Sin embargo, los fracasos en el tratamiento con vancomicina han cuestionado la eficacia de este agente en el tratamiento de las infecciones invasivas, como la bacteriemia16. Por otra parte, como ya se ha comentado anteriormente, la presencia de aislamientos de SARM con CIM de vancomicina elevadas, aunque dentro del intervalo de sensibilidad, se ha asociado a una peor respuesta al tratamiento17.
De esta manera, como han publicado los autores de este artículo previamente2, al comparar los valores de las CIM de vancomicina durante el período 2001 a 2006 se observa un incremento gradual de éstos. El porcentaje de cepas estudiadas correspondientes al año 2001 que presentaban una CIM para la vancomicina de 2μg/ml ha sido del 4,6%; este porcentaje se ha incrementado al 20,8% en el año 2004 y al 31% en el año 2006. Estos datos contrastan con los del estudio comunicado recientemente por Cuevas et al1, que en el año 2006 de un total de 135 aislados de SARM sólo encontraron 6 cepas (4,4%) con una CIM de vancomicina de 2μg/ml.
Algunos estudios recientes muestran que la disminución de la sensibilidad a vancomicina puede estar asociada a una menor sensibilidad a la daptomicina en SARM10,18,19. Por el momento, no se conoce el mecanismo causante de este fenómeno ni tampoco el significado clínico. Por otra parte, se ha comprobado que daptomicina se mantiene activa y muestra una potente actividad bactericida frente a las cepas de SARM con sensibilidad intermedia a vancomicina o con heterorresistencia a este antibiótico20.
En este estudio se observa que la distribución de los valores de la CIM de daptomicina se mantiene prácticamente uniforme durante los 3 años estudiados (2001, 2004 y 2006). Conviene realizar estudios periódicos de seguimiento de la sensibilidad a este nuevo antibiótico con el fin de detectar posibles cambios. La resistencia a la daptomicina es rara, aunque se ha comunicado (en algunos casos) la aparición de aislamientos de SARM no sensibles a daptomicina en pacientes con tratamiento prolongado con este antibiótico21,22. Se recomienda al administrar daptomicina monitorizar los estudios microbiológicos con el fin de conocer la sensibilidad de la cepa23.
La daptomicina se ha mostrado muy activa frente a las cepas procedentes de pacientes con bacteriemia por ECN. Además, se ha comprobado que su actividad no se ve afectada por la resistencia a otros antimicrobianos como oxacilina, linezolid, ciprofloxacino, gentamicina y teicoplanina. La excelente actividad que muestra la daptomicina frente a los aislados de estafilococos incluidos en este trabajo, coincide con la que se comunicó recientemente en diversos estudios24–29. Los autores de este artículo solamente han encontrado una cepa de SARM que presentaba una CIM de daptomicina de 2μg/ml. Otros estudios multicéntricos llevados a cabo en diversos países europeos28 y en Norteamérica27 también han comunicado la detección de cepas de SARM con un valor de CIM para la daptomicina de 2μg/ml y en un porcentaje similar al de este estudio (0,1%); mientras que otras publicaciones refieren el 100% de los aislados de SARM sensibles a la daptomicina24–26. Este antibiótico presenta un perfil de seguridad aceptable y se ha puesto de manifiesto su eficacia clínica en diversos ensayos30. Todos estos datos, junto con los resultados de este estudio indican que daptomicina se puede considerar como un tratamiento útil en las infecciones graves por SARM y por ECN.
Los autores de este estudio agradecen la colaboración de Sanofi Aventis y de Novartis en la realización de este trabajo.
Relación de miembros del Grupo VIRA
Hospital General Universitario de Alicante (Alicante), Hospital Infanta Cristina (Badajoz), Ciutat Sanitària de la Vall d’Hebron (Barcelona), Hospital Clínic i Provincial de Barcelona (Barcelona), Hospital de Basurto (Bilbao), Complejo Hospitalario de Cáceres (Cáceres), Hospital Universitario Puerta del Mar (Cádiz), Hospital Carmen y Severo Ochoa (Cangas del Narcea), Complejo Hospitalario Reina Sofía (Córdoba), Hospital Comarcal Don Benito-Villanueva de la Serena (Don Benito), Hospital General Universitario de Elche (Elche), Hospital Universitario de Getafe (Getafe), Complejo Hospitalario Virgen de las Nieves (Granada), Hospital General y Universitario de Guadalajara (Guadalajara), Hospital Severo Ochoa (Leganés), Hospital 12 de Octubre (Madrid), Hospital Santa Cristina (Madrid), Hospital Universitario La Paz (Madrid), Hospital Clínico San Carlos (Madrid), Hospital General Universitario Gregorio Marañón (Madrid), Complejo Hospitalario Móstoles-Alcorcón (Móstoles), Hospital Central de la Defensa (Madrid), Hospital de Mérida (Mérida), Hospital Universitario Virgen de la Arrixaca (Murcia), Hospital General Universitario J. M. Morales Meseguer (Murcia), Hospital Son Llàtzer (Palma de Mallorca), Hospital Insular de Gran Canaria (Las Palmas de Gran Canaria), Hospital General de las Palmas de Gran Canaria Dr. Negrín (Las Palmas de Gran Canaria), Hospital de Navarra (Pamplona/Iruña), Hospital Clínico (Salamanca), Hospital Clínico Universitario de Santiago (Santiago de Compostela), Hospital General de Segovia (Segovia), Hospital Virgen del Rocío (Sevilla), Complejo Hospitalario Virgen de la Macarena (Sevilla), Complejo Hospitalario Nuestra Señora de Valme (Sevilla), Instituto Valenciano de Oncología (Valencia), Hospital de Sagunto (Valencia), Hospital Universitario La Fe (Valencia), Hospital Universitario de Valladolid (Valladolid), Hospital Clínico Universitario Lozano Blesa (Zaragoza).