Las infecciones fúngicas, incluyendo aquellas producidas por hongos que pueden ser resistentes o multirresistentes a los antifúngicos, representan un serio problema de salud pública. La información sobre la sensibilidad de estos microorganismos a los distintos antifúngicos debe ser analizada lo más rápidamente posible para ayudar a los profesionales clínicos a instaurar un tratamiento adecuado. Desafortunadamente, las pruebas de sensibilidad a los antifúngicos no están tan desarrolladas ni implementadas como las de los antibacterianos, que son similares tanto en su diseño como en su precisión y reproducibilidad, pero laboriosas y lentas. En este artículo realizamos una revisión de los métodos de estudio de sensibilidad in vitro, tanto los de referencia (CLSI y EUCAST) como los comerciales y los nuevos métodos basados en la proteó-mica (MALDI-TOF MS) y en la detección de genes de resistencia por técnicas de amplificación de ácidos nucleicos. Además, se comentan los nuevos puntos de corte clínicos establecidos recientemente, así como los puntos de corte epidemiológicos, que se trata de una nueva categoría que puede ayudar a identificar de manera precoz las cepas aisladas que han adquirido mecanismos de resistencia. También se comentan las ventajas y las limitaciones de cada uno de los métodos revisados. Por tanto, puede concluirse que, aunque se ha avanzado mucho en los estudios de sensibilidad in vitro a los antifúngicos, aún existen limitaciones en su aplicación en la práctica diaria de un laboratorio de microbiología aunque parece que el futuro es esperanzador con las nuevas tecnologías basadas en la proteómica y en la amplificación de los ácidos nuclei-cos. Información sobre el suplemento: este artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. y Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. Todos los derechos reservados.
Fungal diseases, including those caused by (multi)drug-resistant fungi, still represent a global public health concern. Information on the susceptibility of these microorganisms to antifungal agents must be quickly produced to help clinicians initiate appropriate antifungal therapies. Unfortunately, antifungal susceptibility tests are not as developed or widely implemented as antibacterial tests, being similar in design, accuracy and reproducibility, but also laborious and slow. In this article, we review the methods of in vitro susceptibility testing, both reference (CLSI and EUCAST), commercial and new methods based on proteomics (MALDI-TOF MS) and in the detection of resistance genes by nucleic acid amplification techniques. In addi-tion, we discuss the newly established clinical breakpoints, as well as the epidemiological cut-off points, which constitute a new category that can help in the early identification of isolates that have acquired resistance mechanisms. We also discuss the advantages and limitations of each of the methods studied. Therefore, we can conclude that, although there has been much progress in studies of in vitro susceptibility testing to antifungals, there are still limitations in its application in the daily routine of microbiology labo-ratories, although it seems that the future is promising with the new technologies based on proteomics and nucleic acid amplification. Supplement information: This article is part of a supplement entitled «SEIMC External Quality Control Programme. Year 2016», which is sponsored by Roche, Vircell Microbiologists, Abbott Molecular and Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. and Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. All rights reserved.
Las infecciones fúngicas representan un serio problema de salud pública, incluyendo aquellas producidas por hongos que pueden ser resistentes o multirresistentes a los antifúngicos. La información sobre la sensibilidad de estos microorganismos a los distintos antifúngicos debe ser analizada para ayudar a los profesionales clínicos a instaurar un tratamiento adecuado1,2. Desafortunadamente, las pruebas de sensibilidad a los antifúngicos no están tan desarrolladas ni implementadas como las de los antibacterianos, que son similares tanto en su diseño como en su precisión y reproducibilidad, pero laboriosas y lentas1-3.
Los objetivos de la realización del antifungigrama son: conocer la actividad in vitro de los antifúngicos; pronosticar el resultado tera-péutico de determinado tratamiento antifúngico; detectar la aparición de cepas resistentes dentro de la población sensible; correlacionar la actividad in vitro con los resultados in vivo, y determinar la utilidad terapéutica de los nuevos antifúngicos.
De todos ellos, el principal fundamento de las pruebas de sensibilidad in vitro es detectar las cepas aisladas resistentes entre la población sensible o el desarrollo de resistencia durante el tratamiento.
Para conseguir estos objetivos, se necesitan métodos para el estudio de sensibilidad reproducibles y disponer de puntos de corte clínicos para la interpretación de sus resultados. El CLSI (Committee for Clinical and Laboratory Standards) y el EUCAST (European Committee for Antimicrobial Susceptibility Testing) han desarrollado métodos de referencia reproducibles, aunque laboriosos, para determinar la sensibilidad a los antifúngicos de levaduras y hongos filamentosos.
Para la interpretación de estos métodos se han definido una serie de conceptos2,45: concentración mínima inhibitoria (CMI), que es la concentración más baja de antifúngico que inhibe el crecimiento del microorganismo; concentración mínima efectiva (CME), que es la concentración más baja de candina que produce un cambio morfológico (colonias pequeñas, redondeadas y compactas, en lugar de hifas) y se utiliza para definir la actividad de las candinas sobre hongos filamentosos; puntos de corte clínicos (CBP, clinical breakpoints), que clasifican las cepas aisladas en clínicamente sensibles o clínicamente resistentes y se establecen basándose en la correlación entre los resultados de las pruebas de sensibilidad in vitro y la eficacia terapéutica, distribución de las CMI, parámetros farmacocinéticos y farmacodinámicos (PK/PD) y mecanismos de resistencia del antifúngico (existe una correlación entre estos puntos de corte y el éxito/fracaso terapéutico), y puntos de corte epidemiológicos (ECV, epidemiological cutoff value para el CLSI y ECOFF para EUCAST), que son la concentración más elevada que separa la población salvaje (sin ningún mecanismo de resistencia) de las cepas aisladas con algún mecanismo de resistencia, no pertenecientes a la población salvaje. Las cepas aisladas inhibidas con CMI superiores al ECV o ECOFF se clasifican como cepas aisladas con sensibilidad reducida. Pueden responder al tratamiento si la CMI del antifúngico es inferior al punto de corte clínico. Se calcula para cada antifúngico y especie a partir de la CMI modal y distribución de las CMI, teniendo en cuenta la variabilidad inherente a la técnica, y debe incluir, al menos, al 95% de la población. A partir de estos ECV o ECOFF, las cepas se pueden clasificar en población salvaje (WT, wild type): para una especie determinada, una cepa aislada se define como perteneciente a la población salvaje por la ausencia de mutación adquirida o de mecanismos de resistencia. Las cepas aisladas se clasifican como pertenecientes a la población salvaje si la CMI del antifúngico en cuestión es menor o igual al ECV o ECOFF. Si la CMI es mayor que el ECV o ECOFF, se afirma que la cepa aislada no pertenece a la población salvaje (NWT). Las cepas aisladas solo se pueden clasificar como resistentes a un antifúngico cuando se ha determinado el CBP.
Métodos de referencia para determinar la sensibilidad in vitro de levaduras y hongos filamentososEl CLSI ha estandarizado 2 métodos para determinar la sensibilidad a los antifúngicos:
- 1.
El método de microdilución en caldo para levaduras (documentos M27-A45, M606, M574 y M597) y para hongos filamentosos y dermatofitos (documentos M38-A38, M619, M574 y M597).
- 2.
El método de difusión en agar para levaduras (documentos M44-A210 y M606) y para hongos filamentosos no dermatofitos (documentos M51-A11 y M619).
El EUCAST también ha estandarizado un método de microdilución para levaduras (documento E.DEF 7.3.1)12 y para hongos filamentosos (documento E.DEF 9.3)13.
Los métodos CLSI y EUCAST son similares, pero presentan ciertas diferencias metodológicas en relación con la concentración de glucosa del medio de cultivo, forma del fondo de la microplaca, inóculo (más elevado en el caso del EUCAST), tipo de lectura y tiempo de incubación, pero los resultados obtenidos por ambos métodos son similares.
Es importante realizar las pruebas de sensibilidad siguiendo estrictamente los documentos ya que cualquier variable (medio de cultivo, incubación, inóculo, etc.) puede alterar los resultados, por lo que es imprescindible incluir una cepa control de calidad para confirmar la validez del ensayo. Los métodos de dilución estandarizados son muy laboriosos para ser utilizados en la práctica diaria del laboratorio y, aunque ya se dispone de métodos del CLSI estandarizados de difusión en placa tanto para levaduras como para hongos filamentosos6,9-11 más baratos y sencillos de realizar, siempre es recomendable ante una cepa aislada resistente por el método de difusión confirmar por el método estandarizado de dilución (CLSI o EUCAST).
Limitaciones de los métodos de referenciaEstos métodos, además de ser laboriosos y lentos, presentan otra serie de limitaciones: los métodos de microdilución CLSI-M27-A45 y EUCAST DOC.E.7.3.1.12 para levaduras solo son aplicables para Candida spp y Cryptococcus spp aunque podrían aplicarse a otras levaduras, excepto Malassezia spp; tanto los CBP como los ECV/ECOFF descritos son aplicables solo a los antifúngicos sistémicos; el CLSI5 tiene como limitación la dificultad de detectar las cepas aisladas de levaduras resistentes a anfotericina B, mientras que el documento EUCAST E.DEF. 7.3.1.12 recomienda la utilización del medio AM3 (Medio Antibiótico 3) suplementado con el 2% de glucosa para detectar resistencia a anfotericina B aunque están descritas variaciones entre distintos lotes y fabricantes12; la lectura de los resultados es difícil y subjetiva, y puede producir resultados variables y no reproducibles, especialmente cuando la lectura es visual (CLSI), por lo que se necesita personal entrenado; el método CLSI de difusión para levaduras (M44-A2)10 solo es aplicable para Candida spp y el EUCAST no tiene documento para método de difusión; el método de microdilución para hongos filamentosos y dermatofitos (CLSI M38-A3)8 no incluye CBP para ningún hongo, solo describen algunos ECV para Aspergillus spp, en el documento EUCAST14 se establecen puntos de corte para anfotericina B y azoles y algunas especies de Aspergillus, pero no para equinocandinas; el método de difusión del CLSI para hongos filamentosos (M51-A)11 no incluye a los dermatofitos y el EUCAST no tiene documento para método de difusión, y diferencias entre los CBP de CLSI y EUCAST (a veces, mayor a 2 diluciones) hacen difícil la interpretación clínica.
Ninguno de los métodos de microdilución de referencia (CLSI y EUCAST) para el estudio de sensibilidad in vitro de Candida spp recomienda ensayar la sensibilidad a caspofungina por existir alta variabilidad interlaboratorios. Se recomienda realizar solo la sensibilidad in vitro a micafungina y anidulafungina como marcadores de sensibilidad a caspofungina1,15,16.
Métodos alternativosDebido a todas estas limitaciones, los métodos de referencia no son aplicables en la práctica de un laboratorio clínico y por ello, unido a la imposibilidad de que estos métodos puedan ser útiles para la determinación de sensibilidad a todos los antifúngicos y a todos los microorganismos, se han desarrollado métodos comerciales más sencillos:
- 1.
Método colorimétrico (Sensititre YeastOne®, Thermo Scientific, Estados Unidos): es un método colorimétrico basado en la metodología de microdilución del CLSI. Está aprobado por la Food and Drug Administration (FDA) para estudios de sensibilidad in vitro de levaduras no fastidiosas a fluconazol, itraconazol, voriconazol, 5-fluorocitosina y caspofungina. Aunque también incluye anfotericina B, posaconazol, anidulafungina y micafungina, la FDA no los ha aprobado para el diagnóstico. Todos tienen marcado CE para su uso en Europa2. Existen datos en la bibliografía que muestran una buena correlación con el método de referencia CLSI, tanto para levaduras2,17,18 como para hongos filamentosos2,19,20. Es importante saber que este método debe utilizar para la interpretación de los resultados los CBP y los ECV de los documentos del CLSI6,7,21. Muestra baja correlación con caspofungina y C. glabrata y C. krusei22. Espinel-Ingroff et al23 determinan ECV para Candida spp y caspofungina por este método, y observan que, utilizando estos ECV, se puede discriminar entre cepas de Candida spp wild type y non-wild type. Los azoles presentan efecto trailing, que dificulta su lectura.
- 2.
Vitek 2® (bioMerieux, Francia): es un método basado también en la metodología de la microdilución del CLSI. Incluye 6 antifúngicos, de los cuales se han aprobado para diagnóstico por la FDA solo fluconazol, voriconazol y caspofungina2,18. Muestra buena correlación para Candida spp con los métodos de microdilución de referencia (CLSI y EUCAST)17,24-27. La principal limitación del Vitek 2® es que la menor concentración de caspofungina es 0,25 mg/l, que es más alta que el punto de corte (CBP) que establece el CLSI para C. glabrata, por lo que clasifica a cepas de C. glabrata resistentes (con mutación fsk demostrada) a caspofungina como sensibles25. Presenta buena correlación con los azoles17,22,27 aunque con voriconazol pasa algo parecido a la caspofungina, pues utiliza unos rangos de CMI muy altos que producen errores de interpretación21. Existe baja correlación con anfotericina B y Cryptococcus spp17,27. No existen datos para hongos filamentosos.
- 3.
Métodos de difusión en agar: Neo-sensitabs® (Rosco Laboratory, Dinamarca): son tabletas que incluyen prácticamente todos los antifúngicos, incluidos los tópicos y los sistémicos. Existen datos de buena correlación con los métodos de referencia de microdilución y difusión en agar con discos10,11, tanto para levaduras28,29 como para hongos filamentosos30-32.
- 4.
Etest® (bioMerieux, Francia) y otras tiras de gradiente de difusión MIC Test Strips® (Liofilchem, Werfen, España): es un méto-do de difusión en agar basado en el uso de unas tiras de papel impregnadas con un gradiente de concentración de antifúngico. Aprobado por la FDA para estudio de sensibilidad in vitro de levaduras a fluconazol, itraconazol, voriconazol, posaconazol y 5-fluorocitosina2. Con marcado CE también. Existe una buena correlación con los métodos de referencia (CLSI y EUCAST) tanto para los azoles como para las equinocandinas2,17,18,33-35, pero, para conseguirlo, es imprescindible seguir estrictamente las recomendaciones del fabricante y la lectura debe ser realizada por personal experimentado. En el caso del fluconazol, se recomienda que, cuando una cepa aislada sea resistente por Etest®, se confirme con el método de referencia ya que los valores de CMI por Etest para fluconazol son altos36. Parece que es el método de referencia para la detección de cepas resistentes a anfotericina B2,18. La correlación con CLSI es baja para caspofungina con C. glabrata y C. krusei37,38, por lo que no se recomienda en estos casos. Para hongos filamentosos existen estudios32,39 que avalan su uso para el análisis de sensibilidad in vitro a los distintos antifúngicos aunque hay que tener en cuenta que existen problemas de lectura con las equinocandinas40 y que no es un método recomendado para mucorales41. Este método no está recomendado todavía por la FDA para el diagnóstico. Recientemente, Espinel-Ingroff et al42 recomiendan el Etest® como factor pronóstico de resistencia a equinocandinas y a anfotericina B de Aspergillus spp, utilizando los CBP y ECV del CLSI, al igual que lo recomiendan para el estudio de sensibilidad in vitro para A. fumigatus y posaconazol43.
Son métodos lentos, pero menos laboriosos que los de referencia, y las limitaciones que presentan son: subjetividad de la lectura de las CMI, sobre todo si esta lectura es visual ya que puede conllevar una lectura no reproducible y resultados no fiables (Etest® y Sensititre YeastOne®); falta de correlación con los métodos de referencia para Cryptococccus spp y anfotericina B (Vitek 2®), y falta de capacidad de detección de cepas resistentes a anfotericina B y caspofungina (Sensititre YeastOne® y Vitek 2®) y voriconazol (Vitek 2®).
Nuevos métodosSe están desarrollando nuevas herramientas con un futuro esperanzador para el estudio de la sensibilidad in vitro a los antifúngicos, principalmente orientadas a la metodología proteómica (MALDI-TOF MS) y al campo de técnicas de amplificación de ácidos nucleicos. Hay estudios recientes que sugieren que MALDI-TOF MS puede ser utilizado para la detección de resistencias a antifúngicos, tanto para levaduras como para hongos filamentosos1. Sin embargo, otros no lo recomiendan por no aportar mejoras respecto a los métodos de sensibilidad convencionales y no reducir el tiempo de respuesta44.
Los métodos basados en la amplificación de ácidos nucleicos45,46 permiten la detección de mutaciones de genes relacionadas con la resistencia a antifúngicos. En el caso de los azoles y levaduras, son MDR o CDR y ERGU, y en los hongos filamentosos, el gen Cyp51A; en cuanto a la resistencia a equinocandinas, las mutaciones se encuentran en genes FKS y FKS1 para todas las especies Candida y hongos filamentosos, y el gen KFS2 para C. glabrata1.
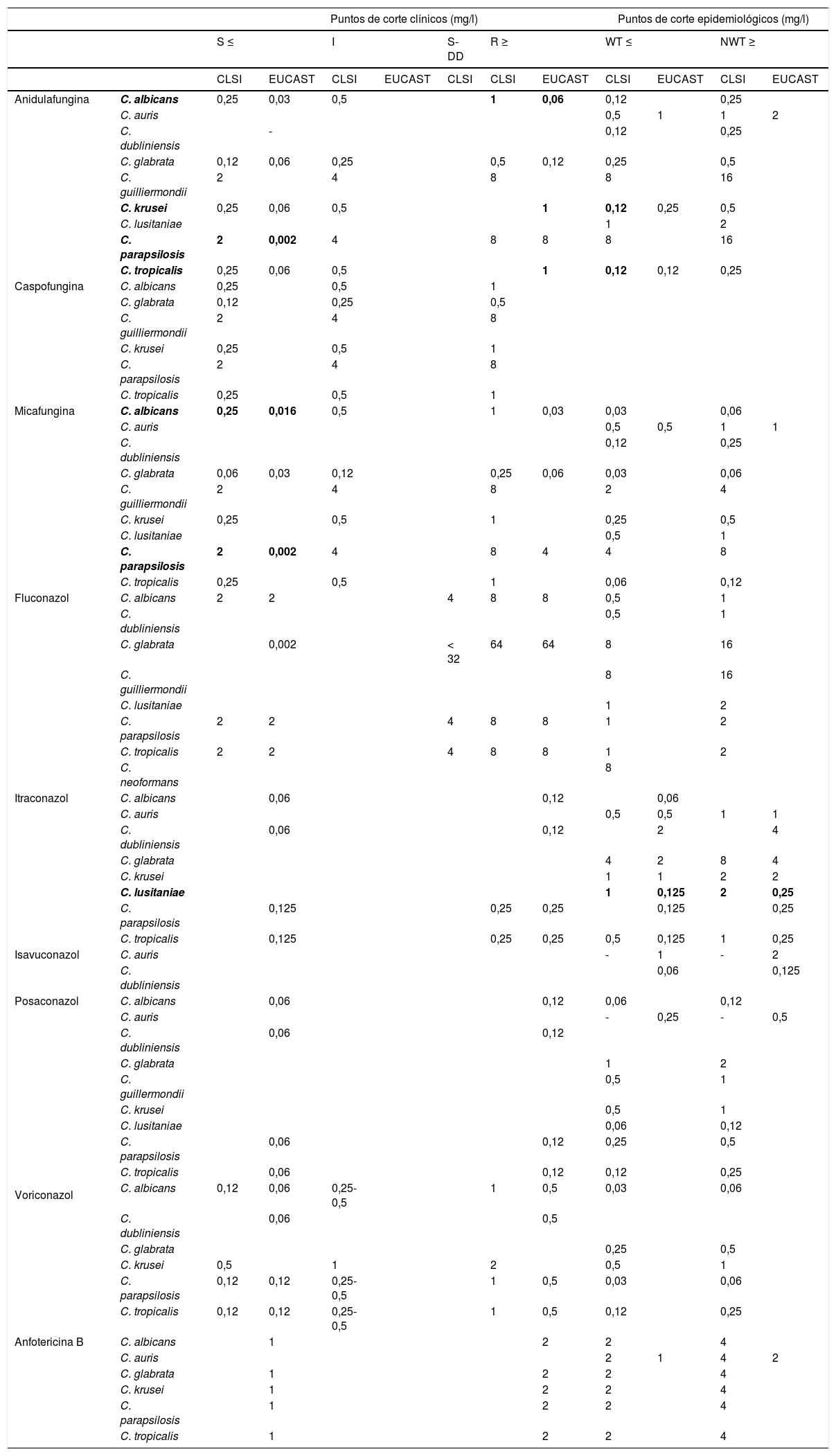
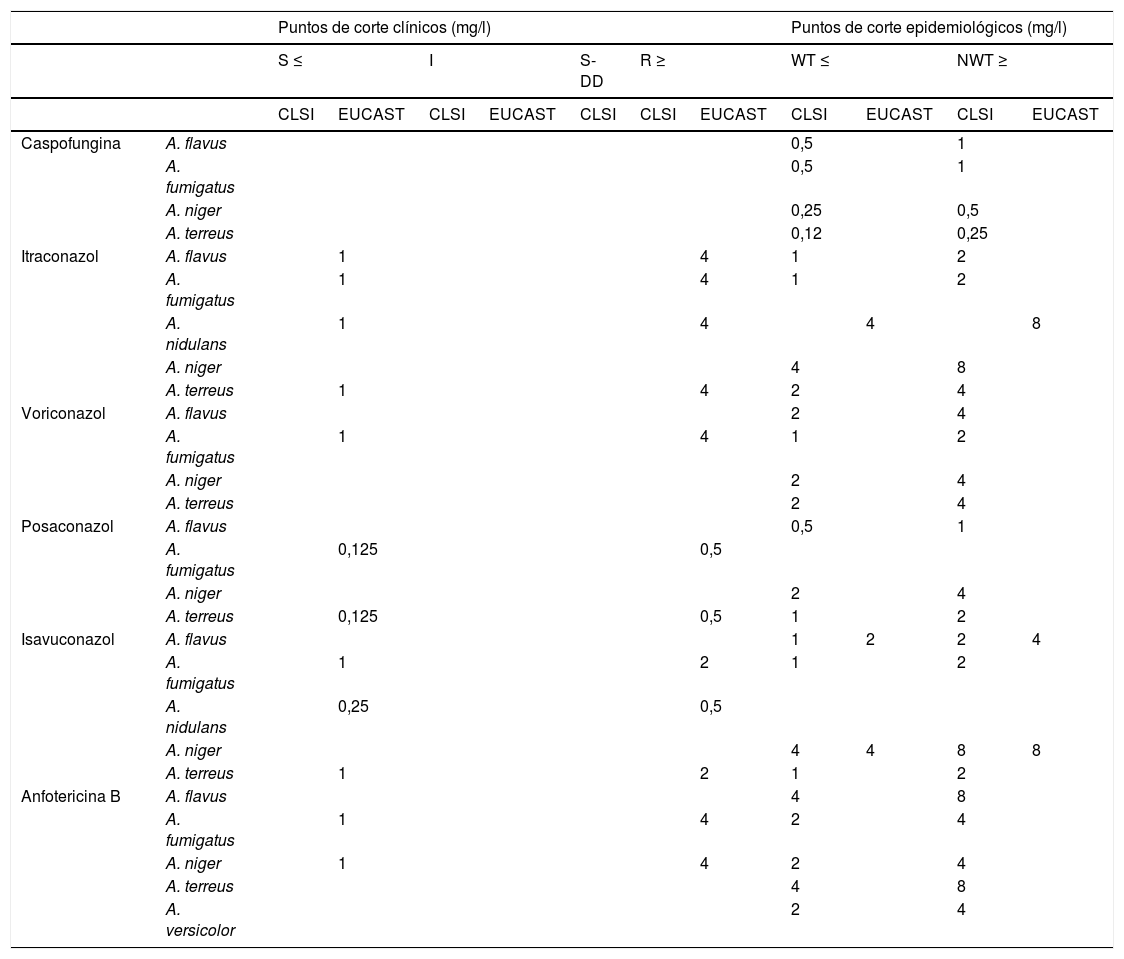
Interpretación de resultados de las técnicas de determinación de la sensibilidad antifúngicaSegún el valor de la CMI mediante los métodos de dilución CLSI y EUCAST, las cepas se clasifican en sensibles (S), intermedias (I), sensibles dependiendo de la dosis administrada (S-DD) y resistentes (R). La categoría S-DD no se incluye en las bacterias. Se ha establecido en función de la dosis de antifúngico administrada y para fluconazol exclusivamente. En la tabla 1 se especifican los puntos de corte clínicos (CBP), puntos de corte epidemiológicos (ECV/ECOFF) del CLSI y del EUCAST para Candida spp, y en la tabla 2, para Aspergillus spp por los métodos de microdilución.
Puntos de corte clínicos (CBP) y puntos de corte epidemiológicos (ECV/ECOFF) para Candida spp 6,7,14,47
| Puntos de corte clínicos (mg/l) | Puntos de corte epidemiológicos (mg/l) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S ≤ | I | S-DD | R ≥ | WT ≤ | NWT ≥ | |||||||
| CLSI | EUCAST | CLSI | EUCAST | CLSI | CLSI | EUCAST | CLSI | EUCAST | CLSI | EUCAST | ||
| Anidulafungina | C. albicans | 0,25 | 0,03 | 0,5 | 1 | 0,06 | 0,12 | 0,25 | ||||
| C. auris | 0,5 | 1 | 1 | 2 | ||||||||
| C. dubliniensis | - | 0,12 | 0,25 | |||||||||
| C. glabrata | 0,12 | 0,06 | 0,25 | 0,5 | 0,12 | 0,25 | 0,5 | |||||
| C. guilliermondii | 2 | 4 | 8 | 8 | 16 | |||||||
| C. krusei | 0,25 | 0,06 | 0,5 | 1 | 0,12 | 0,25 | 0,5 | |||||
| C. lusitaniae | 1 | 2 | ||||||||||
| C. parapsilosis | 2 | 0,002 | 4 | 8 | 8 | 8 | 16 | |||||
| C. tropicalis | 0,25 | 0,06 | 0,5 | 1 | 0,12 | 0,12 | 0,25 | |||||
| Caspofungina | C. albicans | 0,25 | 0,5 | 1 | ||||||||
| C. glabrata | 0,12 | 0,25 | 0,5 | |||||||||
| C. guilliermondii | 2 | 4 | 8 | |||||||||
| C. krusei | 0,25 | 0,5 | 1 | |||||||||
| C. parapsilosis | 2 | 4 | 8 | |||||||||
| C. tropicalis | 0,25 | 0,5 | 1 | |||||||||
| Micafungina | C. albicans | 0,25 | 0,016 | 0,5 | 1 | 0,03 | 0,03 | 0,06 | ||||
| C. auris | 0,5 | 0,5 | 1 | 1 | ||||||||
| C. dubliniensis | 0,12 | 0,25 | ||||||||||
| C. glabrata | 0,06 | 0,03 | 0,12 | 0,25 | 0,06 | 0,03 | 0,06 | |||||
| C. guilliermondii | 2 | 4 | 8 | 2 | 4 | |||||||
| C. krusei | 0,25 | 0,5 | 1 | 0,25 | 0,5 | |||||||
| C. lusitaniae | 0,5 | 1 | ||||||||||
| C. parapsilosis | 2 | 0,002 | 4 | 8 | 4 | 4 | 8 | |||||
| C. tropicalis | 0,25 | 0,5 | 1 | 0,06 | 0,12 | |||||||
| Fluconazol | C. albicans | 2 | 2 | 4 | 8 | 8 | 0,5 | 1 | ||||
| C. dubliniensis | 0,5 | 1 | ||||||||||
| C. glabrata | 0,002 | < 32 | 64 | 64 | 8 | 16 | ||||||
| C. guilliermondii | 8 | 16 | ||||||||||
| C. lusitaniae | 1 | 2 | ||||||||||
| C. parapsilosis | 2 | 2 | 4 | 8 | 8 | 1 | 2 | |||||
| C. tropicalis | 2 | 2 | 4 | 8 | 8 | 1 | 2 | |||||
| C. neoformans | 8 | |||||||||||
| Itraconazol | C. albicans | 0,06 | 0,12 | 0,06 | ||||||||
| C. auris | 0,5 | 0,5 | 1 | 1 | ||||||||
| C. dubliniensis | 0,06 | 0,12 | 2 | 4 | ||||||||
| C. glabrata | 4 | 2 | 8 | 4 | ||||||||
| C. krusei | 1 | 1 | 2 | 2 | ||||||||
| C. lusitaniae | 1 | 0,125 | 2 | 0,25 | ||||||||
| C. parapsilosis | 0,125 | 0,25 | 0,25 | 0,125 | 0,25 | |||||||
| C. tropicalis | 0,125 | 0,25 | 0,25 | 0,5 | 0,125 | 1 | 0,25 | |||||
| Isavuconazol | C. auris | - | 1 | - | 2 | |||||||
| C. dubliniensis | 0,06 | 0,125 | ||||||||||
| Posaconazol | C. albicans | 0,06 | 0,12 | 0,06 | 0,12 | |||||||
| C. auris | - | 0,25 | - | 0,5 | ||||||||
| C. dubliniensis | 0,06 | 0,12 | ||||||||||
| C. glabrata | 1 | 2 | ||||||||||
| C. guillermondii | 0,5 | 1 | ||||||||||
| C. krusei | 0,5 | 1 | ||||||||||
| C. lusitaniae | 0,06 | 0,12 | ||||||||||
| C. parapsilosis | 0,06 | 0,12 | 0,25 | 0,5 | ||||||||
| C. tropicalis | 0,06 | 0,12 | 0,12 | 0,25 | ||||||||
| Voriconazol | C. albicans | 0,12 | 0,06 | 0,25-0,5 | 1 | 0,5 | 0,03 | 0,06 | ||||
| C. dubliniensis | 0,06 | 0,5 | ||||||||||
| C. glabrata | 0,25 | 0,5 | ||||||||||
| C. krusei | 0,5 | 1 | 2 | 0,5 | 1 | |||||||
| C. parapsilosis | 0,12 | 0,12 | 0,25-0,5 | 1 | 0,5 | 0,03 | 0,06 | |||||
| C. tropicalis | 0,12 | 0,12 | 0,25-0,5 | 1 | 0,5 | 0,12 | 0,25 | |||||
| Anfotericina B | C. albicans | 1 | 2 | 2 | 4 | |||||||
| C. auris | 2 | 1 | 4 | 2 | ||||||||
| C. glabrata | 1 | 2 | 2 | 4 | ||||||||
| C. krusei | 1 | 2 | 2 | 4 | ||||||||
| C. parapsilosis | 1 | 2 | 2 | 4 | ||||||||
| C. tropicalis | 1 | 2 | 2 | 4 | ||||||||
* En negrita se especifican las especies con puntos de corte clínicos (CBP) o puntos de corte epidemiológicos (ECV/ECOFF) que presentan diferencia de más de 2 diluciones entre los 2 métodos de referencia (CLSI Y EUCAST).
CLSI: Committee for Clinical and Laboratory Standards; EUCAST: European Committee for Antimicrobial Susceptibility Testing; I: cepas intermedias; NWT: non-wild type (no pertenece a la población salvaje); S: cepas sensibles; S-DD: cepas sensibles dependiendo de la dosis administrada; R: cepas resistentes; WT: wild type (población salvaje).
Puntos de corte clínicos (CBP) y puntos de corte epidemiológicos (ECV/ECOFF) para Aspergillus spp714
| Puntos de corte clínicos (mg/l) | Puntos de corte epidemiológicos (mg/l) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S ≤ | I | S-DD | R ≥ | WT ≤ | NWT ≥ | |||||||
| CLSI | EUCAST | CLSI | EUCAST | CLSI | CLSI | EUCAST | CLSI | EUCAST | CLSI | EUCAST | ||
| Caspofungina | A. flavus | 0,5 | 1 | |||||||||
| A. fumigatus | 0,5 | 1 | ||||||||||
| A. niger | 0,25 | 0,5 | ||||||||||
| A. terreus | 0,12 | 0,25 | ||||||||||
| Itraconazol | A. flavus | 1 | 4 | 1 | 2 | |||||||
| A. fumigatus | 1 | 4 | 1 | 2 | ||||||||
| A. nidulans | 1 | 4 | 4 | 8 | ||||||||
| A. niger | 4 | 8 | ||||||||||
| A. terreus | 1 | 4 | 2 | 4 | ||||||||
| Voriconazol | A. flavus | 2 | 4 | |||||||||
| A. fumigatus | 1 | 4 | 1 | 2 | ||||||||
| A. niger | 2 | 4 | ||||||||||
| A. terreus | 2 | 4 | ||||||||||
| Posaconazol | A. flavus | 0,5 | 1 | |||||||||
| A. fumigatus | 0,125 | 0,5 | ||||||||||
| A. niger | 2 | 4 | ||||||||||
| A. terreus | 0,125 | 0,5 | 1 | 2 | ||||||||
| Isavuconazol | A. flavus | 1 | 2 | 2 | 4 | |||||||
| A. fumigatus | 1 | 2 | 1 | 2 | ||||||||
| A. nidulans | 0,25 | 0,5 | ||||||||||
| A. niger | 4 | 4 | 8 | 8 | ||||||||
| A. terreus | 1 | 2 | 1 | 2 | ||||||||
| Anfotericina B | A. flavus | 4 | 8 | |||||||||
| A. fumigatus | 1 | 4 | 2 | 4 | ||||||||
| A. niger | 1 | 4 | 2 | 4 | ||||||||
| A. terreus | 4 | 8 | ||||||||||
| A. versicolor | 2 | 4 | ||||||||||
CLSI: Committee for Clinical and Laboratory Standards; EUCAST: European Committee for Antimicrobial Susceptibility Testing; I: cepas intermedias; NWT: non-wild type (no pertenece a la población salvaje); S: cepas sensibles; S-DD: cepas sensibles dependiendo de la dosis administrada; R: cepas resistentes; WT: wild type (población salvaje).
Para Candida spp, CLSI no establece CBP para itraconazol, isavuconazol, posaconazol y anfotericina B, pero define ECV para estos antifúngicos (tabla 1) y en el caso de Aspergillus spp solo define ECV (tabla 2). EUCAST no establece puntos de corte para caspofungina e isavuconazol y Candida spp, definiendo ECV para estos antifúngicos (tabla 1). Para Aspergillus spp establece puntos de corte solo hay datos por el EUCAST47. Crytococcus spp solo tiene definido ECV por CLSI7.
¿Cuándo se deben realizar pruebas de sensibilidad antifúngica?El mejor test de sensibilidad es una correcta identificación del microorganismo causante de la infección. Si se conoce la especie, se puede pronosticar su sensibilidad por los datos epidemiológicos de los cuales se dispone. Las pruebas de sensibilidad a los antifúngicos deben realizarse en48-50 todas las micosis invasivas; las micosis orofaríngeas y mucofaríngeas que no responden al tratamiento; en las micosis producidas por patógenos emergentes en las cuales no se dispone de datos previos de su sensibilidad; ante cualquier tipo de micosis que no responda al tratamiento administrado, y cuando se desea conocer la prevalencia de cepas resistentes en el hospital.
¿Cuándo se deben utilizar los métodos de referencia para determinar la sensibilidad a los antifúngicos?Aunque los métodos de referencia son laboriosos y deben realizarse por personal experimentado, hay situaciones en que su uso es imprescindible, como48-50 confirmar las cepas aisladas resistentes obtenidas por otros métodos; cuando se estudia la actividad de nuevos antifúngicos; en la determinación de los puntos de corte clínicos y epidemiológicos; siempre que se quiera evaluar un método comercial, y en estudios epidemiológicos.
Ante una cepa aislada resistente a un antifúngico, por cualquiera de los métodos de sensibilidad, se recomienda comprobar la identificación de la especie aislada y la pureza del cultivo, y repetir el estudio de sensibilidad utilizando siempre un método de referencia de dilución (CLSI o EUCAST) o remitir la cepa aislada a un centro de referencia. Los puntos de corte epidemiológicos y puntos de corte clínicos del CLSI y del EUCAST pueden sufrir cambios, por lo que se aconseja consultar las actualizaciones de los documentos.
ConclusionesLa utilidad clínica de los estudios de sensibilidad in vitro es la de predecir el éxito/fracaso del tratamiento antifúngico, detectando las cepas aisladas resistentes. Aunque está demostrado que la resistencia in vitro en ocasiones pronostica el fracaso terapéutico, hay que tener en cuenta que existen otros factores inherentes al paciente (estado inmunológico, enfermedad de base, etc.) y al antifúngico (dosis administrada y el tiempo que se ha tardado en instaurar el tratamiento) que tienen mucha influencia. Aunque se ha avanzado mucho en los métodos de sensibilidad in vitro a los antifúngicos con la actualización de los documentos de referencia (CLSI y EUCAST) y con la introducción de los métodos comerciales, existen aún muchas limitaciones. Por ello se necesitan nuevos métodos más reproducibles y rápidos. En este sentido parece que las nuevas metodologías basadas en la proteómica y en la amplificación de ácidos nucleicos podrían optimizar la detección rápida de resistencias, lo que favorece la eficacia de la terapia antifúngica.
Conflicto de interesesLas Dras. Carmen Castro Méndez, Estefanía García Sánchez y Estrella Martín-Mazuelos declaran que no tienen ningún conflicto de intereses.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.