Introducción
Las alteraciones metabólicas constituyen uno de los efectos adversos más preocupantes del tratamiento antirretroviral (TAR). Su importancia se puso de manifiesto con la descripción a finales de 1997 de un síndrome caracterizado por lipodistrofia o redistribución de la grasa asociado a hiperlipidemia y resistencia insulínica en enfermos que recibían inhibidores de la proteasa 1-3. Aunque la identificación de este síndrome llevó a pensar que todos los trastornos metabólicos podían tener una patogenia común y que podrían englobarse en un síndrome metabólico único, en la actualidad se sabe que estas alteraciones no siempre se presentan agrupadas. Las dislipemias en particular son muy frecuentes en los pacientes que reciben TAR y pueden presentarse sin cambios en el contenido total o regional de la grasa 4-6. El interés de las dislipemias asociadas a la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) deriva de su estrecha relación con la morbilidad y la mortalidad cardiovascular.
Dislipemias y morbilidad cardiovascular en pacientes con infección por el VIH
Numerosos estudios epidemiológicos han demostrado que la dislipemia, particularmente la elevación del colesterol unido a lipoproteínas de baja densidad (c-LDL), constituye un factor de riesgo cardiovascular en la población general, y existen cada vez más evidencias de que la dislipemia asociada al TAR puede también acelerar el desarrollo de arteriosclerosis en la población infectada por el VIH-1. Se han encontrado diversos marcadores o predictores de arteriosclerosis en los pacientes con infección por el VIH-1, especialmente en los que reciben inhibidores de la proteasa. Además de un perfil lipídico aterogénico, se ha observado una elevación de la proteína C reactiva 7, una mayor incidencia de placas ateroscleróticas en las arterias femorales y carotídeas 8-10 y signos de disfunción endotelial en las arterias 11.
Aunque todavía no se dispone de datos epidemiológicos definitivos sobre la repercusión a largo plazo de las dislipemias asociadas al TAR, en los últimos años se han difundido los resultados de diversos estudios retrospectivos y prospectivos que, en general, han detectado una mayor incidencia de episodios cardiovasculares en los pacientes en TAR 12-16. Los datos más robustos son los de la base de datos de los hospitales franceses 12, los de la cohorte HOPS (HIV Outpatient Study) de Estados Unidos 13 y los procedentes del estudio multicohorte D:A:D 14-16. En el análisis de la base de datos de los hospitales franceses, que incluye cerca de 40.000 pacientes, se observó un aumento en la incidencia de infarto agudo de miocardio (IAM) que se relacionó con la duración del TAR 12. En la cohorte HOPS se examinó la relación entre la terapia antirretroviral y la incidencia de cardiopatía isquémica (IAM o angina) en 5.672 pacientes de 9 centros en Estados Unidos entre enero de 1992 y enero de 2003. La incidencia de IAM aumentó significativamente a partir de la introducción de los inhibidores de la proteasa en 1996, aunque el número total de infartos fue reducido y la mayoría se produjeron en sujetos con varios factores de riesgo cardiovascular 13. La frecuencia de IAM fue mayor en los tratados con inhibidores de la proteasa que en los que no recibían estos fármacos.
El estudio epidemiológico más numeroso realizado hasta ahora para investigar la incidencia de accidentes cardiovasculares en pacientes con infección por el VIH-1 es el estudio multicohorte D:A:D (Data Colection on Adverse Events of Anti-HIV Drugs Study) 14-16. Se trata de un estudio prospectivo internacional en el que se han incluido más de 23.000 pacientes de varias cohortes para determinar la incidencia de IAM, accidentes cerebrovasculares y diabetes mellitus y su relación con el TAR. En una actualización reciente de los datos hasta febrero de 2004 15, con 76.577 pacientes-año de seguimiento, se confirma que existe una asociación estrecha entre la duración del TAR y el riesgo de sufrir un IAM, de manera que, en relación con los no tratados, el riesgo relativo de IAM es de casi el doble al cabo de 1-2 años de tratamiento y de más del cuádruple tras 6 años de tratamiento. La incidencia de IAM en los no tratados fue de 1,39 episodios por 1.000 pacientes-año y llegó a 6,07/1.000 pacientes-año en los tratados durante 6 o más años (riesgo relativo [RR] frente a no tratados, 4,38; intervalo de confianza del 95% [IC 95%]: 2,39-8,04). El riesgo ajustado por cada año adicional de TAR fue de 1,17 (IC 95%: 1,11-1,24). Cuando se ajustó por concentraciones de lípidos (colesterol total, colesterol unido a lipoproteínas de alta densidad [c-HDL], y triglicéridos) la magnitud de la asociación entre TAR e IAM se redujo de manera que el RR de IAM por cada año adicional de TAR fue de 1,10 (IC 95%: 1,01-1,19). Este hallazgo indica que la dislipemia explica parcialmente la relación entre el TAR y el riesgo de IAM.
Frecuencia de dislipemia con los diferentes grupos de fármacos antirretrovirales
La frecuencia de dislipemia difiere sustancialmente según el TAR empleado. Los resultados del análisis transversal de los pacientes incluidos en el estudio D:A:D ofrecen una información interesante sobre la frecuencia de dislipemia con las diferentes pautas de TAR en la práctica clínica 16. En este análisis se incluyeron los datos basales de 17.832 pacientes con diferentes combinaciones de fármacos antirretrovirales y un grupo de sujetos no tratados. La mayor frecuencia de dislipidemias se observó en los tratados conjuntamente con inhibidores de la proteasa y de la transcriptasa inversa no análogos de nucleósidos (hipertrigliceridemia 54%, hipercolesterolemia 44%, descenso del c-HDL 24%), seguidos de los que estaban tratados con inhibidores de la proteasa (hipertrigliceridemia 39%, hipercolesterolemia 27%, descenso del c-HDL 27%). En relación con los que no recibían TAR, la probabilidad de que existiera hipercolesterolemia en los tratados con inhibidores de la proteasa fue el doble (odds ratio [OR]: 2; IC 95%: 1,7-2,3), y el cuádruple en los tratados conjuntamente con inhibidores de la proteasa y de la transcriptasa inversa no análogos de nucleósidos (OR: 4,7; IC 95%: 3,8-5,7). En los que recibían pautas con inhibidores de la transcriptasa no análogos de nucleósidos, la probabilidad de encontrar hipercolesterolemia fue también mayor que en los que no recibían tratamiento antirretroviral (OR: 1,6; IC 95%: 1,3-1,9). A diferencia de los grupos anteriores, los tratados sólo con inhibidores de la transcriptasa análogos de nucleósidos no presentaron un mayor riesgo de hipercolesterolemia (OR: 0,8; IC 95%: 0,7-1). Las variables que se asociaron significativamente con la presencia de hipercolesterolemia en este estudio fueron el tratamiento con inhibidores de la proteasa, la duración del tratamiento con inhibidores de la proteasa y de la transcriptasa inversa no análogos de nucleósidos, una mayor edad, una cifra más alta de linfocitos CD4 y la existencia de lipodistrofia 16.
Una de las principales limitaciones de los estudios epidemiológicos en que se comparan las alteraciones lipídicas asociadas con las diferentes pautas de TAR, es la dificultad para analizar por separado los efectos sobre el perfil lipídico de los distintos fármacos dentro de una misma familia. Es bien conocido que los cambios producidos sobre los lípidos plasmáticos pueden depender no sólo de la familia, sino también del fármaco empleado. El mejor diseño de investigación para evaluar los efectos de los fármacos antirretrovirales sobre el perfil lipídico es el ensayo clínico aleatorizado. En los últimos años, la mayoría de los ensayos sobre fármacos antirretrovirales han incluido el análisis de los cambios lipídos como criterio secundario de valoración, lo que está permitiendo conocer mejor el efecto de los diferentes fármacos sobre el perfil lipídico. En los apartados siguientes se comentan los datos disponibles sobre los lípidos plasmáticos, y la frecuencia y características de las dislipemias asociadas con las tres principales familias de antirretrovirales.
Perfil lipídico de los inhibidores de la proteasa
Los cambios lipídicos asociados con los inhibidores de la proteasa han sido un objetivo preferente en numerosos estudios de investigación realizados en los últimos años 17-37. En conjunto, respecto a los efectos individuales de los distintos fármacos, la información disponible indica que las dislipemias tienden a ser más marcadas con ritonavir y con lopinavir-ritonavir que con otros inhibidores de la proteasa 17,19-25. Amprenavir 29 y nelfinavir 25,31 producen efectos intermedios, mientras que indinavir 25,32 y saquinavir 33 generalmente producen menos alteraciones lipídicas, sobre todo cuando no se usan en combinación con ritonavir. Atazanavir se diferencia de otros inhibidores de la proteasa en su mejor perfil lipídico 35. Los resultados de varios ensayos clínicos donde se ha comparado con diversas pautas de tratamiento antirretroviral han confirmado que induce menos alteraciones lípídicas, tanto en pacientes naive como en pretratados 36,37, especialmente cuando no se potencia con ritonavir.
En general, en los pacientes tratados con inhibidores de la proteasa suele observarse predominantemente hipertrigliceridemia, sobre todo en los que reciben ritonavir 23 y lopinavir/ritonavir 24, pero también es frecuente que se produzca hipercolesterolemia con aumento de c-LDL 25-29. Las concentraciones de c-HDL tienden a permanecer estables 25-27,30 o aumentan discretamente 28,29. Periard et al 25 compararon el perfil lipídico en pacientes tratados con ritonavir, indinavir y nelfinavir. En todos los grupos se observaron elevaciones en las concentraciones de colesterol que fueron más marcadas en el grupo de ritonavir que en el de indinavir o nelfinavir. El tratamiento con ritonavir, pero no con indinavir ni con nelfinavir, se asoció con una elevación importante en los valores de triglicéridos. Las concentraciones de c-HDL no se modificaron 25. Con amprenavir se han descrito elevaciones sobre todo de los triglicéridos, y en menor medida del colesterol total y del c-LDL 29. Como cabría esperar, la incidencia de dislipemias aumenta cuando se emplean inhibidores de la proteasa potenciados con ritonavir. Con indinavir-ritonavir se producen más modificaciones en el colesterol total y en el c-LDL que con saquinavir-ritonavir 34. Las diferencias en el perfil lipídico de atazanavir cuando se administra con y sin ritonavir han sido puestas de manifiesto en el estudio AI424-089, un ensayo aleatorizado en pacientes naive en el que se comparaba atazanavir potenciado con ritonavir (300/100 mg) frente a atazanavir no potenciado (400 mg), en ambos casos en combinación con lamivudina y estavudina. El incremento medio en el colesterol total fue del 15% en los pacientes asignados a atazanavir potenciado frente al 6% en los que recibieron atazanavir no potenciado; los triglicéridos aumentaron un 26% en el brazo de atazanavir potenciado y disminuyeron un 3% con atazanavir no potenciado 38.
Es interesante mencionar que, excepto en el caso de atazanavir, la mayoría de los estudios han puesto de manifiesto que los trastornos lipídicos asociados con los inhibidores de la proteasa son mucho más frecuentes y de mayor magnitud en los pacientes pretratados que en los naive18-22.
Perfil lipídico de los inhibidores de la transcriptasa inversa no análogos de nucleósidos
Con los inhibidores de la transcriptasa inversa no nucleósidos las alteraciones lipídicas ocurren con menor frecuencia que con los inhibidores de la proteasa 39,40, especialmente en el caso de la nevirapina 28,41. Además, estos fármacos en muchos pacientes inducen elevaciones en las concentraciones de c-HDL de mayor cuantía que las observadas con los inhibidores de la proteasa. En los pacientes del estudio Atlantic que recibieron estavudina, didanosina y nevirapina, se observó un perfil lipídico antiaterogénico con aumento del c-HDL y disminución de la proporción colesterol total/c-HDL 28. En un trabajo en el que se analizaban las subclases de lipoproteínas en pacientes tratados con efavirenz se observó una dislipemia caracterizada por un aumento ligero del colesterol total y del c-LDL, con una escasa cantidad de LDL pequeñas y densas y un aumento del c-HDL; un perfil lipídico que se asocia con un menor riesgo cardiovascular que el descrito con los inhibidores de la proteasa 42.
En una comparación directa de nevirapina y efavirenz en el ensayo 2NN, los pacientes tratados con nevirapina presentaron un perfil lipídico más favorable que los que recibieron efavirenz, con mayores aumentos del c-HDL y un descenso más marcado de la proporción colesterol total: c-HDL. En los tratados con nevirapina la elevación de triglicéridos también fue inferior a la observada con efavirenz, aunque las diferencias fueron de una magnitud relativamente pequeña 41.
Perfil lipídico de los inhibidores de la transcriptasa inversa análogos de nucleósidos
El efecto de los inhibidores de la transcriptasa inversa análogos de nucleósidos sobre los lípidos ha sido objeto de especial atención en los últimos años. Aunque en el pasado no se había encontrado asociación entre el uso de estos fármacos y el desarrollo de hiperlipidemia 16,43, datos recientes sugieren que algunos de ellos, en particular la estavudina, pueden estar implicados en la producción de dislipemia 44-46. Así, en un ensayo clínico que comparaba 3 pautas de tratamiento antirretroviral en pacientes naive, dos de ellas compuestas por nelfinavir y dos análogos de nucleósidos (estavudina, lamivudina y nelfinavir, y zidovudina, lamivudina y nelfinavir) y la restante por tres análogos de nucleósidos (zidovudina, lamivudina y abacavir) se comprobó, además del mayor aumento de los lípidos plasmáticos en los 2 brazos de nelfinavir, una mayor elevación en la cifra de triglicéridos a las 48 semanas en el brazo de estavudina, lamivudina y nelfinavir que en el de zidovudina, lamivudina y nelfinavir 44. En otro ensayo clínico reciente, en el que se comparaba tenofovir frente a estavudina, ambos en combinación con lamivudina y efavirenz (Estudio 903-Gilead Sciences Inc), se observó un perfil lipídico más favorable con tenofovir 45. En los pacientes tratados con estavudina se produjo una mayor elevación de los triglicéridos, colesterol total y c-LDL, mientras que el c-HDL aumentó más en los tratados con tenofovir 45. Por último, los resultados preliminares del ensayo 934, también promovido por Gilead Sciences Inc, en el que se comparaban tenofovir-emtricitavina con zidovudina-lamivudina, en ambos casos en combinación con efavirenz, sugieren también un perfil lipídico más favorable con tenofovir que con zidovudina, si bien en este caso las diferencias fueron de menor magnitud que en el ensayo 903 46.
Patogénesis y características de la dislipemia asociada al tratamiento antirretroviral
Los cambios en los lípidos plasmáticos de los pacientes con infección por el VIH se describieron antes de la introducción de los inhibidores de la proteasa 47, aunque su frecuencia y magnitud eran menores que las observadas actualmente con el tratamiento antirretroviral. En la era pre-TARGA (tratamiento antirretroviral de gran actividad), muchos pacientes tenían concentraciones bajas de c-HDL y c-LDL e hipertrigliceridemia, un perfil considerado característico de la caquexia asociada a los síndromes de deterioro general que se producen en las enfermedades crónicas, y que probablemente son inducidos por citocinas 47. Se considera que tanto la hipertrigliceridemia como el c-LDL bajo observados en los pacientes con caquexia asociada al sida son consecuencia de la inhibición de la actividad de la lipoproteinlipasa sérica mediada por el factor de necrosis tumoral y por el interferón-α48.
El mecanismo responsable de las dislipemias secundarias al tratamiento antirretroviral no es bien conocido. No se sabe todavía si se producen por un efecto directo de los fármacos o son el resultado de una interacción entre diferentes factores, incluyendo el tratamiento antirretroviral, la predisposición genética, factores ambientales como la dieta o el ejercicio físico, u otros factores como la respuesta del huésped a la infección VIH-1. En la dislipemia asociada al tratamiento con lopinavir-ritonavir se ha descrito una correlación entre las concentraciones plasmáticas de lopinavir y el incremento del colesterol total y de los triglicéridos 49-51, si bien esta asociación no ha sido observada en todos los estudios 52,53. La variabilidad en el desarrollo de los cambios lipídicos sugiere que la predisposición genética puede tener un papel fundamental. El genotipo de la apolipoproteína E2 y los polimorfismos en el gen de la apolipoproteína C-III se han implicado en el desarrollo de la dislipemia asociada al tratamiento en los pacientes con infección por el VIH-1 54-56.
La influencia de los inhibidores de la proteasa sobre el metabolismo de los lípidos se ha estudiado en modelos experimentales. En un modelo murino se observó que durante el tratamiento con ritonavir aumentaban las sterol regulatory element binding proteins (SREBP-1 y 2), proteínas que modifican la expresión de los genes reguladores del metabolismo lipídico, lo que se traducía en un incremento del colesterol y los triglicéridos 57. Se ha sugerido que los inhibidores de la proteasa podrían inhibir la cytoplasmic retinoid-acid binding protein type 1 (CRABP-1) y la low density lipoprotein-receptor-related protein (LRP) 58. La inhibición de la CRABP-1 induce una reducción de la actividad del receptor retinoide X, lo que conlleva una disminución de la diferenciación y un aumento de la apoptosis de los adipocitos periféricos, y por tanto una hiperlipidemia secundaria a la disminución del almacenamiento de los triglicéridos y a su liberación a la circulación. La inhibición de la LRP, que escinde los ácidos grasos de los triglicéridos circulantes, permitiendo su almacenamiento en los adipocitos, y aumenta la captación hepática de los remanentes de los quilomicrones, produce también un aumento de los triglicéridos plasmáticos. Por otra parte, la resistencia a la insulina característica del síndrome metabólico asociado a los inhibidores de la proteasa produce una alteración funcional de la lipoproteinlipasa, que es la enzima que cataboliza las lipoproteínas de muy baja densidad (VLDL), lo que también contribuye a la hipertrigliceridemia en estos pacientes. El tratamiento con inhibidores de la proteasa de células Hep G2 llevó a la acumulación de Apo B intracelular por inhibición de su degradación y, en presencia de ácido oleico, a un aumento de su secreción, lo que podría también estar implicado en la elevación de los lípidos observada durante el tratamiento con estos fármacos 59.
Como ya se ha comentado, la expresión bioquímica de las dislipemias asociadas al TAR es heterogénea. Pueden presentarse elevaciones aisladas o combinadas de los triglicéridos y del colesterol total con cambios variables en las LDL y HDL, que pueden configurar perfiles lipídicos con un riesgo cardiovascular diferente. En los pacientes tratados con inhibidores de la proteasa se produce fundamentalmente una elevación de los triglicéridos. La hipertrigliceridemia puede favorecer la producción de unas VLDL grandes y ricas en triglicéridos, que desplazan al colesterol que contiene la lipoproteína, que queda por este motivo empobrecida en colesterol. Después de la acción de las lipasas, estas lipoproteínas pierden el exceso de triglicéridos y se transforman en LDL pequeñas y densas, que son más lesivas para la pared arterial 60. De hecho, en pacientes tratados con inhibidores de la proteasa se ha encontrado un predominio de LDL pequeñas y densas 61, una de las alteraciones lipídicas típicas del denominado síndrome metabólico 62.
El síndrome metabólico ha sido definido en el tercer documento del grupo de expertos del National Cholesterol Educational Program (NCEP), Adult Treatment Panel III o ATP III 63, como la constelación de factores de riesgo cardiovascular lipídicos y no lipídicos, habitualmente asociados a variables relacionadas con el estilo de vida, como obesidad y sedentarismo. Para el diagnóstico del síndrome es necesario que se cumplan tres o más de siguientes criterios: obesidad abdominal (circunferencia de cintura > 102 cm en varones y > 88 cm en mujeres); triglicéridos ≥150 mg/dl; c-HDL < 40 mg/dl en varones y < 50 mg/dl en mujeres; presión arterial ≥130/ ≥85; y glucosa en ayunas ≥110 mg/dl. Recientemente la International Diabetes Federation (IDF) 64 ha revisado la definición de síndrome metabólico y se han difundido unos nuevos criterios para establecer el diagnóstico, que se diferencian de los anteriores en que es imprescindible la presencia de obesidad abdominal (definida como circunferencia de cintura ≥94 cm para varones europeos y ≥80 cm para mujeres europeas) y en que la cifra para definir hiperglucemia se reduce a ≥100 mg/dl (5,4 mmol/l). La causa fundamental de este cambio se debe a la importancia que tiene el diámetro de la cintura como factor de riesgo cardiovascular y de diabetes mellitus. Algunos de los pacientes tratados con inhibidores de la proteasa desarrollan lipodistrofia, resistencia a la insulina, hipertrigliceridemia y disminución del c-HDL 1,3,65, por lo que se considera que tendrían una forma secundaria del síndrome metabólico. La dislipemia asociada a este síndrome se caracteriza por una HDL baja, hipertrigliceridemia moderada y LDL pequeñas y densas, altamente aterogénicas 66. Entre los pacientes con infección por el VIH-1, se ha observado una prevalencia de síndrome metabólico que oscila entre el 17 67 y el 45% 68 dependiendo de las características de la población estudiada, pues en aquellos estudios donde la población estaba formada por una mayor proporción de adictos a drogas por vía parenteral (ADVP) y varones la prevalencia de síndrome metabólico fue inferior. La presencia de síndrome metabólico se ha relacionado de forma directa con la edad, el índice de masa corporal y la exposición previa a pautas que contienen inhibidores de la proteasa 67.
Se ha sugerido que las alteraciones producidas por los inhibidores de la proteasa sobre las lipasas que metabolizan los quilomicrones y las VLDL pueden estar implicadas en la génesis de las hipertrigliceridemias graves que ocasionalmente desarrollan estos pacientes 69.
Estrategias terapéuticas para la dislipemia asociada al tratamiento antirretroviral
Modificación del tratamiento antirretroviral
Puesto que las alteraciones lipídicas se han asociado con determinadas pautas o fármacos antirretrovirales, la modificación del TAR, sustituyendo el fármaco potencialmente inductor de la dislipemia por otro, constituye una de las posibles estrategias terapéuticas para el tratamiento de los trastornos lipídicos en estos pacientes. Esta estrategia ha sido evaluada ya en numerosos ensayos clínicos 42,70-91.
Sustitución de inhibidores de la proteasa. Los cambios en el perfil lipídico tras la sustitución de un inhibidor de la proteasa por un inhibidor de la transcriptasa inversa no análogo de nucleósidos (nevirapina o efavirenz) o un tercer análogo de nucleósidos (abacavir) han sido analizados por numerosos investigadores 42,70-82. En la mayoría de los casos se han observado efectos favorables sobre el perfil lipídico, especialmente después de la sustitución del inhibidor de la proteasa por abacavir o por nevirapina. En el ensayo NEFA, 460 pacientes suprimidos virológicamente con inhibidores de la proteasa se aleatorizaron a recibir abacavir, nevirapina o efavirenz 82. Las 3 sustituciones se siguieron de una mejoría en el perfil lipídico, pero fue el grupo de nevirapina el que presentó la mayor elevación en el c-HDL 82,83.
Los resultados de los ensayos clínicos de desarrollo de atazanavir han constatado que este fármaco tiene un perfil lipídico más favorable que otros inhibidores de la proteasa, tanto en pacientes naive como en pretratados 36,37. De esta manera se abre otra estrategia terapéutica para el tratamiento de las dislipemias asociadas al tratamiento antirretroviral: la sustitución del inhibidor de la proteasa por atazanavir. Los datos de varios estudios recientes en los que se ha evaluado este cambio confirman que puede ser beneficioso en muchos casos 84-86. Así, en el ensayo AI424067, la sustitución de una pauta basada en inhibidor de la proteasa potenciado o no con ritonavir por atazanavir no potenciado con ritonavir resultó en una mejoría significativa del perfil lipídico en pacientes suprimidos virológicamente que presentaban hiperlipemia (c-LDL > 130 mg/dl) 84. Los resultados preliminares del ensayo AI424097 (Estudio SWAN) realizado también en pacientes suprimidos virológicamente con inhibidores de la proteasa han confirmado el beneficio sobre los lípidos del cambio a atazanavir no potenciado 85.
Los efectos sobre los lípidos del cambio a atazanavir potenciado con ritonavir en pacientes tratados con una pauta basada en otros inhibidores de la proteasa potenciados están siendo objeto de estudio actualmente en ensayos clínicos aleatorizados. Datos preliminares de estudios observacionales no controlados sugieren que esta estrategia puede ser también beneficiosa sobre el perfil lipídico 86.
Sustitución de análogos de nucleósidos. La constatación del diferente efecto de los inhibidores de la transcriptasa inversa análogos de nucleósidos sobre los lípidos observado en los ensayos ESS40002 87 y GS-903 45, ha propiciado la investigación de los cambios en el perfil lipídico al sustituir estos fármacos. Los datos de varios estudios recientes sugieren que puede obtenerse un beneficio sobre los lípidos al sustituir los análogos de timidina (estavudina o zidovudina) por abacavir o tenofovir 88-91. Los efectos parecen más evidentes cuando se sustituye estavudina por tenofovir. En la fase de extensión del ensayo GS-903, se observó una reducción significativa en las concentraciones plasmáticas de triglicéridos, colesterol total y c-LDL, además de una mejoría en la lipoatrofia periférica, en un grupo de 85 pacientes que fueron cambiados de estavudina a tenofovir 90. Los beneficios sobre los lípidos plasmáticos del cambio a tenofovir en los pacientes tratados previamente con análogos de la timidina fueron observados en el estudio RECOVER 88 y han sido confirmados en el ensayo RAVE 89. En este ensayo clínico aleatorizado, 105 pacientes que presentaban lipoatrofia con una pauta terapéutica que incluía estavudina o zidovudina fueron aleatorizados a cambiar a abacavir o tenofovir. En ambas ramas se observó un aumento de similar magnitud en la grasa subcutánea en las extremidades. Los descensos en el colesterol total, c-LDL y triglicéridos, sin embargo, fueron más marcados en el grupo que cambió a tenofovir que en el de abacavir 89. Los resultados preliminares de un ensayo exploratorio aleatorizado en el que se analizan los efectos metabólicos de la sustitución de estavudina por tenofovir, en comparación con una reducción de dosis de estavudina, han puesto también de manifiesto una mejoría significativa del perfil lipídico en los pacientes que cambian a tenofovir 91.
En conjunto los resultados de los estudios que han evaluado la modificación del TAR indican que puede ser una estrategia beneficiosa para reducir los lípidos plasmáticos. No obstante, debido al carácter multifactorial de la dislipemia asociada a la infección por el VIH-1, las alteraciones lipídicas pueden no resolverse con el cambio del TAR. Aunque en los estudios controlados de sustitución difundidos hasta ahora, en general, no se ha observado una mayor frecuencia de fracaso virológico en los pacientes que sustituyeron un fármaco por otro que en el grupo control, en la mayoría de los ensayos los casos fueron cuidadosamente seleccionados y en algunos de ellos sólo se incluyeron pacientes sin fracasos virológicos previos. La elección de una estrategia de sustitución requiere tener en cuenta la historia antirretroviral previa, ya que no todos los pacientes son igualmente candidatos a realizar esta modificación del tratamiento.
Tratamiento hipolipemiante
La experiencia con el tratamiento hipolipemiante en pacientes con infección por el VIH-1 es todavía relativamente limitada 92-105. El problema principal con el uso de estatinas es su interacción farmacológica con los inhibidores de la proteasa. La mayoría de los inhibidores de la proteasa inhiben y/o inducen el citocromo P-450 (CYP) 3A4, que es el principal sistema enzimático por el que se metabolizan muchas de las estatinas. De los fármacos disponibles en la actualidad, lovastatina, simvastatina y atorvastatina se metabolizan por la vía del CYP3A4, si bien atorvastatina lo hace en menor medida que el resto. Fluvastatina se metaboliza por la vía del CYP2C9. Pravastatina se diferencia de las anteriores en que se elimina por múltiples rutas metabólicas, particularmente la glucoronidación y no utiliza de forma significativa la vía del CYP 106.
Aunque existen todavía muy pocos estudios farmacocinéticos que hayan analizado con profundidad las interacciones entre los inhibidores de la proteasa y las estatinas, los datos disponibles indican que la interacción es particularmente relevante y potencialmente muy peligrosa en el caso de simvastatina y lovastatina. En un trabajo en el que se evaluó la interacción de una combinación de ritonavir y saquinavir (400/400 mg dos veces al día) con simvastatina, atorvastatina y pravastatina en voluntarios seronegativos, se comprobó un aumento en el área bajo la curva de simvastatina y de atorvastatina de 30 veces y 3,4 veces, respectivamente, si bien la exposición a la forma activa de atorvastatina sólo aumentó un 79%. Por el contrario, en el caso de la pravastatina, la interacción fue de escasa magnitud y de signo contrario, y consistió en un descenso en el área bajo la curva de pravastatina de un 50% 107. Se han obtenido resultados parecidos cuando simvastatina y atorvastatina se han usado en combinación con nelfinavir, con un aumento de cinco veces en el área bajo la curva de simvastatina y de un 74% en la de atorvastatina 108. En otro estudio, lopinavir-ritonavir aumentó el área bajo la curva de atorvastatina y pravastatina en un 588 y un 30%, respectivamente 109.
Es posible que existan también interacciones farmacológicas entre las estatinas y los inhibidores de la transcriptasa inversa no nucleósidos, pero todavía no hay datos farmacocinéticos definitivos. Nevirapina es un inductor selectivo del CYP3A4, mientras que efavirenz tiene un efecto mixto, inductor e inhibidor del CYP3A. Existe por tanto la posibilidad de que estos fármacos puedan inducir el metabolismo de las estatinas y reducir así su actividad. En un estudio farmacocinético reciente, efavirenz redujo la exposición a simvastatina, atorvastatina y pravastatina en aproximadamente un 60, 40 y 40%, respectivamente 110. Aunque se necesita más información sobre estas posibles interacciones para poder determinar la dosis apropiada de los diferentes fármacos, los datos disponibles sugieren que las estatinas probablemente puedan utilizarse con seguridad en pacientes en tratamiento con efavirenz o nevirapina 111.
A diferencia de las estatinas, los fibratos son generalmente bien tolerados y se metabolizan por el sistema del CYP4A además del CYP3A4112, por lo que las interacciones con los inhibidores de la proteasa son improbables.
Aunque existe ya un buen número de estudios no controlados que han evaluado la seguridad y eficacia del tratamiento con estatinas o fibratos, el número de ensayos clínicos aleatorios es todavía muy limitado 92-96, especialmente los que han comparado distintas estrategias terapéuticas 94,95,103. La mayoría de los estudios publicados indican que el beneficio del tratamiento hipolipemiante es modesto y con frecuencia las concentraciones lipídicas no regresan a valores normales o a los valores fijados en el documento del grupo de expertos del NCEP 63.
Recientemente se han difundido los resultados definitivos del estudio ACTG 5087 93, un ensayo aleatorizado en el que se comparaba pravastatina con fenofibrato en pacientes con infección por el VIH-1 que presentaban hipercolesterolemia (c-LDL > 130 mg/dl) e hipertrigliceridemia (triglicéridos > 200 mg/dl). Como era de esperar, la pravastatina fue más eficaz para controlar la hipercolesterolemia y el fenofibrato controló mejor la hipertrigliceridemia. La mediana del descenso de colesterol a las 12 semanas en el grupo de pravastatina fue de 48 mg/dl, mientras que en el grupo de fenofibrato los triglicéridos descendieron 138 mg/dl. Un número mayor de pacientes alcanzó los valores de c-LDL recomendados por el NCEP entre los tratados con pravastatina que en los que recibieron fenofibrato, y en los que recibieron fenofibrato hubo una mayor proporción que alcanzó los valores óptimos de triglicéridos y de c-HDL. Sin embargo, a las 12 semanas de tratamiento, sólo el 1% de los tratados con fenofibrato y el 5% de los que recibieron pravastatina, lograron los objetivos del NCEP para c-LDL y triglicéridos. La combinación de fenofibrato y pravastatina, empleada en pacientes que no habían respondido a los fármacos por separado, produjo descensos más marcados y fue bien tolerada 93.
En un estudio prospectivo realizado en 656 pacientes con infección VIH-1 que presentaban hiperlipemia marcada (43,9% triglicéridos > 300 mg/dl; 22,4% colesterol total > 290 mg/dl), Calza et al 96 evaluaron la eficacia de fibratos (bezafibrato, gemfibrozilo, fenofibrato) y estatinas (pravastatina y fluvastatina). En el análisis a los 6 meses de tratamiento, en los pacientes tratados con fibratos la cifra de triglicéridos descendió un 41,2% y la de colesterol total un 23,3%. Las estatinas redujeron los triglicéridos un 36,1% y el colesterol total un 16,9%. La eficacia se mantuvo a los 12 meses, tanto en los pacientes tratados con fibratos como en los que recibieron estatinas.
Se han publicado recientemente los resultados preliminares del primer ensayo clínico en el que se han comparado las dos principales estrategias terapéuticas para el tratamiento de la hiperlipemia en pacientes con terapia antirretroviral: modificación del tratamiento antirretroviral frente a fármacos hipolipemiantes 113. En este ensayo, 142 pacientes que estaban virológicamente suprimidos con una pauta antirretroviral que incluía inhibidores de la proteasa fueron aleatorizados a 4 grupos: añadir un hipolipemiante (pravastatina o bezafibrato) o cambiar el inhibidor de la proteasa por un inhibidor de la transcriptasa no nucleósido (efavirenz o nevirapina). En un análisis de los pacientes en tratamiento a los 12 meses, se observó una mayor reducción en las concentraciones de colesterol total y triglicéridos en los grupos de pravastatina y bezafibrato, comparados con los que cambiaron a no nucleósidos. Los triglicéridos descendieron un 41 y 47%, respectivamente, con pravastatina y bezafibrato, comparado con un 25% en el grupo de nevirapina y un 9% en el de efavirenz. Así mismo, el colesterol total disminuyó un 46% y un 37% con pravastatina y bezafibrato, mientras que se redujo un 27% con nevirapina y un 10% con efavirenz. En conclusión, los fármacos hipolipemiantes tuvieron un impacto significativamente mayor, tanto en el colesterol como en los triglicéridos, que la sustitución de los inhibidores de la proteasa por no nucleósidos. Por otro lado, el cambio a nevirapina indujo mayores descensos en los lípidos que el cambio a efavirenz.
Muy recientemente se ha comunicado en pacientes con infección por VIH-1 la experiencia con ezetimibe, un inhibidor selectivo de la absorción duodenal de colesterol que se utiliza habitualmente asociado a estatinas. La adición de ezetimibe a un pequeño grupo de pacientes con mala respuesta a dosis bajas de pravastatina produjo una reducción significativa de los parámetros lipídicos 104. La posible utilidad de la niacina (ácido nicotínico) y de los ácidos grasos v -3 para el tratamiento de la dislipemia asociada a la infección por el VIH-1 está siendo objeto de atención en fechas recientes 114-116. En un estudio piloto, la administración de niacina redujo significativamente las concentraciones de triglicéridos y de colesterol total en pacientes tratados con antirretrovirales que presentaban dislipemia, pero, desgraciadamente disminuyó la sensibilidad a la insulina 115. La eficacia de los ácidos grasos v -3 en la hipertrigliceridemia asociada al tratamiento antirretroviral ha sido puesta de manifiesto en 2 ensayos clínicos recientes 114,116. En un ensayo aleatorizado y doble ciego en 122 pacientes en TAR con triglicéridos > 200 mg/dl, la administración de ácidos grasos v -3 redujo en un 25% las concentraciones plasmáticas de triglicéridos y logró normalizarlas en el 20% de los pacientes 116.
Recomendaciones para la evaluación y tratamiento de las dislipemias asociadas al tratamiento antirretroviral
Aunque todavía se desconoce cuál será el efecto a largo plazo del tratamiento de la dislipemia inducida por el tratamiento antirretroviral en los pacientes con infección por el VIH-1, se espera que sea también beneficioso. Los expertos coinciden en que la evaluación y el tratamiento de la dislipemia deben formar parte de la práctica clínica habitual de los médicos que tratan pacientes con infección por el VIH-1 111,117. Con el fin de intentar adoptar una conducta común se han elaborado diversas guías de práctica clínica, entre ellas destacan la guía de la Infectious Disease Society of America-AIDS Clinical Trials Group (ACTG) 111, el Documento de Consenso de Gesida y Plan Nacional de Sida sobre las alteraciones metabólicas y de distribución de la grasa corporal y las recomendaciones de la International AIDS Society-USA 117 sobre el tratamiento de las complicaciones metabólicas asociadas con el tratamiento antirretroviral de la infección VIH-1. Todas ellas se basan en el tercer documento de consenso del NCEP 63.
El objetivo principal del tratamiento de la dislipemia es la prevención de la enfermedad aterosclerótica. Desde el punto de vista práctico, esto supone lograr valores de c-LDL por debajo de ciertos límites, que dependen del riesgo cardiovascular del paciente. En todas las recomendaciones se aconseja la determinación en ayunas de las concentraciones plasmáticas de lípidos (triglicéridos, colesterol total, c-HDL y c-LDL) antes de empezar el tratamiento antirretroviral y a los 3-6 meses de iniciado el tratamiento. Se deben también evaluar otros factores de riesgo cardiovascular, los antecedentes familiares de hiperlipidemia o cardiopatía isquémica, y excluir causas de hiperlipidemia secundaria, como diabetes mellitus, insuficiencia renal crónica, colestasis hepática, hipotiroidismo y fármacos que aumentan el c-LDL y disminuyen el c-HDL, como los corticoides.
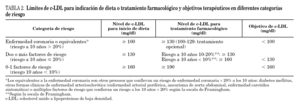
La decisión de tratar o no vendrá determinada por el riesgo individual de enfermedad coronaria de cada paciente. Este riesgo se puede estimar en función de los factores de riesgo cardiovascular no lipídicos (tabla 1) y las concentraciones plasmáticas de c-LDL. Para ello se estratifica a los pacientes según el número de factores de riesgo cardiovascular y las concentraciones de c-LDL, y dependiendo del riesgo estimado se recomienda modificación del estilo de vida con o sin tratamiento farmacológico (tabla 2). Otra forma de evaluar el riesgo de enfermedad coronaria de los pacientes es el cálculo de su riesgo cardiovascular global para lo que se emplean las tablas basadas en el estudio de Framingham, en las que se incluyen el sexo, edad, tabaquismo, colesterol total, presión arterial sistólica y se valora especialmente la existencia de diabetes mellitus. El riesgo de sufrir un episodio coronario (angina, IAM) en los próximos 10 años se estima a partir de la puntuación total obtenida de la suma individual de puntos de cada factor de riesgo. La clasificación del riesgo es la siguiente: bajo < 5%, ligero 5-10%, moderado 10-20%, alto 20-40%, muy alto > 40%. Se puede encontrar una aplicación interactiva para efectuar el cálculo en internet (http://hin.nhlbi.nih.gov/atpiii/calculator.esp.). En el estudio D:A:D la ecuación de Framingham fue un buen predictor de los sucesos cardiovasculares observados en los pacientes con infección por el VIH-1, aunque infraestimó el riesgo a corto plazo 118. El cálculo del riesgo cardiovascular global ofrece la ventaja de no precisar la cifra de c-LDL para establecer la necesidad de tratamiento farmacológico de la hipercolesterolemia. En los individuos con riesgo leve o moderado se recomiendan medidas higiénico-dietéticas. En los pacientes con riesgo alto o muy alto debe valorarse la utilización de tratamiento farmacológico.
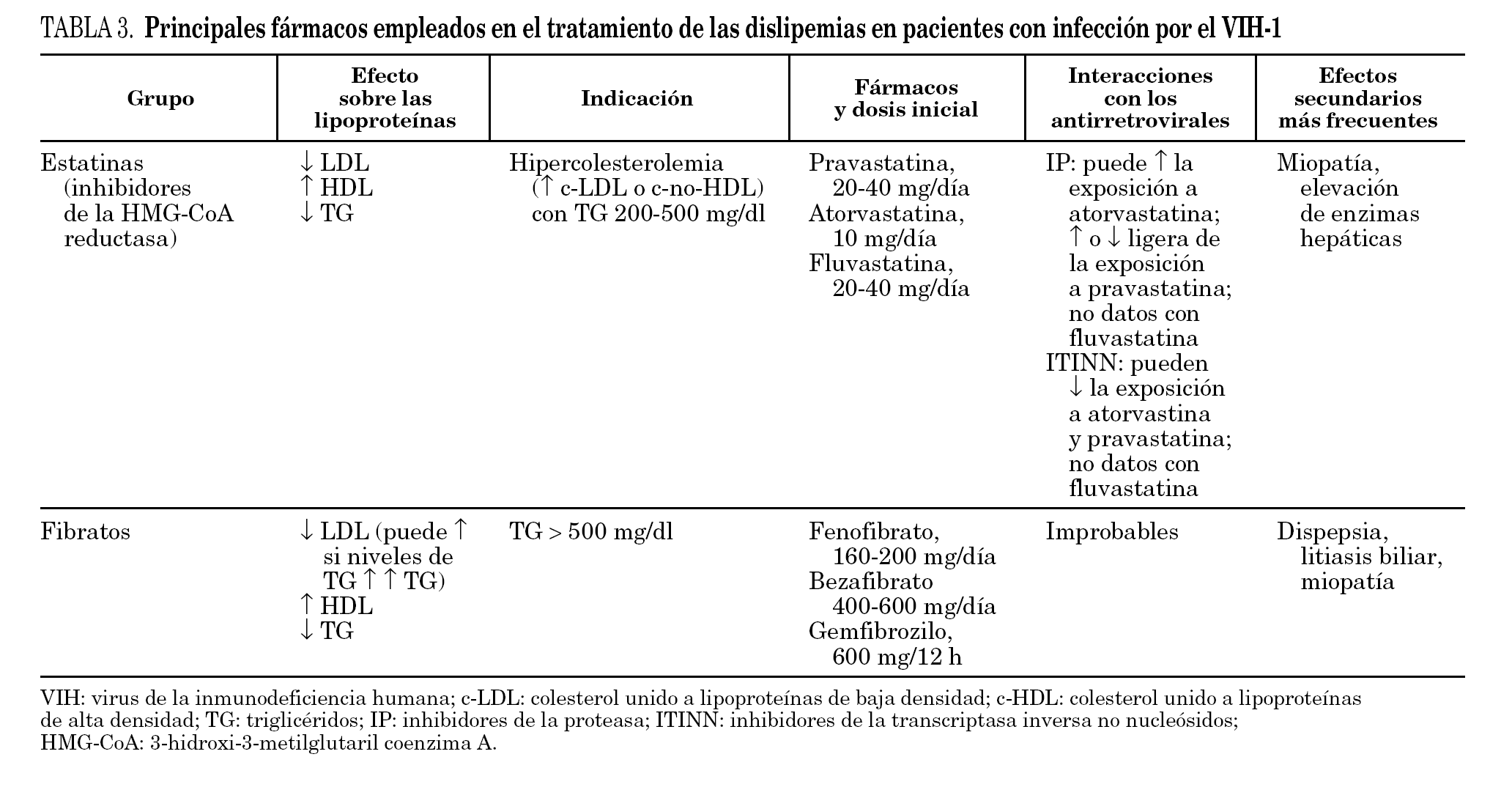
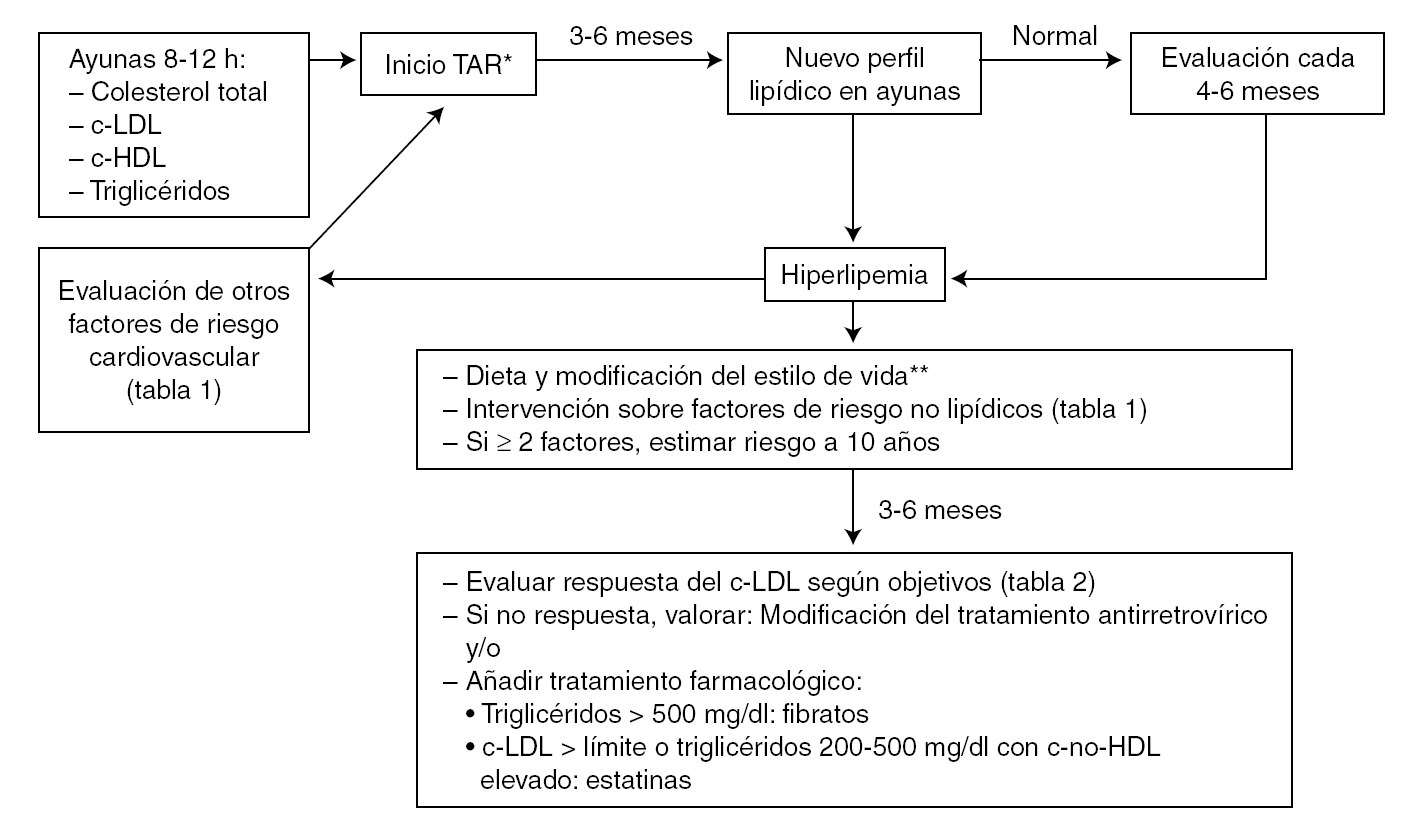
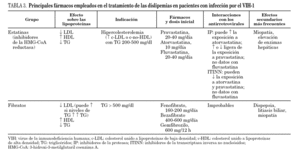
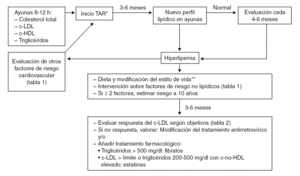
La información más importante sobre los fármacos hipolipemiantes que pueden ser empleados en el tratamiento de las dislipemias en pacientes con infección por el VIH-1 se resume en la tabla 3. En base a los datos disponibles se recomienda evitar el empleo de simvastatina o lovastatina (que es estructuralmente similar a la simvastatina) con inhibidores de la proteasa y utilizar atorvastatina con precaución, comenzando con dosis más bajas de las habituales. Por el contrario, se considera que las interacciones con pravastatina probablemente no son clínicamente importantes y se recomienda empezar con las dosis habituales. Puede considerarse un aumento de la dosis de pravastatina cuando se usa en combinación con ritonavir u otros fármacos capaces de inducir el metabolismo de la pravastatina 111. Aunque con fluvastatina no existen datos farmacocinéticos sólidos, su perfil metabólico, la ausencia de interacciones significativas con otros inhibidores del CYP3A4 119 y la experiencia clínica 92 avalan su uso en combinación con inhibidores de la proteasa 111. La figura 1 esquematiza la conducta recomendada en las guías de práctica clínica para la evaluación y el tratamiento de la hiperlipemia asociada al TAR 111,117.
Figura 1. Evaluación de los lípidos en los pacientes en tratamiento antirretroviral (TAR).
Conclusiones
Las dislipemias son muy frecuentes en los pacientes que reciben TAR y se asocian preferentemente con determinados fármacos antirretrovirales. Con los inhibidores de la proteasa las dislipemias tienden a ser más marcadas con ritonavir y con lopinavir-ritonavir, mientras que atazanavir es el que tiene un perfil lipídico más favorable. Con los inhibidores de la transcriptasa inversa no nucleósidos las alteraciones lipídicas ocurren con menor frecuencia que con los inhibidores de la proteasa, especialmente en el caso de la nevirapina. Datos recientes sugieren que algunos inhibidores de la transcriptasa inversa análogos de nucleósidos, en particular los análogos timidínicos (estavudina en mayor medida que zidovudina), pueden estar también implicados en la producción de dislipemia. La expresión bioquímica de las dislipemias asociadas al TAR es heterogénea. Pueden presentarse elevaciones aisladas o combinadas de los triglicéridos y del colesterol total con cambios variables en las LDL y HDL, que pueden configurar perfiles lipídicos con un riesgo cardiovascular diferente. Existen cada vez más evidencias de que la dislipemia asociada al TAR acelera el desarrollo de arteriosclerosis y ya se ha detectado una mayor incidencia de episodios cardiovasculares que está estrechamente relacionada con la duración del tratamiento.
El beneficio clínico del tratamiento de la dislipemia inducida por el TAR todavía no se ha demostrado, pero se espera que tenga unos efectos similares a los observados en pacientes no infectados por el VIH-1. La mayor parte de los expertos coincide en seguir las recomendaciones de tratamiento propuestas para la población general y considerar una modificación del tratamiento antirretroviral. Si bien la experiencia con el tratamiento hipolipemiante en pacientes con infección por el VIH-1 es todavía limitada, se está generando cada vez más información que avala el uso de los fármacos hipolipemiantes, con las limitaciones impuestas por las interacciones farmacológicas entre las estatinas y algunos medicamentos antirretrovirales.
Aunque la repercusión global de los episodios cardiovasculares en la morbilidad y mortalidad a largo plazo de los pacientes con infección por el VIH-1 es todavía limitada, es previsible que el riesgo de complicaciones vasculares siga incrementándose a medida que se prolongue la duración de los tratamientos antirretrovirales y aumente la edad de los pacientes.
Correspondencia:
Dra. Mar Masiá-Canuto.
Unidad de Enfermedades Infecciosas.
Hospital General Universitario de Elche.
Camí de l'Almazara, s/n. 03202 Elche. Alicante. España.
Correo electrónico: marmasia@ya.com
Manuscrito recibido el 21-4-2006; aceptado el 21-4-2006.