En la última década, la expansión de cepas de bacilos gramnegativos multirresistentes ha suscitado un nuevo interés por antimicrobianos hasta ahora relegados a un segundo plano por un peor perfil de seguridad, pero que aún conservaban su actividad frente a estos microorganismos.
La administración de aminoglucósidos en monodosis ha permitido minimizar sus efectos tóxicos y reintroducirlos en la práctica clínica. Por otra parte, estudios recientes han puesto en entredicho la utilidad de asociar aminoglucósidos a los β-lactámicos de que se dispone actualmente, y no en todas las indicaciones la evidencia disponible ha apoyado el uso de la monodosis.
Las formas farmacéuticas actuales y los nuevos regímenes de dosificación desarrollados para las polimixinas han permitido reducir la toxicidad atribuida a éstas en las décadas pasadas. Aunque son necesarios estudios que permitan definir con claridad su farmacocinética y que establezcan su efectividad, los datos disponibles indican buenos resultados en pacientes con infecciones por bacilos gramnegativos multirresistentes tratados con colistina, tanto en asociación como en monoterapia.
The emergence of multidrug-resistant strains of gram-negative bacilli during the last decade has generated renewed interest in older antimicrobials that had been relegated to a second line because of a poorer safety profile, but that are still active against these microorganisms.
Once-daily administration of aminoglycosides has limited the toxicity of these agents and enabled their reintroduction into clinical practice. Recent studies have shown no additional benefits of concomitant administration of aminoglycosides with current ß-lactams, and the available evidence does not support the use of once-daily administration for all indications.
The new formulations and dosages of polymyxins have also reduced the toxicity rates attributed to these agents in the past. Although more extensive studies are required to properly define their pharmacokinetics and effectiveness, the available data have shown favorable outcomes for patients with infection due to multiresistant gram-negative bacilli treated with colistin, either alone or combined with other antimicrobial agents.
La historia de los aminoglucósidos (AG) comienza en 1944 con la estreptomicina. La posterior comercialización de nuevas moléculas de AG producidas de Streptomyces spp. (neomicina y tobramicina) y Micromonospora spp. (gentamicina) permitió ampliar este grupo de antimicrobianos, que adquirió un lugar preeminente en el tratamiento de las infecciones por bacilos gramnegativos (BGN)1,2. El desarrollo de nuevos AG semisintéticos (dibekacina, amikacina y netilmicina) en los años setenta permitiría superar las resistencias desarrolladas por diferentes cepas bacterianas frente a los AG iniciales1. Sin embargo, la generalización de su uso puso de manifiesto un nuevo perfil de toxicidad y nuevas resistencias bacterianas, comprobándose que la molécula no se podía modificar para menguar su toxicidad sin reducir al mismo tiempo su actividad. Por este motivo, a partir de los ochenta, las fluorquinolonas y β-lactámicos de amplio espectro relegarían a un segundo plano a los AG en el escenario de las infecciones por BGN3. En los últimos años, la expansión de bacterias resistentes a la mayor parte del arsenal terapéutico disponible, como Acinetobacter baumannii, Pseudomonas aeruginosa o enterobacterias productoras de β-lactamasas de espectro extendido (BLEE), ha determinado que antibióticos ya en desuso como los AG o las polimixinas cobren un nuevo interés3. Una intensa actividad investigadora ha dado al uso de los AG una perspectiva muy distinta a la del siglo pasado4, permitiendo aplicar nuevas estrategias de dosificación y minimizar la toxicidad, que ha constituido el principal factor limitante para su utilización.
Clasificación y estructura químicaLa molécula de AG se compone de aminoazúcares unidos por enlaces glucosídicos a un alcohol cíclico hexagonal con grupos amino (aminociclitol). Según el componente aminociclitol, los AG pueden clasificarse en 2 grandes grupos (tabla 1)4.
Clasificación de los aminoglucósidos
| Aminoglucósido con aminociclitol | |
| Aminociclitol estreptidina | Estreptomicina |
| Aminociclitol desoxiestreptamina | |
| Disustituidos 4,6 | |
| Familia kanamicina | Kanamicina |
| Amikacina* | |
| Tobramicina* | |
| Dibekacina | |
| Familia gentamicina | Gentamicina* |
| Sisomicina | |
| Netilmicina | |
| Isepamicina | |
| Disustituidos 4,5 | |
| Neomicina* | |
| Paromomicina* | |
| Aminociclitol sin aminoglucósido | |
| Espectinomicina | |
Con *se indican los AG comercializados actualmente en España33.
Los AG son sustancias de carácter básico, con un peso molecular de 445–600 daltons. Son inhibidos por el pH ácido y por cationes divalentes, por lo que no actúan bien en secreciones bronquiales, abscesos, necrosis tisular ni en localizaciones con abundantes detritos orgánicos. Los AG se inactivan químicamente por los β-lactámicos, y son más sensibles a este fenómeno gentamicina y tobramicina que netilmicina, amikacina o isepamicina, y es más intensa con las penicilinas antipseudomonas. La inactivación requiere varias horas in vitro, y parece que la relevancia clínica de este fenómeno es limitada; no obstante, se recomienda no mezclar AG y β-lactámicos en el mismo frasco de perfusión ni administrar dosis sincrónicas4.
Farmacocinética y farmacodinamiaAdministraciónLos AG no se absorben por vía oral, por lo que es necesario la administración parenteral, salvo en los casos en que se persigue la descontaminación selectiva del tubo digestivo. La absorción por vía intramuscular es completa, alcanzándose la concentración máxima (Cmáx) sérica entre los 30 y 90min tras la administración. Por vía intravenosa se alcanza en 30–60min, y en este caso se recomienda perfundirlos durante al menos 15–30min, tiempo que debe incrementarse hasta 30–60min en caso de dosis elevadas (como en las monodosis) para evitar la aparición de bloqueo neuromuscular4. No se recomienda su administración en las cavidades pleural y peritoneal por la posibilidad de difusión a la circulación sistémica y toxicidad subsiguiente4.
DistribuciónLas moléculas de AG se distribuyen libremente en el espacio vascular y de forma relativamente libre en el líquido intersticial de la mayoría de los tejidos, debido a su escasa unión a proteínas y alto nivel de solubilidad. El volumen de distribución es de 0,2–0,4l/kg, aunque éste puede verse incrementado en situación de ascitis, embarazo, grandes quemados o en la fibrosis quística, entre otras circunstancias5.
El paso de las moléculas de AG a través de las membranas biológicas es en general pobre, de manera que su penetrancia al sistema nervioso central, el árbol biliar, las secreciones bronquiales o el humor vítreo es muy baja. Por este motivo, será necesaria la instilación directa del antibiótico cuando se requiera actividad antimicrobiana a este nivel4.
Es excepción a esta norma el epitelio del túbulo renal y del oído interno, donde la difusión sí es buena, mostrando una cinética de captación saturable que justifica los efectos indeseables en estos órganos. Una hora tras la administración, la concentración urinaria es 25–100 veces superior a la plasmática, y permanece elevada durante varios días. Difunden bien al líquido sinovial, alcanzándose valores sólo algo menores que los plasmáticos4.
ExcreciónTodos los AG se excretan por filtración glomerular sin alteración metabólica previa. Más del 90% de la dosis administrada se recupera sin modificar en la orina durante las primeras 24h; el resto es lentamente reciclado en la luz tubular y se puede detectar en la orina durante un tiempo superior a 20 días4. Así, la vida media sérica de gentamicina, tobramicina y netilmicina es de 2h con función renal normal y la de amikacina entre 2 y 3h. No obstante, en determinadas situaciones clínicas, ésta puede variar, pudiendo acortarse en caso de enfermedad febril y prolongarse si hay insuficiencia renal5.
FarmacodinamiaLos AG muestran un patrón de actividad bactericida que depende de la concentración (ABDC) del antimicrobiano, pero no del tiempo de exposición de las bacterias al AG. Por tanto, el objetivo debe ser incrementar al máximo la Cmáx administrando la dosis más alta posible que permita el límite de toxicidad6.
Los estudios clínicos han comprobado que hay una relación directa entre la Cmáx del AG y la respuesta terapéutica en el tratamiento de la bacteriemia y la neumonía por BGN, y que hay una graduación dosis-respuesta entre el cociente Cmáx/CMI (concentración mínima inhibitoria) y la respuesta clínica. Un mejor cociente Cmáx/CMI disminuye asimismo la selección de poblaciones resistentes6.
Los AG muestran efecto postantibiótico (EPA) frente a bacterias grampositivas y gramnegativas, habiendo correlación entre incremento de la dosis de AG y la duración del EPA. Ésta es variable según el tipo de bacteria, oscilando en los AG entre 0,5 y 7,5h. En general, la presencia de neutrófilos tiende a duplicar la duración del EPA frente a BGN, mientras que la leucopenia puede disminuir su eficacia. Por el contrario, las bacterias sometidas a concentraciones de antibiótico inferiores a la CMI, son capaces de desarrollar resistencias adaptativas, dificultando la penetración del AG al interior de la célula6.
Por lo tanto, el tratamiento con dosis altas de AG permitiría, por una parte, una inhibición del crecimiento bacteriano más efectiva a través de un EPA más prolongado y, por otra, un coeficiente Cmáx/CMI en torno a 10, que evita las resistencias adaptativas al lograr un mayor efecto bactericida inicial y suprimir la supervivencia de mutantes con CMI elevada6.
Espectro de actividadLos AG muestran actividad bactericida frente a BGN aerobios, incluyendo enterobacterias y los bacilos no fermentadores, como P. aeruginosa y A. baumannii. La asociación con antimicrobianos que actúan sobre la pared bacteriana (penicilina, cefalosporinas, monobactam, carbapenemas, glucopéptidos) confiere una actividad sinérgica frente a diversos microorganismos, y permite su uso en el tratamiento de algunas infecciones por cocos grampositivos. Así, diversos estudios in vitro y en animales han demostrado sinergia antimicrobiana frente a Enterococcus spp., estreptococos del grupo viridans, Streptococcus pyogenes, Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, Klebsiella pneumoniae, P. aeruginosa, Serratia marcescens y Listeria monocytogenes. Son activos frente a S. aureus sensible a meticilina pero no frente a la mayoría de cepas resistentes a meticilina2. Estreptomicina es activa contra Brucella spp. y muestra la mayor actividad in vitro frente a Mycobacterium tuberculosis, mientras que amikacina es más activa frente a Mycobacterium avium complex. Los AG mantienen buena actividad in vitro frente a la mayoría de BGN no fermentadores2,3,7,8 y cepas de enterobacterias productoras de BLEE3. En cambio, no tienen actividad frente a neumococo, Stenotrophomonas maltophilia, bacterias anaerobias, rickettsias, hongos ni Mycoplasma spp.4.
Mecanismo de acción y resistenciasLos AG actúan mediante su fijación a la subunidad 30S del ribosoma bacteriano e inhibiendo la síntesis proteica, lo que conduce finalmente a la muerte del microorganismo1.
Algunas especies bacterianas, como los anaerobios y enterococos, presentan resistencia intrínseca a los AG debida a un transporte deficitario a través de la membrana bacteriana. En ocasiones, esta resistencia se puede soslayar asociando al AG un antimicrobiano con actividad frente a la pared bacteriana (β-lactámicos o glucopéptidos), permitiendo este sinergismo bactericida la difusión del AG al interior celular4.
Los mecanismos de resistencia adquiridas pueden sumarse a los anteriores, y son1,2: a) modificación enzimática de la molécula de AG; b) disminución de la concentración intracelular de AG mediante alteración de la difusión al interior de la bacteria, secuestro citoplasmático de las moléculas de AG, o bombas de extracción activa de AG; c) mutación de la subunidad ribosómica 30S, y d) metilación del sitio de unión de los AG en el ribosoma (sitio A del ARNr 16S). La modificación enzimática es la más frecuente, y hay diferentes tipos de enzimas modificadoras de AG, fundamentalmente N-acetiltransferasas, O-nucleotidiltransferasas y O-fosfotransferasas1. Estas enzimas pueden anular el sinergismo bactericida entre AG y β-lactámicos, y de ahí su trascendencia clínica4.
La metilación del sitio de unión de los AG es el mecanismo descrito más recientemente. En el año 2003 comienzan a describirse estas enzimas como un mecanismo de resistencia presente en diferentes cepas de BGN9, que anulan la capacidad de la molécula de AG de unirse a su lugar de acción, por tanto otorgan una resistencia de alto nivel e impiden cualquier sinergismo con antimicrobianos activos frente a la pared bacteriana.
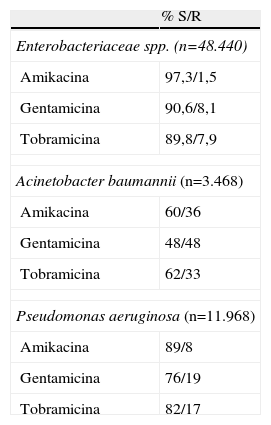
Los estándares del Clinical and Laboratory Standards Instiute (CLSI) consideran sensibles las cepas con CMI de gentamicina y tobramicina ⩽4μg/ml y de amikacina ⩽16μg/ml10. La resistencia de alto nivel para gentamicina viene definida por una CMI >500μg/ml y para estreptomicina por una CMI >1.000μg/ml (microdilución) o >2.000μg/ml (agar)10. Los estudios más recientes sobre resistencias se resumen en las tablas 2 y 37,8,11.
Actividad antimicrobiana de aminoglucósidos frente a cepas de bacilos gramnegativos aisladas en muestras clínicas de Europa, América y Asia
| % S/R | |
| Enterobacteriaceae spp. (n=48.440) | |
| Amikacina | 97,3/1,5 |
| Gentamicina | 90,6/8,1 |
| Tobramicina | 89,8/7,9 |
| Acinetobacter baumannii (n=3.468) | |
| Amikacina | 60/36 |
| Gentamicina | 48/48 |
| Tobramicina | 62/33 |
| Pseudomonas aeruginosa (n=11.968) | |
| Amikacina | 89/8 |
| Gentamicina | 76/19 |
| Tobramicina | 82/17 |
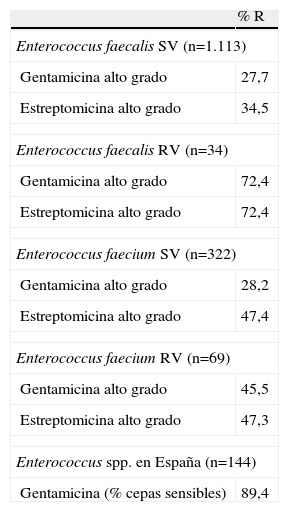
Actividad antimicrobiana de aminoglucósidos frente a cepas de cocos grampositivos aisladas en muestras clínicas de Europa
| % R | |
| Enterococcus faecalis SV (n=1.113) | |
| Gentamicina alto grado | 27,7 |
| Estreptomicina alto grado | 34,5 |
| Enterococcus faecalis RV (n=34) | |
| Gentamicina alto grado | 72,4 |
| Estreptomicina alto grado | 72,4 |
| Enterococcus faecium SV (n=322) | |
| Gentamicina alto grado | 28,2 |
| Estreptomicina alto grado | 47,4 |
| Enterococcus faecium RV (n=69) | |
| Gentamicina alto grado | 45,5 |
| Estreptomicina alto grado | 47,3 |
| Enterococcus spp. en España (n=144) | |
| Gentamicina (% cepas sensibles) | 89,4 |
n: número de cepas aisladas; R: cepas resistentes; RV: resistente a vancomicina; SV: sensible a vancomicina.
Datos obtenidos de Daptomycin Surveillance Programme, Sader et al11.
Los AG siguen ocupando un lugar relevante en el tratamiento de las infecciones graves por BGN, enterococos y estreptococos. El uso de AG en combinación con β-lactámicos cumple un triple objetivo: ampliar el espectro de acción del tratamiento empírico, mejorar la efectividad basándose en sinergismo observado in vitro y reducir la incidencia de desarrollo de resistencias. Sin embargo, la evidencia disponible para sustentar estas indicaciones es escasa, y algunos estudios recientes han puesto en duda su validez12–15.
Pielonefritis agudaLos AG también han demostrado ser efectivos en monoterapia en el tratamiento de la pielonefritis aguda sin inestabilidad hemodinámica que precisa de hospitalización16, si bien la prescripción de AG en este contexto ha sido desplazada por otros fármacos con menos efectos adversos. No obstante, la expansión de microorganismos multirresistentes entre las etiologías de la infección urinaria podría reintroducir el uso de AG en el manejo clínico de este tipo de infecciones2.
Infección respiratoriaActualmente, los AG no son antimicrobianos de primera elección en el tratamiento de la neumonía, debido a las bajas concentraciones y actividad en el líquido alveolar2. No obstante, las guías actuales aún contemplan como alternativa el uso de amikacina, tobramicina o una quinolona, asociados a un β-lactámico de amplio espectro, en el tratamiento de la neumonía del paciente sometido a ventilación mecánica con riesgo de infección por microorganismos multirresistentes17. Asimismo, los AG conservan un lugar relevante en el tratamiento de las reagudizaciones infecciosas de los pacientes con fibrosis quística, frecuentemente colonizados por P. aeruginosa, donde han demostrado ser efectivos tanto por vía intravenosa18 como nebulizados19.
Infección intraabdominalEl uso de AG asociados a antibióticos anaerobicidas ha sido un régimen terapéutico desplazado por los nuevos β-lactámicos, teniendo la misma eficacia pero mayor toxicidad frente a la monoterapia con β-lactámicos15.
Endocarditis infecciosaLas guías de práctica clínica más recientes recomiendan el uso de AG en combinación con β-lactámicos o glucopéptidos para las endocarditis por determinados cocos grampositivos20,21. Sin embargo, estas recomendaciones se basan en estudios in vitro y escasos estudios clínicos no comparativos. Un metaanálisis reciente no objetivó diferencias estadísticamente significativas al comparar el uso de β-lactámicos en monoterapia con el uso de la terapia combinada con AG, y en cambio sí hubo una mayor tasa de efectos adversos, fundamentalmente relacionados con la nefrotoxicidad12,22. Aunque lo reducido de los estudios disponibles recomiendan prudencia en la interpretación de estos resultados, es patente la necesidad de ensayos clínicos aleatorizados que establezcan de manera definitiva el papel de los AG, y las guías de práctica clínica continúan recomendando la terapia combinada para la mayoría de las situaciones.
Actualmente, se dispone de la suficiente evidencia para recomendar el uso de los AG en monodosis en la endocarditis estreptocócica, y aunque los estudios disponibles son escasos para otras etiologías, algunos paneles de expertos abogan por hacer extensible la monodosis también a las endocarditis estafilocócicas que lo requieran. No ocurre así en la endocarditis enterocócica, para la que hay estudios in vitro que han descrito una menor eficacia de la pauta de monodosis al compararla con multidosis20, si bien la trascendencia clínica de estos hallazgos no se ha definido.
Sepsis grave en pacientes inmunocompetentesAunque el uso de AG asociados a β-lactámicos en los pacientes con infecciones graves por BGN estuvo muy extendido, actualmente hay evidencia de que frente a la monoterapia con β-lactámicos no mejoran la supervivencia y sí aumentan la toxicidad2,14,22. Estos hallazgos son similares en pacientes con infección por P. aeruginosa, aunque dado que los estudios disponibles son menos potentes, la terapia combinada con AG podría ser una opción en casos seleccionados14,22.
Neutropenia febrilDurante años, la terapia de elección ha consistido en un AG asociado a un β-lactámico con actividad anti-Pseudomonas. Al igual que en otros cuadros clínicos, esta práctica se apoya sobre datos de sinergia in vitro, aunque ningún estudio ha demostrado que la asociación aporte ningún beneficio al compararla con la monoterapia con β-lactámicos de amplio espectro, y sí una mayor tasa de efectos adversos en el grupo tratado con terapia combinada13, por lo que la asociación se indicaría en función de la epidemiología local. Escasos estudios de baja potencia han sugerido la superioridad de la terapia combinada en pacientes con neutropenia grave (<100células/μl)13.
Otros usosLos AG se han empleado en la endoftalmitis, la otitis externa maligna, y en osteomielitis y meningitis posquirúrgicas4, aunque en el momento actual su uso es más restringido al haber otras alternativas con índice terapéutico más amplio. En nuestro medio se sigue empleando gentamicina en las listeriosis graves; estreptomicina (asociada a doxiciclina) constituye el tratamiento de primera línea para la brucelosis, y pertenece a la segunda línea para la tuberculosis4. Asimismo, estudios recientes han sugerido un papel beneficioso del sellado con AG en la profilaxis de infecciones de catéteres23 y en la prevención de la infección de prótesis articulares mediante su inclusión en espaciadores en la cirugía de recambio protésico24. Finalmente, en un escenario en que no se prevé la comercialización de nuevos antimicrobianos activos frente a los principales BGN multirresistentes durante el próximo lustro, algunos autores han propuesto el uso de AG en estas infecciones2,3,22, aunque no hay ensayos clínicos que establezcan su efectividad.
En la tabla 4 se resumen las indicaciones de AG habituales y la validez de la monodosis con la fortaleza de la recomendación y la calidad de la evidencia25.
Indicaciones más frecuentes de los aminoglucósidos (AG) y eficacia de la monodosis, con especificación de la fortaleza de cada recomendación y calidad de la evidencia25
| Infección/microorganismo | Recomendación de AG y calidad de la evidencia | Eficacia de monodosis |
| Endocarditis Infecciosa | ||
| Staphylococcus aureus | Uso rutinario: AG no añade eficacia al β-lactámico (D-II) | Monodosis no recomendada |
| Bacteriemia persistente (B-II) | ||
| Endocarditis infecciosa protésica (C-III) | ||
| Estreptococos grupo viridans y Streptococcus bovis | CMI penicilina ⩽0,1μg/ml: AG más penicilina, ambas 2 semanas (A-II) | Posible eficacia de monodosis (C-III) |
| CMI penicilina >0,1 y <0,5μg/ml: AG 2 semanas más penicilina 4 semanas (A-II) | ||
| Enterococos | Añadir AG si hay sinergia con β-lactámico o glucopéptido (A-II) | Monodosis no recomendada |
| Bacilos gramnegativos | AG más β-lactámico (B-II) | Monodosis no recomendada |
| Neumonía nosocomial | ||
| Con factores de riesgo de bacteria multirresistente o comienzo tardío | AG como alternativa a quinolona, asociados cualquiera de ellos a β-lactámico con actividad anti-Pseudomonas (C-III). | Monodosis eficaz (B-I) |
| Sin factores de riesgo y comienzo precoz | AG no añade eficacia a β-lactámico de amplio espectro (D-II para uso rutinario, C-III según contexto) | – |
| Fibrosis quística | ||
| Monoterapia con AG i.v. (B-I) | Monodosis eficaz (B-I) | |
| Monoterapia con AG inhalado (B-I) | ||
| Pielonefritis aguda | ||
| Puede utilizarse monoterapia con AG como alternativa (B-II) | Monodosis eficaz (A-I) | |
| Shock séptico: considerarlo asociado a un β-lactámico de amplio espectro (C-III) | ||
| Sin inestabilidad hemodinámica: AG no añade eficacia al β-lactámico (D-I para uso rutinario y C-III según contexto) | ||
| Infección intraabdominal | ||
| AG no añade eficacia al β-lactámico de amplio espectro (D-I para uso rutinario) | Monodosis eficaz (B-I) | |
| Sepsis en inmunocompetente con sospecha o confirmación de BGN | ||
| AG no añade eficacia al β-lactámico de amplio espectro (D-II para uso rutinario, C-III según contexto o bacteriemia por P. aeruginosa) | Monodosis eficaz (B-I) | |
| Neutropenia febril | ||
| AG asociado a β-lactámico con actividad anti-Pseudomonas en función del perfil de resistencias de cada centro (D-I para uso rutinario) | Monodosis eficaz (B-I) | |
| AG más β-lactámico de amplio espectro, si hay neutropenia<100/μl (C-III) | ||
BGN: bacilos gramengativos; CMI: concentración mínima inhibitoria; i.v.: intravenoso.
Los AG se administraron clásicamente mediante la pauta de multidosis a pacientes con función renal normal. En las últimas décadas, diversos estudios han demostrado que una pauta de monodosis diaria puede ser igualmente eficaz y presentar menor toxicidad16, aunque esto no se ha podido confirmar para todas las indicaciones (tabla 4). Si bien el uso de la monodosis es una práctica actualmente generalizada, aún queda por clarificar el papel que pueda desempeñar en situaciones de aumento del volumen de distribución, reducción significativa del aclaramiento de AG y en la endocarditis16.
Administración en multidosisSe recomienda una dosis de carga inicial, seguida de dosis de mantenimiento. Es independiente de la función renal, por lo que la Cmáx depende exclusivamente del volumen de distribución. Por ello, en situaciones con volumen de distribución elevado (sepsis, politraumatismos, fibrosis quística, grandes quemados y anasarca5,6) es necesaria una dosis de carga mayor y se precisan controles frecuentes de los valores séricos4. El volumen de distribución estará disminuido en caso de obesidad, deshidratación y emaciación6.
Administración en monodosis- •
Pacientes con función renal normal. Un método consiste en sumar la dosis diaria recomendada en la pauta de multidosis3. Con este método hay dificultad para conseguir un valor pico adecuado en caso de aumento del volumen de distribución, pero ofrece la ventaja de saber que el valor sérico será<1μg/ml entre 12–18h tras la dosis. Algunos autores han propuesto elevar la dosis diaria de gentamicina o tobramicina a 7mg/kg/día para incrementar el valor pico y favorecer así la ABDC del AG3. Esta dosis tiene un claro beneficio en los pacientes con volumen de distribución elevado, y puede reducirse en los días sucesivos a la dosis convencional de 5mg/kg.
- •
Pacientes con insuficiencia renal. La dosificación es más compleja. Un método sugiere disminuir progresivamente la dosis diaria de manera proporcionada al descenso del aclaramiento de creatinina y, además, prolongando el intervalo si el aclaración de creatinina (ClCr) es ⩽20ml/min4. Con este método, la posología es más cómoda y consigue que en insuficiencia renal ligera o moderada el AG sea indetectable en suero durante un tiempo. No obstante, cuando el aclaramiento es <40ml/min la ventaja de la monodosis desaparece, ya que el valor pico es sólo de 10μg/ml y el AG se mantiene detectable en suero durante las 24h.
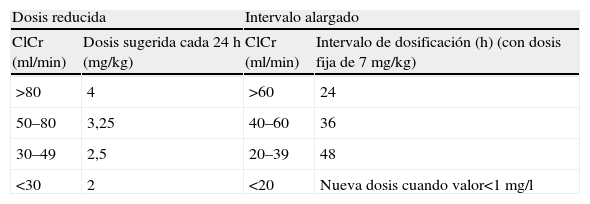
Otro método consiste en alargar el intervalo de administración sin alterar la dosis total. El objetivo es conseguir picos séricos elevados, pero eventualmente la posología puede ser más incómoda, y pueden haber períodos con un elevado valor sérico de AG, con el subsiguiente riesgo de toxicidad. Las estrategias para la dosificación en monodosis en pacientes con función renal alterada se detallan en la tabla 526.
Tabla 5.Métodos de dosificación inicial para la administración en monodosis de gentamicina y tobramicina en personas con función renal alterada
Dosis reducida Intervalo alargado ClCr (ml/min) Dosis sugerida cada 24h (mg/kg) ClCr (ml/min) Intervalo de dosificación (h) (con dosis fija de 7mg/kg) >80 4 >60 24 50–80 3,25 40–60 36 30–49 2,5 20–39 48 <30 2 <20 Nueva dosis cuando valor<1mg/l ClCr: aclaramiento de creatinina.
Datos de Fisman et al26.
La monitorización de los valores de AG tiene el triple objetivo de optimizar la efectividad (mediante el ajuste de valores pico), minimizar la toxicidad (ajustando valores valle) y reducir la selección de subpoblaciones resistentes27. Está especialmente indicada en pacientes críticos en situación de shock séptico o sepsis grave, fracaso hepático o renal, o con variaciones importantes del volumen de distribución (por hipoalbuminemia, fluidoterapia agresiva, nutrición parenteral, terapia con fármacos vasoactivos o ventilación mecánica)5,6, así como los pacientes con mala evolución clínica o aparición de efectos adversos27.
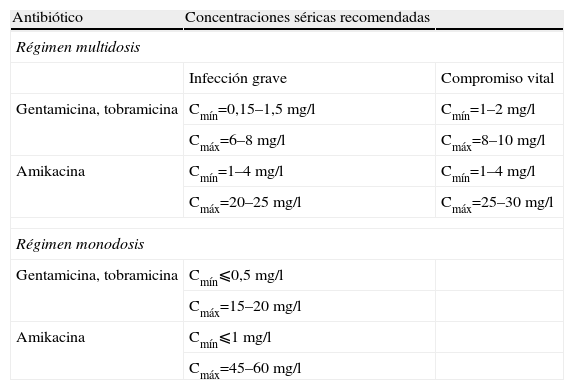
La determinación de los valores plasmáticos debe realizarse en las primeras 24–48h de tratamiento en la pauta de multidosis, o tras la primera dosis cuando se emplea el régimen de monodosis diaria, momento en que se alcanza la fase de equilibrio estacionario. Siempre que se realicen modificaciones en la posología deben determinarse nuevamente los valores en las siguientes 24–48h al cambio. Además, en los pacientes críticos es conveniente realizar determinaciones periódicas cada 3–4 días, incluso con los valores dentro del rango objetivo27. La creatinina sérica debe controlarse cada 3–5 días, y si la función renal cambia debe reajustarse la dosis, repitiendo los controles tras el nuevo ajuste4. Los valores plasmáticos deseables para cada AG se detallan en la tabla 6. Otros detalles técnicos respecto a la correcta praxis en la monitorización pueden ser consultados en bibliografía específica27.
Recomendaciones de las concentraciones óptimas para aminoglucósidos según el régimen de administración
| Antibiótico | Concentraciones séricas recomendadas | |
| Régimen multidosis | ||
| Infección grave | Compromiso vital | |
| Gentamicina, tobramicina | Cmín=0,15–1,5mg/l | Cmín=1–2mg/l |
| Cmáx=6–8mg/l | Cmáx=8–10mg/l | |
| Amikacina | Cmín=1–4mg/l | Cmín=1–4mg/l |
| Cmáx=20–25mg/l | Cmáx=25–30mg/l | |
| Régimen monodosis | ||
| Gentamicina, tobramicina | Cmín⩽0,5mg/l | |
| Cmáx=15–20mg/l | ||
| Amikacina | Cmín⩽1mg/l | |
| Cmáx=45–60mg/l | ||
Cmáx: concentración máxima en situación de equilibrio estacionario; Cmín: concentración mínima en situación de equilibrio estacionario.
Datos obtenidos de Álvarez-Lerma et al; Grupo de Estudio de Infección en el paciente crítico (GEIPC-SEIMC)27.
Todos los AG, excepto espectinomicina, comparten una capacidad potencial para provocar toxicidad renal y ótica y raramente bloqueo neuromuscular.
NefrotoxicidadCon una incidencia que oscila entre el 5 y el 25%, la nefrotoxicidad se define como una elevación en los valores de creatinina sérica de 0,5mg/dl, y se debe a la difusión de los AG por las células del epitelio del túbulo proximal. Habitualmente se manifiesta como una insuficiencia renal no oligúrica y reversible, la necesidad de diálisis es rara, y en algunos pacientes se recupera la función renal incluso a pesar de continuar la administración de AG4. Aumentan el riesgo de nefrotoxicidad la edad avanzada, hipovolemia, nefropatía preexistente, hepatopatía asociada, dosis elevadas, administración en multidosis, tratamiento prolongado y uso concomitante de otros fármacos nefrotóxicos3,4,28.
La administración en monodosis parece ser útil para reducir la nefrotoxicidad3,13–16,18,28, y ésta aparece más frecuentemente cuando los AG se administran durante las horas de reposo nocturno, quizá en relación con la menor ingesta alimentaria28.
OtotoxicidadLos AG pueden causar toxicidad ótica, que es independiente del daño renal y en ocasiones irreversible. Son consecuencia de la destrucción de las células ciliadas externas de la base del órgano de Corti y de las células ciliadas de los conductos semicirculares4,29.
El daño auditivo afecta inicialmente a los niveles más altos de frecuencia (4.000–8.000Hz) de manera reversible, y no deteriora la audición conversacional, aunque puede haber sensación de ruido o embotamiento auditivo. Si la toxicidad progresa, se lesionan las células ciliadas internas del ápex coclear, afectándose los niveles más bajos de frecuencia y la audición conversacional, entonces el déficit es permanente o sólo parcialmente reversible29.
La toxicidad vestibular suele seguir un curso paralelo a la auditiva, aunque generalmente es transitoria. Se manifiesta por vértigo, náuseas, mareo y nistagmo, aunque es frecuente que quede encubierta por los mecanismos compensatorios visuales y propioceptivos29.
Se relacionan con mayor riesgo los tratamientos de más de 8 días, la dosis acumulativa y diaria total, los valores séricos valle elevados, los diuréticos, el uso previo de AG y la edad avanzada29.
Bloqueo neuromuscularPuede ser provocado por todos los AG y, aunque infrecuente, suele ser grave e incluso fatal. Cursa con debilidad de la musculatura respiratoria, parálisis flácida y midriasis. Ocurre asociado a enfermedades o fármacos que interfieren con la transmisión neuromuscular y se relaciona con la perfusión intravenosa rápida. Aumentan el riesgo, la hipomagnesemia, hipocalcemia, relajantes musculares y bloqueadores de canales del calcio. El tratamiento incluye medidas de soporte y gluconato cálcico intravenoso30.
PolimixinasLas polimixinas se descubrieron a finales de los años cuarenta como productos de síntesis de diversas especies de Paenibacillus (Bacillus) polymyxa, y se comercializaron a lo largo de las décadas de los cincuenta y sesenta. El desarrollo de nuevos antimicrobianos de amplio espectro en los setenta y ochenta motivó el abandono de las polimixinas en la práctica habitual, al presentar éstas un perfil de seguridad inferior. Sin embargo, y al igual que ha ocurrido con los AG, la elevada prevalencia actual de BGN resistentes a la mayoría de armas terapéuticas de que disponíamos hasta la fecha, ha obligado a recurrir de nuevo a antibióticos en desuso, como las polimixinas, que aún mantienen su actividad frente a la mayoría de cepas de BGN multirresistentes31.
Clasificación y estructura químicaHay 5 tipos diferentes de polimixinas (A-E), de las cuales sólo la polimixina B y la colistina (polimixina E) tienen uso en la práctica clínica. Son compuestos de peso molecular elevado constituidos por un decapéptido cíclico catiónico unido a un ácido graso. La única diferencia estructural entre la polimixina B y la colistina radica en la porción peptídica, que difiere en un único aminoácido (D-leucina en la colistina o D-fenilalanina en la polimixina B). El tipo de ácido graso, en cambio, define 2 tipos de colistina (colistina A y B), encontrándose en diferentes proporciones en las distintas formulaciones farmacéuticas31.
Hay 2 formas comerciales de colistina: el sulfato de colistina, más potente y tóxico, restringido al uso tópico y oral (por no ser absorbible), y el colistimetato sódico (también denominado metanosulfato de colistina, pentasodio colistimetanosulfato o sulfonilmetato de colistina), de menor toxicidad, para administración parenteral y nebulizada32. La polimixina B está disponible en forma de sulfato, que en nuestro país está restringido al uso tópico33.
Mecanismo de acción y resistenciasLas polimixinas aumentan la permeabilidad de la membrana externa fijando su porción catiónica (polipéptido) a la porción aniónica (lipopolisacárido) de la membrana de los BGN. Esta capacidad para fijar el lipopolisacárido pudiera traducirse en un efecto protector frente al shock inducido por endotoxina, aunque la relevancia in vivo no se ha establecido31,32,34.
La resistencia puede ser genética o adaptativa, la primera es independiente de la exposición previa a polimixinas. Los mecanismos subyacentes implican cambios en la composición de los fosfolípidos del lipopolisacárido que los hace menos afines al antibiótico. La resistencia cruzada entre colistina y polmixina B es casi completa31,32.
Los criterios más recientes del CLSI establecen los puntos de corte para P. aeruginosa en ⩽2μg/ml para las cepas sensibles, 4μg/ml para las intermedias, y ⩾8μg/ml para las resistentes. Los puntos de corte para A. baumannii son ⩽2μg/ml para cepas sensibles y ⩾4μg/ml para las resistentes. No están establecidos los umbrales para enterobacterias10.
La resistencia a polimixinas es infrecuente, probablemente por su escaso uso en las últimas décadas. Los datos más recientes sobre resistencias se describen en la tabla 735.
Actividad antimicrobiana de polimixina B frente a cepas de bacilos gramnegativos aisladas en muestras clínicas de Europa, América y Asia
| Microorganismos | % S/R |
| Pseudomonas aeruginosa (n=8.705) | 98,7/1,3 |
| Acinetobacter spp. (n=2.621) | 97,9/2,1 |
| Stenotrophomonas maltophilia (n=1.256) | 72,4/27,6 |
| Aeromonas spp. (n=368) | 71,7/28,3 |
| Burkholderia cepacia (n=153) | 11,8/88,2 |
| Alcaligenes spp. (n=121) | 63,6/36,4 |
n: número de cepas aisladas; S/R: porcentaje de cepas sensibles (S) y resistentes (R).
Datos obtenidos de SENTRY Antimicrobial Surveillance Program, Gales et al35.
Por otra parte, recientemente se ha observado un fenómeno de heterorresistencia a colistina en cepas de A. baumannii y K. pneumoniae multirresistentes, independiente de la exposición previa a polimixinas. De este modo, cepas teóricamente sensibles según la CMI incluyen subpoblaciones resistentes no detectables por métodos dilucionales, lo que teóricamente podría condicionar el fracaso terapéutico36,37. Este fenómeno parece tener una frecuencia preocupante; se han objetivado prevalencias que oscilan entre el 23 y el 100% de los aislamientos de A. baumanii38, aunque su repercusión clínica no se ha establecido.
Espectro de actividadLas polimixinas mantienen actividad bactericida frente a la mayoría de BGN aerobios, incluyendo la mayoría de cepas de no fermentadores multirresistentes. Proteus spp. constituye la principal excepción, y la mayoría es altamente resistente. Su actividad es baja frente a Providencia spp., Morganella morganii, Serratia marcescens y Burkholderia spp. Son resistentes los microorganismos grampositivos, Neisseria spp., Moraxella catarrhalis, Helycobacter pylori, Vibrio spp., Brucella spp. y la mayor parte de anaerobios39.
SinergiaLos datos descritos in vitro han suscitado un gran interés por encontrar antibióticos sinérgicos con las polimixinas, que permitirían teóricamente mejorar la eficacia y erradicar subpoblaciones resistentes sin necesidad de elevar las dosis de polimixina, y por tanto su toxicidad. Numerosos antibióticos han demostrado actividad sinérgica con colistina in vitro, y los más estudiados son rifampicina e imipenem, aunque también ceftazidima, cotrimoxazol, ciprofloxacino, gentamicina, azitromicina o minociclina. Estos hallazgos han llevado a numerosos clínicos ha incorporar a la práctica habitual la terapia combinada con colistina y rifampicina o carbapenemas para el tratamiento de las infecciones graves por A. baumannii o P. aeruginosa, si bien actualmente no hay ensayos clínicos que avalen esta pauta, y ninguno de los estudios comparativos realizados en humanos hasta la fecha ha demostrado diferencias significativas a favor de uno u otro régimen40. por tanto, la relevancia clínica de las sinergias y de la heterorresistencia queda por determinar.
Farmacocinética y farmacodinamiaHay pocos datos fiables respecto a la farmacocinética de colistina, la mayoría fundamentados en estudios microbiológicos antiguos, cuya validez ha sido cuestionada32.
La forma química de colistina empleada en la práctica clínica para la administración parenteral, el colistimetato, tiene escasa actividad antimicrobiana, pero al entrar en contacto con medios acuosos (in vitro o en plasma humano), se hidroliza en derivados sulfometilados y en colistina, en la cual reside el auténtico poder bactericida. Esta hidrólisis ocurre en mayor o menor medida según diferentes condiciones ambientales, como el pH o la temperatura, lo que podría restar validez a los estudios microbiológicos empleados para definir la farmacocinética de colistina. Por otra parte, los porcentajes de colistina A y B en las formas farmacéuticas varía entre distintos fabricantes, e incluso entre lotes diferentes de un mismo fabricante, lo que se suma a las dificultades previas para establecer la farmacocinética del compuesto31,32.
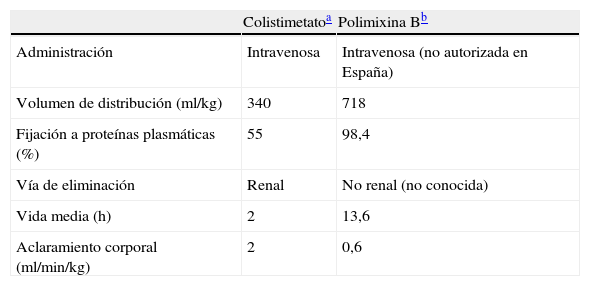
La polimixina B, en cambio, se emplea en forma de sulfato de polimixina B, por lo que los datos de los estudios microbiológicos podrían ser más fiables. Aunque en nuestro país está autorizada exclusivamente para uso tópico33, en otras localizaciones geográficas tiene uso como alternativa terapéutica parenteral para el tratamiento de las infecciones por BGN multirresistentes. No obstante, hay datos limitados en lo que respecta a la farmacocinética del producto32, y sus principales diferencias con colistimetato se describen en la tabla 841,42.
Principales características farmacocinéticas de las polimixinas según los principales estudios publicados en humanos
| Colistimetatoa | Polimixina Bb | |
| Administración | Intravenosa | Intravenosa (no autorizada en España) |
| Volumen de distribución (ml/kg) | 340 | 718 |
| Fijación a proteínas plasmáticas (%) | 55 | 98,4 |
| Vía de eliminación | Renal | No renal (no conocida) |
| Vida media (h) | 2 | 13,6 |
| Aclaramiento corporal (ml/min/kg) | 2 | 0,6 |
Farmacociética de colistimetato tras administración intravenosa en 12 pacientes con fibrosis quística (Li et al42).
Farmacocinética de polimixina B tras administración intravenosa en 9 pacientes sin insuficiencia renal ni condiciones fisiopatológicas modificadoras del volumen de distribución (Kwa et al41).
El sulfato de colistina se puede administrar por vía tópica u oral para descontaminación selectiva del tubo digestivo, y su biodisponibilidad es despreciable39.
El colistimetato sódico se puede administrar por vía intravenosa, intramuscular o nebulizado. Aunque los datos farmacocinéticos se deben relativizar por la problemática ya descrita, estudios antiguos han descrito un porcentaje de hidrólisis de un 31,2% a temperatura de 37°C. Por vía intramuscular los valores pico se alcanzan de manera algo más tardía, pero descienden más lentamente32,39. La administración por vía inhalada en nebulización permite alcanzar valores elevados del fármaco en la vía aérea con escaso paso a la circulación sistémica, por lo que se plantea como una opción adecuada para las reagudizaciones de los pacientes con fibrosis quística crónicamente colonizados por P. aeruginosa34.
DistribuciónEstudios en pacientes con fibrosis quística han definido un volumen de distribución de 340ml/kg para colistimetato42, y modelos animales han descrito un coeficiente de fijación a las proteínas plasmáticas para colistina del 55%32, aunque son precisos estudios que permitan extrapolar estos datos a otras poblaciones de pacientes.
La penetración al líquido cefalorraquídeo es baja, y habitualmente es preciso recurrir a la administración intratecal para tratar infecciones a este nivel. Se han publicado valores de colistina en líquido cefalorraquídeo del 25% de los valores plasmáticos en pacientes con meningitis43. La distribución de colistina a la pleura, pulmón y hueso es también pobre32.
ExcreciónColistina presenta una elevada afinidad por las membranas de las células de múltiples tejidos (encéfalo, hígado, riñón, pulmón, corazón o músculo esquelético), de modo que el aclaramiento de las moléculas ligadas a tejidos ocurre lentamente, y no es completo hasta 5 días tras la última dosis. Esta afinidad es menor para el colistimetato sódico31.
El colistimetato se elimina intacto por vía renal (aproximadamente el 60% en las primeras 24h), mientras que colistina (tanto la exógena como la producida por hidrólisis endógena) se elimina por vías diferentes no totalmente conocidas. No se ha descrito excreción biliar34.
Estudios en pacientes con fibrosis quística registraron una vida media tras administración intravenosa de colistimetato de 2h, y de más de 4h para el sulfato de colistina42. La vida media probablemente es más prolongada en pacientes con insuficiencia renal, y en anuria puede prolongarse hasta 48–72h39, aunque actualmente no se dispone de estudios farmacocinéticos fiables en pacientes con insuficiencia renal. Los datos disponibles en pacientes sometidos a terapia sustitutiva renal son muy escasos, aunque se ha sugerido que el efecto de ésta en los valores del fármaco probablemente sea mínimo44.
FarmacodinámicaLas polimixinas tienen un efecto bactericida precoz y dependiente de la concentración. Estudios in vitro en aislamientos de P. aeruginosa de pacientes con fibrosis quística confirmaron un efecto bactericida y EPA adecuados para colistina y colistimetato, más marcados y precoces para colistina42. Los estudios desarrollados para A. baumannii muestran también un efecto bactericida precoz in vitro para colistina, pero no existe EPA a las concentraciones del fármaco asequibles in vivo. Asimismo, se ha observado un recrecimiento a las 24h de administración del antibiótico que se ha relacionado con la presencia de cepas heterorresistentes36. Por tanto, estos datos parecerían desaconsejar el uso de colistina en monoterapia, así como el régimen de monodosis diaria para el tratamiento de las infecciones por A. baumannii multirresistente, incluso en cepas aparentemente sensibles a polimixinas según criterios dilucionales. Estos mismos hallazgos se han publicado recientemente para cepas de K. pneumoniae multirresistente37. No obstante, estudios in vivo posteriores no han podido establecer una correlación clínica con los fenómenos de heterorresistencia40.
Un único estudio ha descrito la farmacodinámica de polimixina B frente a P. aeruginosa. Describió una acción bactericida precoz, dependiente del cociente del área bajo la curva/CMI. La eficacia se vio disminuida por el efecto inóculo. Se observó recrecimiento en los 4 primeros días, que se relacionó con la amplificación de subpoblaciones que desarrollaron resistencias adaptativas, aunque las causas del recrecimiento no se analizaron específicamente en este estudio45. Estos hallazgos desaconsejarían la monoterapia con polimixina B y sugerirían mayor eficacia para dosis más elevadas que las estándares.
Indicaciones clínicasLa mayor parte de estudios han evaluado la eficacia de colistimetato, siendo muy escasa la bibliografía disponible para polimixina B. En cualquier caso, la evidencia al respecto es limitada para ambos fármacos, y se basa fundamentalmente en series de casos y casos aislados.
El sulfato de colistina y la polimixina B han tenido un amplio uso como agente tópicos para el tratamiento de infecciones dermatológicas, óticas y oftálmicas. En España no está autorizado su uso por vía parenteral para el tratamiento de infecciones sistémicas33.
El colistimetato sódico, con un mejor perfil de seguridad, se ha empleado en la última década como terapia de rescate para las infecciones por BGN multirresistentes, la mayoría de los cuales siguen siendo sensibles a polimixinas. En su forma intravenosa, se ha empleado en monoterapia o asociado a otros antimicrobianos, fundamentalmente en el tratamiento de la neumonía y traqueobronquitis nosocomial, pero también en meningitis, infecciones intraabdominales, infecciones del tracto urinario, bacteriemias, e infecciones de piel y partes blandas y de la herida quirúrgica43,46, describiéndose tasas de mortalidad global que oscilan entre el 20–40%, según las series. No obstante, no hay ensayos clínicos que hayan establecido la efectividad o la superioridad frente a otros regímenes.
Aunque se han descrito casos de meningitis tratadas exitosamente con colistimetato intravenoso43, generalmente es necesario recurrir a la administración intratecal o intraventricular del fármaco para obtener valores licuorales adecuados32,43.
El tratamiento con colistina nebulizada se ha utilizado ampliamente en pacientes con fibrosis quística colonizados por P. aeruginosa. Las formas nebulizadas se han empleado recientemente como tratamiento coadyuvante e incluso en monoterapia en el tratamiento de la infección respiratoria nosocomial por BGN multirresistentes (incluyendo neumonías) con buenos resultados47, aunque la evidencia al respecto aún es limitada.
El uso de polimixinas nebulizadas como profilaxis primaria en pacientes ingresados en unidades de cuidados intensivos con ventilación mecánica, con riesgo elevado de desarrollar neumonía, se ha analizado recientemente. Aunque la mayoría de estudios ha descrito una menor incidencia de neumonías, no ha podido probar ningún beneficio en la supervivencia, y se ha descrito una mayor tasa de desarrollo de resistencias48.
Algunos autores han propuesto incluir a las polimixinas en el tratamiento empírico de las infecciones del paciente crítico, por la peor supervivencia descrita para las bacteriemias por A. baumannii o P. aeruginosa incorrectamente tratadas. Esta decisión debería tomarse según la incidencia local de BGN sensibles sólo a colistina. Serían candidatos los pacientes ingresados en unidades de cuidados intensivos o bien aquellos con riesgo elevado de infección por estos patógenos (ingreso prolongado, aislamiento previo de bacterias sensibles sólo a colistina, o uso previo de antimicrobianos de amplio espectro, especialmente carbapenemas)49.
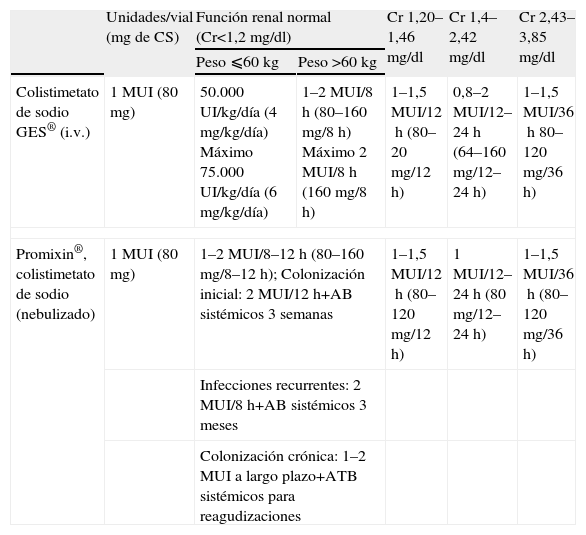
DosificaciónLa escasa información disponible acerca de la farmacocinética y la farmacodinámica limita, a su vez, la evidencia sobre regímenes de dosificación apropiados, especialmente en situaciones de insuficiencia renal o terapia renal sustitutiva. El modo más correcto de expresar la dosis de colistina son las unidades internacionales, dada la heterogeneidad en la composición de las distintas presentaciones. Las dosis recomendadas en España se resumen en la tabla 933.
Posología recomendada para las formas de polimixinas comercializadas en España según datos de ficha técnica33
| Unidades/vial (mgdeCS) | Función renal normal (Cr<1,2mg/dl) | Cr 1,20–1,46mg/dl | Cr 1,4–2,42mg/dl | Cr 2,43–3,85mg/dl | ||
| Peso ⩽60kg | Peso >60kg | |||||
| Colistimetato de sodio GES® (i.v.) | 1MUI (80mg) | 50.000UI/kg/día (4mg/kg/día) Máximo 75.000UI/kg/día (6mg/kg/día) | 1–2MUI/8h (80–160 mg/8h) Máximo 2MUI/8h (160mg/8h) | 1–1,5MUI/12h (80–20mg/12h) | 0,8–2MUI/12–24h (64–160mg/12–24h) | 1–1,5MUI/36h 80–120mg/36h) |
| Promixin®, colistimetato de sodio (nebulizado) | 1MUI (80mg) | 1–2MUI/8–12h (80–160mg/8–12h); Colonización inicial: 2MUI/12h+AB sistémicos 3 semanas | 1–1,5MUI/12h (80–120mg/12h) | 1MUI/12–24h (80mg/12–24h) | 1–1,5MUI/36h (80–120mg/36h) | |
| Infecciones recurrentes: 2MUI/8h+AB sistémicos 3 meses | ||||||
| Colonización crónica: 1–2MUI a largo plazo+ATB sistémicos para reagudizaciones | ||||||
AB: antibiótico; Cr: creatinina; CS: colistimetato de sodio; MUI: millones de unidades internacionales.
Hay pocos datos acerca de la dosificación de pacientes sometidos a terapia renal sustitutiva. La elevada fijación a membranas celulares y el elevado peso molecular de las polimixinas hace improbable que su repercusión en los valores plasmáticos sea relevante, y se han sugerido dosis de 2,5mg/kg/48h en pacientes sometidos a terapia de sustitución renal continua44.
Efectos adversosLos estudios más recientes sobre toxicidad han registrado tasas de efectos indeseables muy inferiores a las descritas en los setenta. Esta discordancia probablemente se puede atribuir a unas mejores formas farmacéuticas y a los regímenes posológicos actuales, que contemplan dosis inferiores a las que venían utilizándose previamente50. Ello ha permitido volver a incluir a las polimixinas en el tratamiento habitual de las infecciones por BGN multirresistentes.
NefrotoxicidadSe ha descrito una incidencia de nefrotoxicidad que oscila en torno al 10–27%32,50, según la definición de deterioro en la función renal que contemple el estudio. Habitualmente, es poco relevante en pacientes con función renal normal y suele revertir al suspender el tratamiento. El mecanismo propuesto es dependiente de la dosis, y consiste en un aumento de la permeabilidad de la membrana celular que induce una mayor flujo de iones y agua hacia el interior de la célula, que conduce a la lisis de ésta50. El uso concomitante de otros fármacos nefrotóxicos se ha relacionado con una mayor incidencia de toxicidad50.
NeurotoxicidadPuede cursar con polineuropatía, parestesias, alteraciones visuales, hipoacusia, vértigo o ataxia. La manifestación más grave es el bloqueo neuromuscular, que oscila entre la debilidad y la apnea por afectación de la musculatura respiratoria, aunque no hay casos de apnea descritos desde hace más de 15 años, probablemente por las nuevas formas farmacéuticas y de dosificación32,50. Los estudios recientes describen una baja incidencia de neurotoxicidad (0–7%), si bien, al haberse desarrollado en pacientes críticos, pueden haber infraestimado la incidencia de efectos adversos menores32. La neurotoxicidad es dependiente de la dosis y habitualmente reversible tras retirar el fármaco. Son especialmente sensibles al bloqueo neuromuscular los pacientes con insuficiencia renal, enfermedades neuromusculares o tratamiento concomitante con AG, sedantes, relajantes musculares o curarizantes. El bloqueo neuromuscular grave puede requerir soporte ventilatorio mientras desaparecen los efectos; la diálisis no es eficaz dada su escasa capacidad para aclarar el fármaco50. La administración intratecal se ha relacionado hasta en un 20% de casos con irritación meníngea (meningismo y pleocitosis licuoral con cultivos negativos) y eventualmente convulsiones43.
Otras reacciones adversasLas reacciones de hipersensibilidad como prurito, exantema o fiebre son infrecuentes, pero pueden ocurrir en pacientes alérgicos a bacitracina50. La administración nebulizada puede inducir broncospasmo, incluso en pacientes sin broncopatía previa, aunque éstos presentan un riesgo superior. Se ha propuesto tratamiento profiláctico con broncodilatadores en pacientes tratados con polimixinas nebulizadas50.