El panel de expertos de GESIDA/Plan Nacional del Sida propone «pautas preferentes» de tratamiento antirretroviral como terapia de inicio en pacientes infectados por el VIH. Las pautas preferentes se basan en resultados de ensayos clínicos y en la opinión de los expertos del panel. El objetivo de este estudio es evaluar los costes y la eficiencia (coste/eficacia) de iniciar tratamiento con estas pautas.
MétodosEvaluación económica de los costes y de la eficiencia (coste/eficacia) mediante la construcción de árboles de decisión. Se definió eficacia como la probabilidad de tener carga viral <50 copias/mL en la semana 48 en un análisis por intención de tratar. La perspectiva es la del Sistema Nacional de Salud, habiéndose tenido en cuenta solo los costes directos diferenciales (fármacos, manejo de efectos adversos, estudios de resistencias y determinación de HLA B*5701). El ámbito es España, el horizonte temporal es de 48 semanas y los costes se refieren a 2011. Se realizó un análisis de sensibilidad determinista construyendo tres escenarios para cada pauta: basal, más favorable y más desfavorable.
ResultadosEn el escenario basal, los costes de iniciar tratamiento oscilaron entre 7.550 euros para ABC/3TC+EFV y 13.327 euros para TDF/FTC+RAL. La eficacia osciló entre 0,66 para ABC/3TC+LPV/r y 0,86 para TDF/FTC+RAL. La eficiencia, en términos de coste/eficacia, osciló entre 10.175 y 15.539 euros por respondedor a las 48 semanas, para TDF/FTC/EFV y TDF/FTC+RAL, respectivamente.
ConclusiónLa pauta más eficiente fue TDF/FTC+EFV, seguida de ABC/3TC+EFV. El análisis de sensibilidad confirmó la robustez de estos hallazgos.
GESIDA (AIDS Study Group) and the National AIDS Plan panel of experts propose “preferred regimens” of antiretroviral treatment (ART) as initial therapy in HIV infected patients. These preferred regimens are based on the results of clinical trials, and on the opinions of the experts of the panel. The objective of this study is to evaluate the costs and the cost effectiveness of initiating treatment following these guidelines.
MethodsEconomic assessment of costs and cost effectiveness through the construction of decision trees. Effectiveness was defined as the probability of having viral load <50 copies/mL at week 48 in an intention-to-treat analysis. The perspective of the analysis is that of the National Health System, taking into account only the differential direct costs (ART, management of adverse effects, studies of resistance, and determination of HLA B * 5701). The area is Spain, the time horizon is 48 weeks, and the costs are those of 2011. A deterministic sensitivity analysis was performed, building three scenarios for each regimen: baseline, the most favourable, and the most unfavourable.
ResultsIn the baseline scenario, the cost of initiating treatment ranges from 7,550 Euros for the ABC/3TC+EFV to 13,327 Euros for TDF/FTC+RAL. The efficacy ranges between 0.66 for ABC/3TC+LPV/r and 0.86 for TDF/FTC+RAL. Efficiency, in terms of cost effectiveness, varies between 10,175 and 15,539 Euros per responder at 48 weeks, for TDF/FTC/EFV and TDF/FTC+RAL respectively.
ConclusionThe most efficient regimen was TDF/FTC+EFV, followed by ABC/3TC+EFV. Sensitivity analysis confirms the robustness of these findings.
El tratamiento antirretroviral (TARV) de gran actividad ha disminuido drásticamente la morbi-mortalidad de la infección por el virus de la inmunodeficiencia humana (VIH) y ha cambiado su historia natural1,2. El TARV suele basarse en combinaciones de tres fármacos y su objetivo es reducir la carga viral plasmática por debajo del límite de detección (en general < 50 copias/mL) y mantenerla suprimida el mayor tiempo posible. Con las pautas actuales de TARV es posible, en la mayoría de los casos, una restauración parcial del sistema inmune, cuantitativa y cualitativamente y con un cierto grado de dependencia del nivel de inmunodepresión de partida3,4. Hay una reducción drástica de la mortalidad y se logra que la esperanza de vida se acerque a la de la población general5. Con ello el TARV, globalmente considerado, se ha convertido en una de las intervenciones médicas con mejor relación coste/eficacia de la historia de la medicina, incluyendo los países en vías de desarrollo6–11.
Entre las diferentes combinaciones posibles para el TARV inicial, el panel de expertos de GESIDA y Plan Nacional sobre el Sida consideran «pautas preferentes» diversas combinaciones avaladas por ensayos clínicos aleatorizados y por la opinión de los expertos del panel12. Sin embargo, en un entorno de recursos limitados, cualquier intervención terapéutica debe utilizarse de manera eficiente y, en consecuencia, es necesario considerar los costes en los que se incurre con los distintos TARV y los resultados que se obtienen para poder establecer las pautas más eficientes dentro de los que el documento de consenso de GESIDA/Plan Nacional sobre el Sida12 acepta como preferentes. Naturalmente, además del coste de los fármacos, existen otros costes asociados, tales como los derivados del manejo de los efectos adversos o estudios de resistencias, entre otros. A pesar de su relevancia, hasta la fecha no ha sido publicado ningún estudio que evalúe la eficiencia de las pautas de TARV en España comparándola con las posibles pautas alternativas.
Por estas razones se ha desarrollado el presente proyecto, cuyo objetivo es evaluar los costes de iniciar una pauta y la eficiencia en términos de coste/eficacia de iniciar las distintas pautas de TARV que las guías de GESIDA/Plan Nacional sobre el Sida proponen como terapia preferente de inicio en pacientes infectados por el VIH que no han recibido TARV previo (pacientes «naives»).
MétodosAl inicio del proyecto se constituyó un comité científico (CC) compuesto por 12 expertos españoles con experiencia en el manejo clínico de pacientes infectados por el VIH. Las tareas del CC han sido: asesoramiento general, validar las asunciones realizadas en el modelo de evaluación económica, proporcionar los ensayos clínicos utilizados como fuente de evidencia científica y proporcionar información como expertos cuando la evidencia científica era insuficiente.
DiseñoEstudio de evaluación económica de los costes y de la eficiencia (coste/eficacia) mediante la construcción de árboles de decisión con análisis de sensibilidad determinista. Para ello, se han construido árboles de decisión que permiten calcular los costes, eficacia y eficiencia de cada una de las pautas recomendadas por el consenso de GESIDA/Plan Nacional sobre el Sida (tabla 1). La perspectiva del análisis es la del financiador: el Sistema Nacional de Salud (SNS). En consecuencia, se han tenido en cuenta solo los costes directos. El ámbito es España. El horizonte temporal del modelo es de 48 semanas. Se trata de un estudio de costes y de coste/eficacia porque los resultados del TARV se basan en los obtenidos en ensayos clínicos.
Pautas evaluadas, ensayos en los que se basa el modelo y coste (PVL+4% IVA) de la pauta
| Pauta | Dosis (mg/día) | Ensayos | Costeb (euros) |
| TDF/FTC/EFV | 300/200+600 | STARTMRK [14]; GS-934 [16] | 8.128 |
| TDF/FTC+DRV/r | 300/200+800/100 | ARTEMIS [17] | 10.278 |
| TDF/FTC+ATV/r | 300/200+300/100 | CASTLE [18]; ARTEN [19] | 10.387 |
| TDF/FTC+RALa | 300/200+800 | STARTMRK [14] | 13.078 |
| TDF/FTC+NVPa | 300/200+400 | ARTEN [19] | 7.366 |
| TDF/FTC+LPV/ra | 300/200+800/200 | ARTEMIS [17]; CASTLE [18]; ABT730 [20]; GEMINI [21]; HEAT [25] | 9.700 |
| ABC/3TC+ATV/ra | 600/300+300/100 | Ninguno con criterios de inclusión | 9.488 |
| ABC/3TC+LPV/ra | 600/300+800/200 | HEAT [25]; KLEAN [23] | 8.801 |
| ABC/3TC+EFVa | 600/300+600 | CNA30024 [24] | 7.228 |
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV; efavirenz; FTC; emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; TDF: tenofovir DF; 3TC; lamivudina.
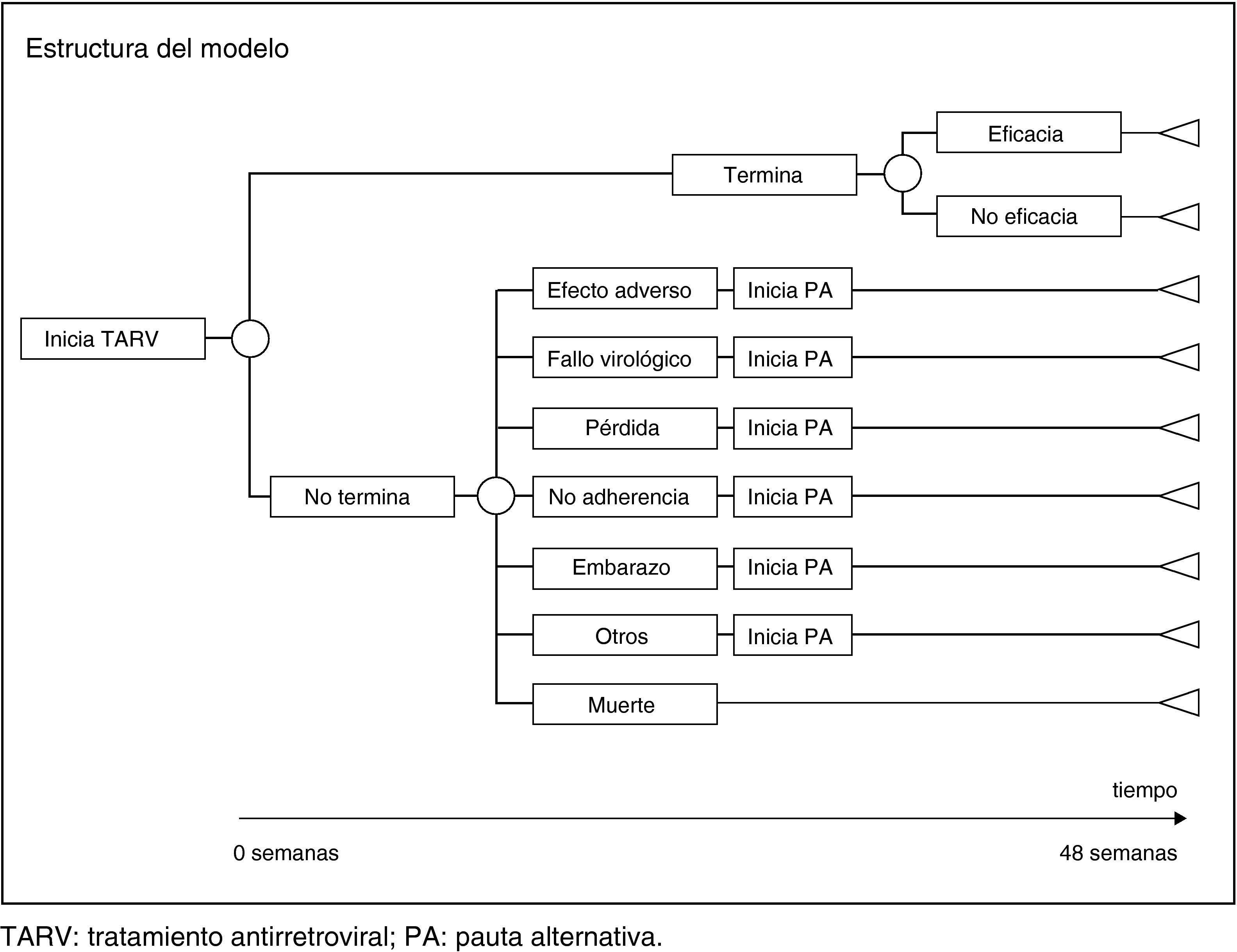
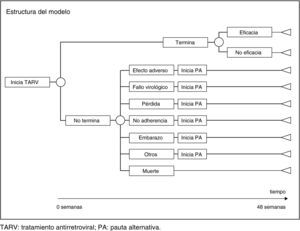
Como modelo de análisis económico se han diseñado tantos árboles de decisión como pautas recomendadas. Para construir cada árbol de decisión se ha partido de los ensayos clínicos en los que se utiliza la pauta correspondiente y se ha reproducido su estructura en cuanto a eficacia, efectos adversos (EA) y causas de abandono (tabla 1 y fig. 1).
Fuentes de evidencia para asignar la eficacia, efectos adversos y abandonosEl CC aportó los ensayos clínicos que potencialmente proporcionaban información útil para los modelos de evaluación económica de las diferentes pautas a evaluar. Se han considerado los ensayos que cumplen los siguientes criterios de inclusión: 1) evalúan al menos una de las pautas consideradas; 2) utilizan o permiten calcular como criterio de eficacia el porcentaje de pacientes con carga viral indetectable (< 50 copias/mL) a las 48 semanas; 3) tienen un horizonte temporal de 48 semanas; 4) describen las pérdidas de seguimiento, y 5) describen los EA producidos. Los artículos fueron leídos de forma independiente por dos investigadores (PLM y AJB), quienes decidieron si el artículo cumplía los criterios de inclusión, en cuyo caso se incluyó como fuente de evidencia para el modelo. La inclusión y exclusión de artículos fue validada por el CC.
Fuentes de información cuando no existía evidencia científica: utilización de la opinión de expertosPara obtener información sobre variables necesarias en el modelo de evaluación económica cuando no existía evidencia científica disponible, se utilizó la opinión de 6 expertos miembros del CC. Dos investigadores (PLM y AJB) elaboraron hojas de recogida de datos que recogían las variables de interés y que fueron enviadas a cada uno de los expertos. No se permitió la interacción entre expertos, de manera que sus respuestas fueron individuales e independientes. Para las variables continuas (e.g., días de duración de un prurito o veces que tienen que acudir a un especialista por fallo renal), se calculó la media de las estimaciones de los expertos. Para las variables dicotómicas (e.g., si el EA es grave/moderado, tiene relación con el TARV sí/no, o es crónico/aislado) se decidió asignar la opinión de la mayoría. Los estimadores de síntesis elaborados fueron validados por el CC. La incertidumbre que puede subyacer en la variabilidad de la respuesta de los expertos se tuvo en cuenta en el análisis de sensibilidad.
Definición y cálculo de eficaciaComo medida de eficacia se ha considerado una proporción en la que el numerador es el número de pacientes con carga viral indetectable (< 50 copias/mL) en la semana 48 después de iniciar el TARV (respondedores) y el denominador el número de pacientes que han iniciado el TARV. Esto implica que todos los pacientes que se pierden o abandonan el tratamiento por cualquier razón se consideran no respondedores al TARV. En definitiva, se ha calculado la eficacia por análisis por Intent-to-treat exposed (ITT-E, intención de tratar en los expuestos ) siguiendo la modalidad de «missing or non-completer=failure». Cuando se disponía de más de un ensayo clínico que evaluaba la misma pauta, se calculó la eficacia como una proporción en la que el numerador es la suma de respondedores y el denominador la suma de los pacientes que han iniciado el TARV en los ensayos clínicos que evalúan esa pauta. Este criterio podía no ser el «end-point» principal del ensayo, pero se podía calcular en todos los artículos evaluados.
Definición y cálculo de costesSe han considerado solo los costes directos. En este estudio se entiende por costes directos el consumo de recursos del SNS. Dentro de estos costes, se han considerado únicamente los costes diferenciales, es decir, los costes que no son idénticos en todas las pautas consideradas. Los costes diferenciales que se han tenido en cuenta son: TARV (PVL+4% IVA)13, manejo de EA, estudio genotípico de resistencias, y determinación de HLA B*5701. Los costes directos se han calculado multiplicando los recursos utilizados por el coste unitario de cada de recurso. El coste de iniciar una pauta es el coste de todas las consecuencias (e.g., efectos adversos o necesidad de cambiar a otra pauta) que se producen en 48 semanas por haber tomado la decisión de iniciar TARV con esa pauta.
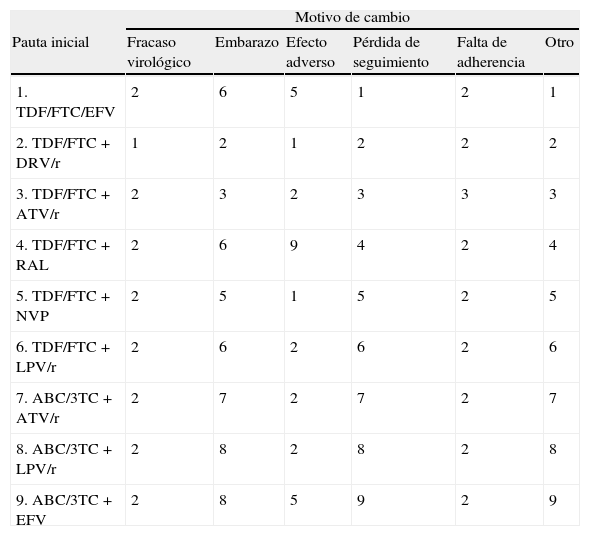
Utilización de recursosTARVA los pacientes que en el ensayo finalizan el tratamiento se les ha asignado el coste de 48 semanas de la pauta con la que inician tratamiento. Para los pacientes que no finalizan el tratamiento, se asume que dejan de recibir la pauta inicial, en promedio a las 24 semanas. Por tanto, a estos pacientes se les ha asignado el coste de 24 semanas de la pauta inicial y el coste de 24 semanas de la pauta alternativa. La pauta alternativa fue decidida en función del motivo de no finalización, según la opinión del CC (tabla 2).
Pautas alternativas a la pauta inicial en función del motivo de cambio según el consenso de 6 miembros del comité científico del estudio
| Motivo de cambio | ||||||
| Pauta inicial | Fracaso virológico | Embarazo | Efecto adverso | Pérdida de seguimiento | Falta de adherencia | Otro |
| 1. TDF/FTC/EFV | 2 | 6 | 5 | 1 | 2 | 1 |
| 2. TDF/FTC+DRV/r | 1 | 2 | 1 | 2 | 2 | 2 |
| 3. TDF/FTC+ATV/r | 2 | 3 | 2 | 3 | 3 | 3 |
| 4. TDF/FTC+RAL | 2 | 6 | 9 | 4 | 2 | 4 |
| 5. TDF/FTC+NVP | 2 | 5 | 1 | 5 | 2 | 5 |
| 6. TDF/FTC+LPV/r | 2 | 6 | 2 | 6 | 2 | 6 |
| 7. ABC/3TC+ATV/r | 2 | 7 | 2 | 7 | 2 | 7 |
| 8. ABC/3TC+LPV/r | 2 | 8 | 2 | 8 | 2 | 8 |
| 9. ABC/3TC+EFV | 2 | 8 | 5 | 9 | 2 | 9 |
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV; efavirenz; FTC; emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; TDF: tenofovir DF; 3TC; lamivudina.
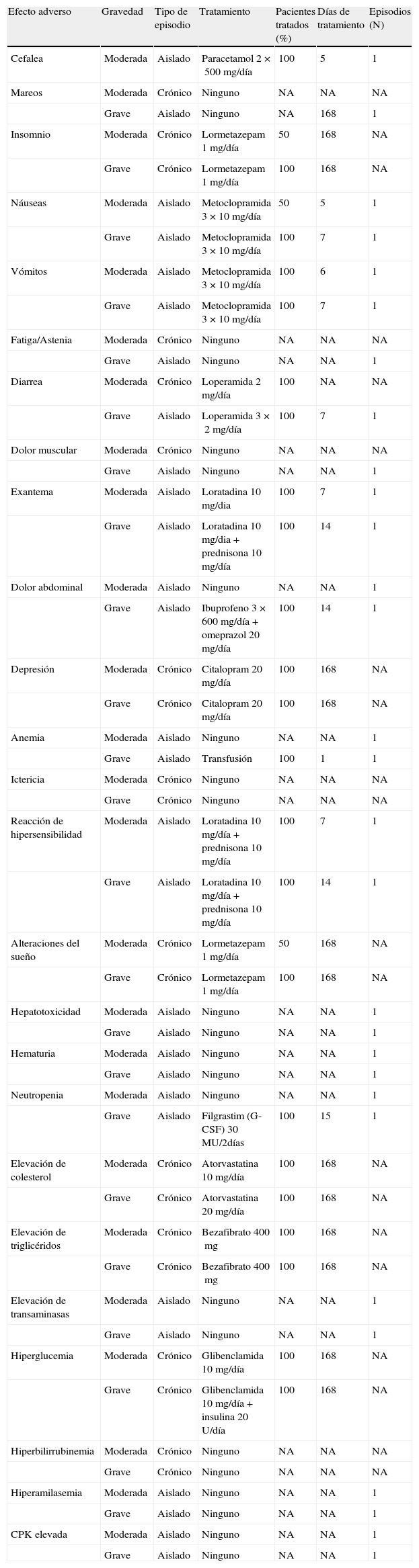
Se han considerado como EA aquellos que el ensayo identificaba como atribuibles al TARV. Cuando el ensayo ofrecía una lista de EA sin especificar si eran atribuibles o no al TARV, se utilizó el criterio del CC. Los ensayos clínicos habitualmente ofrecen información de aquellos EA que se producen en más del 2% de los pacientes tratados con alguna de las pautas comparadas. Por lo tanto, se han tenido en cuenta solo los EA que se producen en al menos el 2% de los pacientes. Los EA se clasificaron en crónicos y aislados, según la opinión del CC. Los EA crónicos son aquéllos que cuando se producen, se mantienen a lo largo del tratamiento (e.g., dislipemia). Los EA aislados son aquellos que se producen puntualmente (e.g., cefalea o erupción cutánea).
Los recursos considerados para el manejo de los EA han sido: tratamiento farmacológico, visitas a urgencias, visitas adicionales al especialista en VIH, visitas a otros especialistas, pruebas diagnósticas e ingreso hospitalario. A los pacientes que en el ensayo finalizan el tratamiento, se les ha asignado el coste del manejo de los EA producidos en las 48 semanas de la pauta con la que inician tratamiento. Para los pacientes que no finalizan el tratamiento, se asume que dejan de recibir la pauta inicial, en promedio a las 24 semanas. Por tanto, a estos pacientes se les ha asignado el coste de EA de 24 semanas de la pauta inicial y el coste de EA de 24 semanas de la pauta alternativa (tabla 2). Se asumió que, en promedio, los EA crónicos se producen en la mitad de la duración del TARV. En consecuencia, se imputa el coste del tratamiento farmacológico del EA crónico durante la mitad del periodo que ha recibido una pauta de TARV determinada. El uso de recursos para el manejo de los EA y la probabilidad de su gravedad han sido estimados por el CC (tabla 3).
Utilización de recursos en el manejo de efectos adversos
| Efecto adverso | Gravedad | Tipo de episodio | Tratamiento | Pacientes tratados (%) | Días de tratamiento | Episodios (N) |
| Cefalea | Moderada | Aislado | Paracetamol 2×500mg/día | 100 | 5 | 1 |
| Mareos | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Aislado | Ninguno | NA | 168 | 1 | |
| Insomnio | Moderada | Crónico | Lormetazepam 1mg/día | 50 | 168 | NA |
| Grave | Crónico | Lormetazepam 1mg/día | 100 | 168 | NA | |
| Náuseas | Moderada | Aislado | Metoclopramida 3×10mg/día | 50 | 5 | 1 |
| Grave | Aislado | Metoclopramida 3×10mg/día | 100 | 7 | 1 | |
| Vómitos | Moderada | Aislado | Metoclopramida 3×10mg/día | 100 | 6 | 1 |
| Grave | Aislado | Metoclopramida 3×10mg/día | 100 | 7 | 1 | |
| Fatiga/Astenia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Diarrea | Moderada | Crónico | Loperamida 2mg/día | 100 | NA | NA |
| Grave | Aislado | Loperamida 3×2mg/día | 100 | 7 | 1 | |
| Dolor muscular | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Exantema | Moderada | Aislado | Loratadina 10mg/dia | 100 | 7 | 1 |
| Grave | Aislado | Loratadina 10mg/dia+prednisona 10mg/día | 100 | 14 | 1 | |
| Dolor abdominal | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ibuprofeno 3×600mg/día+omeprazol 20mg/día | 100 | 14 | 1 | |
| Depresión | Moderada | Crónico | Citalopram 20mg/día | 100 | 168 | NA |
| Grave | Crónico | Citalopram 20mg/día | 100 | 168 | NA | |
| Anemia | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Transfusión | 100 | 1 | 1 | |
| Ictericia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Crónico | Ninguno | NA | NA | NA | |
| Reacción de hipersensibilidad | Moderada | Aislado | Loratadina 10mg/día+prednisona 10mg/día | 100 | 7 | 1 |
| Grave | Aislado | Loratadina 10mg/día+prednisona 10mg/día | 100 | 14 | 1 | |
| Alteraciones del sueño | Moderada | Crónico | Lormetazepam 1mg/día | 50 | 168 | NA |
| Grave | Crónico | Lormetazepam 1mg/día | 100 | 168 | NA | |
| Hepatotoxicidad | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Hematuria | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Neutropenia | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Filgrastim (G-CSF) 30 MU/2días | 100 | 15 | 1 | |
| Elevación de colesterol | Moderada | Crónico | Atorvastatina 10mg/día | 100 | 168 | NA |
| Grave | Crónico | Atorvastatina 20mg/día | 100 | 168 | NA | |
| Elevación de triglicéridos | Moderada | Crónico | Bezafibrato 400mg | 100 | 168 | NA |
| Grave | Crónico | Bezafibrato 400mg | 100 | 168 | NA | |
| Elevación de transaminasas | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Hiperglucemia | Moderada | Crónico | Glibenclamida 10mg/día | 100 | 168 | NA |
| Grave | Crónico | Glibenclamida 10mg/día+insulina 20 U/día | 100 | 168 | NA | |
| Hiperbilirrubinemia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Crónico | Ninguno | NA | NA | NA | |
| Hiperamilasemia | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| CPK elevada | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 |
| Efecto adverso | Gravedad | Pacientes visitan urgencias (%) | Visitas especialista habitual (N) | Visitas otro especialista (N) | Pruebas realizadas | Ingreso (días) | % de gravedad |
| Cefalea | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 100 |
| Mareos | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 66 | 1,0 | 0,0 | Ninguna | 0 | 10 | |
| Insomnio | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 80 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 20 | |
| Náuseas | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 15 | |
| Vómitos | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 40 | 1,5 | 0,0 | Ninguna | 0 | 15 | |
| Fatiga/Astenia | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 90 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 10 | |
| Diarrea | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 100 | 1,0 | 0,0 | Coprocultivo | 3 | 10 | |
| Dolor muscular | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 0 | 1,0 | 0,5 | CPK+EMG | 0 | 5 | |
| Rash cutáneo | Moderada | 50 | 1,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 100 | 1,0 | 1,0 | Ninguna | 6 | 5 | |
| Dolor abdominal | Moderada | 0 | 2,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 75 | 3,0 | 1,0 | Analítica+ECO | 4 | 5 | |
| Depresión | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 50 | 1,5 | 1,0 | Ninguna | 0 | 10 | |
| Anemia | Moderada | 0 | 1,0 | 0,0 | Hemograma | 0 | 90 |
| Grave | 0 | 2,0 | 0,0 | Hemograma | 1 | 10 | |
| Ictericia | Moderada | 0 | 1,0 | 0,0 | Transaminasas+coagulación | 0 | 90 |
| Grave | 50 | 1,0 | 0,0 | Transaminasas+coagulación+ECOa | 3b | 10 | |
| Reacción de hipersensibilidad | Moderada | 50 | 1,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 100 | 2,0 | 0,5 | Analítica | 7 | 5 | |
| Sueño (Dreams) | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 15 | |
| Hepatotoxicidad | Moderada | 0 | 2,0 | 0,0 | Analítica | 0 | 95 |
| Grave | 100 | 3,0 | 0,5 | Analítica+ECO | 5 | 5 | |
| Hematuria | Moderada | 67 | 1,0 | 0,0 | Analítica de orina | 0 | 95 |
| Grave | 67 | 2,0 | 1,0 | Analítica de orina+ECO | 4 | 5 | |
| Neutropenia | Moderada | 0 | 0,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 0 | 1,0 | 1,0 | Biopsia de médula ósea | 0 | 5 | |
| Elevación de colesterol | Moderada | 0 | 0,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 0 | 0,0 | 0,0 | Ninguna | 0 | 10 | |
| Elevación de triglicéridos | Moderada | 0 | 0,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 0 | 0,0 | 0,0 | Ninguna | 0 | 10 | |
| Elevación de transaminasas | Moderada | 0 | 1,0 | 0,0 | Analítica | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | Analítica+ECO | 0 | 5 | |
| Hiperglucemia | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 98 |
| Grave | 50 | 1,0 | 1,0 | Curva de glucemia+insulinemia | 0 | 2 | |
| Hiperbilirrubinemia | Moderada | 0 | 0,5 | 0,0 | Transaminasas+coagulación | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | Transaminasas+coagulación+ECO | 0 | 5 | |
| Hiperamilasemia | Moderada | 0 | 1,0 | 0,0 | Analítica | 0 | 95 |
| Grave | 50 | 1,0 | 1,0 | Analítica+ECO | 4 | 5 | |
| CPK elevada | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | CPK+EMG | 0 | 5 |
ECO: ecografía; EMG: electromiograma; N: número; NA: no aplica.
Los estudios genotípicos de resistencias que se han considerado como coste diferencial son: 1) siempre que hay fracaso virológico, estudio de resistencias convencional; 2) cuando el TARV incluye raltegravir (RAL), estudio de resistencia al RAL antes de iniciar el tratamiento, y 3) si el fracaso virológico se produce en una pauta que contiene RAL, estudio de resistencia al RAL. Consideramos que en todos los pacientes se realizará un test de resistencias antes de iniciar el tratamiento independientemente de la pauta escogida y que esperamos al resultado antes de iniciar el tratamiento. Para las pautas que contienen abacavir (ABC), se ha considerado la determinación de HLA B*5701 antes de iniciar el tratamiento.
Coste unitario de los recursosTARVLos costes de cada pauta se calcularon a partir del precio de venta al laboratorio (PVL) más 4% de IVA. El precio de cada TARV se ha calculado a partir del precio de los fármacos que lo componen. Para el caso de la combinación de abacavir (ABC) y lamivudina (3TC) se ha utilizado el precio del Kivexa®. Para el caso de la combinación emtricitabina (FTC) y tenofovir DF (TDF) se ha utilizado el precio del Truvada®. Para el caso de la combinación de TDF/FTC/EFA se ha utilizado el precio del Atripla®. Los precios se obtuvieron del consenso de GESIDA/Plan Nacional sobre el Sida de 20115 (tabla 1).
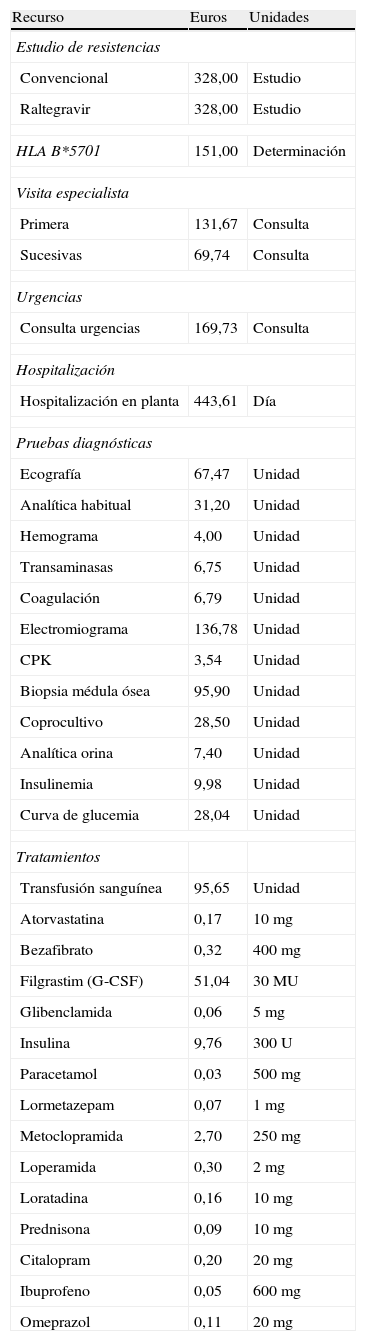
Coste de los efectos adversosPara asignar el coste del tratamiento de los fármacos utilizados en el manejo de los EA, se identificó el coste de los fármacos a precio de venta al público más IVA6. En caso de disponer de más de un preparado comercial, se eligió el coste del más barato. Para los demás recursos utilizados en el manejo de los EA (visitas a urgencias, visitas adicionales al especialista en VIH, visitas a otros especialistas, pruebas diagnósticas e ingreso hospitalario), dado que en España la sanidad es competencia de las comunidades autónomas (CC. AA.) no existe un precio único nacional. Por lo tanto, se han utilizado las tarifas oficiales del precio de los recursos de las CC. AA. El coste de cada unidad de recurso ha sido estimado como la media de los precios públicos (a aplicar por los centro sanitarios a terceros obligados al pago o a los usuarios sin derecho a asistencia sanitaria) correspondientes a los servicios sanitarios prestados por los Servicios de Salud de las Consejerías de Sanidad de las diferentes CC. AA. (tabla 4).
Coste unitario de los recursos utilizados
| Recurso | Euros | Unidades |
| Estudio de resistencias | ||
| Convencional | 328,00 | Estudio |
| Raltegravir | 328,00 | Estudio |
| HLA B*5701 | 151,00 | Determinación |
| Visita especialista | ||
| Primera | 131,67 | Consulta |
| Sucesivas | 69,74 | Consulta |
| Urgencias | ||
| Consulta urgencias | 169,73 | Consulta |
| Hospitalización | ||
| Hospitalización en planta | 443,61 | Día |
| Pruebas diagnósticas | ||
| Ecografía | 67,47 | Unidad |
| Analítica habitual | 31,20 | Unidad |
| Hemograma | 4,00 | Unidad |
| Transaminasas | 6,75 | Unidad |
| Coagulación | 6,79 | Unidad |
| Electromiograma | 136,78 | Unidad |
| CPK | 3,54 | Unidad |
| Biopsia médula ósea | 95,90 | Unidad |
| Coprocultivo | 28,50 | Unidad |
| Analítica orina | 7,40 | Unidad |
| Insulinemia | 9,98 | Unidad |
| Curva de glucemia | 28,04 | Unidad |
| Tratamientos | ||
| Transfusión sanguínea | 95,65 | Unidad |
| Atorvastatina | 0,17 | 10mg |
| Bezafibrato | 0,32 | 400mg |
| Filgrastim (G-CSF) | 51,04 | 30 MU |
| Glibenclamida | 0,06 | 5mg |
| Insulina | 9,76 | 300 U |
| Paracetamol | 0,03 | 500mg |
| Lormetazepam | 0,07 | 1mg |
| Metoclopramida | 2,70 | 250mg |
| Loperamida | 0,30 | 2mg |
| Loratadina | 0,16 | 10mg |
| Prednisona | 0,09 | 10mg |
| Citalopram | 0,20 | 20mg |
| Ibuprofeno | 0,05 | 600mg |
| Omeprazol | 0,11 | 20mg |
Debido a la escasez de información oficial sobre el coste del estudio de resistencias y de determinación de HLA B*5701, se han utilizado los costes del Hospital Clínico de Barcelona (tabla 4).
Definición y cálculo de eficienciaLa eficiencia ha sido definida en términos de coste/eficacia. Para cada pauta, se ha calculado como un cociente en el que el numerador es el coste de iniciar tratamiento con esa pauta y el denominador es la eficacia. Representa el coste de conseguir un respondedor en la semana 48.
Análisis de sensibilidadPara estimar el efecto de la incertidumbre procedente de los estimadores (e.g., de eficacia, EA o costes) se ha realizado un análisis de sensibilidad determinista para cada uno de los modelos. Para ello, se han construido tres escenarios: basal, más favorable y más desfavorable para cada pauta de inicio de TARV. En el escenario basal, la eficiencia se ha calculado como un cociente en el que el numerador es el estimador central del coste y el denominador es el estimador central de la eficacia. En el escenario más favorable, la eficiencia se ha calculado como un cociente en el que el numerador es el estimado más favorable del coste y el denominador es el estimado más favorable de la eficacia. En el escenario más desfavorable, los ratios de eficiencia se han calculado como un cociente en el que el numerador es el estimado más desfavorable del coste y el denominador es el estimado más desfavorable de la eficacia.
Para calcular el estimador central del coste, se ha aplicado el estimador central de la probabilidad de EA y los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. Para calcular el estimador más favorable del coste, se ha aplicado el límite inferior del intervalo de confianza al 95% (IC 95%) de la probabilidad de EA y un 15% menos de los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. Para calcular el estimador más desfavorable del coste, se ha aplicado el límite superior del IC 95% de la probabilidad de EA y un 15% más de los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. En todos los escenarios se ha utilizado el mismo coste de cada pauta de TARV, dado que en este coste no hay ninguna incertidumbre. Para calcular el estimador más favorable y más desfavorable de la eficacia, se han utilizado, respectivamente, los límites superior e inferior del IC 95%.
ResultadosEl CC seleccionó 11 artículos correspondientes a ensayos clínicos que evalúan la eficacia de las pautas preferentes del documento de consenso de GESIDA/Plan Nacional sobre el Sida12: STARTMRK14, ACTG520215, GS-93416, ARTEMIS17, CASTLE18, ARTEN19, ABT73020, GEMINI21, HEAT22, KLEAN23 y CNA3002424. De estos artículos, ACTG520215 y HEAT22 no cumplían los criterios de inclusión. Los datos del estudio HEAT pudieron incluirse porque se aportó un póster presentado en un congreso que reunía todos los criterios de inclusión25. Finalmente, con la evidencia científica disponible se han podido evaluar todas las pautas recomendadas como preferentes, excepto la pauta ABC/3TC+atazanavir potenciado con ritonavir (ATV/r). En la tabla 1 se presentan los ensayos de los que se obtuvo la información para evaluar cada una de las pautas.
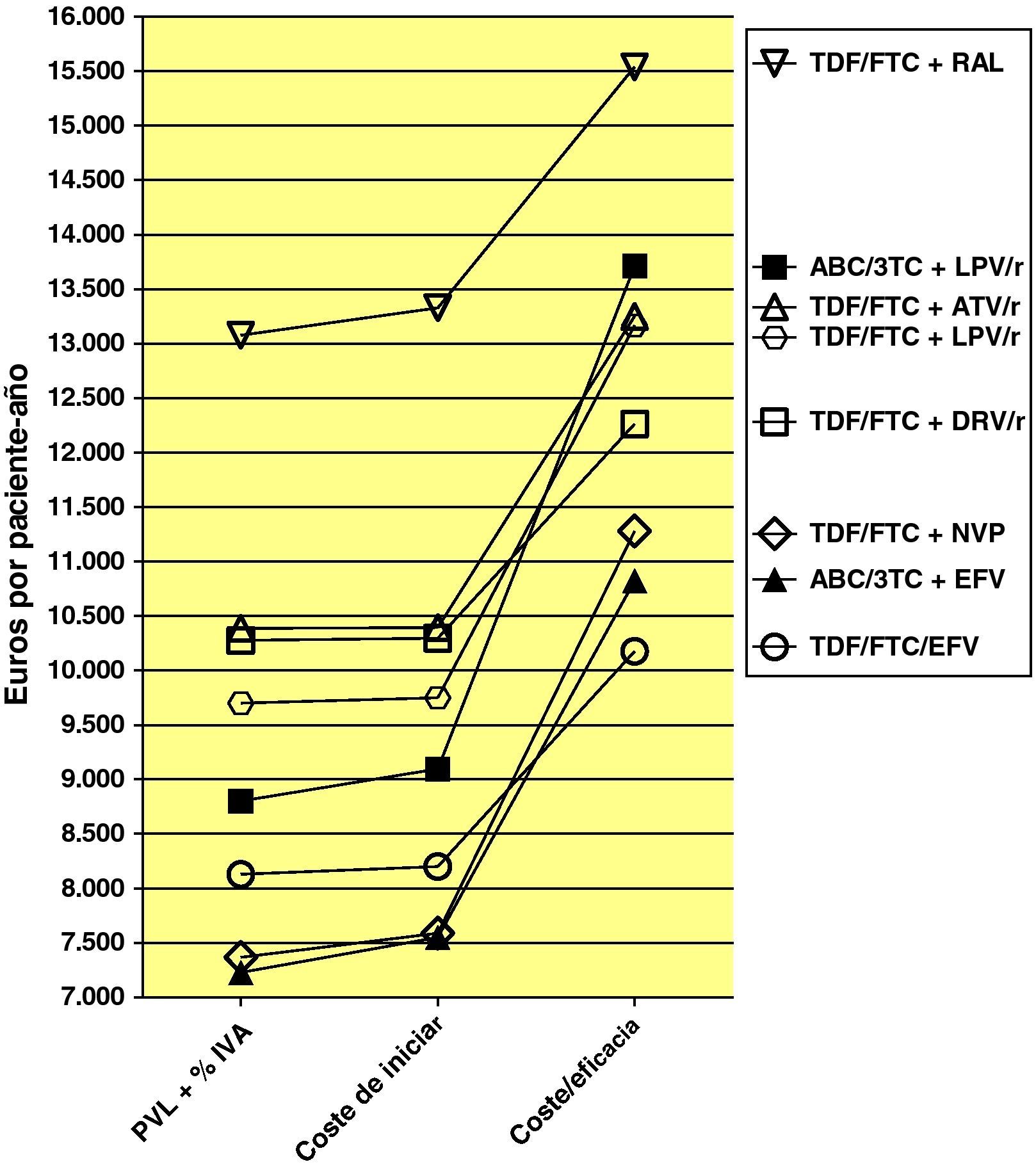
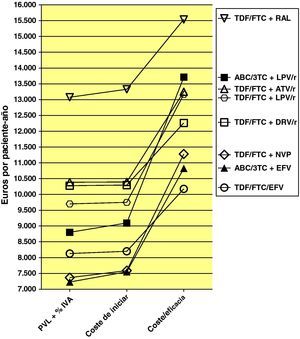
Los costes de las pautas de TARV durante 48 semanas (PVL+4% IVA) oscilan entre 7.228 y 13.078 euros, correspondientes a ABC/3TC/EFV y TDF/FTC+RAL, respectivamente (tabla 1 y fig. 2).
Coste (PVL+4% IVA), coste de iniciar una pauta (coste de iniciar) y eficiencia (coste/eficacia). Obsérvese que las pautas con menor coste (PVL+4% IVA) o con menor coste de iniciarla no son necesariamente las que tienen una mejor relación de coste/eficacia. Obsérvese también que tanto por el coste de iniciarlas como por su eficiencia (coste/eficacia) las pautas se agrupan en tres bloques según contengan un no nucleósido, un inhibidor de la proteasa potenciado con ritonavir o raltegravir (ver también tabla 5). El coste de iniciar tratamiento con una pauta es lo que más directamente incide sobre el presupuesto de farmacia y del hospital. La relación coste/eficacia refleja el coste para el Sistema Nacional de Salud de obtener un respondedor (a las 48 semanas en nuestro caso).
TDF: tenofovir DF; FTC; emtricitabina; EFV; efavirenz; DRV: darunavir;/r: potenciado con ritonavir; ATV: atazanavir; RAL: raltegravir; NVP: nevirapina; LPV: lopinavir; ABC: abacavir; 3TC: lamivudina.
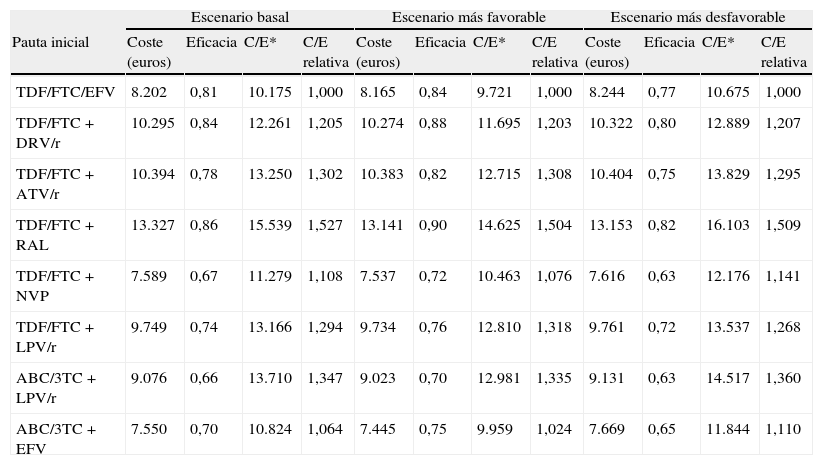
Los costes de iniciar tratamiento en el escenario basal oscilan entre 7.550 euros para ABC/3TC+EFV y 13.327 euros para TDF/FTC+RAL. Entre las pautas que contienen un inhibidor de la proteasa potenciado con ritonavir, los que contienen ABC/3TC+LPV/r y TDF/FTC+LPV/r son los que tienen un menor coste. En el escenario más favorable oscilan entre 7.445 y 13.141 euros, para ABC/3TC+EFV y TDF/FTC+RAL, respectivamente. En el escenario más desfavorable oscilan entre 7.669 y 13.153 euros, para ABC/3TC+EFV y TDF/FTC+RAL, respectivamente (tabla 5).
Coste de iniciar una pauta, eficacia y eficiencia (coste/eficacia) y coste eficacia relativa de iniciar tratamiento con las diferentes pautas y en tres posible escenarios
| Escenario basal | Escenario más favorable | Escenario más desfavorable | ||||||||||
| Pauta inicial | Coste (euros) | Eficacia | C/E* | C/E relativa | Coste (euros) | Eficacia | C/E* | C/E relativa | Coste (euros) | Eficacia | C/E* | C/E relativa |
| TDF/FTC/EFV | 8.202 | 0,81 | 10.175 | 1,000 | 8.165 | 0,84 | 9.721 | 1,000 | 8.244 | 0,77 | 10.675 | 1,000 |
| TDF/FTC+DRV/r | 10.295 | 0,84 | 12.261 | 1,205 | 10.274 | 0,88 | 11.695 | 1,203 | 10.322 | 0,80 | 12.889 | 1,207 |
| TDF/FTC+ATV/r | 10.394 | 0,78 | 13.250 | 1,302 | 10.383 | 0,82 | 12.715 | 1,308 | 10.404 | 0,75 | 13.829 | 1,295 |
| TDF/FTC+RAL | 13.327 | 0,86 | 15.539 | 1,527 | 13.141 | 0,90 | 14.625 | 1,504 | 13.153 | 0,82 | 16.103 | 1,509 |
| TDF/FTC+NVP | 7.589 | 0,67 | 11.279 | 1,108 | 7.537 | 0,72 | 10.463 | 1,076 | 7.616 | 0,63 | 12.176 | 1,141 |
| TDF/FTC+LPV/r | 9.749 | 0,74 | 13.166 | 1,294 | 9.734 | 0,76 | 12.810 | 1,318 | 9.761 | 0,72 | 13.537 | 1,268 |
| ABC/3TC+LPV/r | 9.076 | 0,66 | 13.710 | 1,347 | 9.023 | 0,70 | 12.981 | 1,335 | 9.131 | 0,63 | 14.517 | 1,360 |
| ABC/3TC+EFV | 7.550 | 0,70 | 10.824 | 1,064 | 7.445 | 0,75 | 9.959 | 1,024 | 7.669 | 0,65 | 11.844 | 1,110 |
ABC: abacavir; *: Euros/respondedor (< 50 copias de ARN del VIH/ml de plasma a las 48 semanas; «ITT missing or NC=failure»); ATV: atazanavir; C/E: coste/eficacia; DRV: darunavir; EFV; efavirenz; FTC; emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; TDF: tenofovir DF; 3TC; lamivudina.
La eficacia en el escenario basal oscila entre 0,66 (66% de respuesta a las 48 semanas) para ABC/3TC+lopinavir potenciado con ritonavir (LPV/r) y 0,86 para TDF/FTC+RAL. En el escenario más favorable oscila entre 0,70 y 0,90, para ABC/3TC+LPV/r y TDF/FTC+RAL, respectivamente. En el escenario más desfavorable oscila entre 0,63 para ABC/3TC+LPV/r y TDF/FTC+nevirapina (NVP), y 0,82 para TDF/FTC+RAL (tabla 5 y fig. 2).
La eficiencia, en términos de coste/eficacia, en el escenario basal oscila entre 10.175 y 15.539 euros por respondedor, para TDF/FTC/EFV y TDF/FTC+RAL, respectivamente. En el escenario más favorable oscila entre 9.721 y 14.625 euros por respondedor, para TDF/FTC/EFV y TDF/FTC+RAL, respectivamente. Entre las pautas que contienen un inhibidor de la proteasa potenciado con ritonavir, las más eficientes son TDF/FTC+DRV/r y TDF/FTC+LPV/r. En el escenario más desfavorable, oscila entre 10.675 y 16.103 euros por respondedor, para TDF/FTC/EFV y TDF/FTC+RAL, respectivamente. En términos relativos, si se inicia TARV con la pauta TDF/FTC+RAL, conseguir un respondedor es un 52,7% más caro que con la pauta TDF/FTC/EFV en el escenario basal, un 50,4% más caro en el escenario más favorable y 50,9% más caro en el escenario más desfavorable (tabla 5 y fig. 2).
Entre las pautas que contienen inhibidores de la transcriptasa inversa no nucleósidos, las más eficientes son TDF/FTC/EFV y ABC/3TC+EFV y la menos eficiente es TDF/FTC+NVP con la que conseguir un respondedor es un 10,8% más caro respecto a TDF/FTC/EFV, pudiendo oscilar entre 7,6 y 14,1% para los escenarios más favorable y desfavorable, respectivamente. Entre las pautas que contienen inhibidores de la proteasa potenciados con ritonavir, las más eficientes son TDF/FTC+DRV/r y TDF/FTC+LPV/r, y la menos eficiente es ABC/3TC+LPV/r con la que conseguir un respondedor es un 11,8% más caro respecto a TDF/FTC+DRV/r, pudiendo oscilar entre 11,0 y 12,6% según el escenario (tabla 5 y fig. 2).
DiscusiónDe las pautas que en el documento de consenso de GESIDA/Plan Nacional sobre el Sida de enero de 201112 son consideradas como preferentes, la pauta ABC/3TC+EFV es la menos costosa, tanto considerando únicamente el coste del TARV (PVL+4% IVA) como considerando el coste de iniciar tratamiento con una pauta, que incluye el coste derivado del manejo de los efectos adversos, del estudio de resistencias y HLA B*5701 y los derivados de los cambios de pauta que se producen. Sin embargo, la pauta TDF/FTC/EFV es la más eficiente en términos de coste/eficacia, a pesar de que existen dos pautas que en ensayos clínicos diferentes (y por lo tanto, no comparables) presentaron mayor eficacia relativa (TDF/FTC+RAL y TDF/FTC+DRV/r)14,17. La pauta TDF/FTC+RAL, a pesar de ser la más eficaz en un ensayo clínico que la comparaba con efavirenz14, es también la menos eficiente, como consecuencia de su elevado coste (PVL+4% IVA).
El coste de iniciar tratamiento con una pauta es lo que más directamente incide sobre el presupuesto de farmacia y del hospital. La relación coste/eficacia refleja el coste para el Sistema Nacional de Salud de obtener un respondedor (a las 48 semanas en nuestro caso). Finalmente, el médico y/o el paciente pueden preferir una pauta con un no nucleósido, con un inhibidor de la proteasa potenciado con ritonavir o con raltegravir por razones clínicas o por preferencias, más o menos justificadas. En este caso habría que valorar los costes de iniciar un tratamiento y el coste/eficacia dentro de cada uno de estos tres estratos.
Para todas las pautas, el principal coste de iniciar tratamiento es el coste del TARV (PVL+4% IVA), debido a su elevado precio. Por otra parte, el coste derivado del manejo de los efectos adversos es muy bajo, ya que una proporción muy baja de pacientes presenta efectos adversos y el coste de su manejo también es bajo.
El presente estudio tiene limitaciones. Una de las posibles limitaciones es que está basado exclusivamente en resultados de ensayos clínicos14,16–21,23–25 (no en estudios de cohortes ni en la vida real) realizados en diferentes países, en diferentes periodos de tiempo y con diferentes criterios de inclusión y exclusión de pacientes e incluso con diferentes presentaciones de un mismo fármaco para el caso de las pautas con LPV (cápsulas vs. comprimidos). Los resultados también podrían haber sido diferentes si todas las pautas se hubieran administrado en poblaciones similares y en el mismo periodo de tiempo. Otra limitación es que no todos los ensayos especifican qué EA son atribuibles al TARV, habiéndose considerado los EA que en opinión de los expertos son atribuibles a los TARV, por ser la mejor evidencia disponible. De igual manera, en función de la opinión de expertos, se han estimado los recursos necesarios para el manejo de los EA y las pautas alternativas que se emplean cuando se suspende la pauta inicial, ya que no existe mejor evidencia científica. Finalmente, para evaluar la eficacia de las pautas se ha utilizado la modalidad de «ITT-exposed missing or non-completed=failure» que no coincide necesariamente con el «end-point» principal de algunos estudios, pero los datos de las publicaciones permiten calcularlo. Podía haberse utilizado otras modalidades de análisis para calcular la eficacia y los resultados quizás hubieran sido algo diferentes. Aunque la metodología utilizada asegura un consenso a nivel nacional, los cálculos podrían diferir en otros países. Finalmente, cuando se ha dispuesto de más de un ensayo clínico para una pauta, no se ha podido realizar un metaanálisis debido a que no tienen comparadores comunes. Los datos son aplicables exclusivamente a España y teniendo en cuenta exclusivamente los precios oficiales de los medicamentos (PVL+4% de IVA). Por el contrario, la metodología es aplicable a cualquier entorno cambiando los valores de las variables y las estimaciones. En conjunto, todas estas limitaciones obligan a interpretar los resultados con cautela.
El diseño idóneo para conocer la eficiencia del TARV en el mundo real, según la práctica cotidiana, sería un estudio de coste/efectividad de cohortes prospectivas con pacientes seguidos durante periodos de tiempo lo más prolongados posible, pero es poco probable que pueda ser realizado. A falta de este tipo de estudios, el modelo analítico de decisión utilizado ha permitido examinar los costes y la eficiencia del TARV con la mejor evidencia científica disponible.
Los hallazgos del presente estudio resultan relevantes porque los sistemas sanitarios tienen como misión maximizar los resultados de salud en la población con los recursos disponibles, que son inherentemente limitados. En este contexto, garantizar la sostenibilidad del sistema requiere una utilización eficiente de los recursos. Estudios de evaluación económica como éste pueden ayudar a los profesionales sanitarios, gerentes y decisores políticos a mejorar su proceso de toma de decisiones en el manejo de la infección por VIH.
Conflicto de interesesAntonio Javier Blasco no tiene potenciales conflictos de intereses relacionados con el presente estudio.
José R Arribas ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Janssen; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare y ha recibido pago por desarrollo de presentaciones educacionales para Janssen.
Bonaventura Clotet ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare.
Pere Domingo ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
Juan González-García ha realizado trabajos de investigación promovidos por Bristol-Myers Squibb, Gilead, Abbott Laboratories, MSD, Jansen y Glaxo y ha participado como asesor para Gilead, Jansen, ViiV, Abbott y Bristol-Myers Squibb.
Juan Carlos López Bernaldo de Quirós ha efectuado labores de consultoría en los laboratorios Gilead, Abbott, Bristol-Myers-Squibb. Ha recibido compensación económica por charlas patrocinadas por Abbott, Bristol-Myers-Squibb, Gilead, ViiV Helath Care, Boerhinger, Jansen Cylag, MSD.
Josep Maria Llibre ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck, Pfizer, Roche y ViiV Healthcare y ha recibido compensación económica por conferencias de Abbott, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmith-Kline, Jansen-Cilag, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Boehringer-Ingelheim, Merck y ViiV.
Fernando Lozano ha efectuado labores de consultoría para Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Janssen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithkline, Jansen, Merck-Sharp & Dome, Pfizer, Roche Pharmaceuticals y ViiV Healthcare
Daniel Podzamczer ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Pfizer y Roche, ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Pfizer y Roche; ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Glaxo Smith Kline, Janssen, Merck y Roche.
Juan Miguel Santamaría ha efectuado labores de consultoría en los laboratorios Janssen Cilag y Merck Sharp & Dohme y ha recibido becas y ayudas de investigación de Abbot y Merck. Ha participado en charlas o simposiums patrocinados por Janssen Cilag, Merck Sharp and Dohme, Gilead y Abbot.
Montserrat Tuset ha disfrutado de becas para investigación clínica de laboratorios Bristol-Myers Squibb, Gilead Sciences y Merck; y ha recibido compensación económica por charlas de Janssen, Merck y ViiV Healthcare.
Laura Zamora no tiene conflictos de intereses relacionados con el presente estudio.
Pablo Lázaro no tiene potenciales conflictos de intereses relacionados con el presente estudio.
Josep M Gatell ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmith Kline, Merck y ViiV Healthcare.
El estudio ha contado con el soporte de la Fundación Máximo Soriano Jiménez y con el patrocinio científico del Grupo de Estudio de SIDA (GESIDA) de la SEIMC y el patrocinio científico y el soporte de la Red de Investigación en Sida (RIS; RD06/0006). Las opiniones expresadas por los autores no reflejan necesariamente la posición de GESIDA ni de la RIS.