Los antibióticos betalactámicos, cuyo mecanismo de acción es la inhibición de la última etapa de la síntesis de la pared celular bacteriana, constituyen la familia más numerosa de antimicrobianos y la más utilizada en la práctica clínica. Se trata de antibióticos de acción bactericida lenta, con actividad dependiente del tiempo, que en general tienen buena distribución y escasa toxicidad. Algunas modificaciones de la molécula original han dado lugar a compuestos con mayor espectro antimicrobiano, pero la progresiva aparición de resistencias limita su uso empírico y su eficacia en determinadas situaciones. Aun así, la penicilina continúa siendo el tratamiento de elección en un buen número de infecciones; las cefalosporinas tienen un gran abanico de indicaciones; los carbapenémicos se usan en infecciones nosocomiales y en infecciones causadas por bacterias multirresistentes, y los inhibidores de las betalactamasas permiten recuperar el espectro de actividad de las penicilinas a las que acompañan cuando la resistencia está causada por la producción de betalactamasas.
Beta-lactam drugs, whose mechanism of action is inhibition of the last stage of bacterial cell wall synthesis, are the largest family of antimicrobial agents and the most widely used in current clinical practice. These drugs have a slow, time-dependent bactericidal action, generally good distribution in the body, and low toxicity. Modifications of the original molecule have led to new compounds with a greater antimicrobial spectrum and activity; nonetheless, the use and efficacy of beta-lactams is limited in some clinical settings, owing to the increasing emergence of antimicrobial resistance. Despite this problem, penicillin remains the treatment of choice in a large number of infections, cephalosporins have a wide range of indications, carbapenems are used in nosocomially-acquired infection and infection caused by multiresistant microorganisms, and beta-lactam inhibitors restore the spectrum of activity of their companion penicillins (aminopenicillins, ureidopenicillins) when resistance is caused by beta lactamase production.
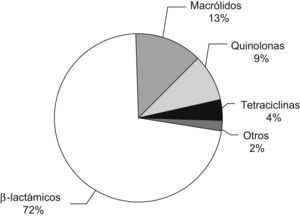
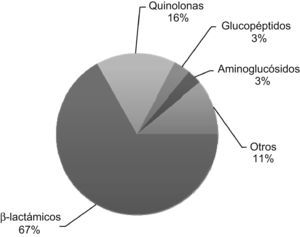
El descubrimiento de la penicilina se atribuye a Alexander Fleming quien, en septiembre de 1928, observó que el crecimiento de Staphylococcus aureus en algunos de los tubos de ensayo utilizados para el cultivo se inhibía ante la presencia del hongo Penicillium notatum. Este hongo producía una sustancia capaz de impedir el crecimiento no sólo de diferentes tipos de estafilococos, sino también de muchos estreptococos1. En 1930, Cecil George Paine, un joven microbiólogo, utilizó por primera vez la penicilina como tratamiento tópico en varios sujetos con infecciones cutáneas (sicosis) y oculares (endoftalmía neonatal)2. Sin embargo, debido a problemas de estabilidad química, el primer tratamiento parenteral con penicilina (de autoría discutida)3,4, tuvo que esperar hasta 1940. Aun ahora, después de casi 70 años, los betalactámicos son los antimicrobianos más prescritos, tanto en atención primaria como en los hospitales5,6 (figs. 1 y 2). A pesar de que no se dispone de ningún betalactámico realmente nuevo desde hace más de 2 décadas, el aumento incesante de las resistencias y de los avances en el conocimiento de sus mecanismos moleculares ha condicionado la existencia de una gran cantidad de información en la literatura médica sobre cada uno de los componentes de esta familia de antibióticos. Quizás la gran novedad en los últimos años es el interés creciente sobre la administración de betalactámicos en infusión continua como parte de una estrategia terapéutica que busca optimizar los parámetros farmacocinéticos y farmacodinámicos de estos antibióticos en el tratamiento de algunas infecciones producidas por microorganismos con sensibilidad reducida.
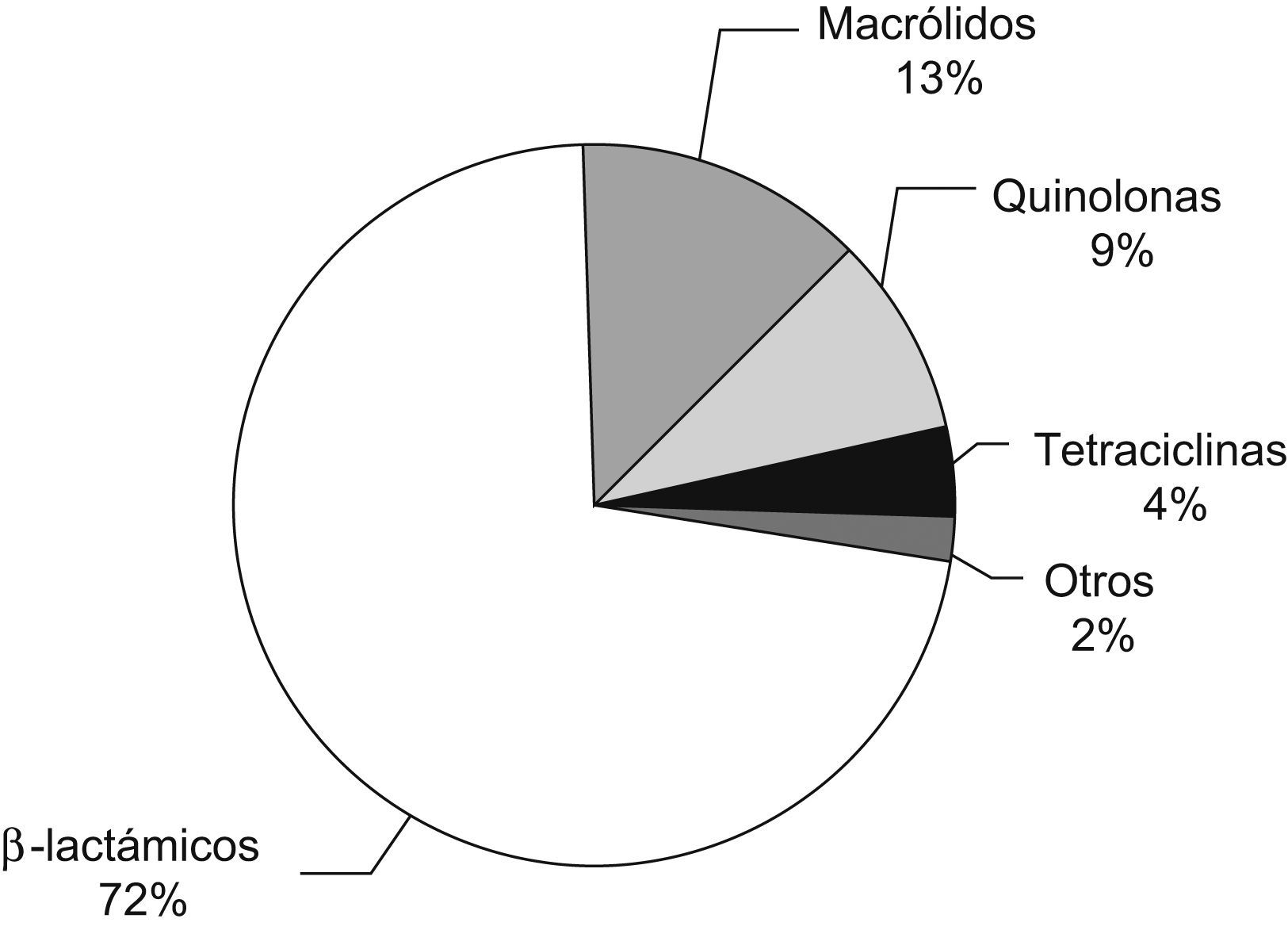
Consumo de antibióticos en atención primaria en 2005 en España. El consumo se mide en dosis diarias definidas cada 1.000 habitantes por día (DID), calculado a partir de datos de ventas (que incluye antibióticos suministrados con y sin receta médica). El consumo global de antibióticos ese año fue de 28,93 DID, y los betalactámicos representan más del 70% del total. Figura adaptada de Campos et al5.
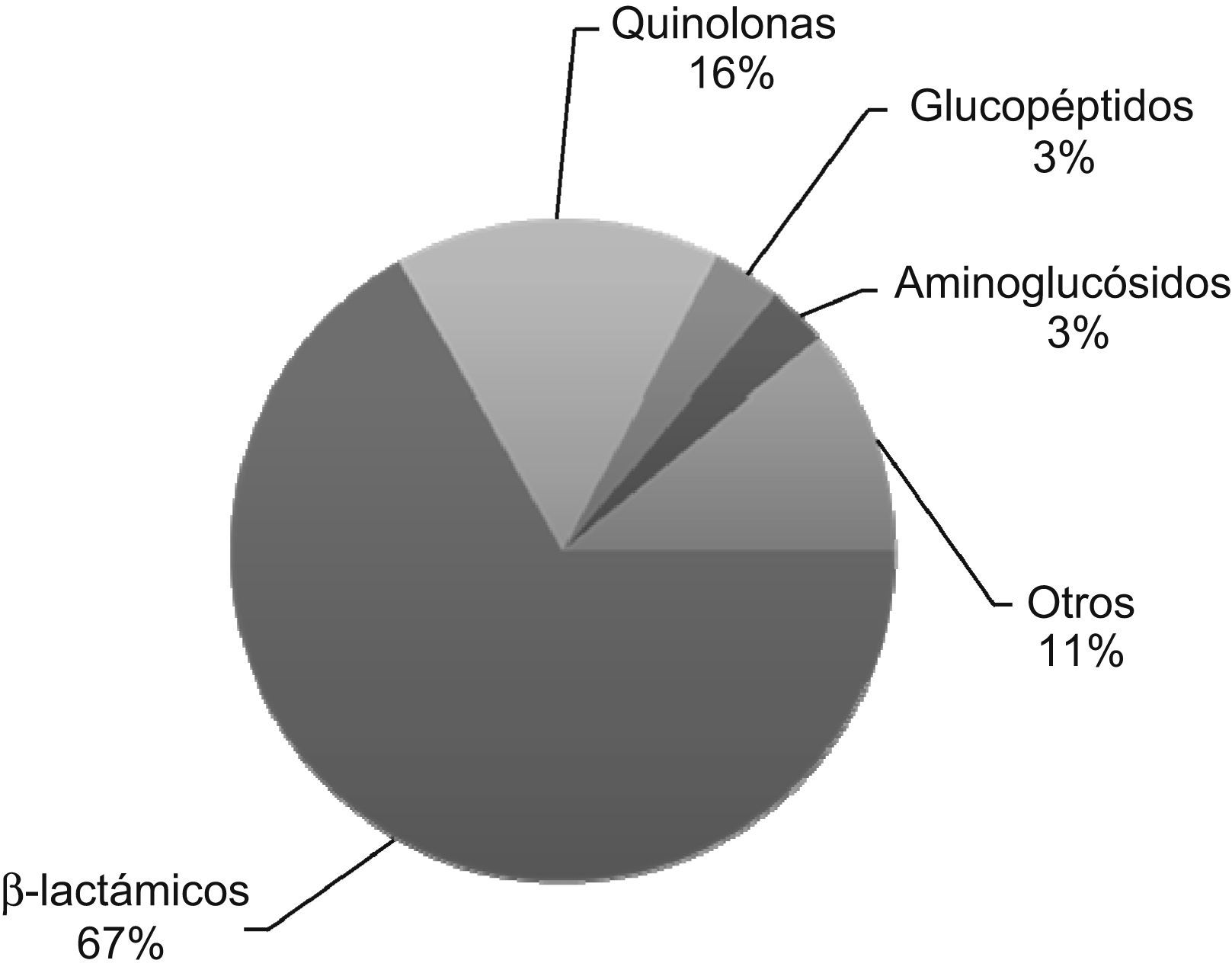
Consumo medio de antibióticos en 12 hospitales españoles en 2005. El consumo medio global fue de 80,54 dosis diarias definidas (DDD) por cada 100 estancias hospitalarias. Los betalactámicos representan casi el 70% del total de antibióticos consumidos. Figura adaptada de Pujol6.
El objetivo del presente artículo es ofrecer una visión conceptual del conjunto de los betalactámicos, de orientación básicamente clínica y adaptada a la realidad del medio. La propia revista Enfermedades Infecciosas y Microbiología Clínica (EIMC) ha publicado recientemente excelentes revisiones sobre mecanismos de resistencia y lectura interpretada del antibiograma7–9, revisiones que han facilitado en gran manera la labor al proporcionar las bases racionales para el establecimiento de las distintas indicaciones clínicas.
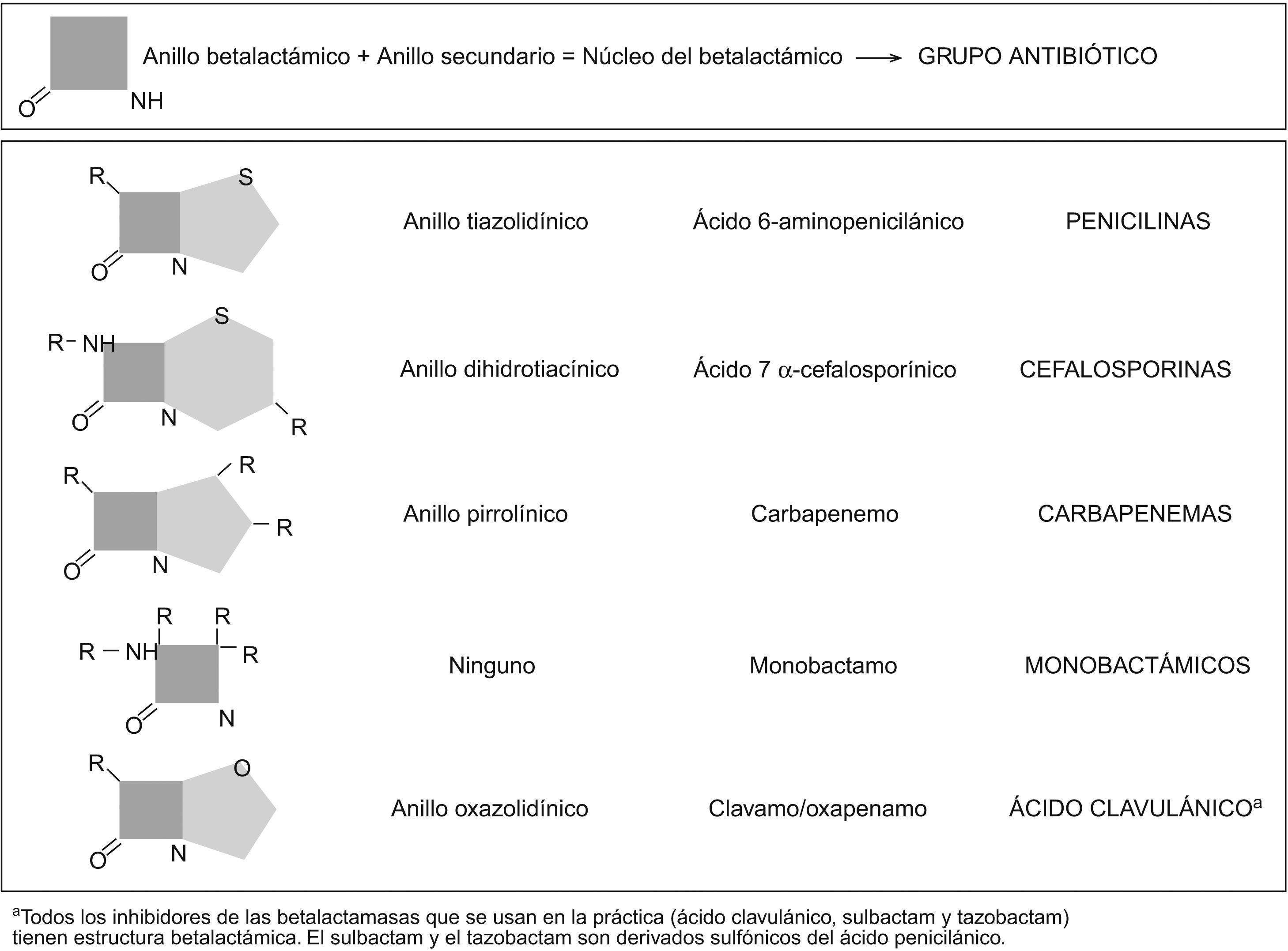
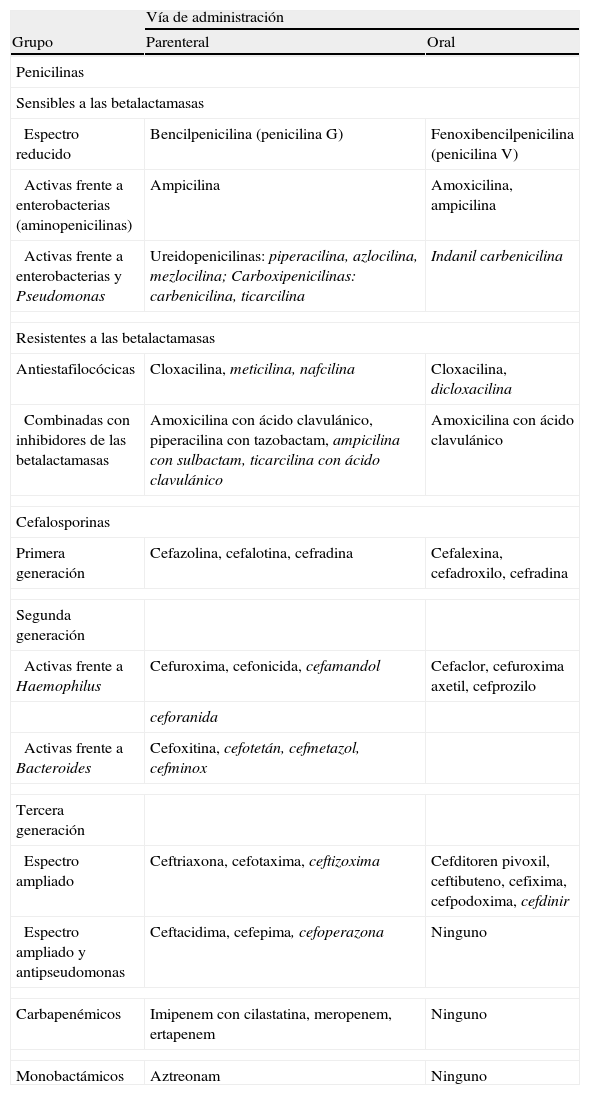
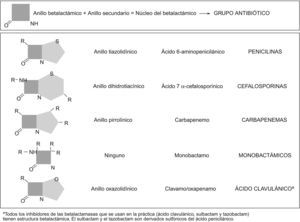
Clasificación y estructura químicaLa presencia del anillo betalactámico (fig. 3) define químicamente a esta familia de antibióticos. Además, éste determina el mecanismo de acción (inhibición de la síntesis de la pared celular), la escasa toxicidad directa (actúa sobre la pared celular del microorganismo que no está presente en la célula eucariota animal) y el principal mecanismo de resistencia (las betalactamasas) de esta gran familia de antibióticos. No obstante, para que el betalactámico sea activo, es preciso que esté unido a otros radicales (habitualmente otros anillos). La asociación de diferentes tipos de cadenas lineales, junto con las características propias de este esqueleto básico formado por los 2 anillos (llamado núcleo), modifica las propiedades del compuesto resultante y da lugar a los diferentes grupos de antibióticos betalactámicos: penicilinas, cefalosporinas, carbapenémicos, monobactamas e inhibidores de las betalactamasas (tabla 1). Dentro de cada grupo, pequeñas alteraciones en la estructura química son capaces de modificar las características del antibiótico, como el espectro, la afinidad por determinados receptores o la resistencia a las betalactamasas10. En la figura 3 se representa de forma esquemática la estructura básica de los diferentes grupos de betalactámicos.
Clasificación de los antibióticos betalactámicos
| Vía de administración | ||
| Grupo | Parenteral | Oral |
| Penicilinas | ||
| Sensibles a las betalactamasas | ||
| Espectro reducido | Bencilpenicilina (penicilina G) | Fenoxibencilpenicilina (penicilina V) |
| Activas frente a enterobacterias (aminopenicilinas) | Ampicilina | Amoxicilina, ampicilina |
| Activas frente a enterobacterias y Pseudomonas | Ureidopenicilinas: piperacilina, azlocilina, mezlocilina; Carboxipenicilinas: carbenicilina, ticarcilina | Indanil carbenicilina |
| Resistentes a las betalactamasas | ||
| Antiestafilocócicas | Cloxacilina, meticilina, nafcilina | Cloxacilina, dicloxacilina |
| Combinadas con inhibidores de las betalactamasas | Amoxicilina con ácido clavulánico, piperacilina con tazobactam, ampicilina con sulbactam, ticarcilina con ácido clavulánico | Amoxicilina con ácido clavulánico |
| Cefalosporinas | ||
| Primera generación | Cefazolina, cefalotina, cefradina | Cefalexina, cefadroxilo, cefradina |
| Segunda generación | ||
| Activas frente a Haemophilus | Cefuroxima, cefonicida, cefamandol | Cefaclor, cefuroxima axetil, cefprozilo |
| ceforanida | ||
| Activas frente a Bacteroides | Cefoxitina, cefotetán, cefmetazol, cefminox | |
| Tercera generación | ||
| Espectro ampliado | Ceftriaxona, cefotaxima, ceftizoxima | Cefditoren pivoxil, ceftibuteno, cefixima, cefpodoxima, cefdinir |
| Espectro ampliado y antipseudomonas | Ceftacidima, cefepima, cefoperazona | Ninguno |
| Carbapenémicos | Imipenem con cilastatina, meropenem, ertapenem | Ninguno |
| Monobactámicos | Aztreonam | Ninguno |
En cursiva se indican los betalactámicos que no se comercializan en este momento en España.
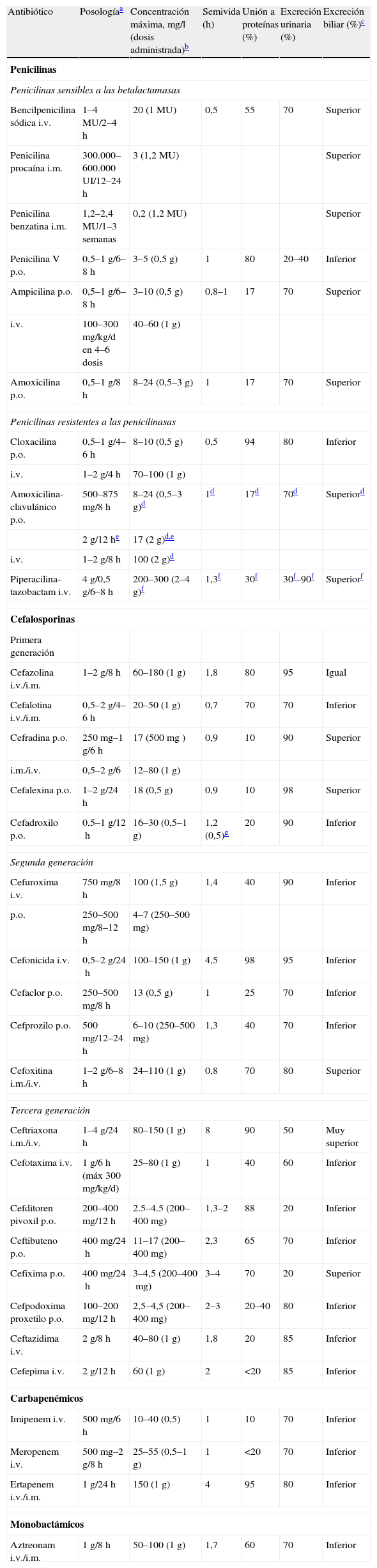
Las propiedades farmacocinéticas de los betalactámicos (que varían según los compuestos) se resumen en la tabla 2. Tras la administración intravenosa se alcanzan con rapidez concentraciones plasmáticas elevadas, pero la semivida de eliminación de la mayoría de los betalactámicos (con función renal normal) es baja, por lo que en general deben administrarse varias veces al día. Los betalactámicos con semividas de eliminación más prolongadas son el ertapenem (4h) y la ceftriaxona (8h); tras su administración se consiguen concentraciones terapéuticas durante 24h. La asociación de procaína y benzatina a la penicilina G consigue la liberación sostenida del antibiótico, lo que permite su administración cada 24h y hasta cada 3 semanas, respectivamente. Las sustancias nativas se absorben poco o nada por vía digestiva (el ácido clorhídrico las degrada), mientras que la absorción de algunos derivados sintéticos y semisintéticos (como la amoxicilina o las cefalosporinas orales) es mejor. La presencia de alimento retrasa y disminuye la absorción, que se produce a la altura de la primera porción duodenal. La unión a proteínas es muy variable (del 15 a prácticamente el 100%), y sólo la fracción libre es activa. Los betalactámicos tienen una distribución corporal amplia, con concentraciones séricas y tisulares adecuadas en la mayoría de los tejidos, incluidos la bilis y el líquido sinovial; atraviesan sin problemas la barrera placentaria, pero no penetran bien ni en el sistema nervioso central no inflamado ni en el ojo. Sin embargo, cuando hay inflamación meníngea, la penetración a través de la barrera hematoencefálica aumenta de 3 a 10 veces, lo que permite concentraciones terapéuticas en algunos de ellos (cloxacilina, ceftriaxona, ceftazidima y meropenem)12. Al tratarse de sustancias poco lipofílicas, su penetración intracelular es escasa y casi nunca alcanzan niveles mayores del 25 al 50% de las concentraciones plasmáticas. Por tanto, son antibióticos poco útiles en el tratamiento de las infecciones intracelulares.
Propiedades farmacocinéticas de los betalactámicos
| Antibiótico | Posologíaa | Concentración máxima, mg/l (dosis administrada)b | Semivida (h) | Unión a proteínas (%) | Excreción urinaria (%) | Excreción biliar (%)c |
| Penicilinas | ||||||
| Penicilinas sensibles a las betalactamasas | ||||||
| Bencilpenicilina sódica i.v. | 1–4 MU/2–4h | 20 (1 MU) | 0,5 | 55 | 70 | Superior |
| Penicilina procaína i.m. | 300.000–600.000 UI/12–24h | 3 (1,2 MU) | Superior | |||
| Penicilina benzatina i.m. | 1,2–2,4 MU/1–3 semanas | 0,2 (1,2 MU) | Superior | |||
| Penicilina V p.o. | 0,5–1g/6–8h | 3–5 (0,5g) | 1 | 80 | 20–40 | Inferior |
| Ampicilina p.o. | 0,5–1g/6–8h | 3–10 (0,5g) | 0,8–1 | 17 | 70 | Superior |
| i.v. | 100–300mg/kg/d en 4–6 dosis | 40–60 (1g) | ||||
| Amoxicilina p.o. | 0,5–1g/8h | 8–24 (0,5–3g) | 1 | 17 | 70 | Superior |
| Penicilinas resistentes a las penicilinasas | ||||||
| Cloxacilina p.o. | 0,5–1g/4–6h | 8–10 (0,5g) | 0,5 | 94 | 80 | Inferior |
| i.v. | 1–2g/4h | 70–100 (1g) | ||||
| Amoxicilina-clavulánico p.o. | 500–875mg/8h | 8–24 (0,5–3g)d | 1d | 17d | 70d | Superiord |
| 2g/12he | 17 (2g)d,e | |||||
| i.v. | 1–2g/8h | 100 (2g)d | ||||
| Piperacilina-tazobactam i.v. | 4g/0,5g/6–8h | 200–300 (2–4g)f | 1,3f | 30f | 30f–90f | Superiorf |
| Cefalosporinas | ||||||
| Primera generación | ||||||
| Cefazolina i.v./i.m. | 1–2g/8h | 60–180 (1g) | 1,8 | 80 | 95 | Igual |
| Cefalotina i.v./i.m. | 0,5–2g/4–6h | 20–50 (1g) | 0,7 | 70 | 70 | Inferior |
| Cefradina p.o. | 250mg–1g/6h | 17 (500mg ) | 0,9 | 10 | 90 | Superior |
| i.m./i.v. | 0,5–2g/6 | 12–80 (1g) | ||||
| Cefalexina p.o. | 1–2g/24h | 18 (0,5g) | 0,9 | 10 | 98 | Superior |
| Cefadroxilo p.o. | 0,5–1g/12h | 16–30 (0,5–1g) | 1,2 (0,5)g | 20 | 90 | Inferior |
| Segunda generación | ||||||
| Cefuroxima i.v. | 750mg/8h | 100 (1,5g) | 1,4 | 40 | 90 | Inferior |
| p.o. | 250–500mg/8–12h | 4–7 (250–500mg) | ||||
| Cefonicida i.v. | 0,5–2g/24h | 100–150 (1g) | 4,5 | 98 | 95 | Inferior |
| Cefaclor p.o. | 250–500mg/8h | 13 (0,5g) | 1 | 25 | 70 | Inferior |
| Cefprozilo p.o. | 500mg/12–24h | 6–10 (250–500mg) | 1,3 | 40 | 70 | Inferior |
| Cefoxitina i.m./i.v. | 1–2g/6–8 h | 24–110 (1g) | 0,8 | 70 | 80 | Superior |
| Tercera generación | ||||||
| Ceftriaxona i.m./i.v. | 1–4g/24h | 80–150 (1g) | 8 | 90 | 50 | Muy superior |
| Cefotaxima i.v. | 1g/6h (máx 300mg/kg/d) | 25–80 (1g) | 1 | 40 | 60 | Inferior |
| Cefditoren pivoxil p.o. | 200–400mg/12h | 2.5–4.5 (200–400mg) | 1,3–2 | 88 | 20 | Inferior |
| Ceftibuteno p.o. | 400mg/24h | 11–17 (200–400mg) | 2,3 | 65 | 70 | Inferior |
| Cefixima p.o. | 400mg/24h | 3–4,5 (200–400mg) | 3–4 | 70 | 20 | Superior |
| Cefpodoxima proxetilo p.o. | 100–200mg/12h | 2,5–4,5 (200–400mg) | 2–3 | 20–40 | 80 | Inferior |
| Ceftazidima i.v. | 2g/8h | 40–80 (1g) | 1,8 | 20 | 85 | Inferior |
| Cefepima i.v. | 2g/12h | 60 (1g) | 2 | <20 | 85 | Inferior |
| Carbapenémicos | ||||||
| Imipenem i.v. | 500mg/6h | 10–40 (0,5) | 1 | 10 | 70 | Inferior |
| Meropenem i.v. | 500mg–2g/8h | 25–55 (0,5–1g) | 1 | <20 | 70 | Inferior |
| Ertapenem i.v./i.m. | 1g/24h | 150 (1g) | 4 | 95 | 80 | Inferior |
| Monobactámicos | ||||||
| Aztreonam i.v./i.m. | 1g/8h | 50–100 (1g) | 1,7 | 60 | 70 | Inferior |
i.m.: intramuscular; i.v.: intravenoso; MU: millones de unidades; p.o.: per os (por vía oral).
La posología indicada es la más habitual para adultos y con función renal normal. Puede variar en función de la indicación.
El metabolismo de la mayoría de los betalactámicos es casi nulo; se mantienen en forma activa hasta su eliminación renal mediante filtrado glomerular y secreción tubular. En general, es necesario ajustar la dosis del betalactámico en sujetos con filtrado glomerular inferior a 50ml/min. Los betalactámicos se aclaran con la diálisis (más con la hemodiálisis que con la diálisis peritoneal), por lo que habitualmente es preciso administrar dosis extras tras el procedimiento, para mantener las concentraciones adecuadas del antimicrobiano. En algunos preparados, como la cefoperazona o la ceftriaxona, predomina la excreción por vía biliar. Muy pocos de los betalactámicos experimentan algún tipo de metabolismo antes de su eliminación, como la desacetilación (en el caso de la cefalotina o de la cefotaxima) o la inactivación por las hidroxipeptidasas renales (en el caso del imipenem).
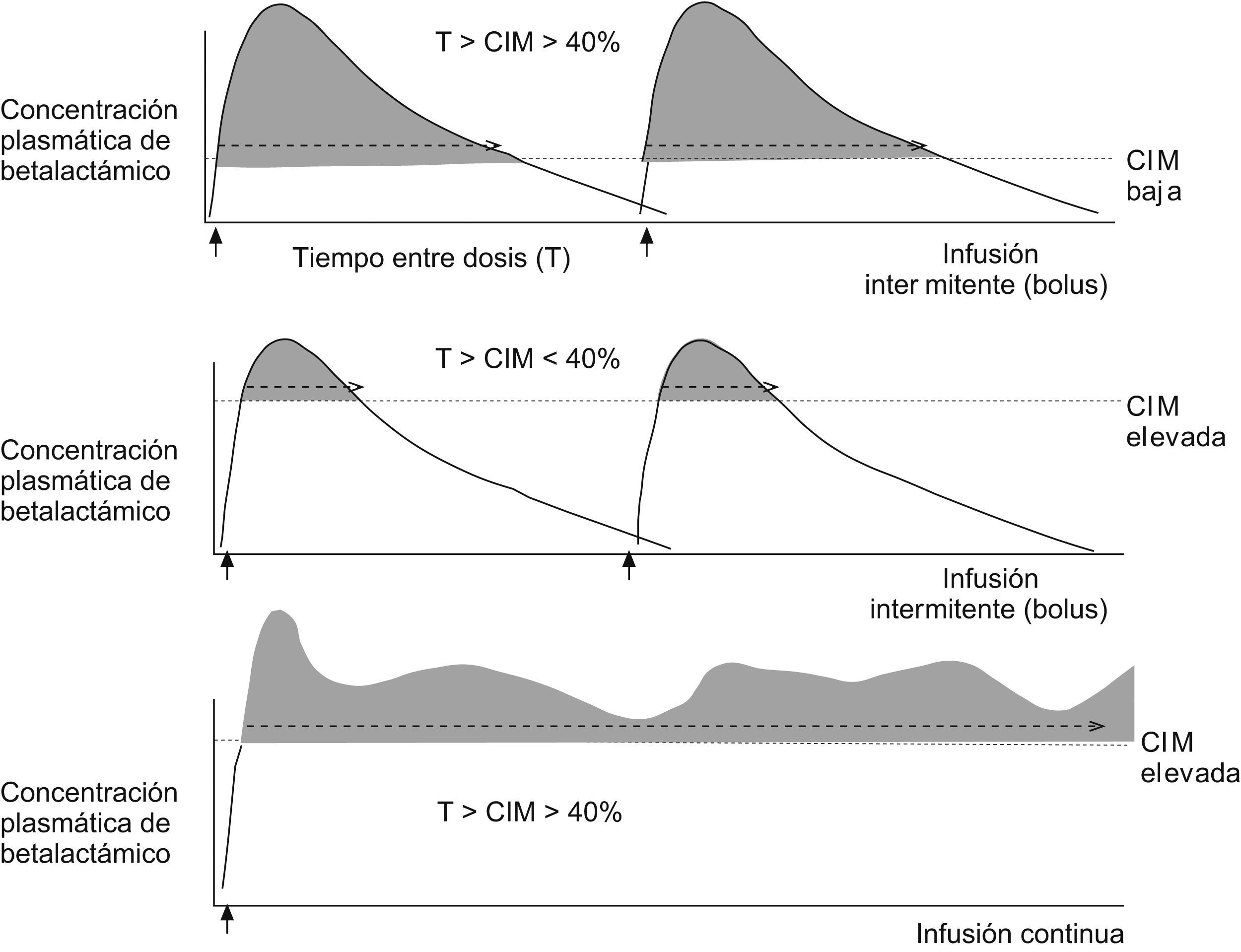
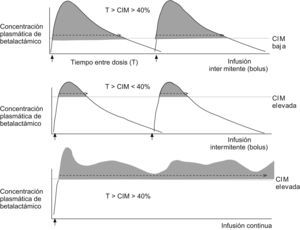
Características farmacodinámicas10,13Los betalactámicos son antibióticos de actividad bactericida lenta, relativamente independiente de la concentración plasmática alcanzada, siempre que ésta exceda la concentración inhibitoria mínima (CIM) del agente causal, o sea, la concentración mínima de antimicrobiano que inhibe el crecimiento bacteriano. Para la mayoría de los microorganismos sensibles, el betalactámico se comporta como bactericida porque la concentración bactericida mínima (CBM), o la concentración mínima de antimicrobiano que elimina el 99,9% de los microorganismos viables, es igual o ligeramente superior a la CIM. En las denominadas cepas tolerantes (definidas como aquéllas con CBM igual o mayor a 32 veces la CIM)10 el betalactámico se comporta como bacteriostático. Por otro lado, la selección de mutantes resistentes durante el tratamiento antibiótico es mucho mayor cuando la concentración del antibiótico es superior a la CIM pero inferior a la CBM. El índice farmacocinético y farmacodinámico que mejor se correlaciona con la eficacia clínica de los betalactámicos es el tiempo (T) durante el que la concentración del antibiótico supera la CIM (T>CIM). El valor óptimo de T mayor a la CIM varía según el microorganismo, el antibiótico y las características del sujeto. Por ejemplo, para la mayoría de las infecciones se considera suficiente un T mayor que la CIM superior al 40 o al 50% del intervalo entre dosis. Sin embargo, en sujetos neutropénicos, con meningitis o con microorganismos intrínsecamente resistentes (como Pseudomonas aeruginosa) se recomiendan valores superiores al 60% e incluso cercanos al 100%. Los betalactámicos tienen un efecto postantibiótico (EPA) frente a grampositivos de tan sólo 2h, y mucho menor frente a gramnegativos14, con excepción de los carbapenémicos en las infecciones por P. aeruginosa15 (con un EPA mucho más prolongado). El EPA se define como el tiempo que dura la inhibición del crecimiento bacteriano tras una exposición limitada a un determinado antimicrobiano, una vez que las concentraciones del antibiótico descienden por debajo de la CIM. Esta característica, propia de los antibióticos con acción preferentemente dependiente del tiempo, junto con la corta semivida de eliminación de la mayoría de los betalactámicos, condiciona su posología, lo que hace que se precise su administración varias veces al día para conseguir un T mayor que la CIM óptima. Si se observa la figura 4, es fácil entender que la consecución de este objetivo depende en gran medida de la CIM del microorganismo en cuestión. Cuanto más elevada sea la CIM, más difícil será alcanzar y superar durante el tiempo necesario esa concentración tras la administración del antibiótico. En los casos de infecciones por microorganismos sensibles con CIM bajas, este hecho no representa ningún problema, ya que la concentración de antibiótico en sangre y tejidos que se alcanza tras la administración de las dosis habituales de betalactámico supera con creces la CIM. En casos de infecciones por microorganismos con CIM más elevadas, aun en el caso de estar en el teórico rango de sensibilidad, puede ser difícil alcanzar un T mayor que la CIM ideal. La administración del betalactámico en infusión continua o infusión prolongada tras una dosis de carga permite optimizar estos parámetros farmacocinéticos y farmacodinámicos, y conseguir concentraciones superiores a la CIM durante mayor tiempo en comparación con la administración tradicional en bolo. Por otro lado, esta estrategia puede prevenir la selección de mutantes resistentes al disminuir el tiempo en que la concentración de antibiótico es inferior a la CBM. En los últimos años se han publicado numerosos estudios (muchos de simulación y en menor cantidad clínicos) sobre la administración de betalactámicos en infusión continua con la utilización de diferentes compuestos (piperacilina y tazobactam, meropenem, ceftazidima, cefepima), la mayoría de éstos en infecciones por P. aeruginosa o por microorganismos productores de betalactamasas de espectro extendido (BLEE). La revista EIMC publicó en 2005 una interesante revisión de los estudios realizados hasta el momento16.
Dado que los betalactámicos ejercen su acción mientras el microorganismo está en fase de crecimiento, su actividad bactericida es menor en el tratamiento de abscesos, en los que gran parte de los microorganismos pueden estar en fase quiescente. En infecciones con gran inóculo bacteriano, especialmente las causadas por algunos gramnegativos (el ejemplo clásico es la neumonía nosocomial gramnegativa), el efecto de los betalactámicos puede ser inferior11 y además es más fácil la selección de mutantes resistentes.
La combinación de penicilinas y aminoglucósidos es sinérgica in vitro frente a grampositivos (estafilococos, estreptococos, enterococos) y a gramnegativos (especialmente P. aeruginosa)17. Además, diversos estudios in vitro apoyan la teoría de que el tratamiento combinado disminuye la selección de mutantes resistentes18. Éstas son las bases teóricas del uso del tratamiento combinado en situaciones clínicas concretas; aunque algunas de ellas están bien establecidas, como la endocarditis, otras son más controvertidas, como el tratamiento del sujeto con sepsis grave o la neutropenia febril. De hecho, en los últimos años se han publicado 4 metaanálisis que estudian el efecto del tratamiento combinado en sujetos con neutropenia febril19,20, en sujetos inmunocompetentes con sepsis21 y en sujetos con bacteriemia gramnegativa22. Todos los estudios coinciden en que el tratamiento combinado no es superior a la monoterapia en cuanto a la reducción de la mortalidad, y sólo uno de los estudios identifica el subgrupo de sujetos con bacteriemia por P. aeruginosa como el único en que el tratamiento combinado es potencialmente beneficioso22. No obstante, los datos de este tipo de estudios han de ser interpretados con cautela, ya que en ocasiones se comparan en los 2 grupos (con y sin aminoglucósido) betalactámicos con diferente espectro, por lo que el efecto clínico de la sinergia puede ser valorado inadecuadamente. La demostrada sinergia de ceftriaxona y ampicilina in vitro se ha aplicado con éxito en el tratamiento de la endocarditis enterocócica23.
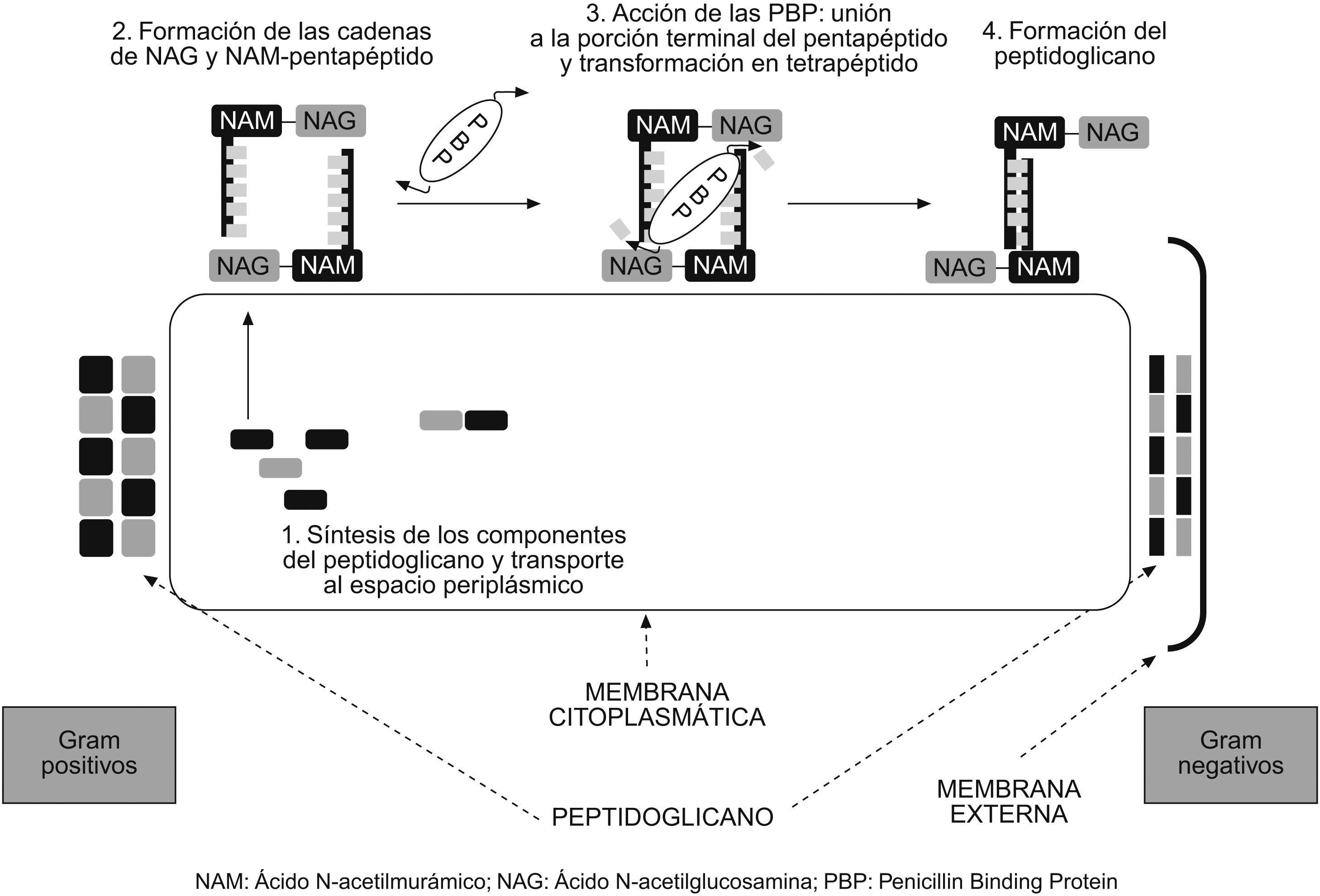
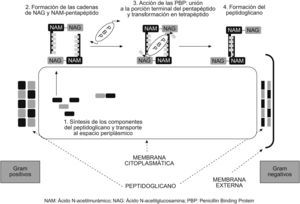
Mecanismo de acción10Los antibióticos betalactámicos son agentes bactericidas que producen su efecto principalmente a través de 2 mecanismos: inhibición de la síntesis de la pared bacteriana e inducción de la autólisis bacteriana. La pared bacteriana es una estructura que envuelve las bacterias de todos los géneros, excepto los micoplasmas; se sitúa por fuera de la membrana citoplásmica y está compuesta principalmente por una proteína llamada peptidoglucano. En las bacterias grampositivas, la pared celular es gruesa y su componente principal es esa proteína. Las bacterias gramnegativas tienen una pared más fina y compleja que consta de una membrana externa formada por lípidos y proteínas, y de una capa interna delgada de peptidoglucano. Las bacterias ácido alcohol resistente tienen una pared similar a la de los microorganismos grampositivos, pero con una capa de peptidoglucano fina y, por fuera, una capa muy rica en lípidos (fig. 5).
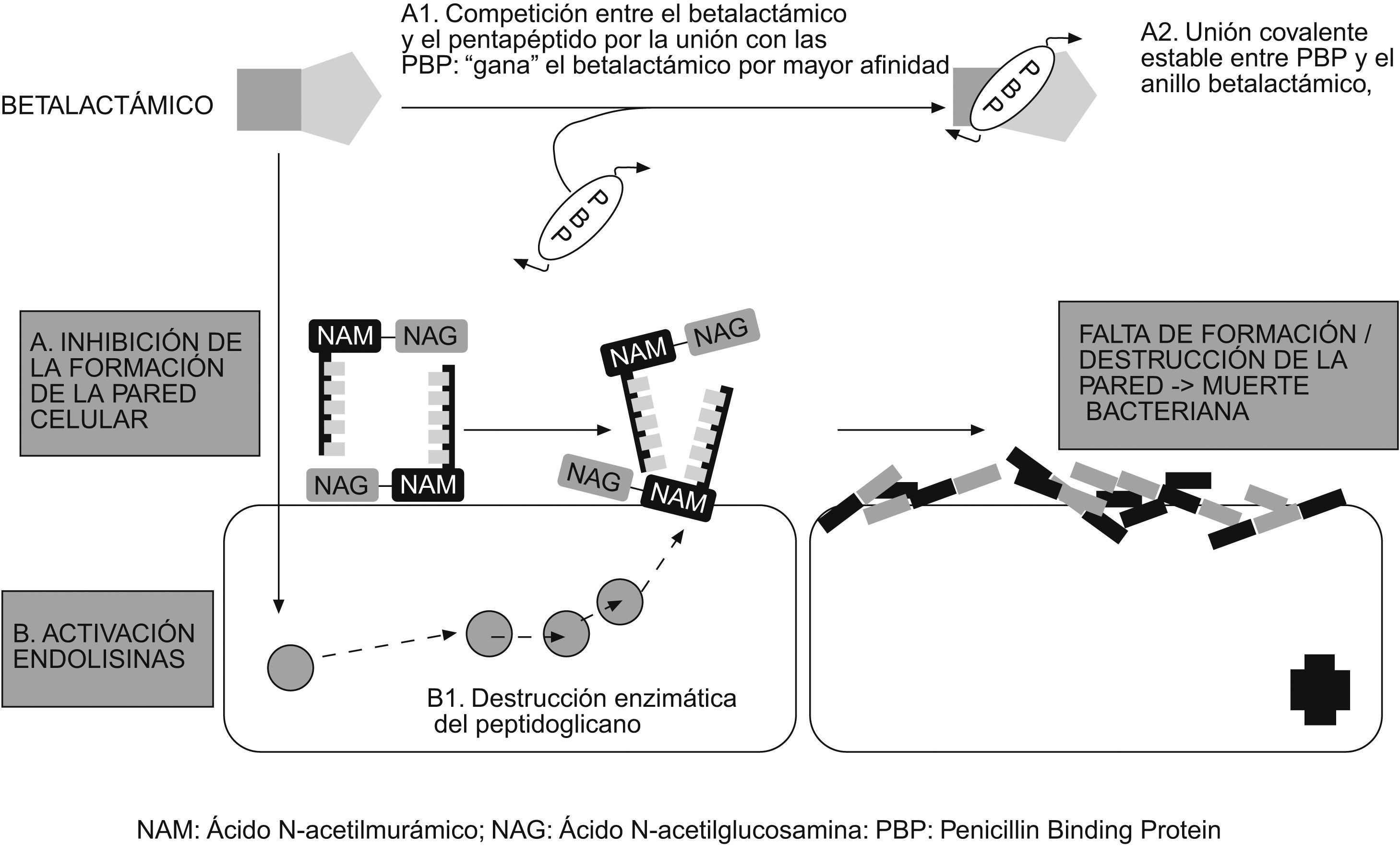
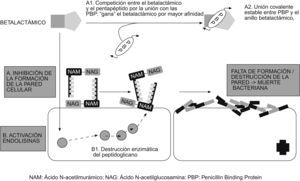
El esqueleto del peptidoglucano está constituido por largas cadenas de glúcidos, formadas por la repetición de moléculas de ácido N-acetilmurámico y N-acetilglucosamina. A su vez, el ácido murámico fija cadenas de tetrapéptidos que se unen entre sí y forman una malla. Los diferentes componentes del peptidoglucano se sintetizan en el citoplasma y son transportados a través de la membrana citoplásmica al espacio que hay entre ésta y la pared celular (espacio periplásmico), donde se van ensamblando hasta formar la estructura previamente descrita (fig. 5). La última fase de la síntesis de la pared bacteriana consiste en la formación de los tetrapéptidos a partir de los pentapéptidos (mediante la pérdida de uno de los aminoácidos terminales), para lo que se necesita la acción de unas enzimas que se localizan en ese espacio periplásmico, llamadas de forma genérica transpeptidasas. El anillo betalactámico presenta una similitud estructural con la región del pentapéptido al que se unen estas enzimas, por lo que es capaz de unirse a ellas de forma covalente e impedir así la formación de la pared celular (fig. 6). Es por eso que estas enzimas se llaman también PBP (penicillin binding protein ‘proteína ligada a la penicilina’). Sin la pared, la bacteria queda expuesta al medio y muere debido a cambios en la presión oncótica. Por tanto, para que actúen los betalactámicos, es preciso que la bacteria se halle en fase de multiplicación, ya que éste es el momento en que se sintetiza la pared celular. Los betalactámicos presentan actividad reducida en situaciones clínicas en las que hay gran parte de la población bacteriana en estado estacionario, como por ejemplo los abscesos.
Los betalactámicos también actúan activando una autolisina bacteriana endógena que destruye el peptidoglucano. Las cepas que carecen de autolisina (generalmente son cepas tolerantes a los betalactámicos) inhiben su crecimiento en presencia del betalactámico, pero no se destruyen completamente.
Espectro antibacterianoEn general, el espectro de los betalactámicos incluye bacterias grampositivas, gramnegativas y espiroquetas. No son antimicrobianos activos sobre los micoplasmas (porque éstos carecen de pared celular) ni sobre bacterias intracelulares como las clamidias o las rickettsias, ya que tienen escasa capacidad de penetración dentro de las células. La resistencia natural de las micobacterias se debe a la producción de betalactamasas, probablemente unida a una penetración lenta debida a las características de la pared.
El espectro antimicrobiano de la penicilina G abarcaba inicialmente los cocos grampositivos, los cocos gramnegativos y los bacilos grampositivos (tanto facultativos como anaerobios), así como las espiroquetas y algunos bacilos gramnegativos anaerobios. La producción de derivados semisintéticos a partir de la molécula nativa permitió disponer de preparados activos por vía oral (penicilina V, aminopenicilinas), con resistencia a las betalactamasas (penicilinas antiestafilocócicas), mayor capacidad de penetración en las bacterias gramnegativas (aminopenicilinas) o incluso con actividad antipseudomónica (ureidopenicilinas y carboxipenicilinas). El mecanismo de resistencia adaptativo más importante frente a los betalactámicos es la producción de betalactamasas por parte de algunos microorganismos (S. aureus, enterobacterias como Salmonella spp., Escherichia coli, Shigella y Bacteroides spp., etcétera). Otros microorganismos, como Klebsiella pneumoniae, producen betalactamasas de forma natural, por lo que son resistentes a las penicilinas naturales de forma intrínseca. Estas enzimas hidrolizan el anillo betalactámico, de modo que el antibiótico no puede ejercer su acción11. Los inhibidores de las betalactamasas son moléculas con una afinidad elevada frente a estas betalactamasas, a las que se unen irreversiblemente, evitando así la inactivación del antibiótico betalactámico. Los efectos que se consiguen es la restauración de la actividad original del antibiótico sobre los microorganismos que se han hecho resistentes por la producción de betalactamasas y la ampliación del espectro de aquellos que las producen de forma natural. Todos los inhibidores de betalactamasas usados en la práctica (ácido clavulánico, sulbactam y tazobactam) tienen estructura betalactámica, pero poseen una actividad antibacteriana mínima, con excepción del sulbactam frente a Acinetobacter baumannii.
Las cefalosporinas de primera generación son muy activas sobre los cocos grampositivos; en líneas generales, las sucesivas generaciones han perdido parte de esta actividad, en beneficio de una actividad mayor frente a bacilos gramnegativos, con excepciones notables. Todas las cefalosporinas son inactivas frente a enterococos, estafilococos resistentes a la meticilina y Listeria monocytogenes.
Los carbapenémicos son los betalactámicos de más amplio espectro, incluidos los microorganismos productores de BLEE. Sólo carecen de actividad frente a los estafilococos resistentes a la meticilina, a los enterococos resistentes a la vancomicina y a Xanthomonas maltophilia; frente a Clostridium difficile son poco activos y frente a P. aeruginosa tienen sensibilidad variable, en función de la epidemiología local. El imipenem es más activo frente a Enterococcus faecalis y menos activo frente a P. aeruginosa que el meropenem. El ertapenem es el carbapenémico con CIM más bajas frente a las enterobacterias, aunque tiene menor actividad que los otros miembros de la familia frente a los enterococos y frente a P. aeruginosa.
El aztreonam (el único monobactámico disponible para uso clínico) posee una actividad excelente sobre bacterias gramnegativas aerobias y facultativas. Carece de actividad frente a grampositivos y bacterias anaerobias.
Mecanismos de resistencia24Las bacterias pueden desarrollar resistencia a los betalactámicos básicamente mediante 3 mecanismos diferentes que, en ocasiones, pueden ir asociados a otros mecanismos causantes de la resistencia a otras familias de antibióticos25. No es objetivo de esta revisión profundizar en este tema, analizado recientemente en esta misma publicación26. Así, de forma somera, los principales mecanismos implicados en la resistencia son los siguientes:
- 1.
Producción de enzimas (betalactamasas). Representa el principal mecanismo de resistencia frente a los betalactámicos, especialmente en gramnegativos (aunque también pueden producirlas grampositivos y anaerobios). Las betalactamasas son enzimas que hidrolizan el anillo betalactámico y que, por tanto, inactivan el antibiótico antes de su unión con las PBP. Su producción puede estar mediada por plásmidos o puede estar cromosómicamente codificada. En el primer caso, pueden ser transferibles y los inhibidores de las betalactamasas suelen inactivarlas; algunos ejemplos son las producidas por S. aureus sensible a la meticilina, Haemophilus influenzae, Moraxella catarrhalis, E. coli, K. pneumoniae, algunas enterobacterias y anaerobios, como Bacteroides fragilis. En el caso de los microorganismos con betalactamasas de origen cromosómico (como Enterobacter spp., Pseudomonas spp., Citrobacter spp., Morganella spp. y Serratia spp.) éstos son a menudo inducibles (aumenta su producción tras la exposición a betalactámicos, especialmente cefalosporinas) y no son sustrato de los inhibidores de las betalactamasas27. Hay muchos tipos de betalactamasas en función de los betalactámicos que hidrolizan. El uso (y abuso) de los antibióticos durante décadas ha favorecido la evolución de estas enzimas hacia una nueva generación, las llamadas BLEE, que son capaces de hidrolizar las cefalosporinas de tercera generación y el monobactámico aztreonam28.
- 2.
Modificación de la diana en las PBP. Diferentes alteraciones en las PBP (mutaciones, hiperexpresión y modificación de la afinidad) pueden dificultar la unión del betalactámico a la proteína, lo que disminuye su actividad. Éste es el mecanismo principal de resistencia a betalactámicos de los microorganismos grampositivos, como S. pneumoniae, S. aureus resistente a meticilina y Enterococcus faecium.
- 3.
Alteraciones en la permeabilidad y bombas de expulsión. Ante la barrera que supone la presencia de una membrana celular (como en el caso de los microorganismos gramnegativos) las sustancias poco lipofílicas (como los betalactámicos) precisan proteínas (poros) que les faciliten la entrada al espacio periplásmico para poder unirse a las PBP. Éste es uno de los motivos por los que, con algunas excepciones, los microorganismos gramnegativos son generalmente más resistentes a los antibióticos que los grampositivos. Algunos microorganismos más sofisticados, como P. aeruginosa, presentan además sistemas de bombeo de antibióticos muy eficaces, que determinan su resistencia intrínseca a muchos antibióticos, incluidos algunos de los betalactámicos29. Algunas alteraciones en la permeabilidad (mutaciones, hiperexpresiones) pueden modificar la resistencia basal a los betalactámicos.
En la práctica, además del espectro antibacteriano, el perfil farmacocinético y las propiedades farmacodinámicas, es esencial conocer la prevalencia local de las resistencias de las principales bacterias frente a los antibióticos teóricamente indicados en su tratamiento. En el caso de los betalactámicos, la situación en España es la siguiente:
S. aureus: un reciente estudio multicéntrico de prevalencia realizado en España, en el que se estudiaron 463 cepas de S. aureus, destaca globalmente la estabilidad en los últimos años en la resistencia a la penicilina, que se mantiene alrededor del 90%30. La mayoría de las cepas de S. aureus sensible a la meticilina son sensibles al resto de los betalactámicos con actividad antiestafilocócica, incluidos los inhibidores de las betalactamasas. Sin embargo, las cepas de S. aureus resistente a meticilina (oxacilina) suelen ser resistentes a todos los betalactámicos y, con frecuencia, a otras familias de antibióticos (el 68% en un estudio31). Aunque la resistencia global a la oxacilina se ha mantenido estable en los últimos años (alrededor del 30%)30, se trata de un problema emergente tanto en centros geriátricos y de larga estancia (prevalencia del 7 al 36% en un estudio multicéntrico32) como en la comunidad33. A diferencia de las cepas relacionadas con el entorno sanitario, las de origen comunitario suelen conservar sensibilidad a la mayoría de los antibióticos.
Staphylococcus epidermidis: alrededor del 75% son resistentes a todos los betalactámicos.
S. pneumoniae: en 2002 se modificaron los criterios utilizados por el National Committee for Clinical Laboratory Standards y se establecieron los nuevos puntos de corte: mayor o igual a 8μg/ml para la penicilina, mayor o igual a 4μg/ml para la cefotaxima en infección extrameníngea y 2 diluciones inferior en infección meníngea. Bajo estos criterios, en un estudio prospectivo reciente en el que se analizaron 1.007 episodios de enfermedad neumocócica invasiva desde 1997 hasta 2007, no se observó ningún aislamiento de neumococo resistente34.
E. faecalis: sensibilidad a los betalactámicos del 98%35, a diferencia de E. faecium (64% de resistencia a la ampicilina en un estudio de sujetos con bacteriemia)36.
Neisseria gonorrhoeae: cerca del 90% de las cepas tienen sensibilidad disminuida o resistencia a la penicilina, pero el 100% son sensibles a la ceftriaxona y al cefditoren37.
Neisseria meningitidis: baja resistencia a las penicilinas, en aumento en los últimos años (del 9 al 71% en un período de 9 años según un estudio con casi 500 cepas en un hospital pediátrico)38. A pesar de esto, la repercusión clínica no es significativa, ya que habitualmente para el tratamiento se utilizan cefalosporinas de tercera generación, que además erradican el estado de portador.
H. influenzae: resistencia a amoxicilina de alrededor del 30%; menos del 5% de estas cepas son resistentes a inhibidores de las betalactamasas, pero sensibles a cefalosporinas de tercera generación, carbapenémicos y aztreonam.
Salmonella enterica: resistencia a la ampicilina del 12%, muy baja a la amoxicilina con ácido clavulánico (del 1 al 5%) y prácticamente nula a la ceftriaxona39.
Shigella sonnei: resistencia a la ampicilina del 15 al 20% (hasta del 65% en casos de diarrea del viajero)40; la resistencia a la amoxicilina con ácido clavulánico es prácticamente nula41.
E. coli: en un estudio multicéntrico que incluyó más de 2.000 urocultivos procedentes de mujeres con cistitis no complicada, la tasa de resistencia a la ampicilina fue del 52%, mientras que la tasa de resistencia a la amoxicilina con ácido clavulánico y cefuroxima fue inferior al 3%42. Aproximadamente un 10% de las cepas son resistentes a los betalactámicos con inhibidores de las betalactamasas. Una proporción cada vez mayor de las cepas es productora de BLEE (1,7 al 5,5%)43,44.
K. pneumoniae y Enterobacter spp.: presentan de forma natural resistencia a las penicilinas y pueden adquirir resistencia frente a cefalosporinas de tercera y cuarta generación, debido a la producción de BLEE plasmídica en el primer caso o a la desrepresión de la betalactamasa cromosómica en el caso de Enterobacter. La resistencia antibiótica varía ampliamente entre centros y unidades, y depende de la situación epidémica local. Se ha descrito algún caso anecdótico de resistencia a carbapenémicos en Klebsiella45.
P. aeruginosa: en un estudio multicéntrico en el que se analizaron 1.250 aislamientos de P. aeruginosa, el porcentaje de resistencia a la piperacilina y a la piperacilina con tazobactam fue inferior al 10%; la resistencia a carbapenémicos osciló en alrededor del 15% y la resistencia a las cefalosporinas antipseudomónicas fue de entre el 15 y el 20%46. No obstante, el patrón de resistencia puede variar mucho de acuerdo con la epidemiología local47.
Indicaciones clínicas48En las tablas 3, 4 y 5 se muestran las indicaciones clínicas de los distintos betalactámicos, junto con el espectro antimicrobiano, siempre que sean el tratamiento de elección o una opción terapéutica de primera línea, así como las dosis habituales en sujetos adultos con función renal normal. Las guías de uso práctico (en especial si recogen datos locales) son muy útiles en el tratamiento diario de los sujetos12. A continuación, se resumen los principales usos de los betalactámicos, agrupados en los principales síndromes infecciosos del adulto.
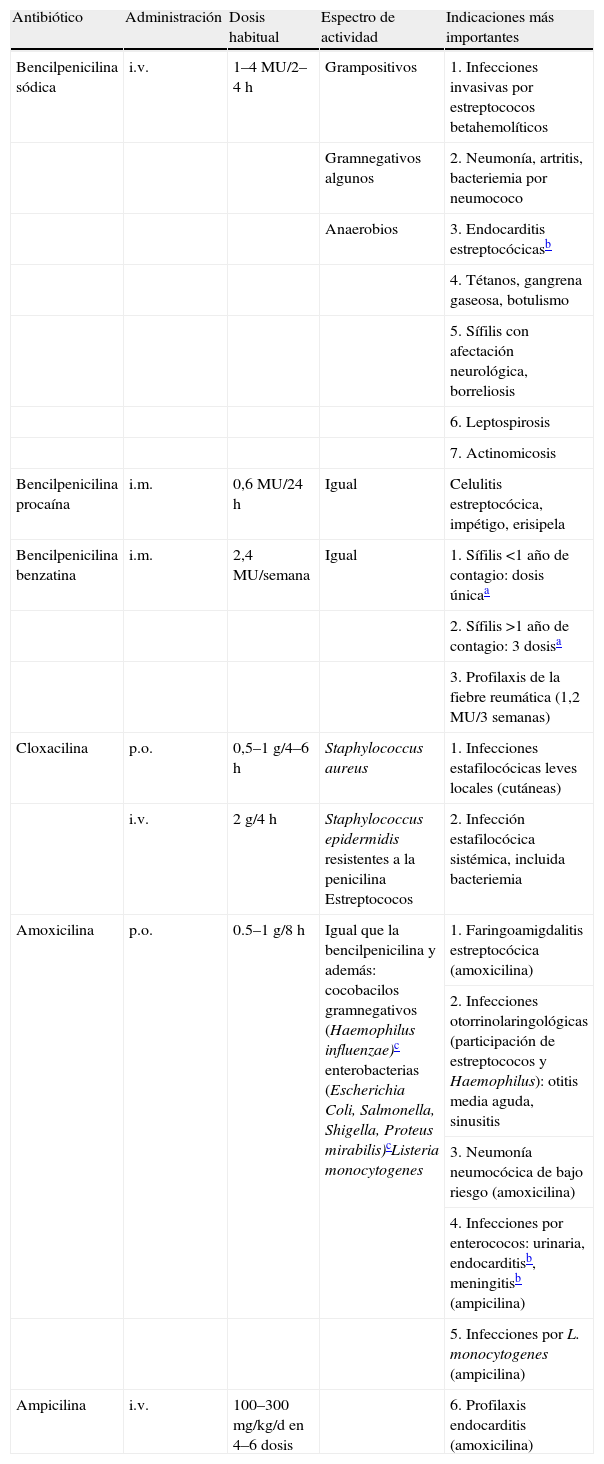
Características y usos de los betalactámicos (i)
| Antibiótico | Administración | Dosis habitual | Espectro de actividad | Indicaciones más importantes |
| Bencilpenicilina sódica | i.v. | 1–4MU/2–4h | Grampositivos | 1. Infecciones invasivas por estreptococos betahemolíticos |
| Gramnegativos algunos | 2. Neumonía, artritis, bacteriemia por neumococo | |||
| Anaerobios | 3. Endocarditis estreptocócicasb | |||
| 4. Tétanos, gangrena gaseosa, botulismo | ||||
| 5. Sífilis con afectación neurológica, borreliosis | ||||
| 6. Leptospirosis | ||||
| 7. Actinomicosis | ||||
| Bencilpenicilina procaína | i.m. | 0,6MU/24h | Igual | Celulitis estreptocócica, impétigo, erisipela |
| Bencilpenicilina benzatina | i.m. | 2,4MU/semana | Igual | 1. Sífilis <1 año de contagio: dosis únicaa |
| 2. Sífilis >1 año de contagio: 3 dosisa | ||||
| 3. Profilaxis de la fiebre reumática (1,2MU/3 semanas) | ||||
| Cloxacilina | p.o. | 0,5–1g/4–6h | Staphylococcus aureus | 1. Infecciones estafilocócicas leves locales (cutáneas) |
| i.v. | 2g/4h | Staphylococcus epidermidis resistentes a la penicilina Estreptococos | 2. Infección estafilocócica sistémica, incluida bacteriemia | |
| Amoxicilina | p.o. | 0.5–1g/8h | Igual que la bencilpenicilina y además: cocobacilos gramnegativos (Haemophilus influenzae)c enterobacterias (Escherichia Coli, Salmonella, Shigella, Proteus mirabilis)cListeria monocytogenes | 1. Faringoamigdalitis estreptocócica (amoxicilina) |
| 2. Infecciones otorrinolaringológicas (participación de estreptococos y Haemophilus): otitis media aguda, sinusitis | ||||
| 3. Neumonía neumocócica de bajo riesgo (amoxicilina) | ||||
| 4. Infecciones por enterococos: urinaria, endocarditisb, meningitisb (ampicilina) | ||||
| 5. Infecciones por L. monocytogenes (ampicilina) | ||||
| Ampicilina | i.v. | 100–300mg/kg/d en 4–6 dosis | 6. Profilaxis endocarditis (amoxicilina) |
i.m.: intramuscular; i.v.: intravenoso; MU: millones de unidades; p.o.: per os (por vía oral).
Características y usos de los betalactámicos (ii)
| Antibiótico | Administración | Dosificación habitual | Espectro de actividad | Indicaciones más importantes |
| Amoxicilina con ácido clavulánico | p.o. | 500–875mg/8h o 2g/12ha | Igual que la amoxicilina y además: | 1. Otitis media (niños) |
| bacterias productoras de betalactamasas | 2. Reagudización de la EPOC y neumonía bacteriana | |||
| i.v. | 1–2g/8h | (Staphylococcus aureus, Klebsiella, Proteus vulgaris; enterobacterias del grupo anterior productoras de betalactamasas) | 3. Infecciones odontógenas | |
| Neisseria gonorrhoeae | 4. Infección del tracto urinario en sujetos sin factores de riesgo para microorganismos resistentesb | |||
| 5. Infecciones intraabdominales, ginecológicas | ||||
| 6. Profilaxis en cirugía | ||||
| 7. Sepsis de la comunidad sin foco aparente | ||||
| Piperacilina-tazobactam | i.v. | 4g/6–8h | Similar a la amoxicilina con ácido clavulánico y además Pseudomonas aeruginosa | 1. Infecciones intraabdominales nosocomiales (peritonitis secundarias) |
| 2. Colangitis tras instrumentación. | ||||
| 3. Infecciones graves de piel y partes blandas | ||||
| 4. Neutropenia febril | ||||
| 5. Neumonía y sepsis nosocomial | ||||
| Cefazolina | i.v./i.m. | 1–2g/8h | Cocos grampositivos | 1. Infecciones sistémicas por S. aureus o Streptococcus pyogenes en alérgicos (alergia no grave) a la penicilina |
| Bacilos gramnegativos: algunos (comunidad) | 2. Profilaxis quirúrgica | |||
| Cefalexina | p.o. | 1–2g/24h | Igual | 1. Infecciones de piel y partes blandas (impétigo, forunculosis, celulitis) |
| 2. Faringitis estreptocócica (alternativa) | ||||
| Cefuroxima axetilo | p.o. | 250–500mg/8–12h | Similar a las de primera generación, pero cubre mejor bacilos gramnegativos (Haemophilus influenzae) | 1. Infecciones del tracto respiratorio (sinusitis, otitis media aguda, epiglotitis, exacerbación de la EPOC) |
| 2. Infecciones urinarias | ||||
| iv | 750mg/8h | 3. Profilaxis quirúrgica |
EPOC: enfermedad pulmonar obstructiva crónica; i.m.: intramuscular; i.v.: intravenoso; p.o.: per os (por vía oral).
Características y usos de los betalactámicos (iii)
| Antibiótico | Administración | Dosificación habitual | Espectro de actividad | Indicaciones más importantes |
| Cefotaxima | i.v. | 1g/6h (máximo 300mg/kg/d) | Respecto a la primera y la segunda generación, menor actividad frente a estafilococos y excelente actividad frente a neumococos | 1. Neumonía comunitaria gravea |
| Mejor actividad frente a gramnegativos | 2. Meningitis bacteriana de la comunidad, absceso cerebral | |||
| 3. Sepsis de la comunidad (sospecha de infección primaria por neumococos) | ||||
| 4. Peritonitis bacteriana espontánea del cirrótico | ||||
| 5. Infección gonocócica | ||||
| Ceftriaxona | i.v./i.m. | 1–2g/24h | 6. Endocarditis estreptocócica | |
| Ceftazidima | i.v. | 2g/8h | Actividad discreta frente a grampositivos | Infecciones documentadas por P. aeruginosa |
| Buena cobertura de Pseudomonas aeruginosa | ||||
| Cefepima | i.v. | 2g/12h | Excelente cobertura grampositivos (no estafilococos) | 1. Neumonía grave de la comunidad con factores de riesgo para P. aeruginosab |
| Excelente cobertura gramnegativos y P. aeruginosab | 2. Tratamiento empírico de la sepsis y la neumonía nosocomial | |||
| 3. Tratamiento empírico de la neutropenia febril | ||||
| Imipenem | i.v. | 500mg/6h | Excelente cobertura grampositivos (no Staphylococcus aureus resistente a la meticilina) | 1. Tratamiento empírico de la neutropenia febril |
| Excelente cobertura gramnegativos, anaerobios y P. aeruginosab | 2. Meningitis por bacilos gramnegativos (meropenem)c | |||
| Ertapenem no cubre P. aeruginosa | 3. Infecciones nosocomiales por microorganismos multirresistentes sensibles a carbapenémicos | |||
| Meropenem | i.v. | 500mg–2g/8h | 4. Infecciones por microorganismos productores de BLEA (sospecha o confirmación) | |
| Ertapenem | i.v./i.m. | 1g/24h | 5. Infecciones graves polimicrobianas | |
| Aztreonam | i.v./i.m. | 1g/8h | Gramnegativos incluida P. aeruginosa | 1. Sepsis nosocomiald |
| No cubre anaerobios ni grampositivos | 2. Infección por bacilos gramnegativos en algunas situaciones especiales: insuficiencia renal, infección urinaria (sin riesgo de microorganismos con BLEE) | |||
| No cubre microorganismos con BLEA | 3. Casos seleccionados de alergia a betalactámicos |
BLEA: betalactamasa de espectro ampliado; BLEE: betalactamasa de espectro extendido; i.m.: intramuscular; i.v.: intravenoso.
- 1.
La amoxicilina es el tratamiento de elección en las infecciones producidas por Streptococcus pyogenes (celulitis, erisipela, impétigo). En infecciones invasivas (sepsis, fascitis) debe utilizarse penicilina G, asociada a clindamicina y gammaglobulinas en caso de acompañarse de síndrome de shock tóxico.
- 2.
La celulitis estafilocócica puede tratarse con una cefalosporina oral de primera generación. En caso de etiología incierta, una buena opción es el tratamiento con amoxicilina con ácido clavulánico, ya que tiene actividad antiestreptocócica y antiestafilocócica.
- 3.
En algunas situaciones concretas, como en el sujeto grave, en las infecciones de origen nosocomial o en sujetos de especial riesgo se puede usar de forma empírica un carbapenémico.
- 1.
La penicilina benzatina intramuscular en dosis única y la amoxicilina oral (500mg/12h; no es preciso administrarla cada 8h en este caso) durante una semana son los tratamientos de elección de la faringitis estreptocócica.
- 2.
La amoxicilina con ácido clavulánico oral (de 500mg/8h a 875mg/8h) es un buen tratamiento empírico de la otitis media aguda (S. pneumoniae, H. influenzae, M. catarrhalis). En caso de confirmarse la etiología neumocócica, la amoxicilina (1g/8h por vía oral) es el mejor betalactámico oral y la ceftriaxona (1g/24h) es la alternativa parenteral más razonable.
- 3.
La amoxicilina con ácido clavulánico oral (de 500mg/8h a 875mg/8h) es un buen tratamiento empírico de los episodios de reagudización de la bronquitis crónica, causada habitualmente por S. pneumoniae y H. influenzae.
- 4.
La amoxicilina oral es un buen tratamiento empírico de la neumonía de bajo riesgo de etiología presumiblemente neumocócica. En los casos de neumonía de alto riesgo que requieren ingreso hospitalario, el betalactámico de elección es la ceftriaxona (o cefotaxima) asociada a un macrólido o a una quinolona. El tratamiento con amoxicilina con ácido clavulánico es preferible en los casos de neumonía por aspiración (que incluiría tanto a sujetos con los factores de riesgo «clásicos» como a muchos de los sujetos con neumonía asociada al sistema sanitario) y en los casos de neumonía en sujetos con enfermedad pulmonar obstructiva crónica (mayor frecuencia de microorganismos productores de betalactamasas). La cefepima es una buena opción si se desea ampliar el espectro a P. aeruginosa.
- 5.
La amoxicilina con ácido clavulánico y el ertapenem son betalactámicos indicados en el tratamiento de la neumonía nosocomial precoz en sujetos intubados (S. aureus, S. pneumoniae, H. influenzae).
- 6.
En el tratamiento empírico de la neumonía nosocomial tardía se emplea generalmente una combinación de antibióticos, en la que suele figurar un betalactámico de amplio espectro con actividad frente a P. aeruginosa, como el imipenem, el meropenem, la piperacilina con tazobactam o la cefepima. En todo caso, la epidemiología local debe determinar la pauta empírica más adecuada, en función del patrón de resistencias local.
- 1.
La penicilina es el antibiótico de elección en la endocarditis causada por estreptococos del grupo viridans, y puede sustituirse por la ceftriaxona. Debe ajustarse la dosis total administrada en función de la CIM del microorganismo. En casos en que la función renal lo permita y no sea preciso un tratamiento prolongado por otro motivo, la utilización simultánea de la gentamicina permite acortar la duración del tratamiento a 2 semanas.
- 2.
La endocarditis enterocócica requiere la administración de ampicilina y gentamicina durante 4 semanas como mínimo. Una buena alternativa es la combinación de ampicilina y ceftriaxona (por ejemplo, en sujetos con función renal alterada que no pueden recibir aminoglucósido).
- 3.
La cloxacilina (con o sin gentamicina al principio) es el tratamiento de elección de la endocarditis estafilocócica producida por cepas sensibles.
- 4.
Las endocarditis causadas por organismos del grupo HACEK (Haemophilus, Actinobacillus, Cardiobacterium, Eikenella y Kingella) se tratan habitualmente con una combinación de ampicilina y gentamicina durante 4 semanas.
- 1.
En la actualidad, la ceftriaxona y la cefotaxima son los antibióticos de elección en el tratamiento, tanto empírico como dirigido, de la mayoría de los sujetos con meningitis bacteriana de la comunidad. Una dosis diaria de 4 g de ceftriaxona (o 12 g de cefotaxima) es adecuada para el tratamiento de la meningitis meningocócica por H. influenzae, Streptococcus agalactiae y S. pneumoniae sensible (CIM⩽0,5μg/ml). Para meningitis producidas por neumococos más resistentes o con sensibilidad no conocida deben emplearse dosis elevadas de cefotaxima (300mg/kg/d). L. monocytogenes es resistente a las cefalosporinas, por lo que, en caso de infección causada por este microorganismo, se debe utilizar ampicilina.
- 2.
El meropenem (2g/8h, intravenoso) es la mejor opción para tratar la meningitis nosocomial por bacilos gramnegativos. Si se usa empíricamente, es más prudente asociarlo a vancomicina para ampliar la cobertura a grampositivos. La asociación de ceftazidima y amikacina por vía sistémica o intraventricular es adecuada para el tratamiento de la meningitis causada por P. aeruginosa sensible.
- 3.
La combinación de la ceftriaxona y el metronidazol es la más utilizada para el tratamiento del absceso cerebral. La cloxacilina (probablemente con rifampicina) es de elección en los abscesos producidos por S. aureus.
- 1.
La cefotaxima (o ceftriaxona) es una buena opción para el tratamiento de la peritonitis bacteriana espontánea del sujeto cirrótico, causada habitualmente por enterobacterias.
- 2.
La peritonitis secundaria es una infección polimicrobiana causada por anaerobios y aerobios facultativos. Por tanto, la monoterapia con amoxicilina con ácido clavulánico es una opción terapéutica muy razonable en los casos de origen comunitario. Otra alternativa es la combinación de la ceftriaxona o el aztreonam con algún antibiótico anaerobicida, como el metronidazol. El ertapenem puede ser útil como tratamiento dirigido de infecciones intraabdominales sin participación de P. aeruginosa.
- 3.
Tanto los carbapenémicos como la piperacilina y el tazobactam se reservan para la peritonitis postoperatoria (nosocomial).
- 4.
La piperacilina con tazobactam es un antibiótico adecuado para la colangitis en sujetos con antecedentes de instrumentación o consumo previo de antibióticos, causada habitualmente por enterobacterias, estreptococos, enterococos y, ocasionalmente, por P. aeruginosa.
- 1.
La cefuroxima axetil y la amoxicilina con ácido clavulánico en pautas cortas (3 días) son buenas opciones terapéuticas en el tratamiento de la cistitis no complicada.
- 2.
El tratamiento definitivo de la pielonefritis aguda debe guiarse por el antibiograma; el uso de las cefalosporinas (cefuroxima axetil y cefixima oral) y de la ceftriaxona (que puede ser incluso una opción de tratamiento domiciliaria si se administra por vía intramuscular) son posibles opciones terapéuticas que implican el uso de betalactámicos. En sujetos con riesgo de infección por microorganismos productores de BLEE es preferible utilizar un carbapenémico o la combinación de amoxicilina y ácido clavulánico con un aminoglucósido. En sujetos con manipulaciones urológicas o riesgo de infección por P. aeruginosa puede administrarse, si la sensibilidad local lo permite, aztreonam combinado con ampicilina.
- 1.
Los betalactámicos son el tratamiento de elección de la artritis séptica estafilocócica (cloxacilina), estreptocócica (penicilina, ceftriaxona) y gonocócica (ceftriaxona). Asimismo, ha sido clásicamente el tratamiento de elección de la osteomielitis estafilocócica, aunque en la actualidad hay mejores alternativas por vía oral.
- 2.
La fase inicial del tratamiento de la osteomielitis por P. aeruginosa se puede realizar con un betalactámico antipseudomónico, como la ceftazidima.
Los sujetos de la comunidad con sepsis sin un foco evidente deben recibir un tratamiento empírico de las infecciones más habituales, incluidas las causadas por enterobacterias, neumococos y S. aureus sensible a la meticilina. Para esto, una muy buena opción es el tratamiento con amoxicilina con ácido clavulánico, que cubre razonablemente todas las posibilidades. En sepsis graves se puede valorar añadir un aminoglucósido.
En los sujetos con sepsis nosocomial el tratamiento empírico debe abarcar, además de lo anterior, P. aeruginosa, estafilococos resistentes a meticilina (en especial en presencia de catéteres) y otras bacterias multirresistentes, según la epidemiología local. La mayoría de las pautas incluyen un betalactámico con actividad antipseudomónica (como la piperacilina con tazobactam o imipenem) asociado a un aminoglucósido y, en ocasiones, a vancomicina.
Neutropenia febrilLos betalactámicos son un componente fundamental del tratamiento empírico de los sujetos con neutropenia febril. La pauta estándar consiste en la asociación de un betalactámico con actividad antigrampositiva y antipseudomónica (cefepima, piperacilina con tazobactam o carbapenémico) y un aminoglucósido, aunque también se pueden utilizar betalactámicos de amplio espectro en monoterapia (piperacilina con tazobactam, ceftazidima, imipenem).
Efectos adversos- 1.
Efectos adversos que no se relacionan con hipersensibilidad. Los betalactámicos son fármacos en general bien tolerados, ya que ejercen su acción sobre un sustrato que no comparte con las células eucariotas, por lo que generan poca toxicidad directa. Tienen cierta acción irritativa sobre el lugar de administración y pueden causar gastritis si se administran por vía digestiva, dolor con la inyección intramuscular (típico de los preparados inyectables de bencilpenicilina) o flebitis (característico de algunos betalactámicos, como la cloxacilina). Otro efecto secundario habitual es la disbacteriosis, consistente en la colonización y superinfección por parte de bacterias endógenas resistentes u hongos, que se puede manifestar en forma de trastornos digestivos (diarrea, flatulencia) o vaginales (candidiasis vaginal). Los trastornos disbacterióticos están en relación directa con la amplitud del espectro antibiótico, con la dosis y con la concentración del antibiótico en las mucosas y en la piel. Pueden aparecer convulsiones y crisis mioclónicas si se utilizan dosis elevadas, especialmente en sujetos con alteración de la función renal. El imipenem disminuye, además, el umbral epileptógeno, por lo que es preferible evitarlo en sujetos con antecedentes o factores de riesgo de crisis convulsionantes. Se pueden producir trastornos hematológicos reversibles (citopenias) y hepáticos (colostasis).
- 2.
Efectos adversos por hipersensibilidad49–51. La penicilina es el fármaco que más frecuentemente causa fenómenos de alergia, y este antecedente está presente en hasta el 10% de los sujetos hospitalizados. Es preciso tener en cuenta que sólo el 10% de los sujetos con historia de alergia a la penicilina tienen reacciones alérgicas cuando se vuelven a exponer a la misma, ya que hay una pérdida de inmunogenicidad con el tiempo. Las manifestaciones alérgicas frente a la penicilina se pueden clasificar, en función del mecanismo y de la cronología en:
- a)
Reacciones mediadas por la inmunoglobulina E (IgE), que suelen ser inmediatas (por lo general, en los primeros 15min), pero que hasta en el 5% de los casos se pueden presentar entre una y 72h tras la administración del fármaco (formas aceleradas). Este tipo de reacción alérgica se puede manifestar como urticaria, rubor brusco intenso o prurito (y no otros tipos de lesiones cutáneas), angioedema, edema laríngeo, hipotensión, arritmia cardíaca o cualquier combinación de los anteriores. La anafilaxia implica la presencia de reacción alérgica grave con 2 o más órganos afectados, y su incidencia es de uno cada 5.000 a 10.000 tratamientos en el caso de la penicilina. Hay que tener en cuenta que las reacciones cutáneas más frecuentes tras la administración de penicilina (exantema morbiliforme, exantema tras la administración de aminopenicilinas en infecciones víricas y otros) no están mediadas por la IgE. En cambio, un sujeto con urticaria puede evolucionar potencialmente hacia una reacción anafiláctica grave. Este tipo de reacción precisa sensibilización (exposición) previa al fármaco. Tras la sensibilización, una exposición al fármaco causante provoca manifestaciones clínicas mucho más rápido (de minutos a horas). La posibilidad de presentar este tipo de reacción alérgica es la que se detecta mediante las pruebas de sensibilidad cutánea, que determinan la presencia de anticuerpos anti-IgE.
- b)
Reacciones mediadas por otros mecanismos. Se presentan a partir de las 72h de la administración del fármaco y pueden estar mediadas por anticuerpos (hemólisis, citopenias, nefritis intersticial), inmunocomplejos (la clásica enfermedad del suero), reacción de sensibilidad retardada mediada por linfocitos T (exantemas no urticariformes) o mecanismos desconocidos (eritema multiforme, eritema fijo medicamentoso, infiltrados pulmonares, eosinofilia, fiebre medicamentosa, síndrome de Stevens-Johnson y síndrome de hipersensibilidad). Este tipo de reacciones no se pueden prever con la realización de pruebas de sensibilidad cutánea.
- a)
Los sujetos con alergia a la penicilina pueden tener reacciones cruzadas con otros betalactámicos, como las cefalosporinas (en general, aproximadamente del 3 al 4% de los expuestos a las cefalosporinas tiene alergia y del 4 al 10% entre los alérgicos a las penicilinas; la reacción cruzada con cefalosporinas de primera generación es mayor) o los carbapenémicos (el 3% en expuestos en general y el 11% en sujetos alérgicos a la penicilina). El aztreonam es bien tolerado por los sujetos alérgicos a betalactámicos.
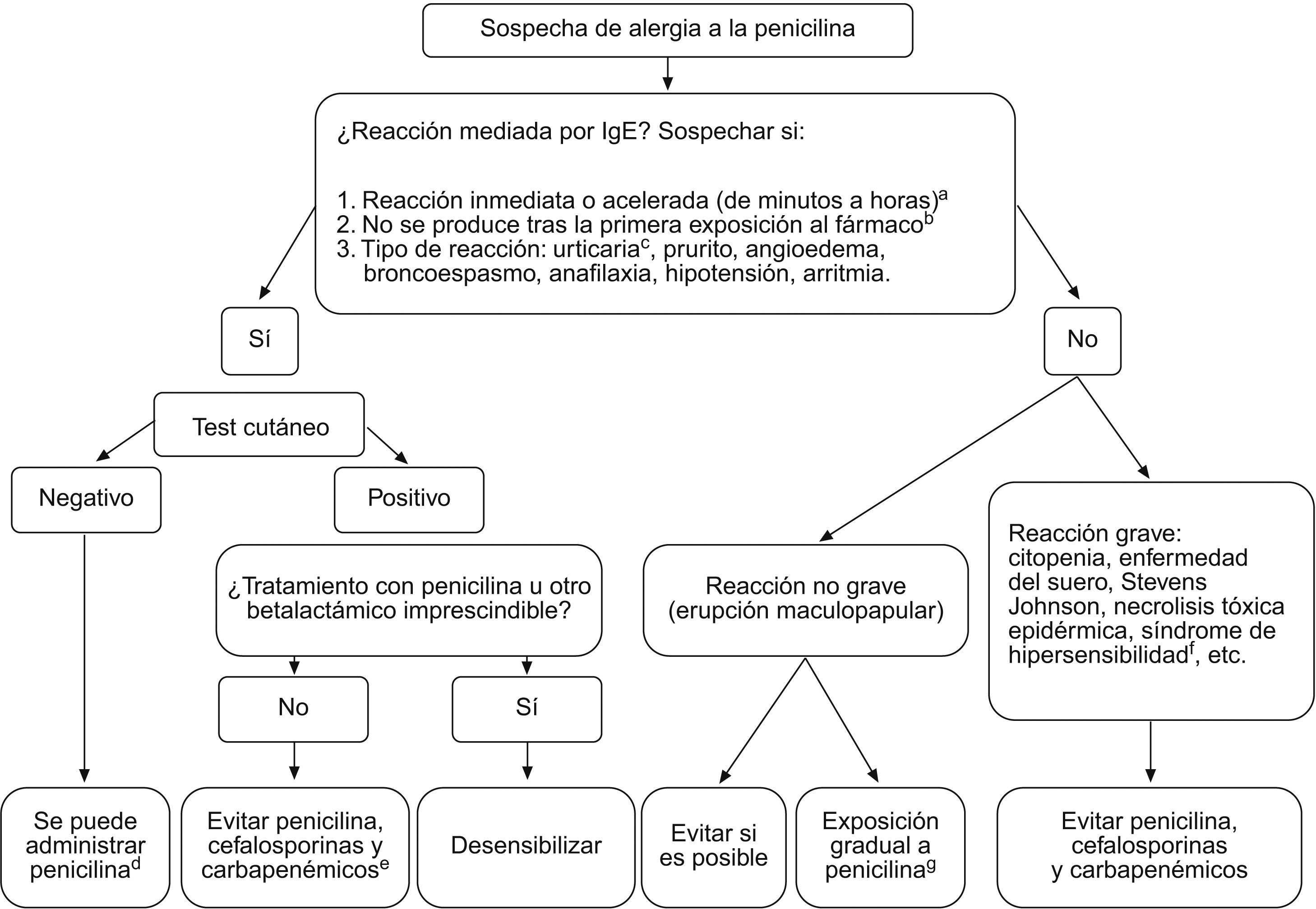
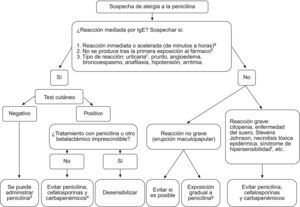
En sujetos con historia clara de alergia de cualquier tipo a betalactámicos, lo más recomendable es evitar el tratamiento con estos fármacos. En los casos (confirmados o sospechosos) de reacción mediada por la IgE, cuando sea necesario administrar un betalactámico (o antes, en previsión de que pueda serlo), está indicado realizar una prueba de sensibilidad cutánea para confirmar el diagnóstico. Un test negativo indica que la reacción que presentó el sujeto no fue mediada por la IgE o que no hay anticuerpos anti-IgE presentes, por lo que es seguro administrar la penicilina nuevamente. Si se realiza con los alérgenos adecuados, el test cutáneo tiene un valor predictivo negativo muy elevado; sujetos con historia bien documentada de alergia a la penicilina y un test cutáneo negativo tienen una probabilidad de presentar algún tipo de reacción tras la administración de la misma penicilina en hasta el 9% de los casos, de los que únicamente el 1% corresponde a reacciones mediadas por la IgE que, por tanto, pueden desembocar en reacción anafiláctica grave. No se ha documentado ningún caso de reacción alérgica grave a otras penicilinas diferentes de la testada en sujetos con test cutáneo negativo. Si el test es positivo y el tratamiento con betalactámicos es inevitable, estaría indicado realizar desensibilización con dosis ascendentes de penicilina (en medio hospitalario, tras el consentimiento informado del sujeto, con la monitorización hemodinámica pertinente y a cargo de un equipo médico entrenado). Con este procedimiento se pueden producir fenómenos alérgicos (hasta en un tercio de los sujetos), pero la anafilaxia es excepcional y es efectivo en el 75% de los casos. Es preciso repetirlo cada vez que se requiera el uso del antibiótico y no influye en las reacciones alérgicas no mediadas por la IgE. Si no se puede hacer desensibilización, hay que evitar el uso de betalactámicos. La conducta que se debe seguir en casos o confirmación de alergia a betalactámicos se resume en la figura 7.
Actitud que se debe seguir en casos de alergia a betalactámicos (adaptado de Gruchalla et al). aLas reacciones retrasadas (de días a semanas), sugieren en general otros mecanismos. bLas reacciones mediadas por IgE precisan de sensibilización (exposición) previa. cLos exantemas no urticariformes (maculopapulares, eccematosos, bullosos, pustulosos…) son reacciones no medidas por IgE. dRiesgo de reacción grave, aún con antecedente por historia clínica, similar al de la población general (ver texto). eEn alérgicos a la penicilina se puede administrar aztreonam. fTipo de reacción grave no mediada por IgE, consistente en fiebre, alteraciones hematológicas con eosinofilia, rash, linfadenopatía. Aunque no es habitual, se puede asociar al uso de antibióticos. gAdministrar dosis ascendentes de penicilina y valorar en función de la evolución: la aparición de lesiones cutáneas graves, como bullosas, extensas o con afectación de mucosas requieren retirar el fármaco; si se presentan reacciones leves se pueden tratar con antihistamínicos o corticoides. La desensibilización no tiene sentido en reacciones no mediadas por IgE.
Nota: Sección acreditada por el SEAFORMEC con 10,1 créditos. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.