La relevancia clínica de la bacteriemia y de la endocarditis por Staphylococcus aureus resistente a la meticilina (SARM) es enorme. El incremento en la incidencia de bacteriemia y endocarditis por SARM está en relación con el uso creciente de catéteres y la realización de manipulaciones vasculares. Los antibióticos glucopéptidos han sido los fármacos de referencia para el tratamiento de estas infecciones, pero desgraciadamente su actividad no es del todo satisfactoria, especialmente frente a cepas de SARM con CMI a la vancomicina >1μg/ml. La aparición de otros antibióticos, como el linezolid y la daptomicina, y en el futuro de otros compuestos, como la dalvabancina, el ceftobiprole o la telavancina, pueden cambiar las expectativas en este campo.
El principal objetivo de este documento de consenso es elaborar una serie de recomendaciones para mejorar el tratamiento de la bacteriemia y de la endocarditis por SARM, a partir de las últimas evidencias científicas publicadas. El documento analiza de forma específica la actuación frente a 3 situaciones clínicas: la bacteriemia de catéter, la bacteriemia persistente y la endocarditis infecciosa por SARM.
Bacteremia and endocarditis due to methicillin-resistant Staphylococcus aureus (MRSA) are prevalent and clinically important. The rise in MRSA bacteremia and endocarditis is related with the increasing use of venous catheters and other vascular procedures. Glycopeptides have been the reference drugs for treating these infections. Unfortunately their activity is not completely satisfactory, particularly against MRSA strains with MICs >1μg/mL. The development of new antibiotics, such as linezolid and daptomycin, and the promise of future compounds (dalvabancin, ceftobiprole and telavancin) may change the expectatives in this field.The principal aim of this consensus document was to formulate several recommendations to improve the outcome of MRSA bacteremia and endocarditis, based on the latest reported scientific evidence. This document specifically analyzes the approach for three clinical situations: venous catheter-related bacteremia, persistent bacteremia, and infective endocarditis due to MRSA.
La infección por Staphylococcus aureus resistente a la meticilina (SARM) se ha diseminado de forma epidémica. Más del 25% de las cepas de S. aureus aisladas en hospitales españoles son SARM1. Estas cepas de SARM presentan un perfil de resistencia que también incluye otros antimicrobianos, esencialmente quinolonas, macrólidos y, en menor grado, aminoglucósidos, lo que dificulta el tratamiento de las infecciones producidas por SARM.
Según datos del esdudio EPINE (Estudio de Prevalencia de Infecciones Nosocomiales en Hospitales Españoles)2, S. aureus ocupa el tercer lugar en orden de frecuencia entre los microorganismos aislados en episodios de bacteriemia, y se ha observado un aumento progresivo de las cepas de SARM. Es posible que el problema se incremente, como está sucediendo en Estados Unidos3, cuando nuevas cepas de SARM comunitarias infecten a pacientes hospitalizados, produciendo así una inversión del flujo tradicional de la infección desde la comunidad al hospital, y no a la inversa, como suele ocurrir con otros microorganismos4.
La bacteriemia por SARM es un problema especialmente importante por la elevada mortalidad que condiciona. En un estudio reciente, realizado en 9 áreas diferentes de Estados Unidos que recogió a casi 9 mil casos de infección invasora por SARM, la bacteriemia fue la situación clínica más frecuente (75% de los casos), seguida por la endocarditis (10%)4. La mayoría de los casos de bacteriemia por SARM fueron de adquisición puramente nosocomial (26,6%), pero un 58,4% de los casos fue de adquisición aparentemente comunitaria en pacientes que habían tenido contacto previo con el ámbito sociosanitario.
La relevancia clínica de la bacteriemia y de la endocarditis por SARM es enorme. La mortalidad actual relacionada con infecciones graves por SARM (incluida la bacteriemia y la endocarditis) en hospitales americanos es superior a la debida al sida4. Junto al incremento en la incidencia de bacteriemia y endocarditis por SAMR, que en general está en relación con el uso creciente de catéteres y la realización de manipulaciones vasculares, se añade el hecho de que hasta hace poco no disponíamos de alternativas terapéuticas a los antibióticos glucopéptidos, que han sido los fármacos de referencia para el tratamiento de estas infecciones. Este hecho ha dado lugar a una sensación de agotamiento de las opciones terapéuticas disponibles. Afortunadamente, la aparición de otros antibióticos, como el linezolid y la daptomicina, y en el futuro de otros compuestos como la dalvabancina, el ceftobiprole, la telavancina y la oritavancina, pueden cambiar las expectativas en este campo.Desde que se redactara la última guía clínica de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) para el diagnóstico y el tratamiento del paciente con bacteriemia5, la Agencia Europea del Medicamento (EMEA) ha aceptado la indicación del tratamiento con daptomicina en adultos con bacteriemia y endocarditis derecha por S. aureus. Esta guía no menciona esta nueva opción terapéutica y tampoco profundiza en el tratamiento de la infección bacteriémica y de la endocarditis por SARM, ni menciona las limitaciones del tratamiento con vancomicina. Por otro lado, las últimas recomendaciones de la SEIMC relacionados con el tratamiento de pacientes con infecciones por patógenos grampositivos y con bacteriemia no recogen tampoco estas nuevas opciones terapéuticas6.
Objetivos, definiciones y metodología utilizadaEl principal objetivo de este documento de consenso es elaborar una serie de recomendaciones para mejorar el tratamiento de la bacteriemia y de la endocarditis por SARM, a partir de las últimas evidencias científicas publicadas.
Para orientar la estrategia diagnóstica y terapéutica inicial más adecuada en un paciente con bacteriemia por SARM, es muy importante atender a su posible foco de origen. En un elevado porcentaje de casos la bacteriemia por SARM tienen su origen en un catéter intravascular. Con menor frecuencia, el origen probable de la bacteriemia no se puede establecer inicialmente, ya que el paciente no presenta signos ni síntomas de infección localizada, ni es portador de catéteres intravasculares. Esta situación clínica suele denominarse bacteriemia primaria y es habitual que en días sucesivos la propia evolución clínica o las exploraciones complementarias permitan establecer el diagnóstico definitivo.
En otros casos, la bacteriemia es consecuencia de una infección estafilocócica localizada, evidente ya desde el inicio. Este bacteriemia, denominada secundaria, es frecuente en el contexto de determinadas infecciones estafilocócicas, como la artritis séptica, la osteomielitis, la celulitis y la neumonía, entre otras, habida cuenta de la facilidad de S. aureus para invadir el torrente sanguíneo. En cualquiera de estas 3 situaciones, después de la instauración de un tratamiento adecuado, los hemocultivos pueden negativizarse o pueden continuar siendo persistentemente positivos. La bacteriemia persistente con frecuencia expresa la existencia de una endocarditis o de otras infecciones metastásicas ocultas. La propia endocarditis, paradigma de la infección estafilocócica bacteriémica, puede desarrollarse a partir de una bacteriemia de catéter, puede presentarse inicialmente como una bacteriemia primaria o puede manifestarse ya de entrada con un cuadro clínico muy indicativo o característico.
En este documento de consenso se analizará específicamente la actuación frente a 3 situaciones clínicas: la bacteriemia de catéter, la bacteriemia persistente y la endocarditis infecciosa (EI) por SARM. Por el contrario, no se abordará el tratamiento de la bacteriemia secundaria a las diferentes localizaciones de la infección por SARM, donde lo más importante es el tratamiento del foco original, por considerar que este aspecto no responde a los objetivos del documento.
El documento se ha elaborado siguiendo las normativas de elaboración de los documentos de consenso SEIMC (http://www.seimc.org). Todos los expertos son socios de la SEIMC y sus recomendaciones se graduaron según los grados de evidencia científica7 (ver Anexo 1). Los autores y los coordinadores han consensuado el contenido y las conclusiones del documento.
Diagnóstico microbiológicoLa administración temprana de antimicrobianos en el paciente con sepsis contribuye a un pronóstico mejor8; por ello, es crucial la detección rápida del agente causal de la bacteriemia. Los hemocultivos siguen siendo el método de referencia para el diagnóstico microbiológico de la bacteriemia por SARM, pero no permiten disponer de la identificación y la sensibilidad del microorganismo antes de 24–48h. Este tiempo se puede acortar mediante el subcultivo de hemocultivos en los que se detecte presencia de cocos grampositivos en racimos, en medios cromogénicos selectivos para SARM9 (A-II). Otra forma de diagnóstico rápido consiste en aplicar a estos frascos técnicas de biología molecular en tiempo real (PCR-TR). Hay incluso sistemas comerciales que simplifican notablemente el proceso técnico con valores de sensibilidad y especificidad cercanos al 100%10 (A-II). Actualmente, hay la posibilidad de aplicar métodos moleculares directamente a la sangre (3ml en K-EDTA) de pacientes con sepsis clínica. El tiempo requerido para obtener una identificación bacteriana desde el momento de extracción es de menos de 6 h11. La sensibilidad de la técnica disminuye en pacientes con bacteriemia paucibacilar y no incluye la detección de genes de resistencia y, por tanto, no puede sustituir a los hemocultivos convencionales12.
El cultivo bacteriológico de la válvula cardíaca resecada durante la cirugía es, en ocasiones, difícil de interpretar, ya que la manipulación de la muestra puede contaminarla. La amplificación por PCR-TR directamente del tejido valvular, utilizando iniciadores universales que amplifican una región del 16S ARNr, seguida de la secuenciación de ésta, ha demostrado ser una técnica diagnóstica más sensible y específica que los cultivos convencionales de sangre o tejido valvular13 (A-II). Sin embargo, los resultados derivados de la PCR-TR se han de valorar con precaución en el seguimiento de un paciente con historia reciente de endocarditis. En estos pacientes, pueden persistir restos de ADN bacteriano en el tejido valvular durante cierto tiempo tras la resolución del cuadro agudo, sin que ello implique necesariamente la presencia de bacterias viables. En resumen, las técnicas moleculares son un complemento a los hemocultivos, aunque su utilidad ha de evaluarse en pacientes con sepsis (C-III).
Importancia de la concentración mínima inhibitoria de la vancomicinaEntre los aislados de S. aureus, se pueden presentar diferentes grados de resistencia o de sensibilidad disminuida a la vancomicina: a) S. aureus resistente a la vancomicina (VRSA), con concentración mínima inhibitoria (CMI)⩾16mg/l; b) S. aureus con resistencia intermedia a la vancomicina (SARIV), con CMI entre 4 y 8mg/l; c) S. aureus con heterorresistencia a la vancomicina, con CMI entre 2 y 8mg/l; d) cepas de S. aureus sensibles a la vancomicina, pero con una CMI en el límite superior del rango de sensibilidad (CMI=2mg/l), y e) cepas de de S. aureus con tolerancia a la actividad bactericida de la vancomicina, generalmente debida a alteraciones en algunos mecanismos de regulación y de autólisis. Recientemente, se ha observado una emergencia de aislados de SARM con sensibilidad intermedia y/o heterorresistencia a la vancomicina, así como un aumento de cepas de SARM con sensibilidad reducida a la vancomicina, es decir, cepas sensibles pero con CMI en el límite superior del rango de sensibilidad14–17. En España, no son infrecuentes los aislados de SARM con CMI de 1–2mg/l18. En el último estudio nacional de prevalencia realizado en 2006, todos los aislados de SARM fueron sensibles a la vancomicina: 6 cepas (4,4%) presentaron CMI de 2mg/l (2 de las cuales procedían de hemocultivos), mientras que la CMI fue⩽1mg/l frente al 95,6% de los aislados de SARM19. Se ha demostrado que hay una tasa elevada de fracasos terapéuticos con vancomicina cuando la CMI oscila entre 4 y 8mg/l20, pero también se ha observado que hay una reducción en la eficacia de vancomicina frente a aislados de SARM con CMI de vancomicina de 1–2mg/l21–24, lo que indica que pequeños cambios en la CMI pueden explicar fracasos clínicos, incluso dentro del rango de CMI definido como “sensible”. Recientemente, se ha demostrado que la mortalidad asociada a la bacteriemia por SARM es superior cuando se utiliza vancomicina empíricamente en el tratamiento de infecciones por cepas con una CMI de vancomicina de 2mg/l25.
El aumento de la CMI de vancomicina tiene consecuencias importantes en la eficacia de este antibiótico y en la mortalidad en pacientes con bacteriemia por SARM. Por tanto, es necesario determinar la CMI de vancomicina y considerar a este antibiótico como un posible tratamiento subóptimo en aislados de SARM con CMI de vancomicina >1mg/l (A-II). Hay discrepancias entre los resultados obtenidos por diferentes métodos para la determinación de la CMI de vancomicina (microdilución y E-test, microdilución y sistema automatizado Vitek); por tanto, se debe utilizar siempre el método de referencia (microdilución en caldo) para determinar la CMI (C-III)26,27.
Seguimiento de la resistenciaS. aureus tiene una capacidad extraordinaria para desarrollar resistencia a los antimicrobianos. El incremento y la diseminación de cepas de SARM, no sólo en el medio hospitalario, sino también en otros centros de atención y cuidados sanitarios, la reciente emergencia de SARM comunitario, la comunicación de infecciones causadas por cepas de SARM con sensibilidad disminuida o con resistencia a los glucopéptidos y la variación en los patrones de resistencia a otros antibióticos, son algunos de los factores preocupantes en cuanto al control y el tratamiento de la infección por SARM28–31. En este contexto, se deben realizar estudios de vigilancia para evaluar la evolución de la resistencia de S. aureus a la meticilina y a otros antimicrobianos, incluidos glucopéptidos, daptomicina y linezolid, no solamente en unidades u hospitales concretos, o en aislados procedentes de determinados tipos de pacientes o síndromes clínicos, sino también en el ámbito nacional para conocer la situación global en un momento dado en las diferentes áreas geográficas (A-I). Desde 1986 se han realizado este tipo de estudios multicéntricos en España y, recientemente, se han publicado los datos correspondientes al año 2006, en el que la prevalencia de SARM fue del 29,2%19.
Asimismo, es recomendable comprobar la evolución de la sensibilidad antibiótica de los aislamientos sucesivos, ya que se ha documentado la selección de mutantes resistentes a diferentes antibióticos, como rifampicina, linezolid y daptomicina, entre otros, durante su administración terapéutica, así como el incremento de la CMI de vancomicina en pacientes con consumo previo de este antibiótico. Además, se ha descrito la aparición de resistencia a la daptomicina durante el tratamiento prolongado con glucopéptidos32–34.
Dado que el mecanismo de acción de la daptomicina es único, en principio no hay resistencia cruzada entre éste y otros antimicrobianos. Sin embargo, algunos estudios han demostrado que cepas de S. aureus con sensibilidad reducida a la vancomicina (CMI de 4–16mg/l) también presentan sensibilidad reducida a la daptomicina35. En los escasos aislados frente a los que la CMI de vancomicina es de 4–16mg/l, la CMI de daptomicina es ⩾2mg/l, es decir, no sería sensible. Sin embargo, la resistencia a la vancomicina mediada por vanA no afecta a la sensibilidad a la daptomicina. Por tanto, cuando haya documentación de una sensibilidad reducida a la vancomicina, se debe tomar precauciones antes de utilizar la daptomicina para el tratamiento de infecciones por S. aureus. En estos casos, se debe determinar la sensibilidad a la daptomicina del aislado de S. aureus, bien por microdilución en caldo, bien mediante E-test antes de iniciar el tratamiento con daptomicina (A-II).
Bacteriemia asociada al uso de los catéteres vascularesRetirada o mantenimiento del catéterLas recomendaciones sobre la retirada o el mantenimiento de los catéteres vasculares causantes de bacteriemia por S. aureus son las mismas, independientemente de cuál sea la sensibilidad del microorganismo a la meticilina36,37.
La detección de una bacteriemia por S. aureus, incluido SARM, en un paciente portador de un catéter vascular de cualquier tipo, asociado a la existencia de signos inflamatorios en el lugar de su inserción, obliga a su retirada inmediata (A-II). En 3 estudios prospectivos observacionales, se ha comprobado que la retirada de un catéter venoso central (CVC) en las bacteriemias relacionadas con este tipo de catéteres (incluidos los casos que no presentan complicaciones), se asocia con una respuesta clínica más rápida y con una tasa inferior de recidivas38–40.
El mantenimiento de un catéter vascular tunelizado (tipo Hickman®) o de un catéter de inserción quirúrgica (tipo Port-a-cath®) causantes de una bacteriemia por SARM únicamente ha de valorarse cuando no hay signos de infección en el túnel, el lugar de la inserción o la incisión quirúrgica, el paciente está estable hemodinámicamente y no hay sospecha de complicaciones metastásicas a distancia38,41. En estas circunstancias puede considerarse realizar un tratamiento conservador mediante la utilización de tratamiento antibiótico local (con la técnica del sellado antimicrobiano) y sistémico36,37. Sin embargo, en diferentes estudios no aleatorizados, se ha observado una tasa de fracasos superior al 50% en casos de tratamiento conservador en pacientes con catéteres tunelizados y bacteriemia asociada por S. aureus42–47. En los pacientes portadores de un CVC para diálisis con bacteriemia por S. aureus, el mantenimiento del catéter y la infección por una cepa de SARM son factores de riesgo independientes para el desarrollo de complicaciones48. Por lo tanto, esta estrategia de tratamiento conservador únicamente debería aplicarse a pacientes muy seleccionados (A-II).
Tratamiento antibiótico inicialEn un paciente portador de catéteres vasculares con hemocultivos positivos a cocos grampositivos, ha de valorarse el inicio de una pauta de tratamiento antibiótico sistémico con un glucopéptido, bien vancomicina a dosis de 30mg/kg de peso/día, bien teicoplanina a dosis de 6mg/kg de peso/día (administrando 2 dosis durante el primer día), que ofrece una cobertura amplia para estafilococos, tanto sensibles como resistentes a la meticilina36,37. En 2 estudios aleatorizados49,50, en los que se incluía a pacientes con cáncer portadores de CVC tunelizados, la respuesta clínica y microbiológica fue similar con ambos glucopéptidos (A-I). Recientemente34, se ha demostrado que la daptomicina, a dosis de 6mg/kg de peso/día, tiene una eficacia similar a la vancomicina, a las dosis estándar, para el tratamiento de la bacteriemia por SARM, incluidas las relacionadas con los catéteres vasculares (A-I). En un estudio en fase II, la dalvabancina fue igual de eficaz que la vancomicina en la baceriemia por grampositivos relacionada con catéteres vasculares, pero este estudio sólo incluyó a 5 pacientes con bacteriemia por SARM51. Este fármaco todavía no se ha aprobado para su uso y se encuentra en fase de desarrollo clínico.
Tratamiento antibiótico definitivoLa sensibilidad a la vancomicina de SARM es un factor importante en el pronóstico de la bacteriemia15,25 y debe tenerse en cuenta junto con la respuesta clínica. En los pacientes sin fiebre y con situación clínica estable transcurridas las primeras 24–48h tras el inicio del tratamiento antibiótico y la retirada del catéter, podría recomendarse continuar el tratamiento inicial con glucopéptidos, independientemente de la CIM a estos fármacos de la cepa aislada, siempre que se halle en el rango de la sensibilidad (C-III). En caso de que la respuesta clínica inicial favorable no sea tan clara, aunque no hay estudios controlados, parece razonable utilizar antibióticos alternativos a los glucopéptidos en la bacteriemia de catéter causada por cepas de SARM con sensibilidad reducida a la vancomicina (CIM >1mg/l). A la luz de la información disponible, la daptomicina y el linezolid son los candidatos principales a considerar. La daptomicina es un nuevo antibiótico que destaca por su actividad rápidamente bactericida frente a SARM. Los estudios realizados hasta el momento han documentado su eficacia en el tratamiento de infecciones graves de la piel, las partes blandas y en la bacteriemia. En un estudio amplio, prospectivo y aleatorizado de bacteriemia por S. aureus, daptomicina demostró una eficacia similar a cloxacilina en los episodios de bacteriemia debidos a S. aureus sensibles a la meticilina (SASM) y a la vancomicina en los episodios debidos a SARM34. En el subgrupo de pacientes con bacteriemia de catéter no complicada, se obtuvieron buenos resultados con la dosis actualmente recomendada, que es de 6mg/kg de peso/día.
Linezolid es un antibiótico bacteriostático que destaca por tener una biodisponibilidad oral del 100%, amplia difusión a tejidos incluidas áreas mal vascularizadas y una buena actividad frente a SARM. Los estudios realizados han probado su eficacia en neumonía, bacteriemia e infecciones graves de la piel y las partes blandas. Un metaanálisis de 5 estudios aleatorizados y controlados en pacientes con bacteriemia por SARM demostró que linezolid tuvo una eficacia similar, pero no superior, a vancomicina52 (B-II). En otro metaanálisis más reciente53 se indica que el linezolid tiene una eficacia superior a los glucopéptidos o a los betalactámicos en el tratamiento de la bacteriemia por cocos grampositivos. Sin embargo, debido al diseño de los estudios incluidos en el metaanálisis, no es posible conocer la información acerca de los diferentes patógenos o de los focos de infección de la bacteriemia, por lo que los propios autores señalan que no se puede alcanzar ninguna conclusión definitiva acerca de la eficacia del linezolid en comparación con glucopéptidos o betalactámicos para el tratamiento de los pacientes con bacteriemia por S. aureus (BII). Recientemente, las agencias reguladoras del uso de fármacos de Europa (EMEA) y de Estados Unidos (Food and Drug Administration) han emitido una advertencia en relación con el uso de linezolid en las bacteriemias relacionadas con los catéteres vasculares. Esta recomendación se desprende de los resultados obtenidos en un ensayo clínico con 726 pacientes, en los que se observó una mortalidad mayor en pacientes con bacteriemia por gramnegativos cuando en el hemocultivo crecía también un grampositivo (flora mixta) o cuando los cultivos eran inicialmente negativos54. En España, las autoridades sanitarias han emitido un informe con estas recomendaciones, limitando el uso de linezolid al tratamiento de la bacteriemia monomicrobiana producida por cocos grampositivos sensibles a este fármaco.
Duración del tratamiento antibióticoLa duración óptima del tratamiento antibiótico en la bacteriemia no complicada por S. aureus originada en un catéter vascular no está bien definida por estudios controlados. En un estudio metaanalítico, se comprobó que, tras la administración de 10–14 días de tratamiento antibiótico sistémico, la tasa de recidivas era únicamente del 6,1%55. No hay información disponible en la bibliografía sobre esta actitud en casos de bacteriemia causada por cepas de SARM. Sin embargo, la experiencia derivada de un ensayo clínico controlado50 hace aconsejable una duración similar del tratamiento antibiótico sistémico en estas situaciones (B-III), siempre que el catéter origen de la bacteriemia se haya retirado y no se trate de una bacteriemia complicada. El tratamiento secuencial por vía oral, con fármacos como el linezolid, podría plantearse en pacientes en situación clínica estable, sin complicaciones metastásicas y con hemocultivos negativos tras el inicio del tratamiento antibiótico y la retirada del catéter vascular (C-III).
La práctica sistemática de una ecocardiografía transesofágica (ETE) a todos los pacientes con bacteriemia por S. aureus originada en un catéter vascular, para evaluar la duración del tratamiento antibiótico sistémico, es un tema no resuelto56 (B-II). La ausencia de riesgo valvular cardíaco (valvulopatía conocida o detectada en el momento de la bacteriemia), así como la respuesta clínica y microbiológica en un período inferior a las 72h tras la retirada del catéter y el inicio de un tratamiento antibiótico adecuado, proporcionan unas tasas de buena evolución, con ausencia de recidivas o complicaciones, en más del 95% de los pacientes tras un tratamiento de 10–14 días57 (B-II).
Uno de los factores predictivos más importantes de bacteriemia complicada por S. aureus es la persistencia de la bacteriemia tras la retirada del catéter58,59. Las estrategias de tratamiento de la bacteriemia persistente se abordan en el apartado siguiente. En estas circunstancias, es necesario realizar una ETE para descartar la existencia de una endocarditis59. La duración del tratamiento antibiótico ha de adaptarse a los hallazgos de esta exploración (AII). Asimismo, la tromboflebitis séptica de las venas centrales puede producir un cuadro clínico similar a la EI. La ausencia de hallazgos ecocardiográficos indicativos de la existencia de una endocarditis obliga a realizar un estudio por ultrasonografía de los troncos vasculares, donde se haya insertado el catéter vascular origen de la bacteriemia, y a alargar la duración del tratamiento antibiótico.
Bacteriemia persistente por SARMConcepto e implicaciones clínicasEn los pacientes con bacteriemia por S. aureus, tanto sensible como resistente a la meticilina, la persistencia de hemocultivos positivos a pesar de haber instaurado un tratamiento antibiótico adecuado es un hecho relativamente frecuente, especialmente si se compara con la bacteriemia causada por otros microorganismos. Aunque no hay un consenso claro, se considera que la bacteriemia es persistente cuando los hemocultivos siguen siendo positivos más allá de 72h de iniciado un tratamiento antibiótico adecuado60,61. La mayoría de estudios realizados hasta la fecha sobre la frecuencia de bacteriemia persistente contemplan conjuntamente casos de bacteriemia por SASM y por SARM. En un estudio en el que se practicó un hemocultivo diario a todos los pacientes con bacteriemia estafilocócica, se documentó bacteriemia persistente en el 37% de los casos60. Algunos autores han observado que la bacteriemia persistente es más frecuente cuando la etiología es SARM, que cuando se trata de SASM48,61. Este hecho podría atribuirse, en parte, a la menor eficacia de vancomicina en comparación con cloxacilina frente a S. aureus62–64.
La detección de bacteriemia persistente obliga a descartar siempre la presencia de infecciones intravasculares y/o de metástasis sépticas (espondilitis, artritis, endoftalmitis, etc.), que en muchas ocasiones no son evidentes en la evaluación clínica inicial.
Muchos estudios documentan la relación estrecha entre bacteriemia persistente y un foco intravascular de la bacteriemia59. Entre los focos intravasculares, el más importante en frecuencia es el relacionado con un dispositivo intravascular no retirado (catéter venoso). En este contexto, es importante descartar la existencia de una tromboflebitis séptica. Otras entidades a destacar en los focos intravasculares son la EI, la infección sobre cable de marcapasos o la infección de una prótesis intravascular. Aunque el foco intravascular es con mucho la etiología más frecuente de la bacteriemia persistente, algunos autores han relacionado esta circunstancia con otros focos, como la neumonía, la artritis séptica o la osteomielitis48,61.
La emisión continua de S. aureus al torrente circulatorio desde un foco, generalmente intravascular, se asocia a un riesgo elevado de desarrollar metástasis sépticas a distancia, un riesgo que se multiplica en los pacientes portadores de un dispositivo protésico intravascular (válvula cardíaca, prótesis vascular) o extravascular (implantes ortopédicos)64–66. En un estudio observacional, sólo el 5% de los episodios de bacteriemia estafilocócica se asociaron a metástasis sépticas cuando la duración de la bacteriemia fue inferior a 3 días, porcentaje que ascendió al 16, 12, 27 y 25% cuando la duración de la bacteriemia fue respectivamente de 3, 4–6, 7–9 y ⩾ 10 días60.
A partir de los datos expuestos, no sorprende que la bacteriemia persistente se asocie además a una mortalidad mayor. En este sentido, un estudio de casos y controles documentó una mortalidad significativamente superior entre los pacientes con bacteriemia persistente, respecto a los pacientes que no tenían bacteriemia persistente (el 27 frente al 13%; p<0,01)61.
Actuación clínica frente a la bacteriemia persistenteDebido a las graves consecuencias que pueden asociarse con la persistencia de hemocultivos positivos, es pertinente preguntarse si es necesario realizar un hemocultivo de control a las 72h de iniciar el tratamiento antibiótico a todos los pacientes con bacteriemia estafilocócica. La lógica inicial permitiría restringir esta práctica a los pacientes con mala respuesta al tratamiento inicial, generalmente asociada a persistencia de la fiebre. Sin embargo, un estudio documentó que la fiebre había desaparecido en un 54% de los pacientes en los que los hemocultivos persistían positivos60. Por este motivo, debe considerarse siempre la práctica de hemocultivos de control, con independencia de la evolución de la fiebre67. Una vez documentado que el paciente tiene una bacteriemia persistente, el clínico debe:
- a)
Retirar el catéter vascular, en el caso de que se trate de una bacteriemia persistente relacionada con un catéter. En el apartado anterior, se han establecido ya los criterios de retirada y mantenimiento del catéter. En un estudio reciente68 se pone de manifiesto que la trombosis venosa es una complicación frecuente de la bacteriemia relacionada con un CVC debida a S. aureus y que puede asociarse a una frecuencia mayor de muerte o recurrencia de la bacteriemia. Puesto que la exploración física tiene una sensibilidad baja para detectar esta complicación, se recomienda la práctica de una ecografía Doppler, especialmente en los casos en los que la bacteriemia persiste después de retirar el catéter.
- b)
Descartar la endocarditis mediante anamnesis y exploración física, así como mediante la realización de una ecocardiografía. La necesidad de realizar en todo episodio de bacteriemia estafilocócica una ecocardiografía es motivo de discusión en la bibliografía. Se ha cifrado en un 26% la incidencia de endocarditis cuando de forma sistemática se realiza una ecografía en pacientes con bacteriemia estafilocócica56,69. Es muy probable que si el mismo estudio se repitiera en pacientes con bacteriemia persistente, este porcentaje ascendiera hasta el 40–50%. Por este motivo, en los pacientes con bacteriemia persistente, debe recomendarse siempre la práctica de una ecografía, preferiblemente transesofágica, dada su mayor sensibilidad en detectar vegetaciones y abscesos perivalvulares.
- c)
Realizar una exploración clínica completa para detectar síntomas o signos clínicos indicativos de metástasis sépticas (artritis, osteomielitis, endoftalmitis, abscesos esplénicos, etc.) y, en caso de sospecha de complicaciones, practicar las exploraciones complementarias necesarias para confirmar el diagnóstico48,59,61,70.
En cualquier caso, es obvio que el tratamiento clínico de la bacteriemia complicada por SARM es muy complejo y requiere un tratamiento multidisciplinario. En este sentido, algunos estudios han mostrado que la valoración por parte de un especialista en enfermedades infecciosas y el seguimiento de sus recomendaciones contribuye a reducir la tasa de complicaciones y se asocia con un pronóstico mejor40,71,72.
Tratamiento antibióticoLa vancomicina es el antibiótico más utilizado en el tratamiento de la bacteriemia por SARM, por lo que la inmensa mayoría de pacientes con bacteriemia persistente estarán recibiendo este antibiótico. En este momento, es necesario plantearse la modificación del tratamiento y las opciones son: a) mejorar la dosificación de la vancomicina para alcanzar una concentración plasmática en el valle por encima de 15μg/ml; b) asociar un segundo antibiótico con actividad frente a SARM, o c) cambiar a un antibiótico alternativo. Las consideraciones que podrían realizarse a cada una de las opciones serían las siguientes:
- a)
Optimización de la dosis de vancomicina. Durante los últimos años, se ha descrito que un aumento de la CMI de vancomicina, dentro del rango de sensibilidad, se asocia a una reducción en la eficacia de este antibiótico15,21,25. Con la dosis habitualmente recomendada (1g/12h) y al alcanzar un valle de 10μg/ml, se obtiene un área bajo la curva (ABC) de concentración de aproximadamente 400mg/h/l. El parámetro farmacodinámico que predice la eficacia de la vancomicina es el ABC/CMI y un valor ⩾345mg/h/l se ha relacionado con una probabilidad mayor de curación24. A partir de estos datos, podemos deducir que la dosis habitual es óptima para tratar infecciones producidas por cepas con valores de CMI⩽1μg/ml y subóptima cuando la CMI es >1μg/ml. Por tanto, una estrategia razonable sería aumentar el valle de vancomicina hasta 15 o incluso 20μg/ml, que permitiría alcanzar un ABC>600mg/h/l. Sin embargo, en un estudio reciente en pacientes con infecciones graves por SARM, tratados con vancomicina y con la dosis ajustada para alcanzar un valle ⩾15μg/ml, se observó que la tasa de curación en los casos con CMI=2μg/ml seguía siendo inferior a la observada en aquéllos con CMI⩽1μg/ml (el 62 frente al 85%; p=0,02)73. Además, dosis más altas de vancomicina se asociaron a un aumento de su toxicidad renal, especialmente en los pacientes que recibían otros fármacos nefrotóxicos74. Por tanto, es necesario evaluar otras alternativas.
- b)
Asociación de vancomicina con otro antibiótico. Los 2 antibióticos que con más frecuencia se han asociado a la vancomicina, en un intento de mejorar su eficacia, son la rifampicina y la gentamicina. La posible utilización de rifampicina se basa en la actividad de este compuesto frente a la fase estacionaria estafilocócica75 y en los resultados favorables obtenidos al asociarla a quinolonas en el tratamiento de las infecciones por SASM relacionadas con prótesis articulares76, osteomielitis o bacteriemias (C-II)77. La combinación de vancomicina con rifampicina en estudios in vitro no ha demostrado actividad sinérgica78 y tampoco se ha observado un beneficio clínico en la adición de rifampicina en el tratamiento con vancomicina de la endocarditis por SARM (D-III)79. La asociación de vancomicina con un aminoglucósido es sinérgica80 y, por tanto, podría contemplarse en pacientes con bacteriemia persistente. Sin embargo, no se ha demostrado una eficacia mayor de esta combinación en pacientes con endocarditis en cuanto a la reducción de la mortalidad, pero sí un aumento de la nefrotoxicidad, por lo que esta opción debe relegarse a un segundo plano.
- c)
Selección de un antibiótico alternativo a la vancomicina. Según los datos expuestos, teniendo en cuenta la gravedad potencial de la bacteriemia persistente, así como la disponibilidad de nuevos antibióticos, es coherente recomendar como primera opción en el paciente con bacteriemia persistente la modificación del tratamiento antibiótico. Antes de discutir los nuevos antiestafilocócicos, conviene recordar la información disponible sobre cotrimoxazol, ya que mantiene una buena actividad frente a SARM, es un antibiótico bactericida y puede administrarse por vía oral18. A pesar de estas características, en un estudio aleatorizado y doble ciego en pacientes con bacteriemia estafilocócica, en el que se comparaba vancomicina (n=58) frente a cotrimoxazol (n=43), se puso de manifiesto una tasa de fracaso clínico mayor en los pacientes que recibieron cotrimoxazol81.
Los principales datos referentes a la eficacia de daptomicina y linezolid en la bacteriemia estafilocócica se han comentado en el apartado de la bacteriemia de catéter. Es importante destacar que no hay estudios que aborden específicamente su papel en la bacteriemia persistente por SARM, por lo que las posibles recomendaciones deben inferirse de la información de estudios más generales sobre bacteremia y de distintas experiencias en endocarditis. La elección entre daptomicina y linezolid dependerá de la sospecha del médico sobre el origen más probable de la bacteriemia persistente, y sobre la localización de las posibles metástasis sépticas. Si la sospecha es de infección intravascular, será preferible utilizar daptomicina, atendiendo a su rápida actividad bactericida; mientras que la sospecha de infección en localizaciones de difícil acceso (como por ejemplo endoftalmitis) aconsejarían el uso de linezolid, por su gran difusión tisular.
En el caso de la daptomicina, en un intento de aumentar la actividad bactericida y de evitar la selección de mutantes resistentes durante el tratamiento, se ha indicado la utilización de una dosis más elevada, de 8mg/kg/día, la cual en voluntarios sanos tratados durante 14 días no se asoció a más toxicidad82–84, o bien asociar un aminoglucósido, puesto que se ha demostrado que esta combinación es sinérgica85.
En cuanto a las combinaciones de linezolid con otros agentes antiestafilocócicos, la evidencia científica es escasa y los resultados, contradictorios. Estudios in vitro han mostrado la disminución de la actividad antibiótica de gentamicina o vancomicina cuando se asociaban a linezolid (C-II)86. Por otro lado, estudios en modelos animales de endocarditis mostraron ventajas en la combinación de linezolid con gentamicina, respecto al uso de linezolid en monoterapia (B-II)87. También se ha comunicado sinergia entre linezolid e imipenem o ertapenem, tanto en estudios in vitro, como en modelos de endocarditis experimental88. Sin embargo, hay un hecho que debilita esta asociación: la sinergia sólo se mantiene si el carbapenémico se administra a dosis subinhibitorias, mientras que concentraciones altas disminuyen la actividad antibacteriana (C-II).
La duración del tratamiento antibiótico en la bacteriemia persistente por SARM depende del diagnóstico definitivo. Si la persistencia se debe a la no retirada del catéter, éste se retira y no se identifica ninguna metástasis séptica, la duración del tratamiento será de 15 días. En el resto de circunstancias asociadas a bacteriemia persistente (p. ej., endocarditis, tromboflebitis séptica, espondilodiscits, etc.), el tratamiento se prolongará 4-6 semanas36,55,89.
Un aspecto sobre el que se dispone de muy poca información es la posibilidad de completar el tratamiento de la bacteriemia por vía oral, en casos de bacteriemia persistente o complicada. En el caso de SASM, disponemos de datos que demuestran que la asociación por vía oral de una fluorquinolona con rifampicina se asocia a una tasa de curación similar a la de un betalactámico por vía intravenosa77. La ausencia de antibióticos eficaces por vía oral limitaba esta posibilidad en el tratamiento de la bacteriemia por SARM; actualmente, linezolid podría facilitar la posibilidad de realizar un tratamiento secuencial adecuado, pero todavía no hay evidencia científica en casos de bacteriemia persistente.
Endocarditis infecciosa por Staphylococcus aureus resistente a la meticilinaPrevalencia, diagnóstico y pronósticoEl diagnóstico clínico de la EI se basa en los criterios de Duke90, efectuándose un diagnóstico definitivo cuando hay bacteriemia continua y se detectan vegetaciones valvulares en el ecocardiograma. En la actualidad, S. aureus es la primera causa de EI, tanto en válvula nativa (población general, drogadictos), como en pacientes con dispositivos intravasculares (válvulas protésicas, marcapasos y desfribriladores)91,92.
En los últimos años, la EI por SARM está aumentando de frecuencia; en general, se adquiere en el hospital o en relación con los cuidados sanitarios y tiene una morbilidad y mortalidad elevadas, superior al 50% en los casos de endocarditis izquierda.
Tratamiento antibiótico empíricoAnte la sospecha de una endocarditis por S. aureus, el tratamiento empírico suele realizarse con vancomicina para cubrir las infecciones por SARM y por SASM y, a las 24–48h, al disponer de los resultados del antibiograma, se cambia el tratamiento a cloxacilina, si el aislado es sensible a este antibiótico. Sin embargo, esta práctica puede ser perjudicial en los casos de endocarditis por SASM, teniendo en cuenta los mejores resultados asociados al uso de betalactámicos en los pacientes con bacteriemia estafilocócica64. En un estudio reciente93, el tratamiento empírico inicial con vancomicina de la endocarditis por SASM en drogadictos se acompañó de una mortalidad mayor, a pesar de que cuando se conoció el resultado del antibiograma se cambió la vancomicina por un antibiótico betalactámico en las 48h siguientes. En consecuencia, se recomienda tratar de forma empírica con la combinación de cloxacilina y vancomicina a los pacientes con sospecha de endocarditis por S. aureus, en espera de conocer los resultados del antibiograma (C-III). Además, el tratamiento combinado con vancomicina y una penicilina isoxazólica (nafcilina) fue sinérgica en el tratamiento de la endocarditis experimental por SARM con sensibilidad reducida a la vancomicina94.
Como alternativa a la combinación de cloxacilina y vancomicina, se podría utilizar como antibiótico empírico inicial la daptomicina (A-I), ya que, en un ensayo clínico, prospectivo y aleatorizado de bacteriemia/endocarditis por S. aureus, este fármaco demostró ausencia de inferioridad respecto al tratamiento con penicilinas isoxazólicas (nafcilina o cloxacilina) en los episodios debidos a SASM o con vancomicina en los debidos a SARM34.
Tratamiento antibiótico definitivoLa vancomicina es hasta ahora el tratamiento de elección de la EI por SARM, tanto si afecta a las valvulas derechas, como a las válvulas izquierdas, tanto nativas, como protésicas (C-III)95,96. Se recomienda la administración de 30mg/kg/día de vancomicina durante 6 semanas. En las formas protésicas, se recomienda la adición de gentamicina y rifampicina, si ambos antibióticos muestran sensibilidad frente a SARM, por extrapolación del tratamiento de la endocarditis en la válvula protésica por Staphylococcus epidermidis resistente a la meticilina96. Sin embargo, no hay evidencia de una eficacia mayor de esta asociación en términos de reducción de la mortalidad y el uso de gentamicina puede ocasionar más nefrotoxicidad (D-I).
En cualquier caso, la tasa de fracasos terapéuticos o recidivas es muy elevada, debido a que la vancomicina tiene un efecto bactericida lento y penetra mal en las vegetaciones cardíacas97,98,99, por lo que es pertinente plantearse otras alternativas.
En la endocarditis derecha por SARM, la daptomicina demostró no ser inferior a la vacomicina en un ensayo clínico aleatorizado de bacteriemia/endocarditis, aunque el número de pacientes incluidos con endocarditis derecha por SARM fue de sólo 15 casos34. Se curaron 3 de los 7 pacientes (43%) tratados con vancomicina y 4 de los 8 pacientes (50%) tratados con daptomicina. En un estudio in vivo en conejos100, la daptomicina (simulando 6mg/kg/día por vía intravenosa [i.v.]) se mostró superior de forma estadísticamente significativa a la vancomicina (simulando 30mg/kg/día por vía i.v.) para el tratamiento de la endocarditis experimental por SARM con una CMI a la vancomicina de 2μg/ml. En este mismo estudio experimental100, se evaluó la eficacia de dosis altas de vancomicina (simulando 60mg/kg/día) para alcanzar una Cmin mediana de 20μg/ml y un cociente ABC/Cmin >345. La eficacia de esta dosificación fue algo mejor que la vancomicina a la dosis recomendada de 30mg/kg/día por vía i.v. e inferior a la daptomicina 6mg/kg/día por vía i.v., aunque las diferencias no fueron estadísticamente significativas, y en el modelo animal no se evaluó la potencial nefrotoxicidad de esta dosis de vancomicina73,74. A la vista de estos resultados y de las limitaciones ya comentadas de la vancomicina, la recomendación de este panel sería basar el tratamiento antibiótico en el valor de la CMI a la vancomicina. El fármaco de elección sería la daptomicina (6mg/kg/día) en los pacientes con una EI por SARM con una CMI a la vancomicina de 2mg/l (C-III), dejando a la vancomicina como fármaco recomendado cuando la CMI fuera ⩽1mg/l (C-III), siendo razonable aumentar el valor valle (Cmin) de vancomicina hasta un valor no inferior a 15μg/ml (C-III).
En la endocarditis izquierda por SARM, tanto la vancomicina como la daptomicina han demostrado poca eficacia. Ninguno de los 9 pacientes con endocarditis izquierda en la válvula nativa por SARM del ensayo clínico de Fowler et al34 se curó. Cinco casos se trataron con daptomicina (6mg/kg/día por vía i.v.) y 4, con vancomicina (30mg/kg/día por vía i.v.). Una publicación posterior de un registro americano, denominado CORE, comprobó que se curaron 9 de los 15 pacientes (60%) tratados con daptomicina101. Hay muy poca información de la eficacia de la daptomicina en la EI protésica102.
¿Como se podría mejorar la actividad de la vancomicina y de la daptomicina en la EI por SARM? Respecto a la vancomicina, anteriormente ya se han comentado las limitaciones de la administración de dosis elevadas de vancomicina y de la combinación de este antibiótico con rifampicina y con gentamicina. La combinación de vancomicina y linezolid, tanto in vitro como in vivo, es indiferente o antagónica103, por lo que no debe administrarse (D-III). Por el contrario, hay estudios experimentales104 y una pequeña experiencia clínica105 que indican que la combinación de vancomicina y quinupristina con dalfopristina (Synercid®) es sinérgica y fue útil para el tratamiento de 5 pacientes con infecciones graves por estafilococos resistentes a la meticilina (C-III). En espera de tener más experiencia con esta última combinación, este panel recomendaría el uso de vancomicina sólo en las endocarditis izquierdas por SARM con una CMI⩽1mg/l (C-III). Respecto a la daptomicina, en un estudio en el modelo experimental por SARM se demostró que el aumento de la dosis de 6 a 10mg/kg/día se acompañó de una reducción significativa del número de colonias en las vegetaciones106. En 2 estudios de endocarditis experimental por SARM, en los que se ha utilizado farmacocinética humanizada, se ha demostrado que la combinación de daptomicina y rifampicina es antagónica107 y la combinación de daptomicina y gentamicina es indiferente108. Por tanto, en el tratamiento de la endocarditis izquierda por SARM recomendaríamos utilizar dosis de 10mg/kg/día de daptomicina (C-III).
Valoración de la respuesta al tratamiento antibióticoLa negativización de los hemocultivos es el mejor parámetro de control microbiológico de la EI96. La mediana de duración de la bacteriemia en la EI por SARM tratada con vancomicina o daptomicina oscila entre 7 y 9 días34,79. Por ello, la persistencia de hemocultivos positivos a partir de los 7 días de tratamiento antibiótico adecuado se tendría que considerar como un fracaso microbiológico96 (C-III). En estos casos, se ha de descartar: la existencia de abscesos paravalvulares mediante ecocardiografía transesofágica, de abscesos esplénicos o de otras metástasis sépticas mediante una prueba de imagen (ecografía o escáner) o la posibilidad de que se trate de cepas con sensibilidad intermedia a la vancomicina o heterorresistentes96.
Tratamiento antibiótico alternativo en casos de fracaso microbiológicoLas alternativas a la vancomicina o a la daptomicina en la EI por SARM son escasas. La experiencia con antibióticos clásicos como el trimetoprim-sulfametoxazol o la teicoplanina en la EI por S. aureus no es buena. Trimetoprim-sulfametoxazol fue inferior a la vancomicina en un ensayo clínico de infecciones por S. aureus (SASM o SARM) en drogadictos81, en que la mayoría de fracasos aparecieron en pacientes con infecciones por SASM o con endocarditis tricuspídea (D-I). La experiencia con teicoplanina tampoco es buena. Fracasaron 4 de los 6 pacientes con una endocarditis derecha por SASM tratados con teicoplanina durante 4 semanas109, a pesar de recibir una dosis elevada durante los primeros 7 días (D-III). Por otra parte, desde hace años se sabe que la combinación de fosfomicina y betalactámicos (cefotaxima, imipenem) es sinérgica in vitro, in vivo y ha demostrado su eficacia en estudios clínicos en el tratamiento de infecciones por SARM110. La combinación de fosfomicina (simulando 2g/6h por vía i.v.) e imipenem (simulando 1g/6h por vía i.v.) fue bactericida in vitro y superior a la vancomicina in vivo (simulando 30mg/kg/día por vía i.v.) en el tratamiento de la endocarditis experimental por SARM con una CMI a la vancomicina de 2μg/ml111. Además, en un estudio clínico multicéntrico preliminar, los 7 pacientes con endocarditis por SARM que fracasaron a la vancomicina (hemocultivos positivos a los 7 días) negativizaron los hemocultivos en menos de 72h con el tratamiento con fosfomicina e imipenem112. Estos datos preliminares justificarían el uso clínico de esta combinación (C-III).
La eficacia de nuevos antibióticos frente a las infecciones por cocos grampositivos, como linezolid o quinupristina con dalfopristina (Synercid®), no ha mejorado las expectativas terapéuticas de la EI por SARM. Los principales inconvenientes del linezolid para el tratamiento de la endocarditis se deben a que tiene una actividad bacteriostática y a su potencial mielotoxicidad en tratamientos prolongados. Por el contrario, tiene la ventaja de que se puede administrar por vía oral y tiene una gran difusión a los tejidos. Linezolid fue eficaz en 4 de 8 pacientes (50%) con una endocarditis por SARIV (CMI a la vancomicina entre 2 y 4mg/l) que fracasaron al tratamiento con vancomicina22. En otro estudio retrospectivo, se curó el 70% de 22 pacientes con EI por SARM que recibieron linezolid por fracaso o intolerancia a la vancomicina o como parte de un tratamiento secuencial113. El tratamiento secuencial con linezolid curó al 100% de 8 pacientes con EI por SARM que se sometieron a recambio valvular temprano (media de 5 días) y el linezolid se administró a partir del quinto día del postoperatorio durante unas 3 semanas114. Por tanto, este comité considera que podría utilizarse linezolid en casos seleccionados de EI por SARM que fracasen o no toleren la vancomicina o la daptomicina (C-III).
Como ya se ha explicado anteriormente, no se recomienda la combinación de linezolid con vancomicina103, existe sinergia in vitro e in vivo con la combinación de linezolid e imipenem o ertapenem, aunque sólo cuando se utilizan a dosis subinhibitorias88, y los resultados de linezolid con aminoglucósidos son contradictorios86,87. Con la combinación de quinupristina con dalfopristina (Synercid®), hay poca experiencia clínica en el tratamiento de la EI por SARM y sólo se han publicado algunos casos tratados en combinación con vancomicina105, por lo que no hay evidencia clínica suficiente para recomendarlo (C-III). Aparte de la sinergia con vancomicina, quinupristina con dalfopristina (Synercid®) también mostró sinergia in vivo con betalactámicos o rifampicina115,116.
No hay experiencia clínica en el tratamiento de la EI por SARM con los nuevos glucopéptidos, como dalvabancina, oritavancina o telavancina117–119, con la tigeciclina120, con las nuevas cefalosporinas con actividad frente a SARM, como ceftobiprole o ceftarolina121,122, con la lisostafina123, con las nuevas quinolonas (garenoxacino)124 o con evernimicina125, aunque la mayoría de estos fármacos ha demostrado su potencial eficacia en los modelos experimentales de EI por SARM.
Tratamiento quirúrgicoLas indicaciones del tratamiento quirúrgico de la EI sobre válvula nativa o protésica por SARM son las mismas que para la EI causada por otras etiologías96. Un situación clínica realmente difícil de tratar es la EI protésica por SARM. En un estudio unicéntrico se demostró que la cirugía temprana, durante el tratamiento antimicrobiano, de la EI protésica por S. aureus reducía la mortalidad, aunque no hubiera otros criterios de recambio valvular126. Sin embargo, en otro estudio posterior del International Collaboration on Infective Endocarditis Merged Database, no se pudo demostrar que la cirugía cardíaca redujera la mortalidad de la EI protésica por S. aureus cuando no había otras indicaciones (p. ej., insuficiencia cardíaca) de recambio valvular127. En estos estudios, la mayoría de casos de EI protésica eran por SASM. Debido a la elevada mortalidad de la EI por SARM, los autores consideran que deberían evaluarse para cirugía cardíaca todos los pacientes con EI por SARM en los que el tratamiento antibiótico no controle la infección (hemocultivos positivos tras 7 días), siempre y cuando no haya focos metastásicos extracardíacos o comorbilidades que la contraindiquen (C-III).
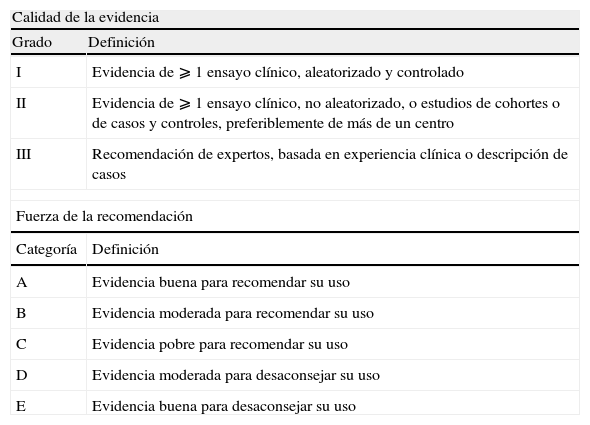
| Calidad de la evidencia | |
| Grado | Definición |
| I | Evidencia de ⩾ 1 ensayo clínico, aleatorizado y controlado |
| II | Evidencia de ⩾ 1 ensayo clínico, no aleatorizado, o estudios de cohortes o de casos y controles, preferiblemente de más de un centro |
| III | Recomendación de expertos, basada en experiencia clínica o descripción de casos |
| Fuerza de la recomendación | |
| Categoría | Definición |
| A | Evidencia buena para recomendar su uso |
| B | Evidencia moderada para recomendar su uso |
| C | Evidencia pobre para recomendar su uso |
| D | Evidencia moderada para desaconsejar su uso |
| E | Evidencia buena para desaconsejar su uso |