Introducción
La infección fúngica invasiva (IFI) es la enfermedad infecciosa que produce mayor mortalidad en el paciente que la desarrolla y, por desgracia, no parece que ésta haya disminuido de forma significativa en los últimos años1-3. Además, el incremento del uso de fármacos inmunosupresores, tanto en pacientes con patología oncológica como en poblaciones con enfermedades autoinmunes o de etiología incierta, el espectacular incremento del número de trasplantes de órganos, la epidemia del síndrome de inmunodeficiencia adquirida (SIDA), así como el aumento de la esperanza de vida de los enfermos sometidos a cuidados críticos, han incrementado sustancialmente el número de pacientes que las padecen.
La anfotericina B ha sido durante casi cuatro décadas el único fármaco disponible para el tratamiento de la IFI. Sin embargo, la importante toxicidad asociada a su uso, los malos resultados con respecto a la curación de los pacientes y el incremento en el número de pacientes que están en riesgo de padecer una IFI han estimulado el desarrollo de nuevos fármacos antifúngicos. Algunos de ellos se han comercializado muy recientemente, por lo que la información disponible sobre su utilidad clínica es escasa. Además, y tal como ha sido puesto de manifiesto por muchos autores, la realización de ensayos clínicos con fármacos antifúngicos en el tratamiento de la IFI se ve dificultado por la heterogeneidad de los pacientes que las padecen, y por la dificultad para establecer un diagnóstico definitivo de la infección en muchos casos4,5.
En todo caso, es muy probable que la creciente disponibilidad de fármacos más seguros, más eficaces y con mejores propiedades farmacocinéticas para el tratamiento de las micosis sistémicas sea capaz de reducir la mortalidad que producen éstas aún hoy.
En el presente trabajo se realiza una revisión de los fármacos antifúngicos disponibles en el mercado español para el tratamiento de la IFI, con especial mención a su utilidad clínica.
Los mecanismos de resistencia frente a los antifúngicos han sido revisados recientemente en esta misma revista por lo que no se comentarán6. Una clasificación general de los antifúngicos se ofrece en la tabla 1.
Anfotericina B
La anfotericina B fue aislada en 1955 de un actinomiceto denominado Streptomyces nodosus y ha sido el fármaco más utilizado en el tratamiento de las infecciones fúngicas profundas. Por la experiencia acumulada sigue siendo considerado el patrón en la comparación de nuevos fármacos antimicóticos7. En la pasada década han aparecido las preparaciones lipídicas de este fármaco que ofrecen una menor toxicidad8-10.
Estructura química y mecanismo de acción
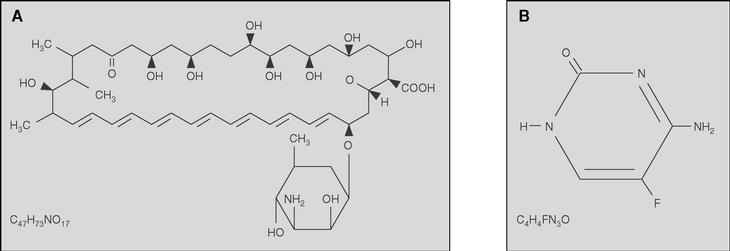
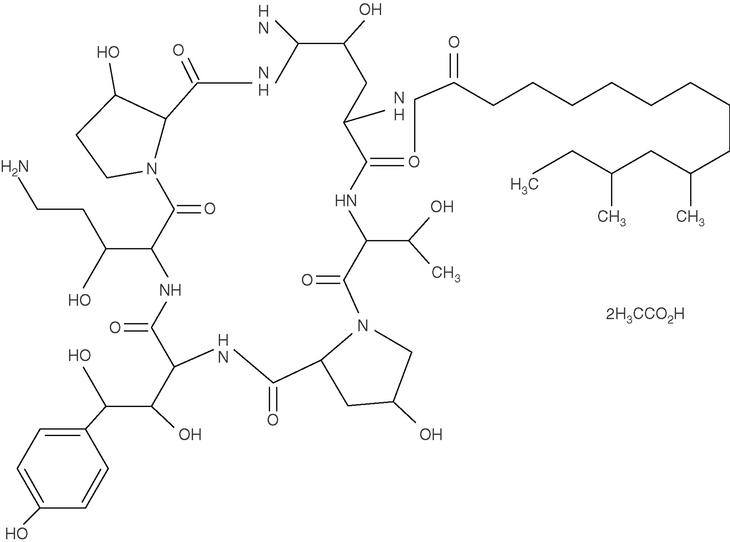
La anfotericina B es un macrólido heptaeno con una molécula de nicosamida en un extremo y siete grupos hidroxilo en el otro (fig. 1).
Figura 1. Estructura química de la anfotericina B (A) y la flucitosina (B).
En la formulación convencional (anfotericina B desoxicolato, ABD) se emplea desoxicolato sódico y fosfato sódico monobásico como excipiente. La anfotericina B complejo lipídico (ABCL) es una formulación de anfotericina B asociada a lípidos compuesta por L-a-dimiristofosfatidilcolina,L-α -dimiristofosfatidilglicerol y anfotericina B. La anfotericina B liposomal (ABL) se compone de fosfatidilcolina hidrogenada de soja, colesterol, diestearoilfosfatidilglicerol y anfotericina B obteniéndose liposomas unilaminares de 55 a 75 nm de diámetro.
La anfotericina B ejerce su actividad antimicótica creando poros en la membrana plasmática del hongo alterando su función. Se une al ergosterol presente en la membrana, y el centro hidrófilo forma un conducto transmembrana que interfiere en la permeabilidad y función de la barrera osmótica.
Espectro de actividad antifúngica
La mayor parte de las especies de hongos que causan infección en humanos son sensibles a la anfotericina B, por lo que este fármaco sigue teniendo el espectro de actividad más amplio entre todos los antifúngicos disponibles. Como excepciones, algunas especies de Candida como C. lusitaniae, C. guillermondii, C. lipolytica o C. tropicalis, Pseudalescheria boydii, y algunas cepas de Fusarium y Trichosporon presentan resistencia clínica y/o valores elevados de la concentración inhibitoria mínima (CIM) frente a anfotericina B.
Farmacocinética-Farmacodinámica (tabla 2)
ABD
Tiene una mínima absorción desde el tracto gastrointestinal por lo que las infecciones sistémicas deben ser tratadas por vía intravenosa.
Las concentraciones más altas se alcanzan en hígado, bazo, pulmón y riñones. En líquido pleural, peritoneal, sinovial y humor acuoso inflamados las concentraciones del fármaco son aproximadamente del 50-60% de las concentraciones plasmáticas mínimas. La penetración en líquido cefalorraquídeo (LCR) es muy baja (2-4%) aumentando en caso de inflamación meníngea. El paso a humor vítreo y líquido amniótico normal es también mínima.
No se conocen metabolitos, produciéndose su degradación en los tejidos. La eliminación es muy lenta fundamentalmente por vía biliar (< 15%) y renal (3%). En algunos tejidos como el hígado se detecta anfotericina hasta 12 meses después. Los valores plasmáticos no se ven influidos por el deterioro de la función renal o hepática ni por la hemodiálisis.
ABCL
Presenta picos séricos y áreas bajo la curva menores que la ABD por su rápida distribución tisular, incrementándose el volumen de distribución y el aclaramiento total. Aunque su distribución tisular no es plenamente conocida se acumula en el sistema monocito/macrófago, alcanzando concentraciones elevadas en pulmón, hígado y bazo. Las concentraciones son bajas en nódulos linfáticos, riñón, corazón y cerebro.
ABD
Se alcanzan picos séricos y áreas bajo la curva mayores que comparado con la ABD y con el ABCL, y el volumen de distribución y el aclaramiento son menores debido a que los liposomas no pueden eliminarse por filtración glomerular. Las concentraciones más altas se encuentran en órganos ricos en células del sistema reticuloendotelial como el hígado y bazo y son más bajas en el riñón y en el pulmón.
Indicaciones clínicas
La mayor parte de la información referida a la eficacia clínica de la anfotericina B lo es en relación con el tipo convencional (ABD). En la gran mayoría de las indicaciones existen escasos estudios comparativos entre la ABD y las formulaciones lipídicas del fármaco (véase más adelante), por lo que es difícil asegurar que, siendo éstas más seguras, sean más o menos eficaces que el fármaco original. En todo caso, los problemas inherentes a la toxicidad de la anfotericina B convencional, sobre todo en pacientes con insuficiencia renal o que reciben simultáneamente fármacos nefrotóxicos obliga en muchas ocasiones a utilizar las formulaciones lipídicas.
Candidemia o candidiasis invasiva
Aunque, como se comentará más adelante, fluconazol ha sustituido a anfotericina B como agente de primera línea en el tratamiento de la candidemia en pacientes inmunocompetentes, son muchos los autores que siguen pensando que la anfotericina B debe seguir siendo la primera elección en el tratamiento de la candidemia y/o candidiasis invasiva en pacientes inmunodeprimidos, inestables, que han recibido profilaxis con azoles o en entornos epidemiológicos donde la posibilidad de infección por C. glabrata o C. krusei sea alta11. Del mismo modo, la mayor parte de los autores consideran que la anfotericina B con o sin flucitosina, es el tratamiento de elección en la meningitis y endocarditis por Candida.
Infección por Criptococcus
La combinación de anfotericina B con flucitosina es el tratamiento recomendado para el tratamiento de la meningitis criptocócica, al menos durante las primeras 2 semanas12.
Infección por Aspergillus
Tradicionalmente, anfotericina B se ha considerado el tratamiento de elección de la aspergilosis invasiva13. Muy recientemente, en un estudio comparativo, voriconazol ha demostrado ser superior a la ABD en el tratamiento de esta infección. No existe comparación, sin embargo, con las formulaciones lipídicas de anfotericina B.
Prevención de la infección fúngica en el paciente inmunodeprimido
La anfotericina B, tanto por vía intravenosa como administrada en aerosol, se ha utilizado con éxito variable en la prevención de la IFI en pacientes inmunodeprimidos, incluyendo pacientes oncohematológicos y receptores de trasplantes. En concreto, la utilización profiláctica de anfotericina B en aerosol es de uso habitual en la prevención de la IFI en el trasplante de pulmón14.
Tratamiento empírico de la neutropenia febril
Desde el estudio inicial de Pizzo et al15 en 1982, ABD ha sido el tratamiento de elección del paciente con neutropenia profunda y fiebre, a pesar de recibir un tratamiento antibiótico de amplio espectro. Más recientemente, Walsh et al16 demostraron que la ABL es igual de eficaz y menos tóxica que la ABD en esta indicación.
Otras infecciones fúngicas
La anfotericina B es el tratamiento de elección de las infecciones por zigomicetos y de las producidas por la mayor parte de los hongos filamentosos con la posible excepción de las infecciones por Scedosporium y Fusarium. Las infecciones graves por Histoplasma, Coccidioides, Sporotrix y Blastomyces deben, también para muchos autores, ser tratados inicialmente con anfotericina B.
Toxicidad e interacciones medicamentosas
Al uso de anfotericina B se han asociado una gran cantidad de efectos adversos tanto en relación temporal con la infusión como en cuanto a toxicidad. Se revisarán los más importantes, refiriéndonos a la ABD para posteriormente compararla con las nuevas formulaciones lipídicas.
Es muy frecuente la aparición de fiebre y escalofríos durante la infusión en la primera semana de tratamiento, disminuyendo posteriormente. Esto ha llevado al uso bastante generalizado de premedicación con fármacos que eviten la aparición de estos efectos, como el paracetamol, dexclorfeniramina y/o meperidina administrados 30 min antes de la infusión de anfotericina. En el caso de empezar con una dosis inicial alta se puede usar hidrocortisona (25-50 mg) en la misma infusión de la anfotericina. Algunos autores lo recomiendan sólo en el caso de que aparezcan los efectos adversos referidos. Puede producirse hipotensión, hipertensión, hipotermia y bradicardias en relación con la infusión del fármaco y excepcionalmente arritmias ventriculares.
La aparición de náuseas y vómitos es frecuente, aunque disminuye con el tratamiento. Es frecuente la tromboflebitis asociada a la infusión intravenosa, aunque rara vez es necesario el uso de vías centrales. Su extravasación puede producir necrosis tisular.
Las reacciones anafilácticas a la anfotericina B son muy raras, pero justifican la realización de dosis de prueba antes de iniciar el tratamiento.
Clásicamente se describe el desarrollo de un cuadro de insuficiencia respiratoria y síndrome de dificultad respiratoria del adulto con la aparición de infiltrados intersticiales en relación con el uso de transfusión de leucocitos de forma concomitante con la anfotericina B. Esto se ha observado en ausencia de transfusión de granulocitos y también en otras situaciones, incluido el uso de factores estimulantes de colonias o coincidiendo con la regeneración de la aplasia posquimioterapia.
Sin duda, el efecto adverso de mayor relevancia y que supone el principal factor limitante es la toxicidad renal. La anfotericina B provoca una disminución del flujo sanguíneo renal y de la filtración glomerular, y afecta a la reabsorción de electrolitos en el túbulo proximal y distal en aproximadamente el 80% de los pacientes. Además de la alteración en la permeabilidad de las células tubulares, también puede asociarse con la lesión renal, el espasmo arteriolar, la depleción de calcio durante períodos de isquemia y la toxicidad celular directa producida por el fármaco. La toxicidad precoz es dependiente de la dosis mientras que la toxicidad tardía está en función de la dosis acumulada. Suele ser reversible, aunque casi todos los pacientes que reciben la terapia completa quedan con algún grado de reducción de la filtración glomerular residual. Se puede desarrollar fracaso renal irreversible. El riesgo de toxicidad renal puede ser reducido asegurando una adecuada hidratación del paciente. En aquellos pacientes que lo toleren se recomienda la administración de una carga de 500-1.000 ml de salino fisiológico 1 o 2 h antes de la infusión de anfotericina.
Se debe monitorizar la función renal periódicamente durante toda la duración del tratamiento. El desarrollo de toxicidad renal es la indicación fundamental para cambiar a formulaciones lipídicas de anfotericina B actualmente disponibles. La insuficiencia renal producida por la ABD suele mejorar o, al menos, permanecer estable cuando se sustituye por una de las formulaciones lipídicas. Más del 25% de los pacientes desarrollan hipopotasemia e hipomagnesemia que deben ser monitorizadas estrechamente.
Es frecuente el desarrollo de anemia normocítica normocrómica como consecuencia de la inhibición de la síntesis de eritropoyetina y también por acción directa sobre médula ósea. La asociación con leucopenia y trombopenia es rara.
Se ha descrito toxicidad hepática con el uso de ABD aunque algunos autores la cuestionan.
La aportación fundamental de las formulaciones lipídicas de anfotericina B es su mejor tolerancia y sobre todo su menor nefrotoxicidad frente a la ABD, lo que permite dosis diarias más altas y dosis totales acumuladas mucho mayores y en un tiempo mucho menor.
La ABCL es mejor tolerada que la ABD y presenta una menor incidencia de efectos relacionados con la infusión, aunque éstos son suficientemente comunes como para que se recomiende el uso de premedicación. Se ha descrito colestasis que puede estar potenciada por la ciclosporina. Presenta una incidencia similar de hipopotasemia que con la ABD y hay que monitorizar los niveles de potasio periódicamente, aunque globalmente la nefrotoxicidad es menor. Se han descrito casos de síndrome de dificultad respiratoria del adulto e insuficiencia respiratoria.
Con el uso de ABL es rara la aparición de efectos adversos durante la infusión y, de hecho, no se usa premedicación. Puede observarse elevación de la fosfatasa alcalina y menos frecuentemente de bilirrubina y transaminasas. La hipopotasemia se produce hasta en el 30%, por lo que hay que monitorizar las concentraciones. Se han descrito cuadros excepcionales de pancreatitis, fibrilación ventricular y reacciones anafilácticas al componente lipídico.
Sólo existe un estudio aleatorizado que haya comparado la seguridad de las dos presentaciones disponibles comercialmente en España; en él, la utilización de ABL se asoció con una menor incidencia de nefrotoxicidad y de reacciones durante la infusión que el uso de ABCL17.
Los pacientes susceptibles de recibir anfotericina B son generalmente enfermos graves que reciben numerosos fármacos. La toxicidad renal es potenciada por el uso con otros fármacos nefrotóxicos como aminoglucósidos, ciclosporina A, antiinflamatorios no esteroideos, foscarnet y cidofovir, así como con diversos agentes antineoplásicos como el cisplatino y mostazas nitrogenadas. En pacientes con virus de la inmunodeficiencia humana (VIH) se ha observado incremento de nefrotoxicidad y mielotoxicidad con el uso concomitante con zidovudina e insuficiencia renal por el empleo conjunto de anfotericina B y pentamidina.
La hipopotasemia inducida por la anfotericina B puede aumentar la toxicidad de los digitálicos y relajantes musculares. Así mismo, puede incrementarse la pérdida de potasio con el uso concomitante con corticoides y corticotropina (ACTH).
La combinación de arabinósido de citosina con anfotericina B se ha asociado al parkinsonismo.
Fluorcitosina
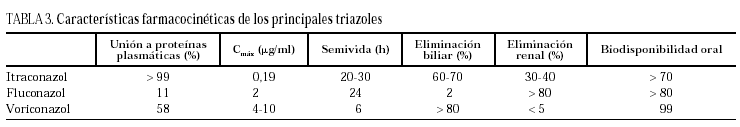
La 5-fluorcitosina o flucitosina fue comercializada como antifúngico al comienzo de la década de 1970. Su utilización ha sido lastrada por su estrecho espectro de actividad, y por la rápida aparición de cepas resistentes dentro de las especies susceptibles cuando se usa como agente antifúngico único18 (tablas 3-5).
Estructura química y mecanismo de acción
La flucitosina es un análogo fluorado del nucleósido citosina. La flucitosina impide la síntesis de ADN del hongo. En las dosis en las que se administra esta transformación se produce preferentemente en el interior del hongo, lo que explica la relativa especificidad de la acción sobre la célula fúngica.
Espectro de actividad antifúngica
La flucitosina es un antifúngico de espectro reducido con actividad prácticamente exclusiva frente a Candida y Cryptococcus, si bien algunas cepas de Aspergillus, Penicillium y Zigomicetos pueden ser sensibles. La flucitosina y la anfotericina B tienen efectos aditivos in vitro frente a Candida y Cryptococcus, lo que permite en la práctica una reducción en las dosis de anfotericina, pero los resultados con Aspergillus son contradictorios y no está claro que la asociación sea beneficiosa en este caso.
Farmacocinética-Farmacodinámica
Flucitosina se absorbe bien por vía oral, aunque su absorción puede verse retrasada por la comida y los antiácidos. La semivida es de 3-4 h, por lo que la dosificación habitual es de 100-150 mg/kg/día administrado cada 6-8 h, se une escasamente a las proteínas y penetra bien en los tejidos, incluyendo el sistema nervioso central (SNC) (74% de las concentraciones séricas con meninges inflamadas), el humor vítreo, el peritoneo y las articulaciones. El fármaco se excreta sin metabolizar por el riñón, y es retirado de la circulación con la hemodiálisis, lo que obliga a reducir las dosis del fármaco en enfermos con insuficiencia renal y a administrar dosis suplementarias del mismo tras las sesiones de diálisis o hemofiltración. Las alteraciones de la función hepática no obligan a modificar la dosificación de flucitosina.
Indicaciones clínicas
Candidemia o candidiasis invasiva
Tal como se ha comentado previamente, flucitosina ha demostrado tener una actividad antifúngica aditiva o sinérgica cuando se administra con anfotericina B. Sin embargo, no hay ningún estudio que haya comparado la eficacia de anfotericina B frente a la combinación de ambos fármacos. A pesar de ello, algunos autores siguen recomendando la asociación en casos de "infecciones muy graves", sobre todo cuando las infecciones están causadas por C. tropicalis, C. krusei o C. guillermondi que son menos sensibles a la anfotericina B11. La aparición de fluconazol, voriconazol y más recientemente de caspofungina hacen dudar del papel actual de flucitosina en el tratamiento de la candidemia y/o candidiasis invasiva.
Por el contrario, dada la excelente penetración del fármaco en el sistema nervioso central (SNC), la combinación de fluocitosina y anfotericina B sigue considerándose el tratamiento de elección de la meningitis candidiásica. Asimismo, muchos autores recomiendan (en muchos casos por tradición y por la ausencia de experiencia válida publicada con los nuevos antifúngicos) el tratamiento combinado con estos dos fármacos en el tratamiento de la endocarditis y la endoftalmitis por Candida.
Meningitis por Criptococcus
La meningitis criptocócica tanto en pacientes con SIDA como en enfermos sin infección por el VIH es la única infección fúngica en la que el tratamiento combinado con flucitosina y anfotericina B ha demostrado ser superior a la anfotericina B sola. Se recomienda que la duración del tratamiento de inducción sea de 6-10 semanas, o de sólo 2 semanas en pacientes con SIDA, si luego se administra fluconazol hasta completar las 10 semanas12.
Toxicidad e interacciones medicamentosas
Cuando la flucitosina se administra con ABD, el 38% de los pacientes desarrollan efectos secundarios relacionados con la flucitosina. La complicación más importante es la toxicidad medular, que suele aparecer a partir de las 2 semanas de tratamiento. Además, flucitosina puede producir toxicidad en la mucosa del tubo digestivo que se manifiesta en forma de náuseas, vómitos y diarrea. Asimismo, también se observan alteraciones de las pruebas de función hepática, generalmente reversibles, exantema y eosinofilia.
Azoles
Estructura química y mecanismo de acción
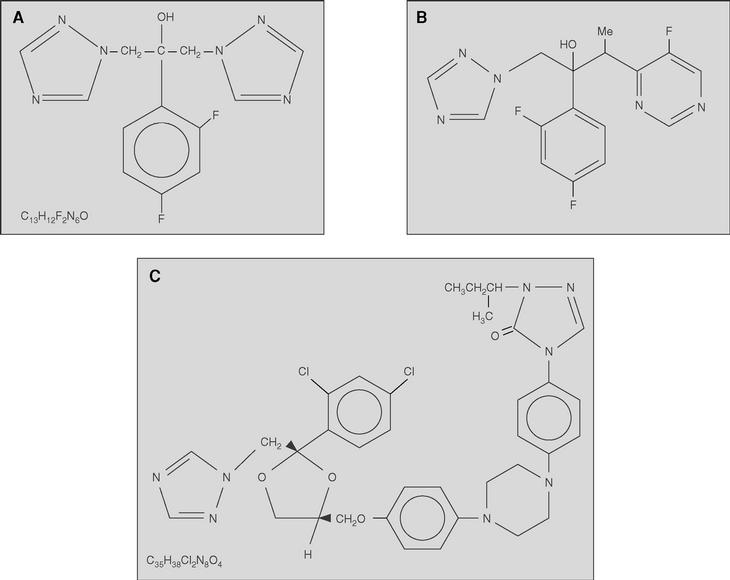
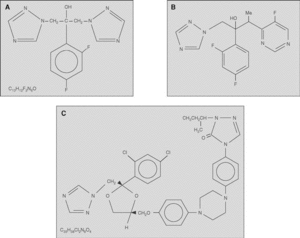
Los antifúngicos azólicos o azoles, son un grupo de fármacos fungistáticos sintéticos que se caracterizan por poseer un anillo imidazólico que contiene 2 o 3 nitrógenos (fig. 2). En función de esta última característica los azoles se dividen en imidazoles y triazoles19.
Figura 2. Estructura química de los azoles: A) fluconazol; B) voriconazol; C) itraconazol.
Los imidazoles (p. ej., miconazol) significaron una considerable aportación al tratamiento de las infecciones fúngicas; sin embargo, la existencia de limitaciones relacionadas con su limitado espectro de actividad, su escasa biodisponibilidad y la posibilidad de aparición con su uso de efectos secundarios graves, restringieron su empleo, por lo que no nos referiremos a ellos en este capítulo.
Los triazoles poseen el mismo mecanismo de acción que los imidazoles, pero un espectro antifúngico superior y menos efectos secundarios. En la actualidad existen tres triazoles utilizados en el tratamiento de la IFI: fluconazol, itraconazol y voriconazol, y varios más en fases avanzadas de desarrollo (posaconazol, ravuconazol, etc.) (tablas 3-5).
Los azoles actúan inhibiendo la enzima 14-a demetilasa. Esta inhibición se produce al formarse un complejo del azol con una parte del citocromo P-450 del hongo. El bloqueo de esta enzima impide la conversión de lanosterol en ergosterol, que es un componente fundamental de la membrana citoplasmática del hongo, y produce una alteración de la permeabilidad de la membrana y la acumulación de peróxidos que la dañan.
En los mamíferos también se produce el paso de lanosterol a colesterol, y por ello existe la posibilidad de que ocurran efectos adversos dependiendo del grado de especificidad del antifúngico por el citocromo P-450.
Fluconazol
Fluconazol es un triazol que fue aprobado para su uso en la práctica clínica en 1990. Sus excelentes propiedades farmacocinéticas y su escasa toxicidad le han convertido en un fármaco excelente para la prevención y el tratamiento de la infección por Candida y Criptococcus20.
Espectro de actividad antifúngica
Fluconazol es activo frente a levaduras (incluyendo Cryptococcus spp.). La mayoría de especies de Candida spp. son sensibles, aunque un buen número de cepas de C. glabrata son resistentes y C. krusei es intrínsecamente resistente21. Además, fluconazol tiene una buena actividad frente a coccidioidomicosis y paracoccidioidomicosis, pero carece de actividad frente a Aspergillus y otros hongos filamentosos.
Farmacocinética-Farmacodinámica
Fluconazol es muy hidrosoluble. Su absorción oral es muy rápida y completa (85-90%, no se ve modificada por la alimentación, la hipoclorhidria ni los tratamientos de la úlcera péptica.
Los niveles sanguíneos se alcanzan entre las 2 y las 4 h y el estado de equilibrio se consigue en tan sólo 4 o 5 días. Una de las características más destacadas es la elevada penetración en los líquidos biológicos de todo el organismo. En el líquido cefalorraquídeo (LCR) de pacientes con meningitis se alcanzan niveles del 90% con respecto a los alcanzados en el suero. Se elimina principalmente por orina sin metabolizar, aunque en gran parte se reabsorbe en los túbulos renales. Un 10% se recupera en orina como glucurónido y el 2% en las heces, sin metabolizar. La insuficiencia renal altera de forma muy importante la excreción del fluconazol y obliga a reducir la dosis. Los pacientes sometidos a hemodiálisis deben recibir una dosis diaria después de cada sesión.
Indicaciones clínicas
Infección por Candida
Fluconazol es muy eficaz en el tratamiento de las infecciones por Candida, y se considera el tratamiento de elección de muchas de ellas11. En concreto, fluconazol ha demostrado ser muy eficaz en el tratamiento del muguet oral, la esofagitis y la vaginitis candidiásica. Además, su excelente penetración tisular le convierte en una excelente alternativa en el tratamiento de la endoftalmitis, y la peritonitis o los abscesos intraabdominales producidos por Candida, y su elevada eliminación urinaria es una garantía para el tratamiento de la cistitis/pielonefritis candidiásica.
A partir del estudio de Rex et al22 fluconazol es considerado por la mayor parte de los autores como el tratamiento de elección de la candidemia en pacientes inmunocompetentes, al demostrarse que su eficacia es similar a la de la anfotericina B y su toxicidad mucho menor. En el caso de pacientes inmunodeprimidos, la información disponible es de menor calidad, por lo que la elección de fluconazol o anfotericina B para el tratamiento de la candidemia o candidiasis invasiva en esa población es motivo de controversia. Más clara parece la elección de fluconazol en el tratamiento de la candidiasis crónica diseminada (candidiasis hepatoesplénica) del enfermo oncológico23.
Desafortunadamente, algunas especies de Candida no albicans, fundamentalmente C. glabrata y C. krusei no son sensibles a fluconazol, por lo que en situaciones epidemiológicas en las que la presencia de estas levaduras sea probable no debe emplearse fluconazol en el tratamiento empírico de la candidemia hasta disponer de la identificación final de la levadura. En ese sentido, se debe evitar el uso de fluconazol en el tratamiento inicial de la candidiasis en pacientes que reciben profilaxis con azoles.
Infección por Criptococcus
El uso de fluconazol en la meningitis criptocócica en pacientes con SIDA se ha evaluado en varios estudios. El más importante de ellos valoró casi a 200 pacientes y demostró que fluconazol era globalmente igual de eficaz que anfotericina B en el tratamiento de la meningitis por criptococo; sin embargo, la rapidez con la que el cultivo del LCR se negativizaba en los enfermos que recibían anfotericina B era mayor que en los tratados con fluconazol, y la mortalidad durante las primeras 2 semanas de tratamiento era mayor en los pacientes que recibieron este último fármaco24. A partir de este estudio, varios autores han probado la eficacia de fluconazol como tratamiento de consolidación de la meningitis criptocócica tras un tratamiento de inducción durante 2 semanas con anfotericina B ± flucitosina25.
Existe mucha menos información sobre la utilidad de fluconazol en pacientes con meningitis criptocócica sin infección por VIH, lo cual sugiere una actitud similar a la observada en los pacientes con SIDA.
Profilaxis de la infección fúngica en el paciente inmunodeprimido
Fluconazol ha demostrado ser un fármaco eficaz en la prevención de la infección fúngica, fundamentalmente la producida por Candida, en diferentes poblaciones de pacientes inmunodeprimidos. En ese sentido, existe sólida evidencia de que la administración profiláctica de fluconazol en dosis de 400 mg al día reduce la infección por Candida en receptores de un trasplante alogénico de médula ósea26,27. Más aún, con este régimen profiláctico, algún estudio ha documentado, también, una reducción en la mortalidad atribuible a IFI, y en la incidencia de enfermedad injerto contra huésped28. Por el contrario, la eficacia de fluconazol en la reducción de la incidencia de IFI en pacientes con neoplasias hematológicas pero no sometidos a un trasplante alogénico de médula ósea, es dudosa29.
Asimismo, fluconazol a dosis de 100-400 mg al día reduce de manera significativa la infección por Candida en el paciente sometido a un trasplante hepático o pancreático30,31. Muy recientemente, un estudio aleatorizado, controlado con placebo, ha demostrado que la administración de fluconazol en niños prematuros de muy bajo peso es capaz de reducir la incidencia de infección profunda por Candida32. La utilidad de la profilaxis con fluconazol en la prevención de la infección por Candida en pacientes críticos es objeto de controversia33.
Tratamiento empírico de la neutropenia febril
Winston et al34 compararon la eficacia de ABD y fluconazol en pacientes con neutropenia profunda y fiebre persistente a pesar de un tratamiento antibacteriano de amplio espectro. En este estudio, la eficacia de ambos fármacos fue similar, y fluconazol fue el más seguro.
Otras infecciones fúngicas
Fluconazol es utilizado con éxito en el tratamiento de las infecciones por hongos regionales como coccidioidomicosis, y constituye una alternativa a itraconazol en el tratamiento de histoplasmosis y esporotricosis. Fluconazol no está indicado en el tratamiento de las infecciones por hongos filamentosos.
Toxicidad-interacciones medicamentosas
Fluconazol es un fármaco seguro y generalmente bien tolerado. Sólo se requiere la suspensión en el 1-2% de los pacientes tratados. El efecto secundario más común son las molestias gastrointestinales, la cefalea y el exantema cutáneo. Más raramente pueden encontrase elevaciones moderadas de las enzimas hepáticas que, de manera excepcional, pueden desembocar en cuadros de hepatitis grave. En tratamientos prolongados y con dosis elevadas se ha descrito la aparición de alopecia.
Las interacciones medicamentosas de fluconazol son mucho menos importantes que las asociadas al uso de itraconazol y voriconazol (véase más adelante). En general, fluconazol a dosis superiores a 200 mg/día puede ocasionar aumentos significativos de las concentraciones sanguíneas de fenitoína, glipicida, gliburida, tolbutamida, dicumarínicos o ciclosporina. La rifampicina disminuye las concentraciones sanguíneas de fluconazol en alrededor del 25%.
Itraconazol
Itraconazol es un derivado triazólico activo por vía oral, introducido en el tratamiento de las micosis sistémicas en 1992. Su actividad antifúngica es más amplia que la de fluconazol e incluye Aspergillus, pero sus propiedades farmacocinéticas son menos favorables que las de este último fármaco35 (tablas 3-5).
Espectro de actividad antifúngica
Itraconazol tiene una excelente acitividad in vitro frente a levaduras, incluidas algunas especies de Candida resistentes a fluconazol, aunque también tiene escasa actividad frente a C. krusei. La mayoría de las cepas de Cryptococcus neoformans son sensibles. Aspergillus fumigatus presenta unas CIM entre 0,01 a 1,0 mg/l siendo superiores para otras especies, como A. niger. Los zigomicetos, en cambio, no son sensibles, como tampoco lo son las especies de Fusarium.
Farmacocinética-farmacodinámica
El itraconazol está disponible actualmente en forma de cápsulas y de solución oral, que usa como excipiente ciclodextrina para favorecer su absorción. En este momento, no existe en el mercado español, pero sí en algunos otros países, una presentación de itraconazol para su administración parenteral.
Itraconazol es, al contrario que fluconazol, insoluble en agua y muy soluble en lípidos. La absorción oral de la presentación de itraconazol en cápsulas necesita un ambiente ácido, por lo que ésta se incrementa si se administra tras las comidas o junto a bebidas de cola o con zumos de frutas. Por el mismo motivo, la absorción disminuye con la administración de fármacos que reducen la acidez gástrica (antiácidos, omeprazol, ranitidina, etc.), o en pacientes con hipo o aclorhidria (pacientes oncológicos, con infección por VIH, etc.). Debido a que la absorción oral es tan errática, muchos autores recomiendan la medición de las concentraciones plasmáticas de itraconazol. La solución oral se absorbe mejor que las cápsulas gracias a su unión a ciclodextrina y no se ve modificada por el pH gástrico. La solución oral es más conveniente para lactantes, niños pequeños y pacientes neutropénicos con mucositis, en los que prácticamente ha desplazado a la formulación en comprimidos.
El itraconazol se une a las proteínas en un 99%. Posee una semivida de 15-24 h; alcanza concentraciones mínimas en el LCR y la saliva, pero muy elevadas en muchos tejidos, incluido el cerebro. Para llegar al estado de equilibrio se necesitan más de 10 días, por lo que los valores plasmáticos se deben medir a partir de entonces.
La metabolización, que se produce en el hígado, es muy elevada y solamente un 1% se elimina como producto activo en orina. Los datos de que se dispone indican que la insuficiencia renal no afecta a la farmacocinética del preparado, por lo que es necesario ajustar la dosis en caso de insuficiencia hepática.
Indicaciones clínicas
Infecciones por Candida
Itraconazol es una alternativa válida a fluconazol en el tratamiento de la infección orofaríngea por Candida (muguet), tanto en pacientes con infección por VIH como sin ella. Hay que tener presente que las cepas de Candida resistentes a fluconazol exhiben CIM relativamente elevadas frente a itraconazol, por lo que el tratamiento con este último fármaco debe efectuarse con dosis más elevadas, y con frecuencia aparece resistencia cruzada. La eficacia de itraconazol oral en el tratamiento de la candidiasis sistémica no se ha estudiado de forma sistemática, por lo que habrá que esperar los resultados que se obtengan en los ensayos con la formulación intravenosa.
Infecciones por Aspergillus
No existen estudios aleatorizados que hayan comparado la eficacia de itraconazol con la de anfotericina B en el tratamiento de la aspergilosis invasiva. Sin embargo, sí existen estudios no comparativos en pacientes con formas clínicas diversas de aspergilosis invasiva tratados con itraconazol. En los dos más importantes se incluyeron 202 pacientes, obteniéndose una respuesta favorable (completa o parcial) en el 39 y 63% de los pacientes, respectivamente36,37. Más recientemente, Caillot et al38 han evaluado la utilidad de itraconazol intravenoso seguido de itraconazol oral (en cápsulas) en el tratamiento de la aspergilosis invasiva, obteniendo una respuesta favorable en el 48% de los casos. Por otro lado, el itraconazol se ha utilizado frecuentemente, y durante períodos prolongados de tiempo, como tratamiento de "consolidación" de los pacientes con aspergilosis invasiva tras el tratamiento inicial con anfotericina B.
Infección por Criptococcus
El itraconazol constituye una alternativa válida al fluconazol en el tratamiento de "consolidación" de la meningitis criptocócica, tras el tratamiento de inducción con anfotericina B y flucitosina.
Prevención de la infección fúngica en el paciente inmunodeprimido
En pacientes sometidos a un trasplante alogénico de médula ósea, Winston et al39 han demostrado recientemente que la administración secuencial de itraconazol intravenoso seguido de la solución oral del fármaco fue más eficaz en la prevención de la IFI que fluconazol.
Por el contrario, en receptores de un trasplante de hígado itraconazol no fue más eficaz que fluconazol en la prevención de la IFI y produjo, además, un mayor número de efectos secundarios40. La experiencia de administración profiláctica de itraconazol en otro tipo de trasplantes es anecdótica. Su eficacia se ha comunicado en series pequeñas y en estudios no comparativos de receptores de trasplante cardíaco y pulmonar.
Tratamiento empírico de la neutropenia febril
Boogaerts et al41 han comparado la eficacia de ABD e itraconazol por vía intravenosa seguido de solución oral del fármaco en pacientes con neutropenia y fiebre que no responde a un tratamiento antibiótico de amplio espectro. El itraconazol fue tan eficaz como la anfotericina B en la prevención de la IFI en estos pacientes, la mortalidad fue similar en ambos grupos y la eficacia global de ambos fármacos no fue significativamente diferente. Sin embargo, la utilización de itraconazol se asoció con menos efectos secundarios (19% de abandonos por toxicidad entre los tratados con itraconazol frente al 38% en el grupo de anfotericina B).
Otras infecciones fúngicas
El itraconazol es el tratamiento de elección de la esporotricosis, la blastomicosis, cuando no existe afectación del SNC, paracoccidioidomicosis, faeohifomicosis e histoplasmosis en pacientes inmunocompetentes en ausencia de afectación meníngea42.
Toxicidad e interacciones medicamentosas
La administración en cápsulas, de itraconazol generalmente es bien tolerada y, en pacientes no neutropénicos, menos del 5% de los enfermos abandonan la medicación por efectos adversos. En tratamientos cortos, la intolerancia digestiva, el prurito, la cefalea y vértigo son los síntomas más comunes. La diarrea, las náuseas y otros trastornos gastrointestinales son más frecuentes con la solución oral que con los comprimidos, seguramente por el efecto osmótico o a las sales biliares unidas a la ciclodextrina. Entre el 1 y el 2% de los pacientes tratados pueden presentar elevaciones transitorias y asintomáticas de las transaminasas y se han descrito casos excepcionales de hepatitis tóxica atribuidas al itraconazol. Se han demostrado algunos casos de hipopotasemia e hipertensión moderada en tratamientos prolongados.
En los animales de experimentación se ha apreciado un efecto embriotóxico y teratogénico, por lo que su uso está contraindicado durante el embarazo y la lactancia.
Las numerosas interacciones del itraconazol con otros fármacos pueden dificultar su empleo. La rifampicina, rifabutina, isoniacida, fenitoína, carbamacepina, fenobarbital y cisaprida disminuyen los valores sanguíneos de itraconazol.
El itraconazol, a su vez, reduce las concentraciones sanguíneas de rifampicina y aumenta las de los antihistamínicos terfenadina y astemizol, y puede provocar taquicardia ventricular polimorfa (torsades de pointes), así como aumento de las concentraciones de cisaprida, dicumarínicos, benzodiacepinas, bloqueantes de los canales del calcio, digoxina, quinidina, ciclosporina, tacrolimus, metilprednisolona, inhibidores de la proteasa del VIH (ritonavir, indinavir) y los alcaloides de la VINCA (vincristina, vinblastina).
Voriconazol
Voriconazol es el último antifúngico azol que se ha incorporado al mercado. Como se explicará con detalle en los siguientes párrafos, se trata de un fármaco que comparte características farmacocinéticas y de actividad antifúngica tanto con fluconazol como con itraconazol43 (tablas 3-5).
Espectro de actividad antifúngica
Voriconazol es, entre los azoles disponibles en el mercado, el que tiene una mayor actividad antifúngica. Es activo frente a Candida, incluyendo las especies que como C. glabrata o C. krusei que son resistentes al fluconazol o al itraconazol, aunque frente a estas las CIM son mayores que para otras especies de Candida. Además, es un fármaco activo frente a Cryptococcus, Trichosporon aspergillus, Fusarium, Scedosporium, Bipolaris y hongos regionales como Histoplasma, Blastomyces o Coccidioides, pero no frente a zigomicetos.
Farmacocinética-farmacodinámica
Voriconazol posee una biodisponibilidad oral excelente, casi igual que la de la vía intravenosa, siempre que se administre una hora antes o una hora después de la comida. La forma intravenosa lleva ciclodextrina como excipiente. El estado de equilibrio se alcanza tras 5 o 6 días de tratamiento, pero si se da una dosis de carga de 6 mg/kg cada 12 h el estado de equilibrio se podría alcanzar el primer día. En animales y en seres humanos alcanza concentraciones en LCR que son aproximadamente un 50% de las del plasma.
Se metaboliza en el hígado vía citocromo P-450 y sus metabolitos carecen de actividad antifúngica. Se necesita un ajuste de la dosis en pacientes con deterioro moderado de la función hepática y su empleo debería ser sopesado en pacientes con una insuficiencia hepática grave. La eliminación renal de voriconazol sin metabolizar es escasa, por lo que la formulación oral no precisa ajuste de dosis en presencia de insuficiencia renal, pero la administración de la forma intravenosa debería ser limitada a aquellos pacientes que no tengan insuficiencia renal grave (aclaramiento de creatinina > 50 ml/min), ya que el excipiente (ciclodextrina) puede acumularse.
Indicaciones clínicas
Infecciones por Candida
El voriconazol ha demostrado ser tan eficaz como fluconazol en el tratamiento de la esofagitis candidiásica en pacientes con SIDA. Además, en un pequeño estudio no comparativo, voriconazol fue capaz de curar a pacientes con esofagitis candidiásica que no habían respondido previamente al tratamiento con fluconazol44,45.
Más recientemente, Perfect et al46 han publicado los resultados del tratamiento de "rescate" de diferentes infecciones fúngicas en los que se administró voriconazol tras el fracaso o la toxicidad grave asociada al uso de otro/s fármacos antifúngicos. En el caso de la infección por Candida, voriconazol obtuvo una respuesta favorable en el 58% de los pacientes con infección "refractaria" por Candida.
Por el momento, no existen datos sólidos publicados sobre la eficacia de voriconazol en el tratamiento de la candidemia o la candidiasis invasiva, aunque los resultados de un estudio comparativo frente a anfotericina B, aunque se espera que sean comunicados en los próximos meses.
Infecciones por Aspergillus
La eficacia de voriconazol en el tratamiento de la aspergilosis invasiva se ha evaluado en dos estudios diferentes. En el primero de ellos, Denning et al47 realizaron un estudio abierto y no comparativo sobre la eficacia de voriconazol en el tratamiento de aspergilosis, bien como tratamiento de primera línea o bien tras el fracaso de otro fármaco antifúngico. En ese estudio, voriconazol obtuvo una respuesta favorable (completa o parcial) en el 59% de los casos cuando se administró como tratamiento inicial, y del 38% en los pacientes que habían fracasado con otro tratamiento antifúngico.
Más recientemente, Herbrecht et al48 han comparado en un ensayo aleatorizado la eficacia de voriconazol frente a anfotericina B en 277 pacientes con aspergilosis invasiva. A las 12 semanas de iniciarse el tratamiento antifúngico se obtuvo una respuesta favorable en el 53% de los pacientes tratados con voriconazol frente a sólo el 32% de los que recibieron anfotericina B, siendo la primera vez que un fármaco antifúngico demuestra no sólo ser más eficaz que la anfotericina B en el tratamiento de la aspergilosis invasiva, sino que su utilización redujo de manera significativa la mortalidad en los pacientes que lo recibieron (71% frente a 58%).
Tratamiento empírico de la neutropenia febril
Walsh et al49 compararon en un estudio amplio y aleatorizado la eficacia y seguridad de voriconazol frente a ABL en el tratamiento empírico de pacientes neutropénicos con fiebre persistente. En el grupo tratado con voriconazol existieron menos IFI, pero en el índice compuesto para valorar la eficacia global del tratamiento en los pacientes tratados con voriconazol no alcanzó a cumplir el límite prefijado en el diseño del estudio para aceptar que el fármaco no fuera inferior a la ABL, por lo que las agencias reguladoras, tanto en Estados Unidos como en Europa no han aceptado la inclusión de esta indicación en los usos clínicos de voriconazol. Tanto el diseño del estudio como esta decisión han sido objeto de una gran controversia.
Otras infecciones fúngicas
Voriconazol es un fármaco muy prometedor en el tratamiento de las infecciones por hongos filamentosos emergentes. En ese sentido, en el ya referido trabajo de Perfect et al46 en los que se administró voriconazol tras el fracaso o la toxicidad grave asociada al uso de otros fármacos antifúngicos, se obtuvo una respuesta favorable en el 46% de las infecciones por Fusarium, el 90% de las infecciones por Penicillium y en el 30% de las producidas por Scedosporium.
A pesar de sus excelentes propiedades farmacocinéticas y de su potente actividad in vitro, no existen, por el momento, trabajos que hayan evaluado la eficacia del uso de voriconazol en el tratamiento de otras infecciones fúngicas, como criptococosis, histoplasmosis, blastomicosis, etc.
Toxicidad e interacciones medicamentosas
El voriconazol es un fármaco generalmente bien tolerado. El efecto secundario más común, único entre los azoles, es un trastorno reversible de la visión (fotopsia) que ocurre hasta en el 30% de los pacientes, pero que generalmente no obliga a suspender el tratamiento. Por frecuencia, el siguiente efecto secundario más común es la aparición de exantema cutáneo que sólo excepcionalmente es grave, aunque los pacientes deben ser avisados de la potencial fotosensibilización asociada a la utilización de voriconazol y evitar la exposición directa al sol.
Como ocurre con otros azoles, el uso de voriconazol produce en algunos casos elevaciones de las enzimas hepáticas, generalmente leves, aunque se han descrito algunos casos de hepatitis grave. Otros efectos adversos menos comunes son los vómitos, la diarrea, el dolor abdominal y las alucinaciones visuales.
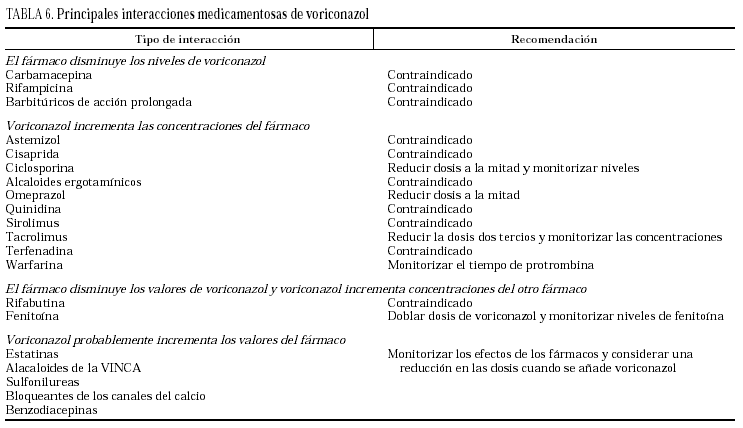
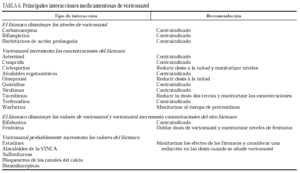
Debido a su metabolización a través de las isoenzimas del citocromo P-450, el potencial de interacciones medicamentosas de voriconazol es elevado. En la tabla 6 se resumen las interacciones más importantes.
Caspofungina
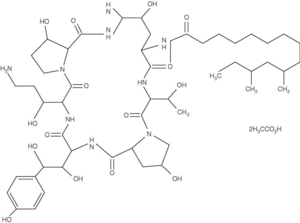
Caspofungina es el primer representante de una nueva familia de antifúngicos denominados equinocandinas que se caracterizan por actuar en una diana fúngica, la pared del hongo, distinta de la del resto de los antifúngicos disponibles (fig. 3)50 (tablas 3-5).
Figura 3. Estructura química de la caspofungina.
Estructura química y mecanismo de acción
Caspofungina es un lipopéptido cíclico semisintéticos con una cadena lateral N-acil que fue sintetizado a partir de un producto de fermentación de Glarea lozoyensis, un hongo aislado en las riberas del río Lozoya. Actúa inhibiendo la síntesis del 1,3-β -D-glucano, componente clave de la pared de la célula fúngica, lo que provoca inestabilidad osmótica e impide sus funciones de crecimiento y replicación. El 1,3-β -D-glucano no está presente en las células de los mamíferos, lo que explicaría la escasa toxicidad del fármaco sobre la célula humana.
Espectro de actividad antifúngica
No existe, todavía, un método de referencia para valorar las CIM de la caspofungina frente a levaduras y hongos filamentosos, por lo que hay que ser muy cauto en la extrapolación de los datos in vitro a la actividad in vivo que es mejor valorada en los modelos animales. Con esta limitación, la caspofungina es activa frente a Aspergillus spp. y frente a otros hongos filamentosos como Alternaria spp., Exophiala jeanselmei, Curvularia lunata, Fonsecaea pedrosoi, Paceiloyces variotii y Scedosporium apiospermum y tiene una potente actividad fungicida in vitro e in vivo frente a Candida spp., incluidas C. krusei, C. glabrata y C. dublinensis. También son activas frente a algunos hongos dimórficos como H. capsulatum, Coccidioides immitis o Blastomyces dermatitidis. Por el contrario, no presentan actividad in vitro frente a Cryptococcus neoformans, Trichosporon beigelii, ni frente a hongos dematiáceos, Rhizopus spp. o Fusarium spp.
Farmacocinética-farmacodinámica
Debido al tamaño de su molécula, la caspofungina es un fármaco de administración exclusiva por vía intravenosa que se dispensa en forma de acetato. Se administra en infusión intravenosa lenta. Los estudios farmacocinéticos han demostrado que una única dosis diaria es suficiente.
La semivida es de 9-11 h, y en el plasma tiene una elevada unión a proteínas (97%), distribuyéndose a los tejidos (fundamentalmente en hígado, bazo y pared intestinal) siguiendo un modelo tricompartimental.
Caspofungina es metabolizada en el hígado mediante hidrólisis y acetilación, lo cual genera varios metabolitos sin actividad antifúngica reseñable, eliminándose una pequeña cantidad sin cambios por la orina, por lo que no precisa ajustes de la dosis en casos de insuficiencia renal. Caspofungina no es dializable, por lo que no es necesario repetir su administración tras una sesión de diálisis. En el caso de enfermos con insuficiencia hepática moderada-grave (más de 7 puntos en la escala de Child) se recomienda reducir la dosis de mantenimiento a 35 mg/día. No existe experiencia con la administración de caspofungina en pacientes con insuficiencia hepática grave (más de 9 puntos en la escala de Child).
Tampoco es necesario adaptar las dosis de caspofungina en los pacientes ancianos o de razas diferentes a la caucásica. El fármaco no se ha estudiado adecuadamente en personas menores de 18 años.
Indicaciones clínicas
Infecciones por Candida
Caspofungina ha demostrado una eficacia comparable a la de anfotericina B y fluconazol en el tratamiento de pacientes, la mayor parte de ellos con SIDA, con candidiasis orofaríngea y esofágica51,52. Más recientemente, Kartsonis et al53 han demostrado que caspofungina es eficaz en el tratamiento de esofagitis candidiásica refractaria al tratamiento con fluconazol.
Caspofungina ha sido comparada con ABD en el tratamiento de pacientes adultos, la mayor parte no neutropénicos, con candidemia mediante un ensayo clínico aleatorizado y doble ciego54. En este estudio se consiguió éxito
terapéutico en el 73% de los pacientes tratados con caspofungina frente al 62% entre los tratados con anfotericina B (p = 0,08). Estas cifras de curación aumentaban al 81 y 65%, respectivamente, si sólo se analizaban los pacientes que habían recibido al menos 5 días de tratamiento (p = 0,03). Como era de esperar, la toxicidad de caspofungina fue muy inferior a la de anfotericina B, y fue necesario suspender la medicación en el 23% de los tratados con anfotericina frente a sólo el 3% de los que recibieron caspofungina.
Infección por Aspergillus
La experiencia existente con caspofungina en el tratamiento de pacientes con aspergilosis invasiva se concreta en los pacientes con aspergilosis "refractaria" al tratamiento antifúngico convencional (generalmente anfotericina B) o que desarrollaron toxicidad grave con el mismo. En esos pacientes seleccionados, Maertens et al55 han demostrado que caspofungina era capaz de producir una respuesta favorable (completa o parcial) en el 45% de los 90 pacientes tratados.
Toxicidad e interacciones medicamentosas
Tal como ya se ha comentado, la caspofungina es un fármaco muy seguro. En los estudios clínicos publicados sólo entre el 3 y el 4% de los pacientes tratados con el fármaco han tenido que abandonar la medicación por efectos adversos. No es nefrotóxico, y, aunque se producen elevaciones de las cifras de transaminasas, éstas son leves y generalmente no están relacionadas con el fármaco.
En algunos casos la administración simultánea de caspofungina y ciclosporina produjo alteración de la función hepática, por lo que, por el momento, no se recomienda la utilización de estos fármacos simultáneamente, excepto si se considera que los beneficios pueden ser superiores a los riesgos. Los niveles de tacrolimus se reducen en aproximadamente un 20% con la administración simultánea de caspofungina, por lo que las concentraciones plasmáticas de aquél deben monitorizarse estrechamente cuando ambos fármacos se administran juntos. El uso concomitante de caspofungina y fármacos inductores enzimáticos como efavirenz, nevirapina, dexametasona, fenitoína o carbamacepina puede producir una reducción en los valores séricos de caspofungina, pero no modifica las concentraciones de anfotericina B, itraconazol o voriconazol.
La mayor disponibilidad de fármacos antifúngicos sistémicos, más seguros y eficaces para el tratamiento de los pacientes con IFI, es un paso imprescindible para mejorar el pronóstico de estas infecciones. Los datos disponibles sobre eficacia clínica de muchos de los fármacos antifúngicos es aún escasa, por lo que sería deseable que en los próximos años la investigación en este campo fuera más intensa, no sólo comparando los diferentes fármacos entre sí, sino evaluando nuevas dosificaciones de éstos, así como la posibilidad de combinar varios de ellos. En los próximos meses el Grupo de Micología Médica (Micomed) de la SEIMC va a publicar en esta misma revista unas guías sobre el tratamiento de la IFI en los que se harán recomendaciones específicas sobre el tratamiento de estas infecciones.