La originalidad consiste en volver al origen.
A. Gaudí
Introducción
El espectacular auge de las resistencias a antibióticos constituye, junto con los patrones de infección compleja asociados a estados de inmunodepresión, una de las problemáticas más graves en la clínica antiinfecciosa. Las soluciones se han limitado en gran medida a la modificación de estructuras antibióticas ya existentes o a terapias de combinación de varios fármacos, mientras que el desarrollo de nuevos diseños de antibióticos o la identificación de nuevas dianas terapéuticas han sido notablemente inferiores.
Desde esta perspectiva, las características ideales de un antibiótico serían la dificultad de inducir resistencia y un amplio rango de patógenos susceptibles. Ambas las cumplen los péptidos antibióticos de origen eucariótico (PAE), presentes en toda la gama de organismos pluricelulares, desde invertebrados y plantas hasta seres humanos.
Su función en vertebrados superiores es colaborar con otros componentes de la inmunidad innata (p. ej., complemento o fagocitosis) para neutralizar, o al menos retrasar, la diseminación de los patógenos mientras se organiza la respuesta antigenoespecífica. Ésta requiere al menos de 2 días1; por su parte, una única bacteria que se duplicara sin restricción cada 50 min originaría 108 en 24 h2.
El presente trabajo expone los aspectos básicos de los PAE y su posible incidencia clínica y farmacológica, centrándose en los PAE humanos, los ensayados como fármacos o aquellos que permitan documentar alguna cuestión específica.
Características fundamentales
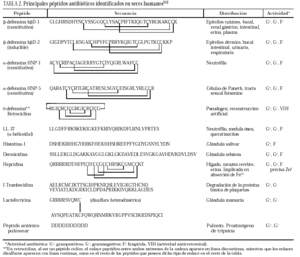
El tamaño medio de los principales PAE varía de 10 a 50 residuos; sin embargo, el límite es arbitrario, ya que existe un rango continuo que incluye proteínas microbicidas (lisozima, proteinasa G, calprotectina, fosfolipasa A2, etc.) de tamaño considerablemente superior. El número de PAE naturales descritos supera los seiscientos3. Los únicos rasgos comunes a la mayoría de ellos son su alta carga neta positiva y su estructura anfipática, con delimitación clara entre zonas polares e hidrofóbicas2.
Los PAE son codificados por genes y sintetizados por el ribosoma como precursores que constan de un péptido señal, seguido de un propéptido aniónico que evita la citotoxicidad intracelular y, en el extremo carboxilo, la secuencia madura activa. Sus modificaciones posteriores son escasas4.
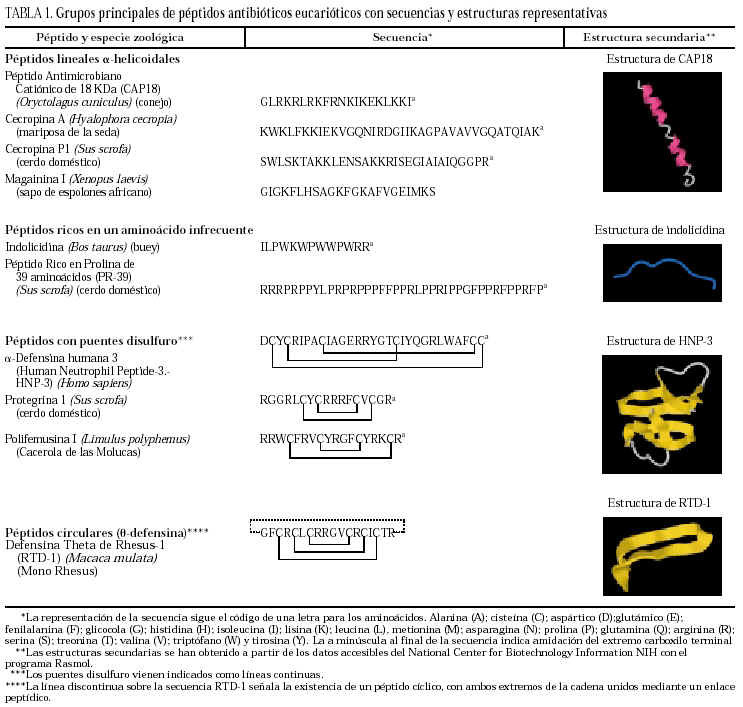
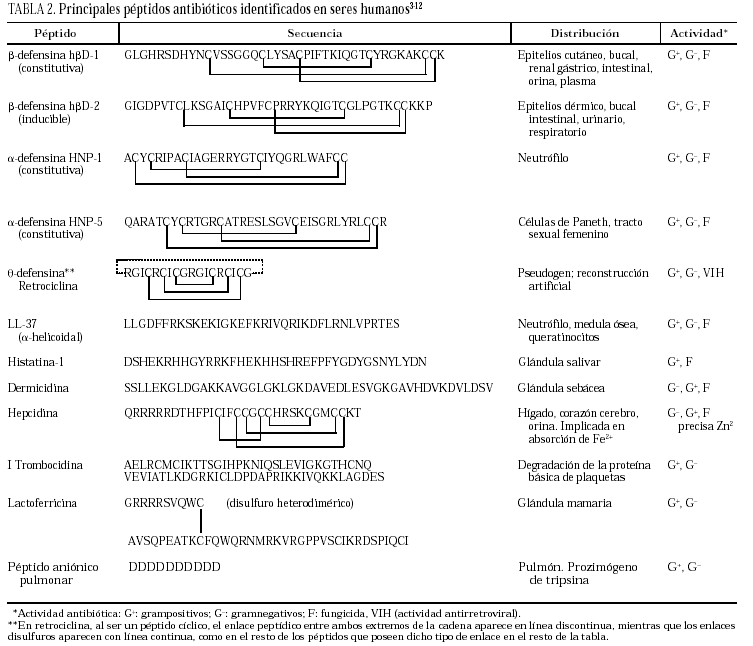
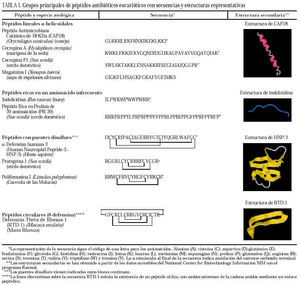
La clasificación estructural de los PAE en grupos, con ejemplos representativos de cada uno de ellos, se detallan en la tabla 13, y los principales PAE humanos y su distribución anatómica en la tabla 23-12. El procesamiento proteolítico de los PAE puede originar nuevas variantes con diferente actividad y especificidad. Como ejemplos, el péptido de neutrófilo humano-2 (HNP-2) es una degradación de la HNP-1 por aminopeptidasas, así como muchas de las isoformas de histatinas de menor tamaño. Toda la panoplia de PAE se complementa con proteínas microbicidas13,14 como la calprotectina, que inhibe el crecimiento bacteriano por disminución de los niveles de Zn++ disponibles; la proteína bactericida por incremento de permeabilidad (BPIP), que permeabiliza las membranas en gramnegativos, neutraliza el lipopolisacárido (LPS) y opsoniza la bacteria; la lisozima, que además de degradar el peptidoglucano posee actividad bactericida intrínseca por su carácter catiónico; la fosfolipasa A2, de neutrófilos y células de Paneth, que degrada preferentemente fosfolípidos bacterianos; el inhibidor de proteinasas secretado de leucocitos (SLPI), presente en numerosas secreciones, con actividad microbicida en su región aminoterminal, o la granulisina de linfocitos T citotóxicos y células asesinas (NK), que interviene mediante acción citolítica directa o induciendo apoptosis en células hospedadoras de patógenos intracelulares.
Mecanismo de acción microbicida
Los PAE actúan rápidamente, reduciendo 3-5 log el número de colonias viables en los primeros minutos. Ello va acompañado de pérdida de homeostasia celular, despolarización de la membrana y liberación de metabolitos intracelulares, debido a la interacción de los fosfolípidos con la estructura anfipática del péptido15.
La especificidad del proceso se basa en el mayor contenido en fosfolípidos aniónicos de la membrana plasmática de los patógenos respecto a eucariotas superiores, donde dichos fosfolípidos se hallan confinados en la cara citoplásmica de la membrana, inaccesibles al péptido. La ausencia de esteroles en la membrana bacteriana y la presencia de un potencial de membrana negativo en el citoplasma, son otros factores secundarios de especificidad.
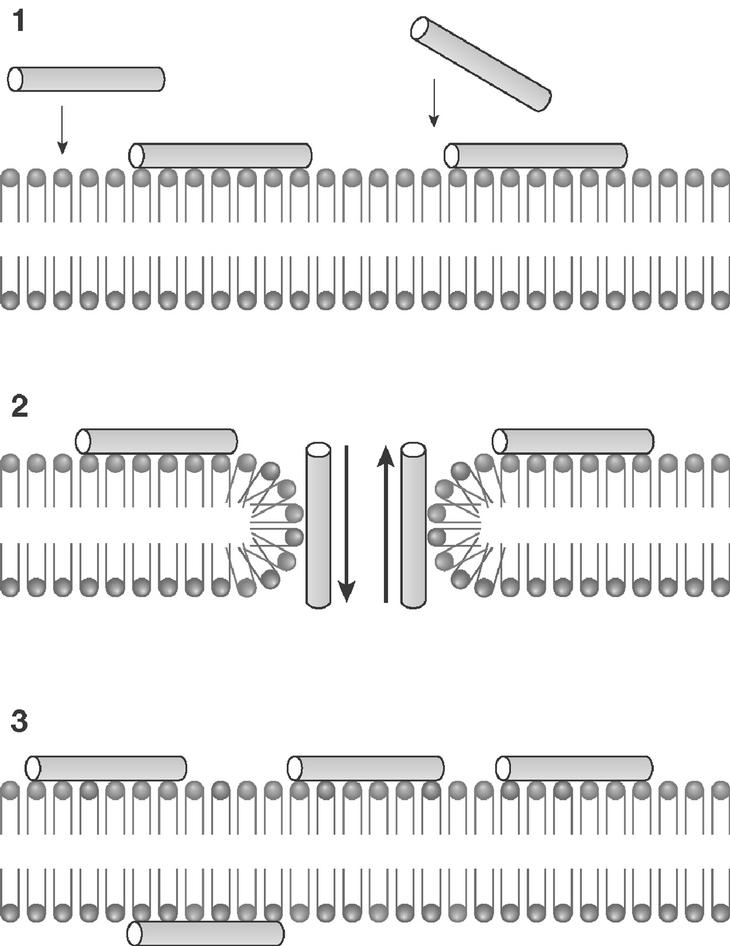
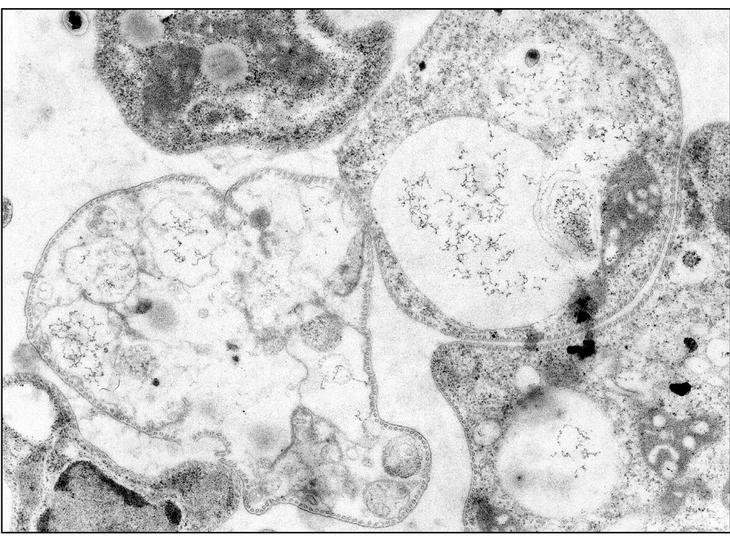
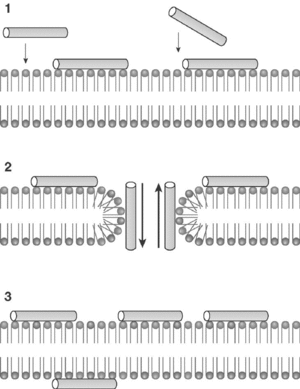
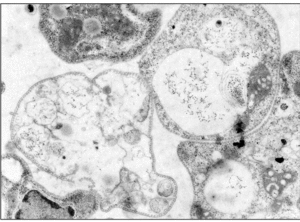
El modelo que mejor describe la acción de la mayoría de PAE es el denominado "agujero de gusano", esquematizado en la figura 1. Comienza por una acumulación de moléculas de péptido en la cara externa de la membrana, por interacción de sus cargas positivas con los fosfolípidos aniónicos. Alcanzada una densidad crítica de péptido, algunas moléculas del mismo tenderían a orientarse perpendicularmente al plano de la membrana, originando poros de estequiometría variable con flujo de metabolitos y pérdida de asimetría de membrana por intercambio de fosfolípidos entre ambas caras. En una etapa final, el poro transitorio se destruiría, relocalizando el péptido a ambos lados de la membrana. En la figura 2 puede observarse la afectación de las membranas de promastigotes de Leishmania donovani tratados con el péptido antibiótico CA(1-8)M(1-18). El daño de la membrana plasmática es suficientemente extenso para provocar la lisis del parásito y la salida del contenido intracelular.
Figura 1. Esquema del modelo de agujero de gusano para la permeabilización de membrana por péptidos antibióticos eucarióticos. I) Acumulación electrostática de péptido en la superficie; II) formación de poro transitorio; III) disolución del poro. La distribución de fosfolípidos se representa en diferentes colores para señalar el intercambio de éstos.
Figura 2. Microscopia electrónica de promastigotes de Leishmania donovani tratados con 12 μg/ml del péptido sintético híbrido cecropina A-melitina CA(1-8)M(1-18). Obsérvese el daño a la membrana plasmática, con pérdida del contenido intracelular para muchos de los organismos (Por cortesía de A. Guinea y P. Díaz-Achirica) (× 24.150).
La acción de los PAE es estequiométrica y no por inhibición enzimática o de sistemas de adquisición de nutrientes, como la mayoría de antibióticos clásicos. Al ser la membrana un sistema biológico universal, intentar diseñar péptidos más activos aumentando excesivamente su afinidad por membranas ocasionaría pérdida de especificidad y, con ello, efectos citotóxicos. Numerosos intentos de manipulación estructural no han conseguido obtener concentraciones inhibitorias mínimas (CIM) inferiores a 1 μM (~3-10 μg/ml). Por otra parte, y en el aspecto positivo, la inducción de resistencias exigiría un cambio radical en la composición de los fosfolípidos de la membrana plasmática, como diana de actuación para los PAE, con afectación simultánea de los numerosos sistemas enzimáticos y de transporte de ésta, procesos altamente improbables.
En gramnegativos, los PAE deben primero desorganizar la membrana externa, por interacción con el lipopolisacárido aniónico al igual que la polimixina, para acceder a la membrana interna, su diana final2. Por otra parte, la membrana no siempre es el objetivo final; algunos PAE poseen dianas intracelulares específicas (p. ej., la mitocondria para las histatinas)16.
Algunos PAE son activos frente a virus con membrana como herpes, estomatitis viral, gripe y virus de la inmunodeficiencia (VIH). El mecanismo de acción no siempre implica la destrucción de la membrana, sino que pueden inhibir la fusión viral7 o la transcripción.
La actividad in vivo de los PAE se ve modificada por factores ambientales. Niveles altos de Ca++ o Mg++, alta salinidad, polisacáridos aniónicos (heparina o alginato bacteriano) o complejación con proteínas tienen efecto inhibitorio. La propia célula diana puede modular la acción microbicida del PAE mediante enzimas de superficie (ADP-ribosilación de la HNP-1; reducción de disulfuros de la NK-lisina). Por otra parte, las concentraciones locales de PAE secretadas por estímulo microbiano son muy superiores a las de ensayos en fase fluida y pueden actuar sinérgicamente con otros PAE, incrementando su eficacia letal8,13,14.
Aunque PAE como las defensinas del neutrófilo, las criptidinas, la β1-defensina o las histatinas se producen constitutivamente en ausencia de estímulo; la biosíntesis de otros muchos PAE viene regulada a nivel de la transcripción del ARN mensajero (ARNm) por estímulos bacterianos o inflamatorios (LPS, lipoproteína bacteriana, etc.) a través de vías de señalización complejas que pueden variar con el tejido. La activación de los PAE, sintetizados como precursores, requiere la eliminación proteolítica de su prosegmento inhibidor mediante proteinasas específicas. Los PAE como el LL-37, las defensinas mieloides o las criptidinas se almacenan en gránulos. Para los dos primeros, la descarga en el fagosoma tiene lugar tras la ingestión del patógeno. Para las criptidinas, los gránulos se vierten a la luz de las criptas de Lieberkühn tras estimulación de las células de Paneth por bacterias o estímulos colinérgicos debidos a la llegada de comida. A la posterior distribución de criptidinas a la luz intestinal y zonas vecinas contribuye el flujo hídrico resultante de la activación de canales de Cl por las propias criptidinas5.
Función fisiológica
La complejidad de la respuesta inmunitaria humana y la coexistencia de diferentes PAE en una misma localización dificultan la asignación de la contribución individual de cada uno de ellos. Sin embargo, hay suficientes evidencias sobre su papel en las fases tempranas de defensa:
1. El síndrome de deficiencia gránulo-específico, caracterizado por la carencia de gránulos azurófilos, y en consecuencia de defensinas, cursa con infecciones frecuentes y graves en las personas que lo padecen; de igual manera, los pacientes que padecen morbus Kostmann, una deficiencia congénita recesiva que cursa con neutropenia y ausencia de LL-37 en la saliva, padecen infecciones recurrentes y periodontitis crónicas17.
2. Hay correlación entre los niveles de PAE y la gravedad de la infección. Así, la defensina hβD-2 experimenta un incremento local en la neumonía, en la infección por Mycobacterium avium-intracellulare, acné o enteritis bacteriana. A la inversa, niveles bajos de granulisina se asocian a la lepra diseminada en comparación con la tuberculoide, los de histatinas con oromucositis por Candida albicans en pacientes con síndrome de inmunodeficiencia adquirida (SIDA), o infecciones en quemadura por ausencia de hβD-25. Recientemente se ha descrito en la revista Science por Zhang y cols la contribución de las defensinas HNP1, HNP2 y HNP3, al denominado factor antiviral CD8 (CAF), que suprime la replicación de VIH. Dicho factor es producido por los linfocitos citotóxicos de aquellos pacientes donde la enfermedad no progresa en años y mantienen la competencia inmunológica.
3. La concentración fisiológica de los PAE es microbicida: las criptidinas en las criptas de Lieberkühn y las defensinas mieloides en el fagosoma superan los 3 mg/ml. Incluso la β-defensina 1 bovina, un PAE secretado constitutivamente, alcanza de 20 a 100 μg/ml en el epitelio lingual.
4. Se ha observado correlación entre gravedad de la infección y anulación de la actividad de los PAE, p. ej., en ratón por knock-out de genes de PAE como β -defensina 1 o cnbD-1 (equivalente murino de LL-37), o de enzimas de procesamiento. La controvertida mayor salinidad del fluido broncoalveolar en pacientes de fibrosis quística sería responsable de la inhibición de la actividad de la hβD-118. También se observa correlación significativa entre resistencia a PAE y gravedad de la infección, demostrada para estreptococo respecto a LL-3719, para Salmonella respecto a criptidina o para Staphylococcus aureus respecto a la proteína básica de plaquetas.
Mecanismos de resistencia microbiana
Los PAE no constituyen una panacea universal contra las infecciones. La resistencia de determinadas cepas o especies se restringe a una determinada clase de PAE. En general, estos fenómenos son constitutivos o inducidos por otros estímulos; pero muy raramente se asocian a la inducción por presencia de PAE20.
La expresión de hβD-1 y LL-37 es inhibida por Shigella a través de su ADN plasmídico por un mecanismo todavía desconocido. La infección por Yersinia inhibe, a través de mecanismos de secreción tipo III, la señalización por vía NF-κB, esencial para la expresión de numerosos PAE.
Por otra parte, el patógeno puede impedir el acceso del PAE a la membrana plasmática mediante barreras fisicoquímicas. Entre éstas, la más externa es la matriz del biofilm bacteriano, particularmente rica en alginato aniónico. El LPS puede presentar modificaciones que impidan su interacción con PAE21. Su ausencia en Treponema denticola, una mayor longitud del antígeno O en S. tiphymurium y Burkholderia cepacia, o su sustitución con grupos aniónicos ácido urónico en Bordetella bronchiseptica o fosforilcolina en Haemophilus influenzae provocan resistencia a los PAE.
La activación de los sistemas PhoP-PhoQ y PMrA-PMrB de Salmonella21, relacionados con la virulencia, ocasionan resistencia de la bacteria a PAE, por palmitoilación adicional del lípido A que disminuye la fluidez de la membrana externa y dificulta la penetración del PAE, así como por reducción de los sitios aniónicos de unión de PAE en el lípido A. La disminución de carga negativa en el peptidoglicano de grampositivos también implica una mayor resistencia de S. aureus a los PAE20, rasgo también asociado a una mayor capacidad de colonización de superficies.
El alto contenido en proteasas en Proteus y Serratia es causa de su baja susceptibilidad a los PAE1. Otros ejemplos son la proteasa pgtE en Salmonella, la OmpT en Escherichia coli, ambas de membrana externa y dependientes de PhoP-PhoQ21, o la cisteinproteasa de Porphyromonas gingivalis, que degradan histatinas9. Otras bacterias poseen proteasas que actúan sobre la matriz extracelular de las células eucarióticas, liberando fragmentos del polisacárido aniónico dermatán sulfato que neutraliza la actividad del PAE.
En mutantes de S. aureus resistentes a LL-37, la conjugación de fosfatidilglicerol a lisina supone la conversión de un fosfolípido aniónico en catiónico, impidiendo la unión de LL-37 a la membrana interna20. Otros mecanismos de resistencia, descritos en Neisseria, Salmonella, Vibrio flescheri, S. aureus y Yersinia20 actúan mediante extrusión de péptidos unidos a la membrana por sistemas de transporte dependientes de energía.
Otras actividades
Control de la flora bacteriana
La inhibición de la producción de PAE en anfibios determina infecciones entéricas por flora bacteriana de piel y boca22. En mamíferos hay resultados dispares sobre la estimulación de producción de PAE por la flora local: la expresión de criptidinas es idéntica en ratones crecidos en ausencia o presencia de microorganismos22, la de hβD-2 en epitelio bucal se estimula por el comensal Fusobacterium nucleatum, mientras que en otros tejidos epiteliales sólo es inducida por bacterias patógenas.
Acción antiendotóxica
La interacción de PAE con LPS y ácidos teicoicos inhibe efectos como la producción de factor alfa de necrosis tumoral (TNF-α) e interleucina 1 (IL-1). Los PAE impiden la unión del LPS a la proteína de unión de lipopolisacárido, que cataliza su transferencia a CD14 y dispara las correspondientes vías de transducción de señales1. Una consecuencia importante es que la eliminación bacteriana causada por PAE cursa con baja respuesta inflamatoria y ausencia de shock endotóxico, en contraposición a otros antibióticos clásicos, que promueven la liberación de LPS2.
Cooperación de los PAE con la inmunidad antígeno específica
Las α- y β-defensinas y LL-37 son quimiotácticos para otras células del sistema inmunitario a concentraciones muy inferiores a las microbicidas23; HNP1 y HNP2 lo son para las células T y los monocitos; hβD-1 y hβD-2 para las células dendríticas inmaduras, pero no para las maduras; hβD-3 para los monocitos periféricos y macrófagos, y hβD-4 para monocitos23. En ciertos casos se han identificado los respectivos receptores; la homología estructural entre quimiocina 6 y hβD-2 les permite compartir el receptor CCR6. La relación PAE-quimiocina es recíproca; las quimiocinas inducidas en monocitos por interferón gamma (CXC9, CXCL10 y CXCL11) son microbicidas, así como las trombocidinas procedentes del procesamiento de quimiocinas plaquetarias12. La quimiotaxis se activaría sólo cuando la actuación microbicida, ya sea por PAE o quimiocinas, fracasara; las células presentadoras atraídas por el quimiotactismo se encontrarían fragmentos de patógeno unidos a PAE o quimiocina, favoreciendo su unión a la superficie, su posterior procesamiento y, finalmente, su presentación antigénica23.
Otras actuaciones de los PAE en la respuesta microbicida global son la inhibición de producción de cortisoles por HNP, la liberación de histamina de células cebadas y la promoción de la regeneración tisular1.
Aplicaciones farmacológicas de los PAE
Las expectativas creadas por la actuación de los PAE en la Naturaleza y en modelos animales con protegrinas, histatinas, magaininas y cecropinas4,5,8,9,13 han promovido una extensa investigación tendente a su aplicación clínica.
La interacción fármaco-membrana como base de la actividad microbicida del primero se ha descrito para polimixina, gramicidina2 o anfotericina B. La novedad de los PAE respecto a estos fármacos radica, primero, en su menor citotoxicidad y, por otro lado, y ahí reside quizá su principal ventaja, en el amplio rango de patógenos susceptibles, ya que es muy frecuente que un mismo PAE actúe en grampositivos y gramnegativos y además sea fungicida4. Sólo hay ejemplos concretos de resistencia cruzada para polimixina B y PAE, debido a que comparten el mecanismo de autopromoción a través de la membrana externa, pero únicamente los PAE permeabilizan la membrana interna a su CIM, permitiéndoles actuar sobre cepas resistentes a polimixina B24. Respecto a la gramicidina, los PAE poseen una mayor especificidad e índice terapéutico, al ser más catiónicos y discriminar mejor entre membranas con fosfolípidos aniónicos o neutros en la capa externa. La acción letal de anfotericina B requiere su interacción con el ergosterol de la membrana. La sustitución de éste por otro esteroide análogo es relativamente asequible, comparado con el cambio drástico (aunque no imposible20) de fosfolípidos preciso para lograr una resistencia frente a los PAE.
Además de su actuación sobre cepas multirresistentes25, los PAE pueden revertir estas resistencias mediante al menos dos mecanismos: a) en gramnegativos, la destrucción de la membrana externa facilita el acceso de otros fármacos clásicos a sus dianas intracelulares y b) los PAE causan depleción de adenosintrifosfato (ATP) intracelular, impidiendo la expulsión de fármaco por sistemas de transporte dependientes de energía. Existen numerosos ejemplos de estas sinergias: betalactámicos más magainina sobre E. coli; buforina más azitromicina sobre Cryptosporidium parvum, o más cefazolina frente a S. epidermidis, histatina 5 más anfotericina B frente a Candida9. Otro modo de actuación sinérgica es la combinación de PAE: magainina 2 más taquiplexina, HNP-1 más LL-378 o hβD-2 más lisozima o lactoferrina; la capacidad de esta última para secuestrar Fe++ permite inhibir la formación de biofilms26.
La estructura nativa de los PAE puede ser modificada para optimizar cualitativa y cuantitativamente la actividad microbicida, la vehiculización farmacológica o los costes de producción. Las estrategias utilizadas en este proceso se enumeran de forma muy concisa en la tabla 32,4,27,28.
La optimización por actuación sobre la estructura secundaria del PAE se ha circunscrito casi exclusivamente a los péptidos lineales helicoidales. El retrato-robot de un PAE ideal de esta clase sería un péptido helicoidal de talla reducida (< 20 residuos), con carga positiva pero no excesivamente alta y con alta anfipaticidad (segregación entre áreas polares e hidrofóbicas).
El precio de un PAE de síntesis es, incluso a escala multigramo, 10 veces el de un antibiótico convencional2. La producción recombinante de éstos ha conseguido un número importante de éxitos, por lo general bajo formas inactivas para la bacteria productora, que son posteriormente procesadas. También se ha logrado su expresión transgénica en la leche de ratón2.
Una de las aplicaciones de los PAE con más futuro es la terapia génica antiinfecciosa28, imposible para la totalidad de los otros antibióticos. La transferencia de hCAP18/LL37 a explantos de epitelio respiratorio de pacientes con fibrosis quística incrementa de tres a cuatro veces los niveles de LL-37 y permite recuperar la actividad bactericida perdida, independientemente de la salinidad del medio extracelular. Ratones infectados por adenovirus con el gen del mismo péptido muestran una supervivencia muy superior frente a neumonía por P. aeruginosa o septicemia por E. coli. Aumentando los niveles de histatina en saliva por infección bucal con el correspondiente adenovirus recombinante disminuye la incidencia de placas y gingivitis en perro. Más elaborada aún es la expresión inducible en ratones transgénicos de Shiva 1, un análogo de cecropina, lograda bajo el promotor de IL-2, que permite manipular, de forma externa o como producto de la infección, el grado de expresión del PAE, evitando posibles daños patológicos o incluso creación de autoinmunidad contra éste. Dichos ratones transgénicos son altamente resistentes a la infección con Brucella abortus. Los macrófagos humanos carecen de defensinas mieloides; la expresión de HNP-1 mediante infección con retrovirus o de hbD-2 mediante transfección con ARNm causa la eliminación de Histoplasma capsulatum y de M. tuberculosis. Por último, la expresión de melitina en células HeLa disminuye en un 40% su infección por Chlamydia o Mycoplasma.
La inclusión de PAE en biomateriales utilizados en prótesis se ha probado con éxito en resinas dentales de polimetilmetacrilato conteniendo histatina, como prevención frente a Candida. El mismo péptido, complejado a mucina salival o xantano, proporciona una liberación más controlada en la cavidad oral y aumenta su resistencia a las proteasas de los patógenos. Una estrategia similar se ha ensayado con inclusión de polimixina en el cemento acrílico de prótesis óseas. El encapsulamiento de indolicidina en liposomas neutros elimina Aspergillus en macrófagos. La impregnación previa con buforina de implantes vasculares reduce notablemente la tasa de infección por S. epidermidis. La misma estrategia se aplica a los cultivos artificiales de piel para quemaduras y heridas extensas; aunque los queratinocitos son per se productores de hβD-2, la sobreexpresión de ésta mediante ingeniería génica disminuiría la tasa de fracasos de implantes por infección.
La acumulación masiva de PAE sobre la superficie del patógeno, base de su acción letal, se ha aprovechado para la identificación de focos infecciosos mediante marcaje del péptido con 99Tc29.
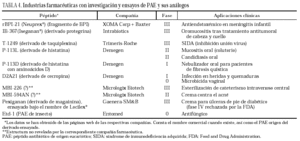
La falta de datos sobre la farmacocinética de los PAE obedece a los escasos ensayos clínicos realizados hasta la fecha, resumidos en la tabla 4. Además de su elevado coste, otro de los principales problemas de la farmacocinética de los PAE radica en su difícil acceso a capas profundas del tejido. Como posibles soluciones se han propuesto la terapia génica o la conjugación a transportanos, péptidos capaces de atravesar la membrana sin necesidad de receptores y que pueden introducir incluso enzimas en el interior celular.
Conclusiones y perspectivas
En los apartados anteriores se ha enfatizado la importancia de los PAE como nueva alternativa quimioterapéutica. A pesar de sus obvios atractivos, conviene introducir un contrapunto sobre un excesivo optimismo en este tema.
La presencia de PAE en toda la escala evolutiva demuestra su importancia como arma universal frente a la infección. Sin embargo, estudios de "arqueología molecular" demuestran que los PAE han sufrido una fuerte y constante modificación, tendente a la conservación de su eficacia frente a la lógica evolución de la virulencia bacteriana. Las diferencias en la conservación de secuencias entre rata y ratón, o la localización exclusiva de histatina en homínidos, así lo atestiguan. Un caso dramático en este proceso ha sido la pérdida de expresión en seres humanos de retrociclina (tabla 2)7, un péptido capaz de inhibir la infección por VIH del cual existen versiones análogas en primates, que ofrecen nuevas perspectivas no sólo en el posible tratamiento de la enfermedad, sino en el origen y posibles reservorios salvajes de ésta7.
Otra incertidumbre nace del delicado equilibrio entre la flora bacteriana local y los PAE presentes en su hábitat22. La utilización indiscriminada de PAE puede conducir tanto a un desequilibrio de aquélla, con colonización preferente de otras especies mejor adaptadas, como al desarrollo y propagación de mecanismos de resistencia que ocasionen la transformación de comensal en patógeno o de fenotipo susceptible a resistente a los PAE.
El conocimiento actual sobre los PAE es muy fragmentario. Las nuevas técnicas genómicas han permitido el descubrimiento de más de 20 secuencias de posibles defensinas30, pero se desconoce si pueden existir otros PAE con estructuras muy diferentes a las conocidas y cuya identificación haya sido ignorada por una posible actuación muy localizada o efímera, por actuar a muy baja concentración, o ser inducido por un patógeno o estímulo muy concreto.
Otra importante faceta aún insuficientemente explorada de los PAE son sus mecanismos "secundarios" de actuación, como por ejemplo, su interacción con el sistema inmunitario, o la recientemente descrita con el sistema endocrino por parte de la hepcidina, que complican extraordinariamente la definición de su papel fisiológico y plantean incógnitas sobre la existencia de repercusiones insospechadas en su actuación clínica. En el 150 aniversario de Antoni Gaudí, los PAE nos desafían a modo de un complejo trencadís fisiológico, donde las incertidumbres coexisten con sugerentes posibilidades, planteando en conjunto una nueva visión de la infección que deberemos resolver y explotar en los próximos años.
Agradecimientos
La investigación de los autores ha sido subvencionada por los proyectos 08.2/0054/2001.2 y Programa de Grupos Estratégicos en Biotecnología de la Comunidad de Madrid, y Unión Europea (QLRT-20000-01404) a L. R., y por la Generalitat de Catalunya (CERBA) a D. A. El CIB participa en la Red de Centros del FIS (CO3/14).