La fase crónica de la enfermedad de Chagas se caracteriza por una parasitemia baja e intermitente. En esta fase la sensibilidad de la reacción en cadena de la polimerasa (PCR) es muy variable, limitando su utilización como técnica diagnóstica. A pesar de ello, la realización de la PCR en pacientes no tratados puede aportar datos sobre el comportamiento del parásito y su presencia en sangre periférica.
MétodosSe realizó PCR a tiempo real de forma puntual en una cohorte de 495 pacientes con enfermedad de Chagas crónica en ausencia de tratamiento. También se realizó seguimiento de una subcohorte de 29 pacientes mediante PCR a tiempo real seriadas, entre 8 y 12 meses en los que no tuvieron acceso al tratamiento por falta de suministro.
ResultadosEl porcentaje de positividad de PCR a tiempo real fue de 42%. Este porcentaje fue significativamente mayor en pacientes con 5 años o menos de residencia en España (p=0,041). La detección de ADN no se relacionó con la existencia de alteraciones cardíacas y/o digestivas.
En el subgrupo de pacientes a los que se realizaron determinaciones seriadas, el resultado de PCR fue sostenidamente positivo en el 13,8% de los pacientes, negativo en el 31% e intermitente en el 55,2%.
ConclusionesLas diferencias de resultados de PCR a tiempo real en función del tiempo de residencia apuntan que existen factores externos que pueden influir en la presencia del parásito en sangre periférica. Así mismo, factores propios del hospedador parecen influir en la dinámica parasitaria a lo largo del tiempo.
The chronic phase of Chagas disease (CD) is characterised by a low and intermittent parasitaemia. The Polymerase Chain Reaction (PCR) presents a variable sensitivity in this stage limiting its use as a diagnostic tool. Despite this, the use of PCR in untreated patients can provide information on the parasite behaviour and its presence in peripheral blood.
MethodsA timely real-time PCR determination was performed on a cohort of 495 untreated chronic CD patients. Also, a subcohort of 29 patients was followed-up by serial real-time PCR during a period from 8 to 12 months in which they could not have access to the treatment due to lack of supply.
ResultsThe positive percentage of real-time PCR in our series was 42%. Nevertheless, real-time PCR positive results were significantly higher in patients with five years or less of residence in Spain (P=.041). The detection of DNA was not related to the existence of cardiac and/or gastrointestinal abnormalities.
In the follow-up subgroup, real-time PCR was consistently positive in 13.8% of patients, consistently negative in 31%, and intermittent in 55.2%.
ConclusionsThe different real-time PCR results regarding the time of residence suggests the possible relationship of external factors in the parasite presence in peripheral blood. On the other hand, specific host factors may be involved in the behaviour of parasitaemia over time.
La enfermedad de Chagas (EC), causada por el protozoo flagelado Trypanosoma cruzi (T. cruzi), es la enfermedad parasitaria más importante en América Latina, donde es endémica1. Se considera que hay entre 6 y 7 millones de personas afectadas en todo el mundo y es la causa de 12.000 muertes anuales2. En los últimos años, como consecuencia de los importantes movimientos migratorios, ha habido un cambio en la distribución geográfica de la enfermedad, convirtiendo la EC en un problema de salud global. Debido a las relaciones socioeconómicas y culturales con América Latina España es el primer destino en Europa para migrantes latinoamericanos, y por tanto el mayor receptor de pacientes infectados3.
Fuera del área endémica, donde no hay transmisión vectorial, la mayor parte de los pacientes se encuentra en la fase crónica de la enfermedad. En esta fase la parasitemia es baja e intermitente, y generalmente los pacientes están asintomáticos, aunque un 30-40% presentará alteraciones cardíacas y/o digestivas que pueden llegar a ser graves. Debido a la baja parasitemia, las técnicas parasitológicas presentan una baja sensibilidad y el diagnóstico se basa en la detección de anticuerpos anti-T. cruzi4.
A pesar de que la eficacia del tratamiento antiparasitario en la fase crónica es controvertido y presenta importantes efectos secundarios, los efectos beneficiosos de la disminución de la carga parasitaria hacen que sea ampliamente utilizado5. En nuestro medio el fármaco más utilizado es el benznidazol (BZL) y se indica a todos los pacientes con EC en fase crónica excepto gestantes, pacientes con cardiopatías evolucionadas u otras contraindicaciones que lo desaconsejen6. La pérdida de los anticuerpos anti-T. cruzi es el único marcador definitivo de curación de la EC, a pesar de que es un proceso muy lento y su confirmación requiere varios años de seguimiento7.
Desde los años 90 se han desarrollado múltiples protocolos basados en técnicas de amplificación genética, y en particular de reacción en cadena de la polimerasa (PCR) para la detección de ADN de T. cruzi en sangre periférica. Existen diferentes protocolos de PCR con distintos resultados de sensibilidad, dependiendo de múltiples factores, entre los que destacan la región amplificada (ADN satélite o kinetoplasto), el diseño de los cebadores o las condiciones del termociclador8. La introducción de la PCR cuantitativa a tiempo real presenta importantes ventajas, como el diseño de protocolos múltiplex o la cuantificación de la carga parasitaria. Además ha permitido mejorar la calidad de los resultados y la estandarización de la técnica9.
La PCR ha demostrado ser muy útil en los casos con alta parasitemia, pero en la fase crónica, debido al comportamiento del parásito en sangre periférica, un resultado negativo de PCR no permite descartar la infección, limitando su utilidad como técnica diagnóstica8.
Actualmente la mayor utilidad de la PCR en la fase crónica radica en el seguimiento de los pacientes tratados. Un resultado positivo de PCR es el mejor y más precoz marcador de fracaso terapéutico10.
A pesar de ello, la realización de la PCR en pacientes no tratados puede generar información útil sobre el comportamiento del parásito en fase crónica y su presencia en sangre periférica.
El objetivo de este trabajo es analizar los resultados de la realización puntual de la PCR a tiempo real en una cohorte de 495 pacientes, y de forma seriada durante el seguimiento de una pequeña cohorte de 29 pacientes con EC crónica en ausencia de tratamiento.
Material y métodosEste es un estudio observacional retrospectivo realizado en el Servicio de Microbiología del Hospital Vall d́Hebron entre junio de 2010 y mayo de 2012. Los criterios de inclusión de los pacientes en el estudio fueron: edad superior a 18 años, serología positiva para T.cruzi y no presentar causas de inmunosupresión. Ninguno de los pacientes incluidos había recibido tratamiento tripanocida.
Se recogieron los datos clínicos y epidemiológicos, así como de PCR a tiempo real de todos los pacientes incluidos. Para la valoración de posibles complicaciones cardíacas se utilizó la clasificación de Kuschnir, mientras que para las digestivas se emplearon el esofagograma y/o el enema opaco.
En el análisis estadístico las variables cualitativas se presentaron en números absolutos y porcentaje, mientras que para las variables cuantitativas se utilizó la media y la desviación estándar (DE). Se utilizó la prueba de χ2para comparar variables cualitativas y la prueba «t» de Student para variables cuantitativas. Se realizó un modelo de regresión logística univariante mediante el paquete informático SPSS©, para evaluar la asociación de diferentes variables. Los resultados se consideraron estadísticamente significativos si el valor de p era<0,05.
Este estudio fue aprobado por el Comité de ética del Hospital Vall d́Hebron.
Procedimientos microbiológicosPara el diagnóstico serológico de la EC todas las muestras de suero fueron analizadas simultáneamente mediante 2 ELISA, uno de ellos utiliza antígeno recombinante (Bioelisa Chagas, Biokit, Lliçà d’Amunt, España) y otro lisado del propio parásito (Ortho T. cruzi ELISA, Johnson & Johnson, High Wycombe, Reino Unido). Se consideraron positivas las muestras reactivas por ambos métodos.
Las muestras de sangre para PCR a tiempo real se recogieron en una visita previa al inicio del tratamiento. Una vez recibida la muestra en el laboratorio se diluye de forma inmediata en una proporción 1:1 con clorhidrato de guanidina 6M (Sigma Aldrich) durante 24horas a temperatura ambiente. La extracción de ADN se realizó a partir de 200μl, eluyendo en 50μl mediante un equipo automatizado (NucliSens easyMAG, Biomerieux, Francia). La amplificación se realizó por duplicado, según el protocolo descrito por Piron et al.11. El resultado de PCR a tiempo real se consideró positivo cuando el control interno de amplificación (Taq Man Human RNase P detection reagent; Applied Biosystems, Foster City, CA, EE. UU.) estaba dentro de rango (ciclo de amplificación [Ct] 26±2) y al menos una de las 2 determinaciones era positiva para T. cruzi (Ct<40). En todos los paneles de PCR se incluyó un control externo positivo y negativo.
Para validar los resultados de la PCR a tiempo real se incluyó un programa de calidad (EQA). Este programa incluye el procesamiento de paneles de muestras preparados con distintas diluciones de sangre contaminada con epimastigotes provenientes de cultivos de diferentes linajes de parásito (TcIa, TcId, TcV y TcVI), así como muestras negativas. El panel fue preparado y evaluado por un laboratorio de referencia externo12.
ResultadosSe incluyeron 495 pacientes con EC crónica que no habían recibido tratamiento.
La mayor parte de ellos eran mujeres de origen boliviano. La media de edad de los pacientes fue de 37,7 (19-68) años.
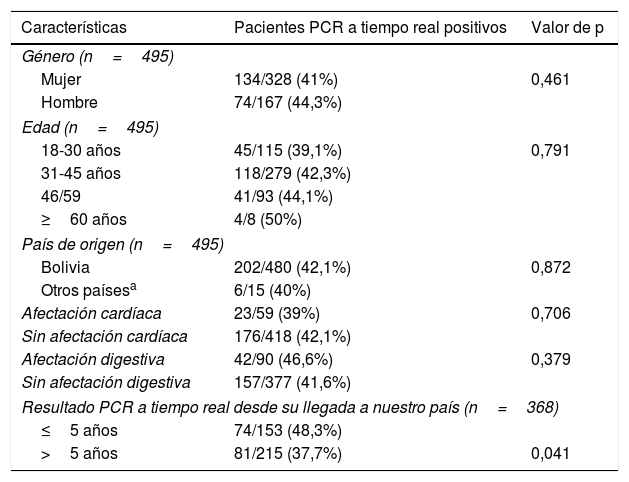
La PCR a tiempo real fue positiva en una única determinación puntual antes de iniciar el tratamiento en 208 (42%) de los pacientes. No se encontraron diferencias significativas entre los pacientes con PCR a tiempo real positiva y negativa en relación con la edad, el sexo, el país de origen y la presencia de alteraciones cardíacas y/o digestivas. A pesar de utilizar una escala logarítmica, se empleó el valor de los Ct como marcador indirecto de carga parasitaria. No se encontraron diferencias significativas en el valor del Ct entre los pacientes que presentaron alteraciones viscerales y los que no (media±DE: 37,02±2,6 vs. 36,8±2,3; p=0,55). Los datos clínicos y epidemiológicos de los pacientes con resultados de PCR a tiempo real positivos se detallan en la tabla 1.
Características clínicas y epidemiológicas de los pacientes con resultado positivo de PCR a tiempo real
| Características | Pacientes PCR a tiempo real positivos | Valor de p |
|---|---|---|
| Género (n=495) | ||
| Mujer | 134/328 (41%) | 0,461 |
| Hombre | 74/167 (44,3%) | |
| Edad (n=495) | ||
| 18-30 años | 45/115 (39,1%) | 0,791 |
| 31-45 años | 118/279 (42,3%) | |
| 46/59 | 41/93 (44,1%) | |
| ≥60 años | 4/8 (50%) | |
| País de origen (n=495) | ||
| Bolivia | 202/480 (42,1%) | 0,872 |
| Otros paísesa | 6/15 (40%) | |
| Afectación cardíaca | 23/59 (39%) | 0,706 |
| Sin afectación cardíaca | 176/418 (42,1%) | |
| Afectación digestiva | 42/90 (46,6%) | 0,379 |
| Sin afectación digestiva | 157/377 (41,6%) | |
| Resultado PCR a tiempo real desde su llegada a nuestro país (n=368) | ||
| ≤5 años | 74/153 (48,3%) | |
| >5 años | 81/215 (37,7%) | 0,041 |
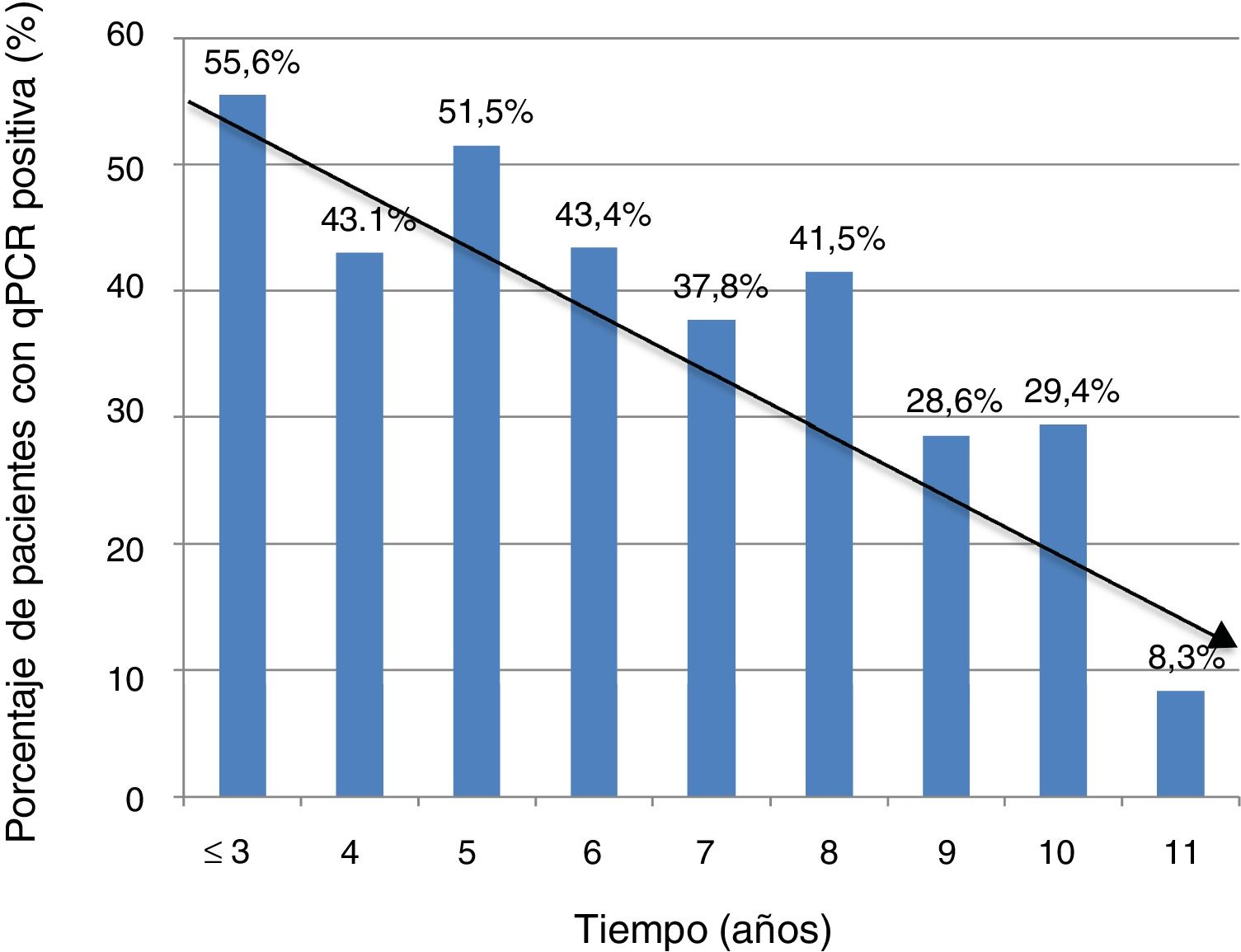
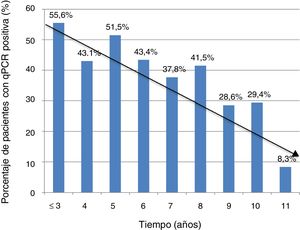
La información sobre el tiempo de residencia en España estaba disponible en 368 casos (74,3%). El porcentaje de PCR positiva fue mayor en aquellos pacientes con un tiempo de residencia más corto (5 años o menos) respecto a los que llevaban más de 5 años en nuestro país: 74/153 (48,3%) vs. 81/215 (37,7%); p=0,041. Sin embargo, no hubo diferencias significativas en el valor del Ct entre el grupo de pacientes que llevaban menos tiempo de residencia respecto a los que llevaban más (media±DE: 37±2,3 vs. 36,8±2,5; p=0,74).
La tendencia a la disminución de la positividad de PCR en función del tiempo de residencia queda reflejada en la figura 1.
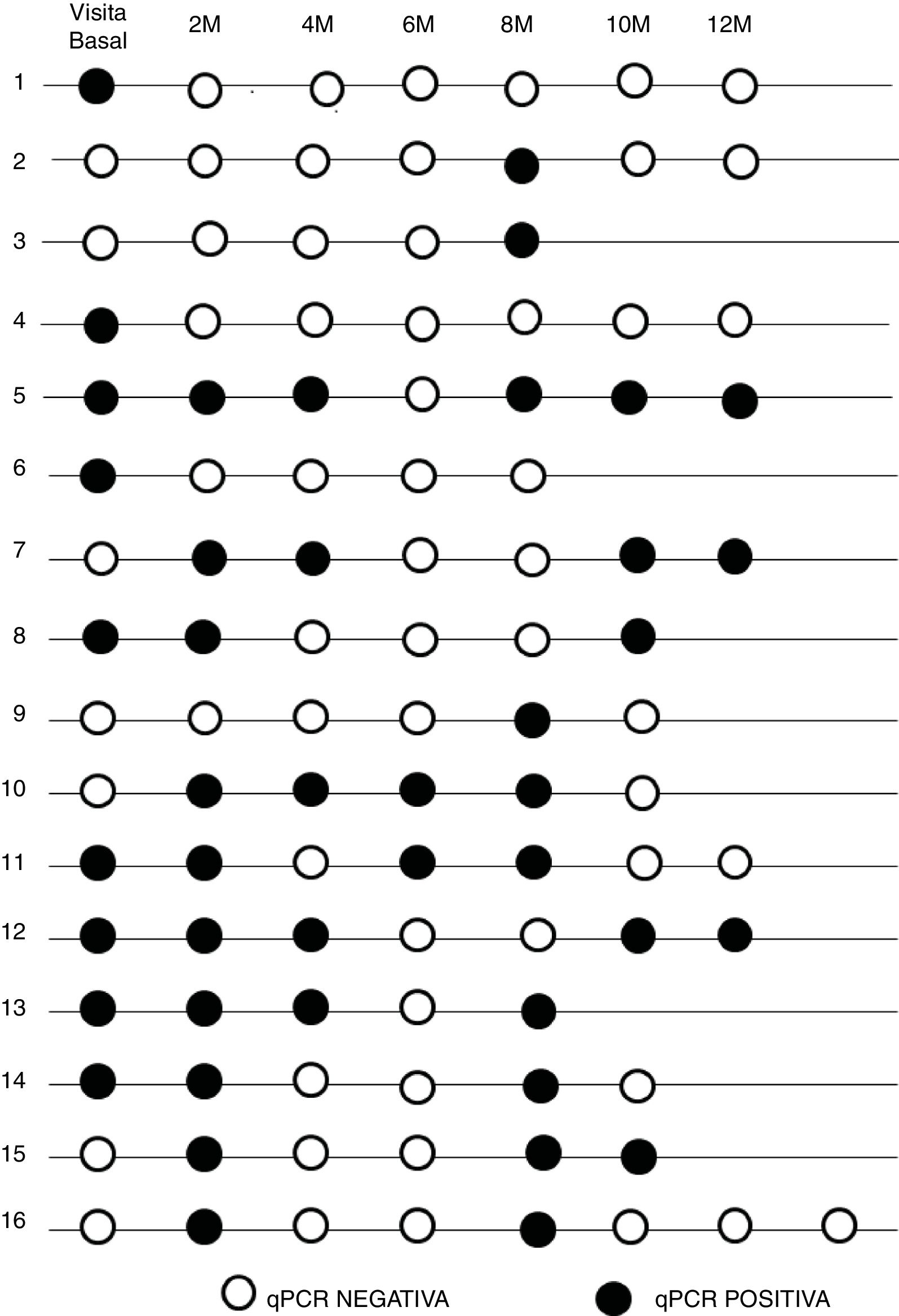
A un subgrupo de 38 pacientes no se les pudo ofrecer tratamiento tripanocida por falta de suministro, y se les ofreció realizar determinaciones seriadas cada 2 meses mediante PCR. Solo 29 hicieron un seguimiento regular como mínimo de 8 meses. Todos los pacientes fueron tratados una vez y se pudo administrar de nuevo el fármaco. De estos 29, eran mujeres 20 y hombres 9, y el 96,5% era de origen boliviano. Diez de ellos (34,5%) llevaban 5 años o menos de residencia en España.
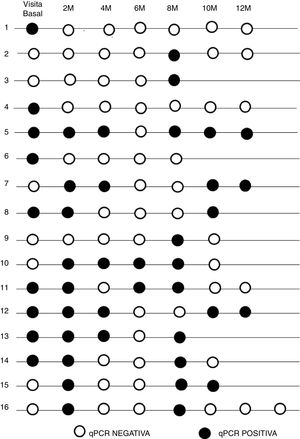
El resultado de la PCR a tiempo real inicial en este subgrupo fue positiva en 13 pacientes (44,8%) y negativa en 16 (55,2%). Durante el seguimiento 9 (31%) de ellos tuvieron una respuesta negativa de PCR a tiempo real sostenida, 4 (13,8%) positiva y en 16 (55,2%) la parasitemia fue intermitente.
La cronología de los resultados de PCR a tiempo real en el seguimiento de los pacientes con detección de ADN intermitente aparece reflejada en la figura 2.
De los 10 pacientes con menos tiempo de residencia en España el 20% presentó una parasitemia mantenida, en 2 pacientes (20%) fue negativa y en 6 (60%) intermitente, mientras que de los 19 que llevaban más tiempo fuera del área endémica en 2 (10,5%), 7 (36,9%) y 10 (52,6%) la PCR a tiempo real fue positiva, negativa o intermitente respectivamente.
A pesar de que entre los pacientes que llevaban más tiempo fuera del área endémica 17/19 presentaban PCR negativa o intermitente, la diferencia entre ambos grupos no fue significativa (p=0,59).
DiscusiónEn este estudio se incluyen los resultados de PCR a tiempo real obtenidos de una cohorte de 495 pacientes con EC en fase crónica que no habían recibido tratamiento tripanocida.
La PCR a tiempo real permitió detectar la parasitemia en el 42% de los pacientes, porcentaje similar al obtenido en otros estudios españoles, con porcentajes que varían entre el 28% y el 68%13–16. Este bajo nivel de detección reafirma el escaso valor diagnóstico de la PCR a tiempo real en fase crónica, ya que un resultado negativo no permite descartar la infección.
Un resultado positivo de PCR a tiempo real tampoco se ha relacionado con la presencia de anomalías viscerales. Estos datos son concordantes con los obtenidos en otras series publicadas, tanto dentro como fuera del área endémica, y permiten descartar que un dato puntual de PCR a tiempo real pueda utilizarse como marcador de progresión de la enfermedad17. En la actualidad únicamente la parasitemia detectada en el tercer trimestre de gestación es útil como predictor, ya que puede considerarse un factor de riesgo para la transmisión congénita de la enfermedad18.
El límite de detección de la PCR depende directamente de los protocolos utilizados y del número de amplificaciones. Actualmente la implementación de la PCR a tiempo real, que ha permitido la estandarización de la técnica, junto a la realización de EQA, han contribuido a reforzar la calidad de los resultados analíticos, lo cual confirma la buena sensibilidad de la PCR para detectar ADN de T. cruzi9,19. Este estudio fue uno de los primeros en implementar un programa de EQA con resultados comparables a los obtenidos por el laboratorio de referencia12.
Excluyendo la influencia del protocolo de PCR utilizado, los factores propios del hospedador y del parásito son los que determinan principalmente su presencia en sangre periférica en la fase crónica, y por tanto la posibilidad de detectar su ADN por PCR. El hecho de no incluir pacientes con parasitemias potencialmente más altas, como mujeres embarazadas o pacientes inmunodeprimidos, podría explicar que el porcentaje de positivos en nuestra cohorte no sea mayor20.
El porcentaje de detección de ADN de T. cruzi en cohortes fuera del área endémica es sensiblemente menor al obtenido en áreas endémicas, que en algunas series obtiene valores superiores al 80%8. Estas diferencias también existen al comparar entre diferentes países latinoamericanos. En datos extraídos del estudio BENEFIT la mediana de la parasitemia detectada en Argentina y Colombia fue aproximadamente 20 veces superior a la de pacientes con características clínicas comparables en Brasil21. Este hecho parece estrechamente relacionado con los distintos linajes de parásito causantes de la infección.
La disminución significativa del porcentaje de positividad de PCR a tiempo real en pacientes que llevan más de 5 años en España, respecto a los recién llegados, puede ayudar a explicar el menor porcentaje de positivos de PCR en series fuera del área endémica, reforzando la idea de la influencia de factores externos sobre la dinámica del parásito. Estos datos concuerdan con los descritos en otra serie española en 2010, y con el hecho de que las tasas de transmisión congénita encontradas fuera del área endémica sean menores15,22.
Variables como la coinfección con otros parásitos, la dieta o el estilo de vida son factores que podrían estar implicados. La coinfección por helmintos, y especialmente por Strongyloides stercoralis, es frecuente y se ha asociado significativamente con una mayor detección de ADN de T. cruzi en sangre periférica23. Esta relación refleja la acción inmunomoduladora de S. stercoralis en pacientes con EC24. Otros datos sugieren la importante flexibilidad y adaptación de T. cruzi a cambios ambientales y al estado nutricional, como el que sufre la población de Latinoamérica al llegar al país receptor25.
La PCR a tiempo real no es una medida dinámica y únicamente da información del momento en el que se ha tomado la muestra. El seguimiento regular y continuado de un grupo de pacientes debido a una rotura de stock de BZL nos ha permitido obtener información del comportamiento del parásito y su presencia en sangre periférica en una zona sin posibilidad de reinfección. En estudios realizados en Brasil tanto la carga parasitaria como la cinética del parásito están directamente ligadas con el linaje26. En nuestro caso, a pesar de no haber estudiado el linaje del parásito, todos ellos procedían de Bolivia, lo cual hace pensar que este no es un factor determinante27. Factores genéticos relacionados con el hospedador, asociados con el control inmunológico frente a la infección crónica, podrían favorecer la presencia del parásito en sangre28.
La detección de ADN de T. cruzi de forma sostenidamente positiva, negativa o intermitente, al igual que la determinación puntual, tampoco se ha relacionado con la aparición de complicaciones viscerales.
A pesar de estas aportaciones, actualmente la mayor utilidad de la PCR a tiempo real en fase crónica es como marcador de fracaso terapéutico en la monitorización del tratamiento tripanocida29. En los últimos años un resultado positivo de PCR a tiempo real también se ha utilizado como criterio de inclusión y marcador de fracaso en ensayos clínicos que permitan valorar nuevos fármacos30.
Este estudio presenta ciertas limitaciones. En primer lugar se trata de un estudio retrospectivo, por lo que el seguimiento de los pacientes no ha sido uniforme. Por el mismo motivo no fueron recogidas variables como viajes a zonas endémicas durante el seguimiento para descartar posibles reinfecciones, la existencia de coinfección por S. stercoralis u otras variables relacionadas con la dieta o el estilo de vida. La detección de factores genéticos en el hospedador y del linaje de T. cruzi permitiría valorar mejor el comportamiento de la parasitemia.
ConclusionesDebido al bajo índice de positividad, la PCR a tiempo real no permite descartar la infección por T. cruzi en fase crónica, limitando su uso en el diagnóstico. En este estudio tampoco se ha observado relación con la aparición de manifestaciones viscerales cardíacas y/o digestivas, por lo que un resultado positivo de PCR no es un buen marcador de progresión clínica. Sin embargo, actualmente es el mejor marcador de fracaso en pacientes tratados.
A pesar de todo ello, la realización de la PCR a tiempo real en pacientes no tratados ha permitido conocer datos sobre la presencia del parásito en sangre periférica, y apuntar posibles factores relacionados con su dinámica en fase crónica. El mejor conocimiento de estos factores puede ayudar a interpretar mejor los resultados de PCR en distintas situaciones, principalmente cuando se utilice para valorar la eficacia del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.