En enero de 2014 se conoció la existencia de un posible brote de bacteriemia por Burkholderia cepacia en un centro concertado de hemodiálisis en La Línea de la Concepción (Cádiz). Se inició una investigación para determinar la causa del brote y establecer medidas de control.
MétodosSe realizó un análisis descriptivo de los pacientes afectados por bacteriemia por Burkholderia cepacia desde noviembre de 2013 hasta febrero de 2014 y de las posibles características comunes entre cada uno de ellos. Se tomaron muestras de diferentes zonas y superficies buscando el origen el brote. Se realizó estudio de tipificación molecular mediante electroforesis en gel de campo pulsado (Spel PFGE) y análisis mediante MLST en centro de referencia para determinar la similitud genética de las cepas aisladas.
ResultadosEn el periodo de estudio se aisló la bacteria en los hemocultivos de 7 pacientes, en 3 muestras de sellado (líquido endoluminal) de catéteres (2 de ellos fueron también casos) y en 4 muestras de botes de clorhexidina. Los pacientes eran coincidentes en 2 de los 6 turnos de diálisis. La edad media de los casos fue de 67 años. El 57% fueron mujeres. Se analizó la relación clonal entre casos y una muestra ambiental y resultaron ser idénticos genéticamente (clon ST653).
ConclusionesSe confirmó la presencia de un brote de Burkholderia cepacia con 7 casos entre pacientes que estaban siendo hemodializados. El brote fue debido a una misma cepa con una fuente probablemente común y una transmisión secundaria de persona a persona.
In January 2014 a possible outbreak of Burkholderia cepacia bacteremia occurred in a hemodialysis center situated in La Linea de la Concepción (Cadiz). An investigation was begun to confirm the outbreak, identify the source, and implement control measures.
MethodsA descriptive analysis was performed to describe the characteristics of the patients affected with Burkholderia cepacia bacteremia from November 2013 to February 2014. Environmental samples were taken. A molecular typing study was performed using pulsed field gel electrophoresis (SpeI PFGE) and MLST analysis in order to determine the genetic similarity between the isolates.
ResultsThe bacterium was isolated from blood cultures of 7 patients during the study period. Three of the samples (2 of which were also cases) were endoluminal fluid from catheter locks, and 4 chlorhexidine bottle samples. The patients were coincident in 2 of the 6 work shifts. The mean age of the cases was 67 years of whom 57% were women. Human samples and an environmental sample was analyzed and found to be genetically identical (ST653 clone).
ConclusionsThe analysis confirmed the outbreak of Burkholderia cepacia, with 7 cases among the patients of the hemodialysis center. The outbreak was due to the same strain, probably a common source and secondary transmission from person to person.
El complejo Burkholderia cepacia (B. cepacia) es un grupo de bacilos gramnegativos no fermentadores1 que clásicamente se ha asociado a infecciones graves en pacientes con fibrosis quística y en inmunodeprimidos2. Además, se han descrito brotes en unidades de cuidados intensivos3,4 y servicios de hemodiálisis5 debidos a la contaminación de fluidos y de soluciones desinfectantes. Las infecciones incluyen bacteriemia, infecciones de las vías respiratorias y urinarias, entre otras6. La gravedad de la infección por B. cepacia, en particular cuando cursa con bacteriemia, viene dada por la virulencia del microorganismo, la delicada situación del paciente y por la frecuente resistencia a múltiples antibióticos.
Fue descubierta en 1949 como patógeno de plantas, encontrado sobre todo en cebollas y ampliamente distribuido en el suelo7. En 1972 se aisló por primera vez como patógeno oportunista en humanos, concretamente en pacientes neutropénicos sometidos a ventilación mecánica y en pacientes con de fibrosis quística8. Ocasiona bacteriemia en inmunocomprometidos, en brotes epidémicos asociados a la administración de fluidos parenterales o antisépticos contaminados9–13. En 1992 fue definido como un nuevo género, separándose del género Pseudomonas por estar menos relacionado genéticamente14.
B. cepacia suele ser multirresistente a los antimicrobianos y no siempre responde al tratamiento con aminoglucósidos, ureidopenicilinas o ceftazidima pese a ser sensible in vitro15.
En enero de 2014 el Servicio de Medicina Preventiva del Hospital de La Línea de la Concepción (Cádiz) conoció la existencia de 4 hemocultivos positivos a B. cepacia en pacientes hemodializados en un centro concertado de diálisis, el primero de los cuales fue aislado en noviembre de 2013. Se decidió crear un grupo de trabajo multidisciplinar formado por los Servicios de Medicina Preventiva del Hospital de La Línea de la Concepción, Epidemiología del Área de Gestión Sanitaria Campo de Gibraltar, Enfermedades Infecciosas y Microbiología del Hospital de La Línea de la Concepción, Nefrología de la provincia de Cádiz y los nefrólogos del propio centro de diálisis implicado.
Los objetivos del estudio fueron realizar la descripción del brote (tiempo, lugar, persona), identificar la causa o causas que pudieran haber contribuido a su aparición, evitar la aparición de casos adicionales eliminando el reservorio y elaborar recomendaciones para prevenir brotes similares en el futuro.
MétodosSe realizó un estudio descriptivo del brote ocasionado por B. cepacia en el centro de diálisis entre el 1 de noviembre de 2013 y el 28 de febrero de 2014. Se diseñó un protocolo de actuaciones para llevar a cabo el estudio de campo que incluyó, entre otras, las siguientes: confirmación de la presencia del brote, verificación del diagnóstico, búsqueda activa de casos, elaboración de la curva epidémica, inspección del centro de diálisis, estudio de la incidencia de infección por B. cepacia en años anteriores en la unidad, recogida de muestras y remisión al laboratorio de referencia de Andalucía, Hospital Universitario Virgen Macarena, para tipificación molecular de las cepas.
El centro de diálisis implicado en el brote es un centro privado con concierto con el Servicio Andaluz de Salud. En el centro se dializan 131 pacientes de todo el Área de Gestión Sanitaria Campo de Gibraltar, en 3 turnos diarios, lo que supone una media de 70 sesiones diarias de 3-4h duración. El centro dispone de una sala principal de diálisis con 21 puestos y 2 salas anexas con 2 y 4 puestos más y otra pequeña sala en el piso superior con 4 puestos de diálisis para tratamientos especiales (virus de la inmunodeficiencia humana+; virus de la hepatitis B+). La unidad de diálisis funciona desde 1998 y tiene una proporción paciente/enfermera de 5:1.
Se definió caso como toda persona que hubiera recibido al menos una sesión de hemodiálisis en el centro, en el periodo comprendido entre el 1 de noviembre de 2013 y el 28 de febrero de 2014, con bacteriemia y hemocultivo positivo a B. cepacia.
El aislamiento de B. cepacia se realizó utilizando el sistema semiautomatizado MicroScan Walkaway suplementado con pruebas manuales para la identificación y antibiograma6.
ResultadosDesde noviembre de 2013 hasta febrero de 2014 (periodo epidémico) se detectaron 7 casos. No se registraron casos de infección durante el periodo preepidémico.
Se realizó búsqueda activa de casos a través del Servicio de Microbiología, sin encontrarse nuevos casos.
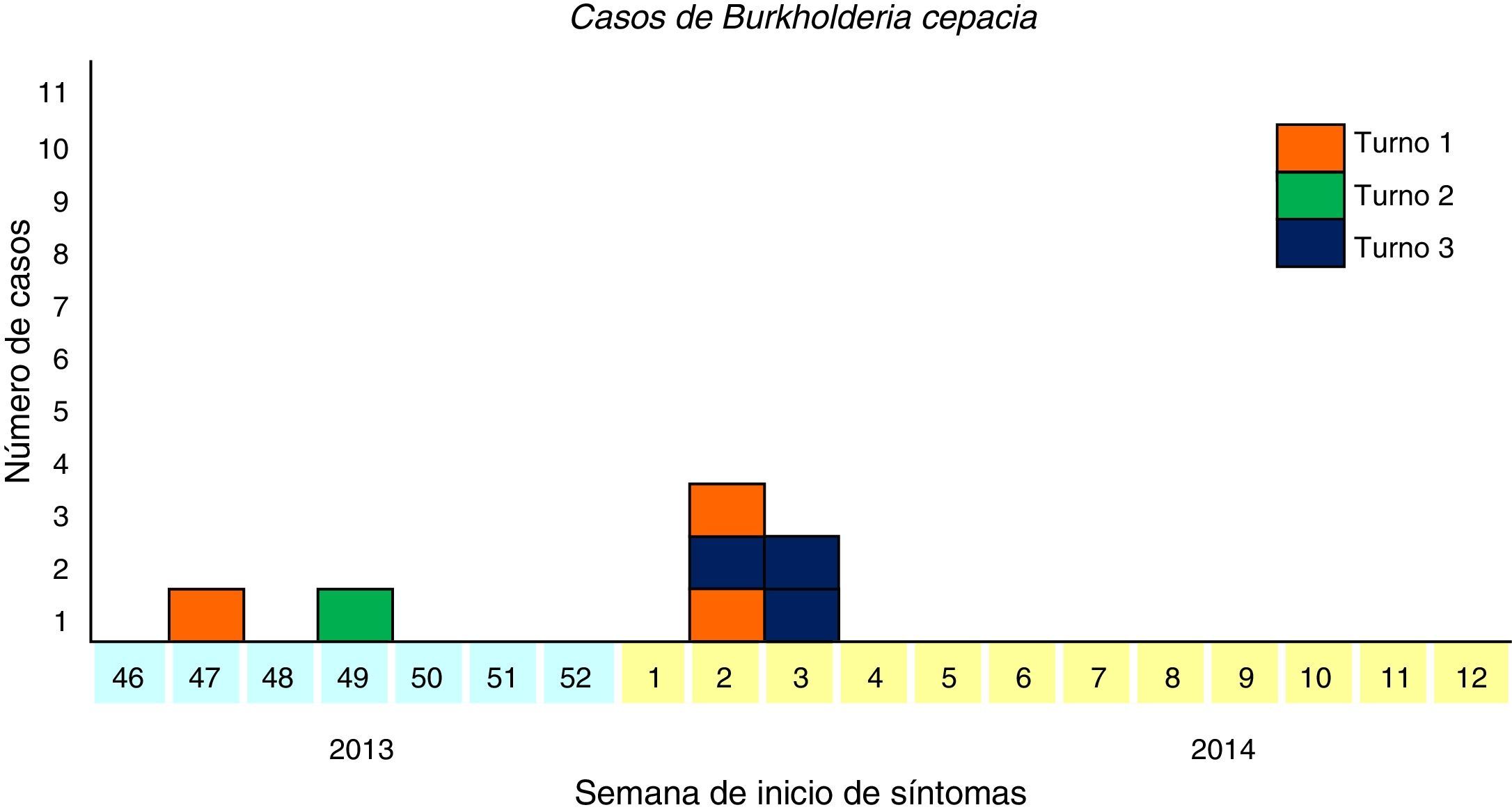
Cuando se notificó el brote, a mitad de enero, eran 4 las personas que cumplían la definición de caso y otras 4 estaban pendientes de resultados de laboratorio, 3 de las cuales terminaron confirmándose como caso en los días siguientes. El primer caso inició síntomas durante la semana 47/2013 y el segundo caso 14 días después. El resto de los casos se concentraron en la mitad de enero de 2014 (fig. 1).
Con relación al horario de comienzo de las bacteriemias, se produjeron todas en la segunda o tercera hora de diálisis (siempre durante la sesión).
Respecto al lugar de aparición de los casos, los 2 casos iniciales se dializaron en la sala de la primera planta de tratamientos especiales. El resto de los casos se dializaron en la sala principal. No hubo coincidencias en las máquinas de diálisis entre los casos. Sin embargo, al analizar los turnos de diálisis de los pacientes se observó la coincidencia de 6 de ellos en 2 de los 6 turnos disponibles. Fue imposible estudiar al personal de cada turno ya que el centro no pudo detallar con exactitud dicha distribución al trabajar el mismo personal en diferentes turnos e intercambiarse de forma continua.
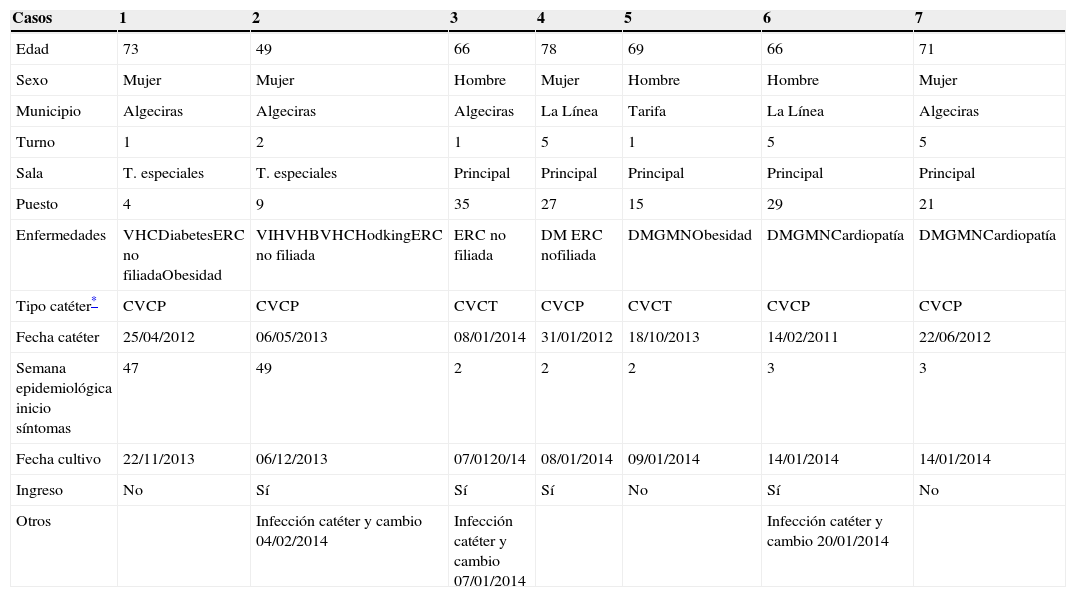
La edad media de los casos fue de 67,4 (mín 49, máx 78) y el 57% fueron mujeres. La mayoría de los casos, al igual que los no casos, eran pacientes pluripatológicos. Los 7 casos eran portadores de catéteres venosos, colocados en diferentes periodos de tiempo. Ningún caso presentó infección en el lugar de inserción del catéter, por lo que se descartó contaminación periluminal. Cuatro de los casos requirieron ingreso hospitalario (tabla 1). Todos los pacientes fueron tratados con sulfametoxazol y trimetropim, una ampolla de 400mg después de cada sesión de diálisis (cada 48h) durante 14 días, sellado del catéter con el mismo antimicrobiano y se recuperaron sin complicaciones.
Descripción casos
| Casos | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Edad | 73 | 49 | 66 | 78 | 69 | 66 | 71 |
| Sexo | Mujer | Mujer | Hombre | Mujer | Hombre | Hombre | Mujer |
| Municipio | Algeciras | Algeciras | Algeciras | La Línea | Tarifa | La Línea | Algeciras |
| Turno | 1 | 2 | 1 | 5 | 1 | 5 | 5 |
| Sala | T. especiales | T. especiales | Principal | Principal | Principal | Principal | Principal |
| Puesto | 4 | 9 | 35 | 27 | 15 | 29 | 21 |
| Enfermedades | VHCDiabetesERC no filiadaObesidad | VIHVHBVHCHodkingERC no filiada | ERC no filiada | DM ERC nofiliada | DMGMNObesidad | DMGMNCardiopatía | DMGMNCardiopatía |
| Tipo catéter* | CVCP | CVCP | CVCT | CVCP | CVCT | CVCP | CVCP |
| Fecha catéter | 25/04/2012 | 06/05/2013 | 08/01/2014 | 31/01/2012 | 18/10/2013 | 14/02/2011 | 22/06/2012 |
| Semana epidemiológica inicio síntomas | 47 | 49 | 2 | 2 | 2 | 3 | 3 |
| Fecha cultivo | 22/11/2013 | 06/12/2013 | 07/0120/14 | 08/01/2014 | 09/01/2014 | 14/01/2014 | 14/01/2014 |
| Ingreso | No | Sí | Sí | Sí | No | Sí | No |
| Otros | Infección catéter y cambio 04/02/2014 | Infección catéter y cambio 07/01/2014 | Infección catéter y cambio 20/01/2014 |
CVCP: catéter venoso central permanente; CVCT: catéter venoso central transitorio; DM: diabetes mellitus; ER: enfermedad renal crónica; GMN: glomerulonefritis; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
La primera hipótesis que se barajó fue la contaminación del agua al ser el único vínculo común entre los 7 casos positivos. Se revisaron todos los controles bacterianos realizados de forma mensual al agua ultrapurificada, los cuales resultaron todos negativos. Se ordenó tomar nuevas muestras de la masa grande de agua, filtros y grifos, las cuales también fueron negativas. Dieron positivo a Pseudomonas aeruginosa 7 muestras de agua de drenaje de las máquinas de diálisis. Dichas máquinas se retiraron inmediatamente del funcionamiento para su desinfección con hipoclorito. Las muestras de la entrada de agua de esas 7 máquinas de diálisis resultaron todas ellas negativas. Se revisó todo el proceso de diálisis, el procedimiento de conexión del puesto de diálisis y se inspeccionaron todas las salas del centro.
Ante la alta probabilidad de transmisión cruzada de esta bacteria y la observación directa de uso deficiente de jabones desinfectantes y soluciones hidroalcohólicas para la higiene de manos, se introdujo una severa política dirigida a la seguridad del paciente, haciendo hincapié en la higiene de manos (lavado de manos, lavado antiséptico de manos, antisepsia de manos por frotación) para prevenir las infecciones relacionadas con la atención sanitaria. Se tomaron muestras de diferentes productos utilizados para la desinfección de manos así como de las manos del personal, resultando todos ellos negativos a B. cepacia.
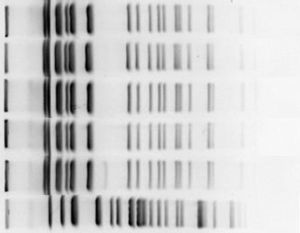
Se tomaron muestras ambientales de superficies inanimadas o sólidas, muestras animadas del personal sanitario, y muestras de soluciones líquidas (clorhexidina, agua, alcoholes, jabones…). Cuatro de ellas, tomadas de 2 botes de spray de clorhexidina utilizados para la desinfección y mantenimiento de catéteres, situados en la sala principal de diálisis, resultaron positivas a B. cepacia. Las muestras de otros botes del mismo producto todavía sin abrir, dieron negativas. En la Unidad de diálisis recibían las garrafas de 5l de clorhexidina que posteriormente manipulaban rellenando diferentes recipientes pequeños formato spray, no desechables. Tras la notificación del brote, Medicina Preventiva tomó una serie de medidas correctoras de forma inmediata como la retirada de todos los botes de spray rellenados y la recomendación de utilizar solo botes pequeños (100ml) de clorhexidina al 2% alcohólica desechable, dejándose así de realizar técnicas de relleno. Se envió una de las muestras de los botes de spray de clorhexidina que resultaron positivas a B. cepacia al laboratorio del Hospital Universitario Virgen Macarena, de referencia en el estudio de brotes dentro del programa andaluz PIRASOA, donde se procedió al análisis de la relación clonal entre los aislados (fig. 2). Los aislados se compararon mediante Spel PFGE. El dendograma se generó mediante el índice de Dice con un 0,5% de optimización y un 0,50% de tolerancia de posición de bandas. Cuatro de los aislados presentaban una similitud del 100% y un aislado mostraba una banda de diferencia (un 97,3% de similitud). La conclusión fue que los 5 aislados (4 casos y la muestra del bote de clorhexidina) eran idénticos genéticamente, pertenecientes al clon ST653 de B. cepacia.
Se revisó el procedimiento de heparinización de catéter, el cual se realizaba con viales unidosis, y se comprobó que no se hacía profilaxis antibiótica. Se llevaron a cabo hemocultivos de sangre extraída a través del catéter al resto de los 53 pacientes con catéter vascular para descartar contaminación y/o ayudar en la toma de decisión de retirada del catéter. El microorganismo implicado en el brote se aisló en 3 hemocultivos de sangre del catéter: en un paciente no caso y en el primer y segundo caso que comenzaron en noviembre y diciembre de 2013.
Se decidió investigar el caso índice siguiendo la hipótesis de que fuese ese paciente quien introdujo la bacteria en el centro de diálisis. Durante julio de 2013 estuvo ingresada en el Hospital Puerta del Mar de Cádiz por neumonía, pero se descartó con microbiología el aislamiento de esta bacteria en el mismo periodo en el hospital. Se decidió tomar muestras de la sonda nasogástrica pero dicha sonda fue cambiada 2 días antes de la toma de muestras y el resultado del cultivo de la misma fue negativo a B. cepacia.
DiscusiónEn este brote, la tasa de ataque global fue del 5,34% de los susceptibles y todos los casos aparecieron en el periodo de tiempo de 9 semanas. En total fueron 7 casos, lo que suponía un hecho sin precedentes en el centro de diálisis, por lo que la confirmación de la presencia del brote resultó obvia.
Las muestras de los 4 pacientes en los que se pudo secuenciar la B. cepacia fueron enviadas al laboratorio de referencia en el estudio de brotes para su tipificación, confirmando que las 4 eran idénticas genéticamente.
Se encontraron múltiples oportunidades de contaminación cruzada, lo que está descrito en la bibliografía16.
Para el control nosocomial de las infecciones por B. cepacia es fundamental aislar al paciente colonizado y asegurar una técnica aséptica en la práctica clínica. Es también importante mantener una vigilancia de las bacteriemias por B. cepacia para evitar posibles brotes nosocomiales. Hasta el momento de intervención por parte de Medicina Preventiva, en el centro de diálisis no existían políticas de higiene de manos y se estaban realizando prácticas de relleno de las soluciones desinfectantes (clorhexidinas) y jabones, las cuales pueden provocar contaminación bacteriana. Por ello se recomendó la retirada de todos los botes de clorhexidina rellenables y la utilización de botes desechables de un solo uso.
Las medidas de control que se deben poner en marcha ante una situación de brote de B. cepacia tienen muy bajo nivel de evidencia como se señala en el documento de manejo de la ESCMID17. Solo la higiene adecuada de manos con un desinfectante a base de alcohol antes y después del contacto con el paciente y lavado de manos con agua y jabón tienen una recomendación fuerte en base a lo demostrado para otros microorganismos multirresistentes. La toma de cultivos periódicos de los pacientes, las precauciones de contacto, la limpieza ambiental y la toma de muestras de las superficies ambientales tienen igualmente muy bajo nivel de evidencia y su recomendación es condicional.
El abordaje precoz y efectivo de un brote permite limitar el número de casos y prevenir la aparición de otros futuros, así como minimizar las posibles repercusiones sociales, económicas e incluso legales que pudieran derivarse de una gestión descoordinada entre los distintos servicios implicados. Un abordaje integral y multidisciplinar es fundamental, el trabajo consensuado en equipo permite que las personas que forman el grupo superen sus niveles de eficiencia individuales, como ha demostrado la coordinación multiniveles de este brote.
Una limitación del estudio es que se inició 2 meses después del comienzo de los síntomas del caso índice por lo que no se pudo demostrar que este caso índice introdujera la B. cepacia en el centro de diálisis. La búsqueda retrospectiva de la fuente hace que se pierdan oportunidades de identificarla. El retraso en la actuación del brote fue debido a que no se declaró el mismo a tiempo al Servicio de Preventiva.
El aislamiento de la B. cepacia en los botes de clorhexidina rellenados por el personal y los cultivos negativos del resto de las muestras reforzó la hipótesis de la transmisión persona a persona a través de las manos del personal.
FinanciaciónNo existe fuente de financiación.
Conflicto de interesesNo hay conflicto de intereses.
A Lorena López Cerero, Jesús Rodríguez Baño y Álvaro Pascual Hernández del laboratorio de referencia para tipificación molecular de patógenos nosocomiales y detección de mecanismos de resistencia a antimicrobianos de interés sanitario en Andalucía (programa PIRASOA) por su colaboración en los estudios de identificación molecular de los aislados.