Serratia marcescens puede producir brotes nosocomiales en las unidades de cuidados intensivos neonatales. Describimos un brote por Serratia marcescens en una unidad de cuidados intensivos neonatales y proponemos recomendaciones adicionales de prevención y control.
MétodosEntre marzo de 2019 y enero de 2020 se tomaron muestras en pacientes de la unidad de cuidados intensivos neonatales (frotis rectales, faríngeos, axilares y otras localizaciones) y de 15 grifos y sus sumideros. Se implementaron medidas de control incluyendo la limpieza exhaustiva de incubadoras, educación sanitaria a personal y familiares de neonatos, y uso de envases unidosis. Se hizo PFGE en 19 aislados de pacientes y en 5 muestras ambientales.
ResultadosDesde el primer caso (marzo 2019) hasta la detección del brote transcurrió un mes. Finalmente, 20 pacientes estaban infectados y 5 colonizados. El 80% de los neonatos infectados presentó conjuntivitis, el 25% bacteriemia, el 15% neumonía, el 5% infección de herida y el 5% infección urinaria. Seis neonatos tuvieron 2 focos de infección. De los 19 aislados estudiados, 18 pertenecieron al mismo pulsotipo y solo uno de los aislados del sumidero presentó relación clonal con los del brote. Las medidas iniciales para el control del brote fueron ineficaces y se implementaron con la limpieza exhaustiva de la unidad, el uso de colirios individuales, la toma de muestras ambientales y el cambio de lavabos.
ConclusiónEste brote presentó un elevado número de neonatos afectados por su tardía detección y evolución tórpida. Las cepas de los pacientes estaban relacionadas con un aislado ambiental. Se proponen medidas adicionales de prevención y control de brotes, incluyendo la toma de muestra microbiológica rutinaria semanal.
Serratia marcescens may cause nosocomial outbreaks in neonatal intensive care units. We describe an outbreak of Serratia marcescens in a neonatal intensive care unit and propose additional prevention and control recommendations.
MethodsBetween March 2019 and January 2020, samples were taken from patients in the neonatal intensive care unit (rectal, pharyngeal, axillary and other locations) and from 15 taps and their sinks. Control measures were implemented including thorough cleaning of incubators, health education to staff and neonates’ relatives, and use of single-dose containers. PFGE was performed in 19 isolates from patients and in 5 environmental samples.
ResultsFrom the first case in March 2019 to the detection of the outbreak, a month elapsed. Finally, 20 patients were infected and 5 colonized. Eighty percent of infected neonates had conjunctivitis, 25% bacteremia, 15% pneumonia, 5% wound infection, and 5% urinary tract infection. Six neonates had 2 foci of infection. Among the 19 isolates studied, 18 presented the same pulsotype and only one of the isolates from the sinkhole showed a clonal relationship with those of the outbreak. Initial measures established were ineffective to control the outbreak and were implemented with exhaustive cleaning, use of individual eye drops, environmental sampling and changing sinks.
ConclusionThis outbreak presented a high number of neonates affected due to its late detection and torpid evolution. The microorganisms isolated from the neonates were related to an environmental isolate. Additional prevention and control measures are proposed, including routine weekly microbiological sampling.
El entorno hospitalario tiene un papel importante en la transmisión de patógenos mediante transmisión cruzada1, incrementando las infecciones relacionadas con la asistencia sanitaria. Serratia marcescens (SM) es conocida por su ubicuidad y puede desarrollar resistencias a cefalosporinas de tercera generación2. En los últimos años se ha asociado con brotes en unidades de cuidados intensivos neonatales (UCIN)1. Algunos de los factores de riesgo identificados para la colonización/infección por este microorganismo en la UCIN son: bajo peso al nacer, prematuridad, larga estancia en el hospital, y uso de antibióticos y medidas invasivas3.
El acontecimiento de un brote por SM en una UCIN es un hecho importante ya que puede diseminarse rápidamente4. Su detección temprana es útil para evitar la propagación5,6. No existe un consenso universal de las medidas específicas a llevar a cabo en sus brotes y la mayoría de los estudios repiten actuaciones similares, como el refuerzo de higiene de manos, precauciones de transmisión por contacto, educación sanitaria de los profesionales y aislamiento por cohortes de los pacientes colonizados/infectados4. Sin embargo, puede haber otros factores, como la contaminación de material sanitario, que hacen que el brote se extienda7,8. En la actualidad, existen herramientas microbiológicas, como la electroforesis en campo pulsado (PFGE) y la secuenciación genómica masiva, que permiten establecer la relación clonal y son aplicables al estudio de brotes, para su control9,10. Pese a todo, en la práctica clínica estas medidas planteadas pueden resultar insuficientes debido a múltiples motivos, como la presencia de reservorios ambientales.
El objetivo de este trabajo es describir la evolución de un brote por SM, las medidas para su control y erradicación, y las técnicas microbiológicas usadas, para revisar y proponer nuevas medidas de evaluación y control.
Material y métodosLocalizaciónSe realizó un estudio transversal, descriptivo y retrospectivo de un brote ocurrido en la UCIN del Hospital Universitario Virgen de las Nieves de Granada entre marzo de 2019 y enero de 2020. Su UCIN está dotada de 38 camas, de las que 20 pertenecen al Módulo de Básicos, 10 a Intermedios y 8 a Intensivos (figura suplementaria 1). Su personal de enfermería en aquel momento era de 39 enfermeras y 30 técnicos auxiliares de cuidados de enfermería.
Detección del broteEn abril del 2019, el Servicio de Microbiología comunica a Medicina Preventiva el aislamiento de SM en una muestra de exudado conjuntival en un neonato de la UCIN, alertando que parecía haber una agregación de casos en los últimos meses. Se inicia la investigación, solicitándole los aislamientos en la UCIN desde enero del 2019 hasta abril, con 7 casos (5 exudados conjuntivales y 2 hemocultivos). El 26 de abril de 2019, el Servicio de Medicina Preventiva declara un brote por SM en la UCIN, que se notificó al Sistema de Vigilancia Epidemiológica de Andalucía. Finalmente, se detectaron 25 casos, siendo el primer aislamiento identificado en un exudado conjuntival del 13 de marzo de 2019 (caso 1) y el último de un exudado conjuntival del 12 de septiembre de 2019 (caso 25). El brote se dio por finalizado en enero de 2020, 2 meses después de que el caso 20 se diera de alta.
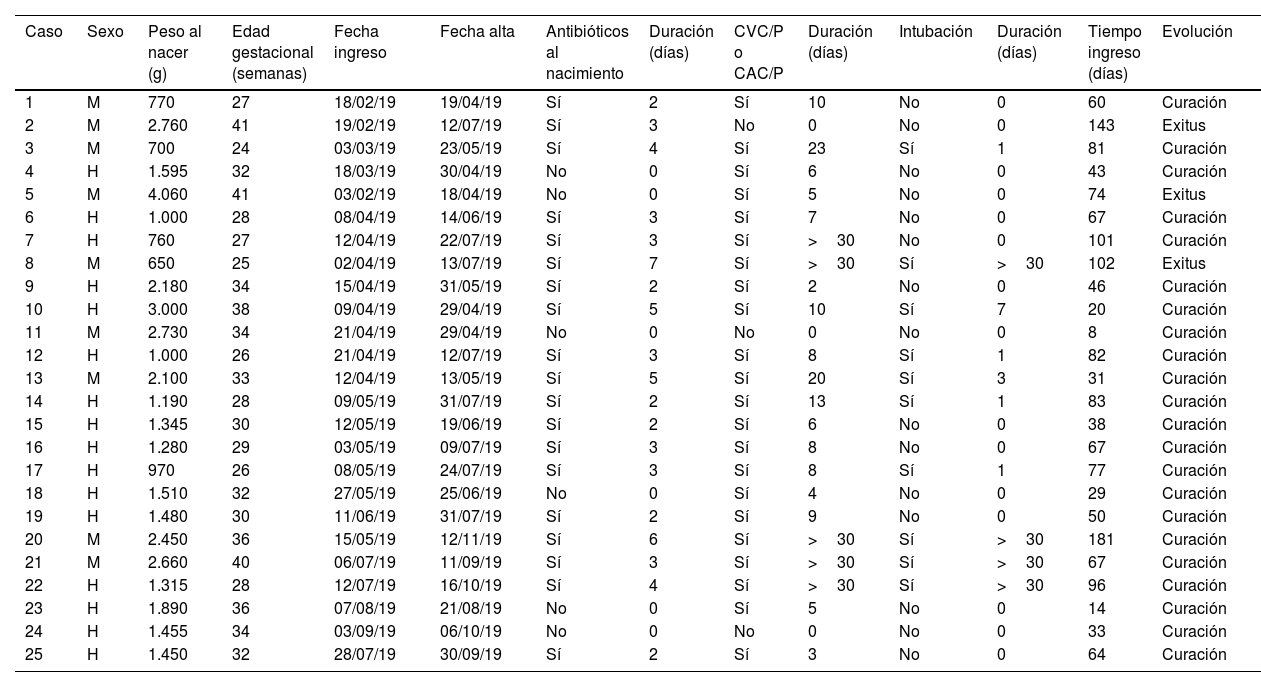
Investigación clínica y epidemiológicaSe realizaron rastreos microbiológicos en los neonatos ingresados en la UCIN (29/04/19, 13/05/19 y 22/05/19) y en reservorios ambientales (09/08/19; 15 grifos y 15 sumideros)11. Se consideró «caso» cualquier neonato ingresado en la UCIN en el periodo de brote en el que se aislase SM, ya fuese de muestra clínica o de estudio de portadores (frotis rectal, faríngeo o axilar). Se denominó «colonizado» a aquellos pacientes que presentaron una muestra positiva para estudio de portadores y que no presentaban signos de infección; e «infectado» a aquellos que presentaron al menos una muestra clínica de cualquier origen junto con sintomatología compatible en la que se aislara SM. Se recogieron datos clínico-demográficos generales (tabla 1) y relacionados con la presencia de SM (tabla 2).
Factores de riesgo intrínsecos y extrínsecos en los neonatos con infección/colonización por Serratia marcescens ingresados en la UCIN
| Caso | Sexo | Peso al nacer (g) | Edad gestacional (semanas) | Fecha ingreso | Fecha alta | Antibióticos al nacimiento | Duración (días) | CVC/P o CAC/P | Duración (días) | Intubación | Duración (días) | Tiempo ingreso (días) | Evolución |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 770 | 27 | 18/02/19 | 19/04/19 | Sí | 2 | Sí | 10 | No | 0 | 60 | Curación |
| 2 | M | 2.760 | 41 | 19/02/19 | 12/07/19 | Sí | 3 | No | 0 | No | 0 | 143 | Exitus |
| 3 | M | 700 | 24 | 03/03/19 | 23/05/19 | Sí | 4 | Sí | 23 | Sí | 1 | 81 | Curación |
| 4 | H | 1.595 | 32 | 18/03/19 | 30/04/19 | No | 0 | Sí | 6 | No | 0 | 43 | Curación |
| 5 | M | 4.060 | 41 | 03/02/19 | 18/04/19 | No | 0 | Sí | 5 | No | 0 | 74 | Exitus |
| 6 | H | 1.000 | 28 | 08/04/19 | 14/06/19 | Sí | 3 | Sí | 7 | No | 0 | 67 | Curación |
| 7 | H | 760 | 27 | 12/04/19 | 22/07/19 | Sí | 3 | Sí | >30 | No | 0 | 101 | Curación |
| 8 | M | 650 | 25 | 02/04/19 | 13/07/19 | Sí | 7 | Sí | >30 | Sí | >30 | 102 | Exitus |
| 9 | H | 2.180 | 34 | 15/04/19 | 31/05/19 | Sí | 2 | Sí | 2 | No | 0 | 46 | Curación |
| 10 | H | 3.000 | 38 | 09/04/19 | 29/04/19 | Sí | 5 | Sí | 10 | Sí | 7 | 20 | Curación |
| 11 | M | 2.730 | 34 | 21/04/19 | 29/04/19 | No | 0 | No | 0 | No | 0 | 8 | Curación |
| 12 | H | 1.000 | 26 | 21/04/19 | 12/07/19 | Sí | 3 | Sí | 8 | Sí | 1 | 82 | Curación |
| 13 | M | 2.100 | 33 | 12/04/19 | 13/05/19 | Sí | 5 | Sí | 20 | Sí | 3 | 31 | Curación |
| 14 | H | 1.190 | 28 | 09/05/19 | 31/07/19 | Sí | 2 | Sí | 13 | Sí | 1 | 83 | Curación |
| 15 | H | 1.345 | 30 | 12/05/19 | 19/06/19 | Sí | 2 | Sí | 6 | No | 0 | 38 | Curación |
| 16 | H | 1.280 | 29 | 03/05/19 | 09/07/19 | Sí | 3 | Sí | 8 | No | 0 | 67 | Curación |
| 17 | H | 970 | 26 | 08/05/19 | 24/07/19 | Sí | 3 | Sí | 8 | Sí | 1 | 77 | Curación |
| 18 | H | 1.510 | 32 | 27/05/19 | 25/06/19 | No | 0 | Sí | 4 | No | 0 | 29 | Curación |
| 19 | H | 1.480 | 30 | 11/06/19 | 31/07/19 | Sí | 2 | Sí | 9 | No | 0 | 50 | Curación |
| 20 | M | 2.450 | 36 | 15/05/19 | 12/11/19 | Sí | 6 | Sí | >30 | Sí | >30 | 181 | Curación |
| 21 | M | 2.660 | 40 | 06/07/19 | 11/09/19 | Sí | 3 | Sí | >30 | Sí | >30 | 67 | Curación |
| 22 | H | 1.315 | 28 | 12/07/19 | 16/10/19 | Sí | 4 | Sí | >30 | Sí | >30 | 96 | Curación |
| 23 | H | 1.890 | 36 | 07/08/19 | 21/08/19 | No | 0 | Sí | 5 | No | 0 | 14 | Curación |
| 24 | H | 1.455 | 34 | 03/09/19 | 06/10/19 | No | 0 | No | 0 | No | 0 | 33 | Curación |
| 25 | H | 1.450 | 32 | 28/07/19 | 30/09/19 | Sí | 2 | Sí | 3 | No | 0 | 64 | Curación |
CAC/P: catéter arterial central o periférico; CVC/P: catéter venoso central o periférico; H: hombre; M: mujer; UCIN: Unidad de Cuidados Intensivos Neonatales.
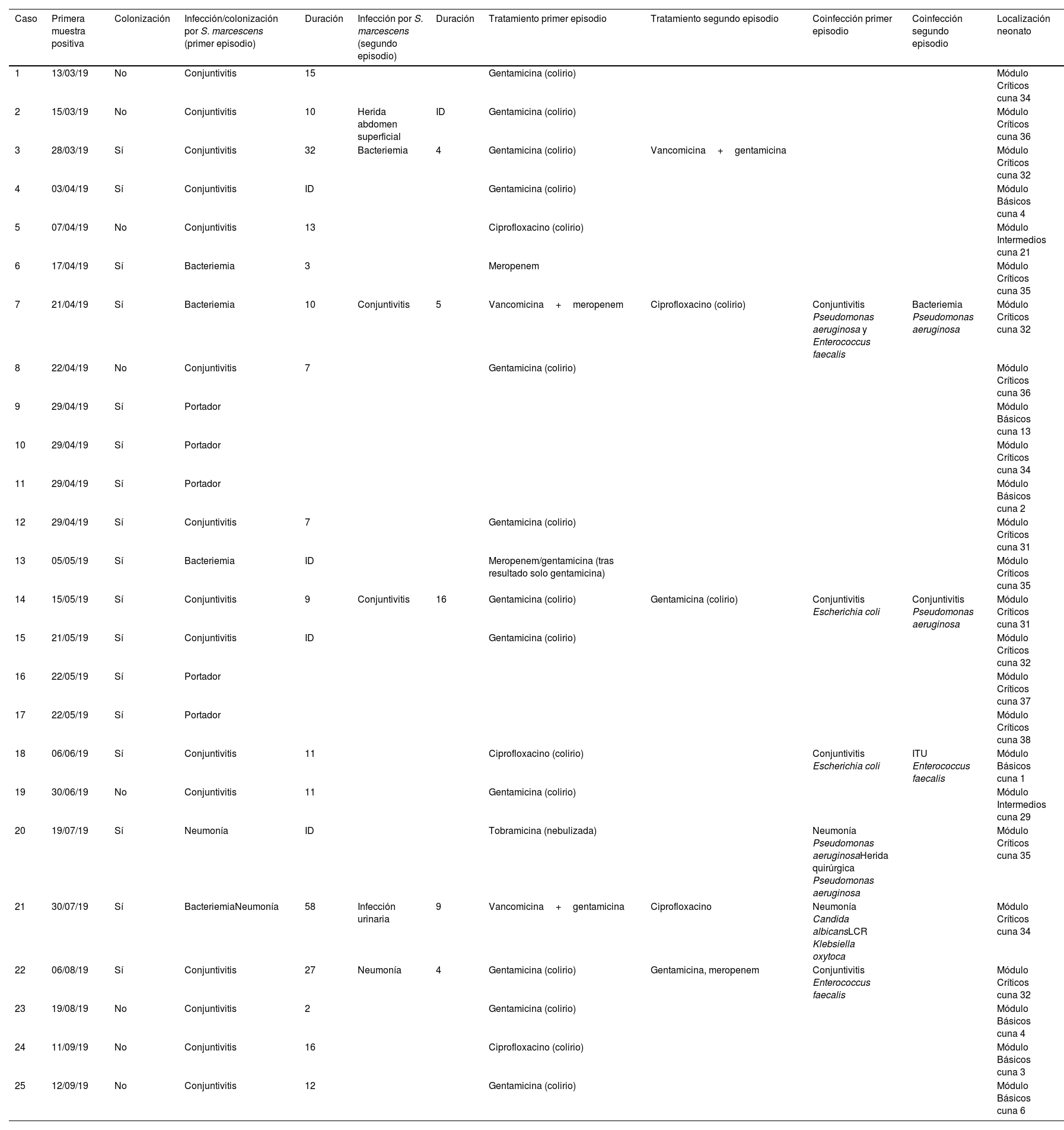
Temporalización, tipos de infección/colonización, tratamientos y localización de los neonatos con Serratia marcescens ingresados en la UCIN
| Caso | Primera muestra positiva | Colonización | Infección/colonización por S. marcescens (primer episodio) | Duración | Infección por S. marcescens (segundo episodio) | Duración | Tratamiento primer episodio | Tratamiento segundo episodio | Coinfección primer episodio | Coinfección segundo episodio | Localización neonato |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 13/03/19 | No | Conjuntivitis | 15 | Gentamicina (colirio) | Módulo Críticos cuna 34 | |||||
| 2 | 15/03/19 | No | Conjuntivitis | 10 | Herida abdomen superficial | ID | Gentamicina (colirio) | Módulo Críticos cuna 36 | |||
| 3 | 28/03/19 | Sí | Conjuntivitis | 32 | Bacteriemia | 4 | Gentamicina (colirio) | Vancomicina+gentamicina | Módulo Críticos cuna 32 | ||
| 4 | 03/04/19 | Sí | Conjuntivitis | ID | Gentamicina (colirio) | Módulo Básicos cuna 4 | |||||
| 5 | 07/04/19 | No | Conjuntivitis | 13 | Ciprofloxacino (colirio) | Módulo Intermedios cuna 21 | |||||
| 6 | 17/04/19 | Sí | Bacteriemia | 3 | Meropenem | Módulo Críticos cuna 35 | |||||
| 7 | 21/04/19 | Sí | Bacteriemia | 10 | Conjuntivitis | 5 | Vancomicina+meropenem | Ciprofloxacino (colirio) | Conjuntivitis Pseudomonas aeruginosa y Enterococcus faecalis | Bacteriemia Pseudomonas aeruginosa | Módulo Críticos cuna 32 |
| 8 | 22/04/19 | No | Conjuntivitis | 7 | Gentamicina (colirio) | Módulo Críticos cuna 36 | |||||
| 9 | 29/04/19 | Sí | Portador | Módulo Básicos cuna 13 | |||||||
| 10 | 29/04/19 | Sí | Portador | Módulo Críticos cuna 34 | |||||||
| 11 | 29/04/19 | Sí | Portador | Módulo Básicos cuna 2 | |||||||
| 12 | 29/04/19 | Sí | Conjuntivitis | 7 | Gentamicina (colirio) | Módulo Críticos cuna 31 | |||||
| 13 | 05/05/19 | Sí | Bacteriemia | ID | Meropenem/gentamicina (tras resultado solo gentamicina) | Módulo Críticos cuna 35 | |||||
| 14 | 15/05/19 | Sí | Conjuntivitis | 9 | Conjuntivitis | 16 | Gentamicina (colirio) | Gentamicina (colirio) | Conjuntivitis Escherichia coli | Conjuntivitis Pseudomonas aeruginosa | Módulo Críticos cuna 31 |
| 15 | 21/05/19 | Sí | Conjuntivitis | ID | Gentamicina (colirio) | Módulo Críticos cuna 32 | |||||
| 16 | 22/05/19 | Sí | Portador | Módulo Críticos cuna 37 | |||||||
| 17 | 22/05/19 | Sí | Portador | Módulo Críticos cuna 38 | |||||||
| 18 | 06/06/19 | Sí | Conjuntivitis | 11 | Ciprofloxacino (colirio) | Conjuntivitis Escherichia coli | ITU Enterococcus faecalis | Módulo Básicos cuna 1 | |||
| 19 | 30/06/19 | No | Conjuntivitis | 11 | Gentamicina (colirio) | Módulo Intermedios cuna 29 | |||||
| 20 | 19/07/19 | Sí | Neumonía | ID | Tobramicina (nebulizada) | Neumonía Pseudomonas aeruginosaHerida quirúrgica Pseudomonas aeruginosa | Módulo Críticos cuna 35 | ||||
| 21 | 30/07/19 | Sí | BacteriemiaNeumonía | 58 | Infección urinaria | 9 | Vancomicina+gentamicina | Ciprofloxacino | Neumonía Candida albicansLCR Klebsiella oxytoca | Módulo Críticos cuna 34 | |
| 22 | 06/08/19 | Sí | Conjuntivitis | 27 | Neumonía | 4 | Gentamicina (colirio) | Gentamicina, meropenem | Conjuntivitis Enterococcus faecalis | Módulo Críticos cuna 32 | |
| 23 | 19/08/19 | No | Conjuntivitis | 2 | Gentamicina (colirio) | Módulo Básicos cuna 4 | |||||
| 24 | 11/09/19 | No | Conjuntivitis | 16 | Ciprofloxacino (colirio) | Módulo Básicos cuna 3 | |||||
| 25 | 12/09/19 | No | Conjuntivitis | 12 | Gentamicina (colirio) | Módulo Básicos cuna 6 |
ITU: infección del tracto urinario; LCR: líquido cefalorraquídeo; UCIN: Unidad de Cuidados Intensivos Neonatales.
Estas medidas fueron el Apoyo de la Dirección hospitalaria, educación del personal con formación periódica y a la incorporación, la utilización correcta de la antibioterapia, la vigilancia epidemiológica, el uso y cumplimiento de las precauciones de transmisión, las medidas medioambientales y, por último, la descolonización, solo en caso de brote nosocomial si se considera necesario. Debido a la ubicuidad y la forma de transmisión de SM se implementa limpieza exhaustiva y desinfección de incubadoras y aislamiento/agrupamiento de cohortes en pacientes colonizados/infectados por SM, personal exclusivo para ellas, y, por último, el cierre de la unidad si el brote no se controla, medida que no hubo que tomar en el brote que se describe. Se llevaron a cabo medidas para el control del brote, que se detallarán por mes de implementación (material suplementario)4.
Estudio microbiológico y análisis de relación clonalLos aislados fueron identificados mediante MALDI-TOF (Biotyper, Brucker Daltonics, Billerica, MA, EE. UU.) y se realizó el estudio de sensibilidad antimicrobiana a los aislados clínicos mediante MicroScan WalkAway (Beckman-Coulter, Brea, CA, EE.UU.). Para el estudio de relación epidemiológica a nivel molecular, se seleccionó un único aislado por paciente, así como todos los aislados detectados en muestras ambientales, y se enviaron al laboratorio de referencia del Programa Andaluz de Vigilancia y Control de Infecciones Asociadas a la Asistencia Sanitaria y Administración de Antibióticos (programa PIRASOA). Las pruebas de sensibilidad antimicrobiana se realizaron en este laboratorio por microdilución y se interpretaron mediante EUCAST (https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Consultation/2018/Information_for_NACs_-_Redefining_antimicrobial_susceptibility_testing_categories.pdf). Todos los aislados fueron analizados mediante PFGE con XbaI-DNA (http://www.cdc.gov/pulsenet). Los aislados que diferían en 2 o más bandas en los ensayos de PFGE se asignaron a diferentes pulsotipos. Los aislados sin bandas de diferencia (100% de similitud) se consideraron idénticos; y los aislados con más de 5 bandas de diferencia (<80% de similitud) se consideraron distintos. Los fragmentos de restricción resultantes se separaron en el sistema CHIEF DR-II (Bio-Rad Laboratories, Alcobendas, Madrid, España) con gel de agarosa al 1%. Posteriormente, se tiñeron con bromuro de etidio, se iluminaron con luz ultravioleta y se fotografiaron en un sistema automático de imágenes Gel Logic 200 (Kodak, Rochester, NY, EE. UU.). La conversión, la normalización y el análisis de los patrones de bandas se realizaron utilizando el software BioNumerics 12.0 (AppliedMaths, Austin, TX, EE. UU.), analizando los patrones como se describió anteriormente, utilizando el coeficiente de Dice con configuraciones de tolerancia de posición de 1% de optimización y 1% de tolerancia de posición de la banda. No existe un esquema MLST desarrollado por el Instituto Pasteur para caracterizar esta especie de bacteria; sin embargo, todos los aislamientos que presentaban el mismo pulsotipo estaban relacionados.
Declaración de ORIONSe siguieron los criterios de las guías de The ORION statement para asegurar la transparencia en el informe de brote (https://www.ucl.ac.uk/drupal/site_antimicrobial-resistance/sites/antimicrobial-resistance/files/checklist_authors.pdf).
Aprobación éticaEl Comité de Ética de la Investigación de Granada dio su aprobación al proyecto con fecha 21/12/2021 y código de referencia 2390-N-21.
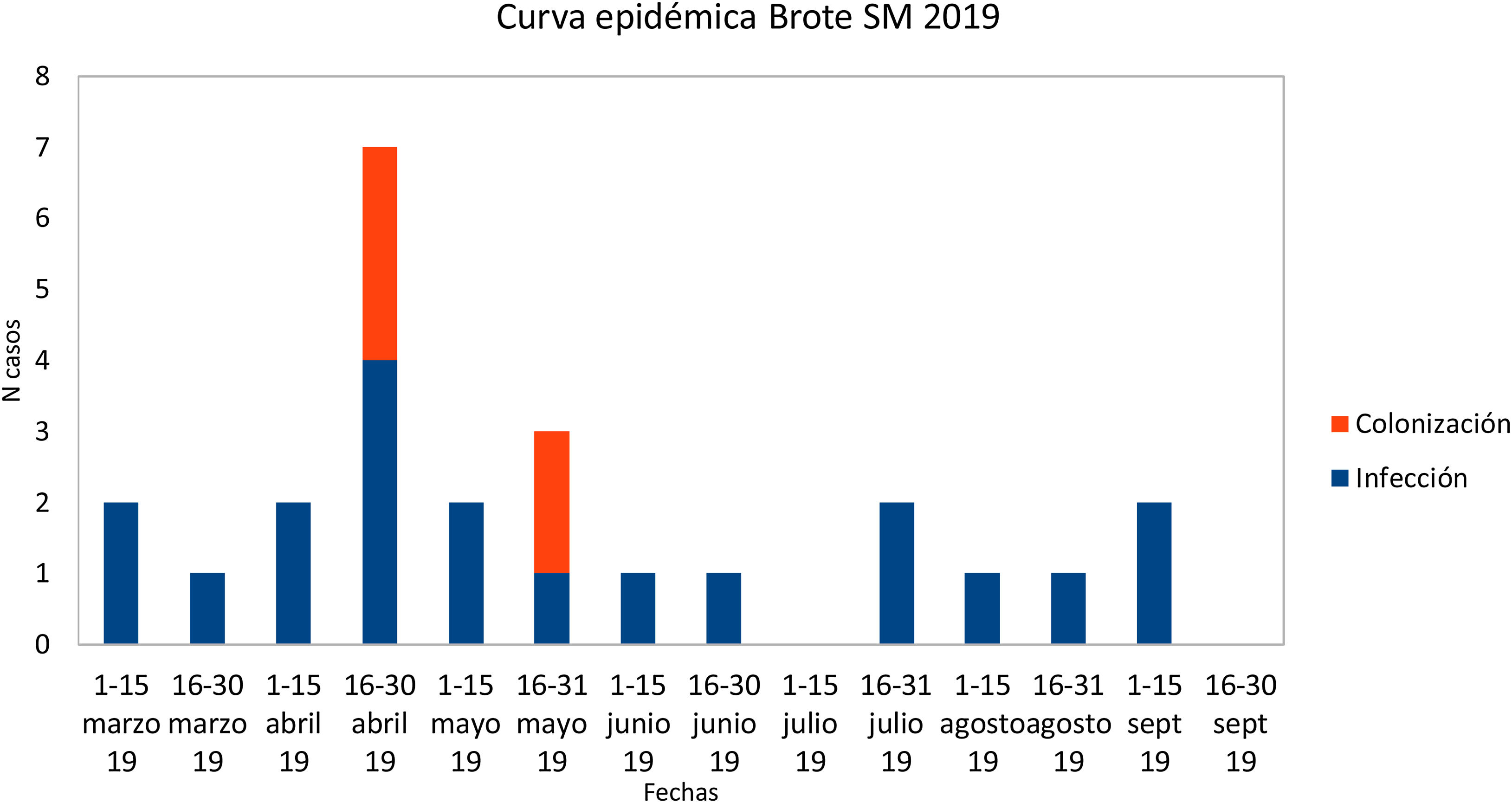
ResultadosInvestigación clínico-epidemiológicaEl 29 de abril se extrajeron muestras de portadores a 19 neonatos (frotis rectales y frotis faríngeos), 6 ya clasificados como casos, y se identificaron 4 nuevos colonizados. El 13 de mayo se extrajeron muestras de control a 5 casos. Finalmente, el 22 de mayo se extrajeron muestras a 8 neonatos ingresados, siendo previamente parte del brote 3 de ellos e identificando a 2 nuevos colonizados. En uno de los colonizados su estado cambió a infección (conjuntivitis), quedando finalmente compuesto el brote por 20 infectados (80%) y 5 colonizados (20%). En la curva epidémica se puede observar la evolución de los casos (fig. 1). Se analizaron 25 pacientes, siendo 16 (64%) varones. Su peso y edad gestacional media al nacer fue de 1.692g (rango: 650-4.060g y DT: 857,46) y 31,64 semanas (rango: 24-41 semanas y DT: 5,02), respectivamente. El tiempo medio de estancia en la UCIN fue de 66,28 días (rango: 8-181 días y DT: 39,48) (tabla 2). Doce (60%) de los 20 neonatos con infección estaban colonizados a nivel rectal. De los 20 pacientes infectados, 16 (80%) presentaron conjuntivitis, 5 (25%) bacteriemia, 3 (15%) neumonía, uno (5%) infección de herida quirúrgica y otro (5%) infección urinaria. En 6 (30% de los infectados y 24% del total) neonatos se aisló SM en más de una localización y uno de ellos presentó 2 episodios de conjuntivitis. Trece de las conjuntivitis se trataron con colirio de gentamicina (76,5%) y 4 con ciprofloxacino (23,5%). En 6 (30% de los 20) neonatos se detectó simultáneamente infección por otro microorganismo (tabla 2). Tres (12%) neonatos fueron exitus debido a causa ajena a la infección por SM. En el momento del primer aislamiento microbiológico (tabla 2), 16 (64%) casos se hallaban en el módulo de Cuidados Críticos, 7 (28%) en Cuidados Básicos y 2 (8%) en Cuidados Intermedios. En cuanto a las muestras ambientales, el 100% de las muestras de grifos fueron negativas y se detectó SM en 4 sumideros (5 aislados, 26,7%) (tabla 3), localizados en la sala-lavadero de incubadoras (uno, 25%), críticos (2, 50%) y cuidados intermedios (uno, 25%).
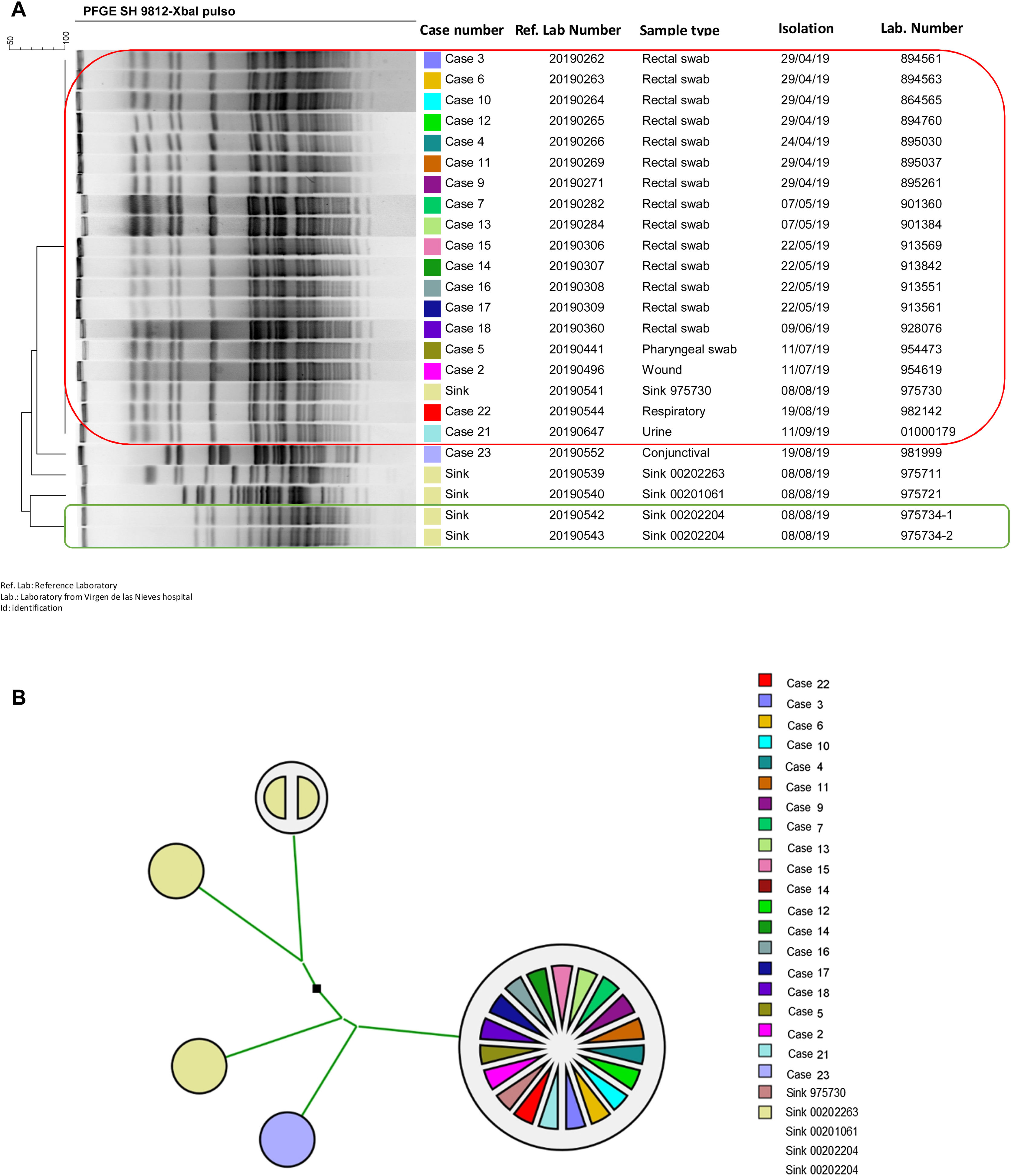
Se detectaron 2 perfiles de sensibilidad diferentes (tabla 4). Del caso 3 solo pudo analizarse un aislado con fenotipo 2. De los 25 casos definidos en el brote, se analizó la relación clonal de 19 aislados clínicos (14 frotis rectales y uno faríngeo; uno de orina; un exudado de herida, uno respiratorio y otro conjuntival) y 5 de 4 reservorios ambientales. El 94,7% de los aislados detectados en muestras de pacientes fueron idénticos entre sí; solo un aislado (caso 23) presentó un pulsotipo diferente. Un aislado ambiental (sumidero 975730) fue idéntico a este clúster de aislados clínicos. El resto de los aislados ambientales presentaron pulsotipos diferentes a los aislados del brote. Los 2 aislados detectados en el mismo sumidero fueron idénticos entre sí (fig. 2).
Perfiles de sensibilidad de los aislados de Serratia marcescens
| Antibióticos | Fenotipo 1Casos 1, 3a y 20 | Fenotipo 2Casos 2, 3a, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 21, 22, 23, 24 y 25 |
|---|---|---|
| AMP | R | R |
| A-C | R | R |
| CFT | R | S |
| AZT | R | S |
| TOB | R | R |
| AMK | R | R |
| P-T | S | S |
| CFP | S | S |
| ETP | S | S |
| IMP | S | S |
| MPM | S | S |
| CPX | S | S |
| GTM | S | S |
| T-S | S | S |
A-C: amoxicilina-clavulánico; AMK: amikacina; AMP: ampicilina; AZT: aztreonam; CFP: cefepima; CFT: cefotaxima; CPX: ciprofloxacino; ETP: ertapenem; GTM: gentamicina; IMP: imipenem; MPM: meropenem; P-T: piperacilina-tazobactam; R: resistente; S: sensible; T-S: trimetoprima-sulfametoxazol; TOB: tobramicina.
Relación clonal de aislados de Serratia marcescens de muestras de pacientes y ambientales de la Unidad de Neonatología del HUVN (Granada). A) Dendograma de aislados de S. marcescens enviados al laboratorio de referencia PIRASOA. Se muestran en un recuadro los aislados idénticos (rojo: 18 aislados de neonatos y aislado de sumidero; verde: aislados del mismo sumidero). B) Árbol filogenético de aislados de S. marcescens enviados al laboratorio de referencia PIRASOA.
Debido a la prolongada duración del brote nosocomial por SM en la UCIN, a las actuaciones iniciales para su control se fueron añadiendo otras nuevas, ya que seguían apareciendo casos (tabla suplementaria 1). Tras la implementación de todas las medidas para el control del brote, a las que se añadió el control de la antibioterapia, el alta de los neonatos cuando las condiciones clínicas lo permitieron, los exhaustivos controles clínicos y ambientales, y la implicación de todos los profesionales de la UCIN, el brote queda cerrado 2 meses después del último caso, debido a la posibilidad de que SM persista en superficies inanimadas durante meses.
DiscusiónSM se ha identificado como la tercera causa de brotes en hospitales12, como en la UCIN en niños con bajo peso al nacer, prematuridad, larga estancia en la UCI y presencia de dispositivos13. En nuestro estudio la mayoría de los neonatos presentaban peso bajo al nacer, prematuridad y tenían un catéter. En este brote hubo 3 (12%) exitus, ninguno de ellos debido a bacteriemia, y este hecho ya se ha descrito previamente3,14. También destaca el elevado número de episodios, en comparación con otros estudios15. Esto se podría deber al incumplimiento de medidas estándar de control y a la detección tardía del brote, que llevó al retraso en el inicio de las medidas de control, ya que fue notificado cuando existían 7 casos confirmados, a finales de abril de 2019. En algunos estudios se han identificado fuentes y reservorios con SM durante la investigación de un brote, por ejemplo, en los desinfectantes16, nutrición parenteral17, champús18 o contenedores de agua19, pero en la mayoría la fuente no queda clara20. En este estudio el caso 1 fue el primero identificado en marzo de 2019 con infección por SM, pero no podemos asegurar que sea la fuente inicial, ya que pudo haber neonatos ingresados previamente a los que no se les tomaron muestras de portadores. Además, en este caso no se pudo estudiar el pulsotipo. También habría que tener en cuenta a los familiares de los neonatos, ya que no se analizó en ellos la presencia del microorganismo. Aunque una de las medidas implementadas fue educación sanitaria (destacando la higiene de manos), no se realizaron observaciones en ellos, y tratándose de personas que entran y salen de la UCIN, pudieron introducir en esta sala algún microorganismo. En cuanto al personal del hospital, tampoco se analizó en ellos la presencia de SM, pero se reforzaron las medidas de higiene de manos, las precauciones de transmisión y la disciplina adecuada respecto a la ropa en una UCIN. Esta decisión fue así debido a que la realización de cribado de SM en el personal podía no conllevar ninguna información relevante. De hecho, no se recomienda la realización de estudio de portadores en este sector, ya que raramente son la causa15,21. Una de las medidas de control del brote fue el refuerzo de la higiene de manos en el personal hospitalario, sobre todo el personal de la UCIN; para su evaluación se realizaron las observaciones de higiene de manos entre el 15 de mayo y el 5 de junio y el análisis ofreció un 62,4% de cumplimiento, algo más alto que la media que arroja los resultados de una revisión sistemática (59,6%), aunque inferior al observado en otras UCIN (67%)22.
En cuanto a la transmisión del brote, como en otros descritos, la presencia de neonatos asintomáticos colonizados por SM constituiría el principal reservorio23, a través de las manos del personal del hospital24,25. Además, como parte de las medidas para el control del brote se realizó toma de muestra ambiental y se identificaron 4 sumideros contaminados, de los cuales solo el perteneciente al fregadero de incubadoras y otro aparataje de uso en neonatos fue idéntico a los aislados del brote. Este hecho no supone que se trate de la fuente inicial del brote, ya que, al encontrarse en sumidero, se podría interpretar como que se ha contaminado tras el lavado de incubadoras donde los neonatos residían («caso ambiental»). Sin embargo, es un factor participante en la dispersión del brote, ya que SM puede permanecer en superficies inanimadas durante meses26. Tras el cambio de grifos y lavabos, siguieron apareciendo casos, lo cual apoya que los propios neonatos fuesen el reservorio principal, y el personal, los vectores de transmisión, y los sumideros siguieran colonizándose tras el uso de los lavabos durante la presencia de casos positivos.
Además, la aparición de casos nuevos puede estar relacionada con la menor ratio enfermería/paciente y la deficiencia en formación de medidas de prevención en los profesionales20, ya que entre junio y septiembre había menos personal y/o había un personal menos especializado, que trabajan en una sala abierta, que no favorece la higiene de manos. Otros factores relevantes en la propagación del brote fue la antigüedad de la UCIN y su disposición: espacio reducido entre incubadoras y un tránsito fluido de profesionales de distintas especialidades, familiares de los neonatos y traslado de pacientes entre los 3 módulos.
En cuanto a las muestras extraídas en los neonatos y enviadas al laboratorio de referencia, hubo un caso (caso 23) en el que, tras el análisis, se observó que SM pertenecía a un pulsotipo distinto al del brote. Es destacable que en este paciente la muestra se extrajo 13 días tras el último caso detectado (fecha caso identificado hasta el momento: 06/08/19), encontrándose además en una ubicación distinta a la de los últimos casos, lo que apunta a la introducción de un nuevo linaje de SM en la UCIN. No se analizaron mediante PFGE los aislados de los casos 24 y 25, por lo que no es posible confirmar si SM pertenecía a la misma cadena epidemiológica del brote o había surgido otra a partir del caso 23. También, la identificación de otros linajes en otros sumideros favorece la hipótesis de que existen distintas cepas, de cadenas de transmisión distinta, que coinciden en el tiempo durante esta situación de brote nosocomial.
Pese a todas las medidas de control tomadas en este brote, no es infrecuente que se sigan produciendo brotes en la UCIN, tal y como sucedió en noviembre de 2020. De hecho, en otros informes se han identificado brotes secundarios y terciarios27–29. Con base en lo anterior se realizan las siguientes propuestas de mejora a implantar para evitar las consecuencias que puede acarrear un brote similar en una UCIN. En primer lugar, es importante la vigilancia constante en unidades de riesgo y la comunicación efectiva entre servicios hospitalarios ante la sospecha de eventos de infección nosocomial para la detección temprana de brotes y actuar con premura para evitar la propagación en el entorno hospitalario. A continuación, la realización de cribado microbiológico, con periodicidad sistematizada (al menos quincenal), dentro de la rutina clínica, para la detección temprana de microorganismos «no habituales». Así se lograría interrumpir de forma precoz la transmisión del microorganismo y se evitarían brotes con elevado número de casos. Según se recoge en un estudio alemán, hacer cribados a todos los neonatos que ingresan en la UCIN resulta útil para la detección precoz de estos microorganismos30. Por otro lado, consideramos que sería de utilidad la existencia de un documento de consenso de medidas universales para la actuación en brotes, además de ser necesaria la formación continuada de todos los profesionales del hospital y, especialmente, de aquellos que atienden en unidades de riesgo, en las medidas de prevención de infección nosocomial, destacando la higiene de manos.
Como limitaciones de este estudio destacamos que no se determinaran los pulsotipos de todos los casos del brote; concretamente, del caso 3 se obtuvieron varios aislados con fenotipos 1 y 2, sin embargo, solo pudo realizarse el análisis molecular en el fenotipo 2. Otro aspecto es que, debido principalmente a la falta de recursos humanos, no se continuó realizando cribados, lo que pudo contribuir a la persistencia del brote durante más tiempo, así como tampoco se analizaron reservorios ambientales hasta varios meses después de la detección del brote.
En conclusión, se ha producido un brote por SM en una UCIN de un hospital regional del sudeste español donde hubo un elevado número de individuos afectados debido a su tardía detección y persistencia. Además de las medidas de prevención y controles habituales, se proponen otras nuevas, como son los cribados microbiológicos rutinarios, con una cadencia programada, para la prevención y control, así como la formación continuada del personal en medidas higiénicas, enfatizando la higiene de manos.
FinanciaciónLos autores declaran no haber recibido ayuda alguna para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses