Las infecciones osteoarticulares causadas por Mycobacterium xenopi son muy infrecuentes1,2. El 70-80% de las infecciones causadas por esta micobacteria son pulmonares2. Más del 80% de las bursitis se deben a S. aureus y el resto a Streptococcus sp. y a diversas bacterias gramnegativas, micobacterias y hongos3. Sin embargo, existen casos de bursitis causados por microorganismos más infrecuentes y que conviene tener en cuenta por su potencial gravedad, tal y como ilustra el siguiente caso.
Varón de 40 años, natural de Ucrania, con antecedentes de lupus eritematoso sistémico (LES) diagnosticado en su país de origen en 1991. Seguía tratamiento con hidroxicloroquina y prednisona. Controlado desde enero de 2003 en el Servicio de Reumatología de nuestro hospital a raíz de presentar, entre 2003 y 2006, de forma secuencial, varios episodios de úlceras en ambas piernas, infartos óseos múltiples, osteonecrosis de ambas cabezas femorales y, finalmente, de ambas cabezas humerales. En febrero de 2006 se le implantaron sendas prótesis de cadera (PTC). Se añadió metotrexato al tratamiento con prednisona y cloroquina, que se cambió en abril de 2008 a rituximab por dolor poliarticular, particularmente coxalgia derecha y desarrollo de osteoartritis del tobillo homolateral. El cultivo, tanto convencional como micobacteriano, del líquido sinovial del tobillo derecho resultó negativo. El 20 de abril de 2009 se procedió a recambiar la PTC derecha al objetivarse su aflojamiento, que se diagnosticó de «aséptico», dada la ausencia de pus en el material retirado y la negatividad de los cultivos realizados tras la sonicación de la PTC. Desde entonces, el paciente sigue tratamiento con prednisona, 10mg/día y micofenolato 360mg/12h. El 18 de abril de 2010 ingresó en reumatología por neumonía basal derecha y se observó, por una parte, un patrón radiológico compatible con bronconeumopatía crónica, confirmada por TC torácica y pruebas funcionales respiratorias, y, por otra, una tumoración blanda en la región superoexterna del muslo derecho, compatible con bursitis trocantérea. Se descartó deterioro de la prótesis articular mediante gammagrafía ósea marcada con leucocitos, ya que no mostró captación a este nivel.
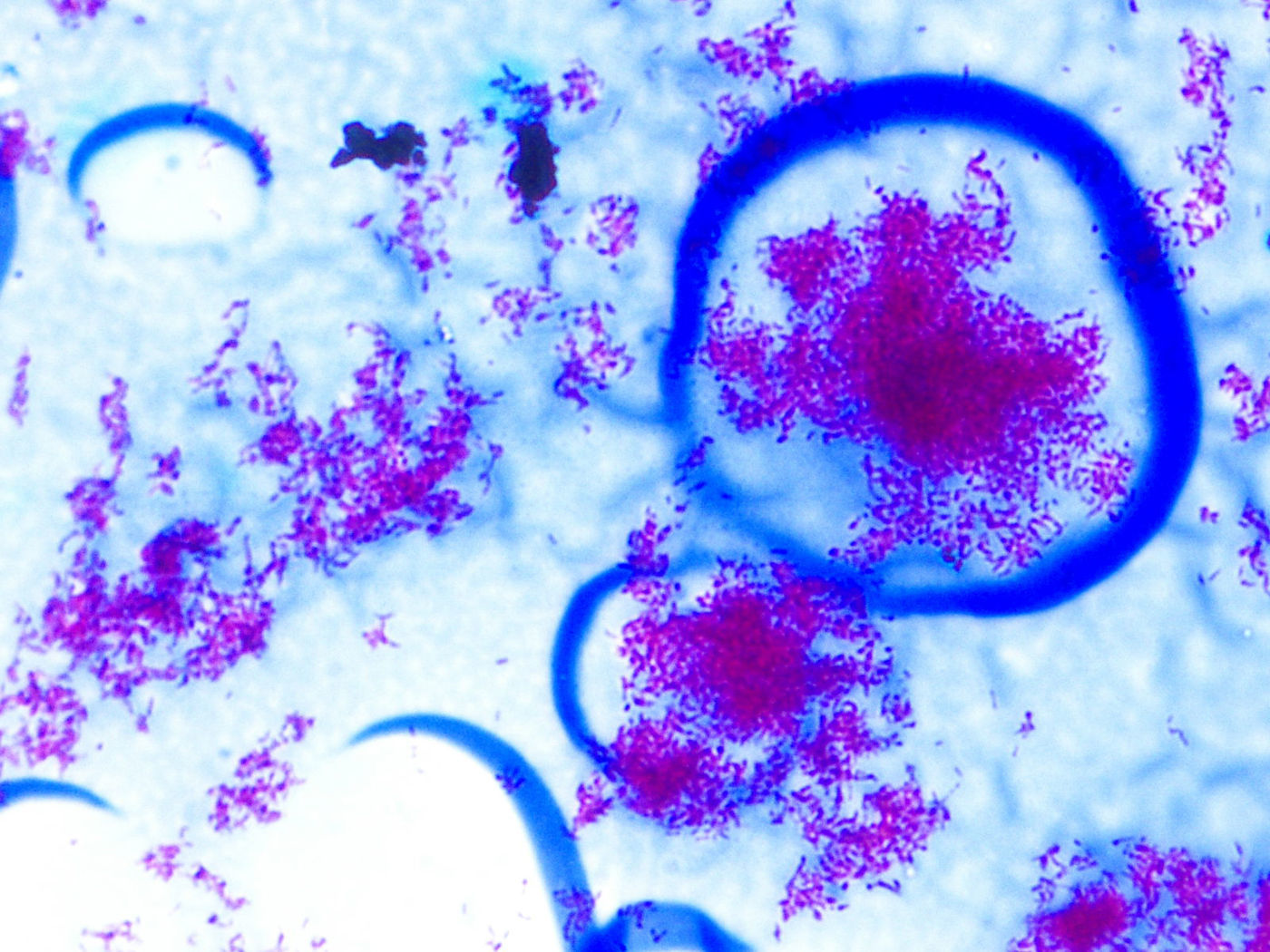
Se tomó muestra de la tumoración que se envió al laboratorio de microbiología para estudio bacteriológico y de micobacterias. La muestra se cultivó en los medios agar sangre, agar chocolate, agar MacConckey y caldo tioglicolato. Se realizó una tinción de auramina-rodamina como método de cribado de micobacterias, que fue negativa. Además, la muestra se sembró en Löwenstein-Jensen y en un frasco de medio líquido MB/BacT®, que se incubó en el sistema automatizado de detección de Micobacterias Bact/ALERT 3D® (bioMérieux). Se detectó crecimiento a los 41 días de incubación a 37°C, realizándose una tinción de Ziehl-Neelsen, donde se observaron abundantes bacilos ácido-alcohol resistentes largos y delgados que se agrupaban formando estructuras en «nido de pájaro» (fig. 1) compatibles con M. xenopi. Se realizó una identificación genotípica mediante el producto comercial INNO-LiPA Mycobacteria (Innogenetics®) que confirmó la identificación como M. xenopi. Este sistema se basa en la amplificación del espacio intergenético 16S-23S ribosomal y posterior hibridación del producto de amplificación sobre las diferentes sondas dispuestas en una tira de nitrocelulosa.
A los 66 días de incubación en Löwenstein-Jensen, se observó el crecimiento de colonias compatibles con la especie identificada anteriormente por PCR en el medio líquido MB/BacT®. Se realizó una tinción de Ziehl-Neelsen que lo confirmó. No se observó crecimiento micobacteriano en ninguna de las tres muestras de esputo seriadas solicitadas durante el proceso diagnóstico. Tras iniciar tratamiento con la asociación de isoniazida, rifampicina y etambutol, la tumoración de la bursa articular se ha reducido hasta su desaparición.
M. xenopi es una micobacteria no tuberculosa termofílica, escotocromógena de crecimiento lento2. Durante mucho tiempo ha sido considerada como contaminante ambiental; sin embargo, desde 1965, M. xenopi ha sido reconocido como un patógeno oportunista y nosocomial1. La principal fuente de contaminación por M. xenopi es por colonización de los conductos de agua caliente (donde puede formar biocapas). La infección se puede producir por inhalación de aerosoles de agua contaminada o por contaminación de material quirúrgico con agua contaminada2. El paciente presentaba una historia de LES tratado con corticoides. La reducción de los valores de interferón gamma por la terapia inmunosupresora podría ser un factor predisponerte para la infección por micobacterias no tuberculosas. Pacientes con alteraciones del tejido conectivo, como el LES, podrían presentar una mayor predisposición debido a su alteración de la inmunidad adquirida4. La mayoría de los pacientes con bursitis tuberculosa presentan infecciones en otra parte del cuerpo (el 42%, pulmonar, y el 10,5%, genitourinaria)5. Aunque este paciente, en tratamiento inmunosupresor y con un lupus de base, tiene razones fisiopatológicas para haber desarrollado una infección micobacteriana pulmonar con diseminación hemática, la ausencia de infección documentada en el pulmón y, en cambio, el hecho de haber sufrido una manipulación ortopédica repetida pueden haber favorecido la inoculación directa/contaminación por M. xenopi de la articulación.
Aunque sólo un bajo porcentaje de bursitis son causadas por micobacterias6, el siguiente caso ilustra la conveniencia de descartar la infección por estos microorganismos ante la evolución inesperada o tórpida de un proceso inflamatorio osteoarticular en el que los cultivos convencionales no muestren crecimiento microbiano. El diagnóstico precoz y el inicio del tratamiento específico evita las graves secuelas funcionales asociadas a la evolución espontánea de la enfermedad.